El síndrome hemolítico urémico es la causa más frecuente de insuficiencia renal aguda no prerrenal en edad pediátrica y suele ser secundario a diarrea aguda infecciosa, generalmente por Escherichia coli productor de verotoxina. Se caracteriza por fracaso renal agudo, anemia hemolítica y trombocitopenia. Puede producir secuelas renales a largo plazo y llevar a insuficiencia renal terminal.
Material y métodosEl objetivo de este estudio retrospectivo es describir las secuelas renales y analizar los factores pronósticos de las mismas en los pacientes pediátricos atendidos en un hospital terciario español en los últimos 28 años.
ResultadosHan sido atendidos 43 niños con esta patología, 38 de ellos con antecedentes de diarrea. Entre los seguidos más de 3 meses, en el momento de la última revisión (media 6,6 años, DE 5 años de seguimiento), un 21,6% (8/37) presentaba deterioro del filtrado glomerular. Incluyendo proteinuria e hipertensión arterial, encontramos hasta un 35,1% (13/37) de enfermedad renal crónica. Un 8,1% (3/37) entró en insuficiencia renal terminal. Encontramos como factores pronósticos de lesión renal a largo plazo en regresión logística univariante: hipertensión durante el ingreso, mayor leucocitosis, mayor duración del ingreso, mayor duración de la anuria y menor filtrado glomerular al alta. El análisis multivariante muestra asociación con la duración de la anuria.
ConclusionesAproximadamente, una tercera parte de nuestros casos de síndrome hemolítico-urémico desarrollaron a largo plazo afectación renal en grado variable. Una mayor y más prolongada afectación de la función renal inicial se asocia en nuestro estudio con una mayor probabilidad de deterioro renal en su evolución posterior.
Hemolytic uremic syndrome (HUS) is the most frequent cause of non-pre-renal acute renal failure in pediatrics and it is usually secondary to acute infectious diarrhea, generally due to Shiga-toxin producing E. coli. It is characterized by acute renal failure, hemolytic anemia and thrombocytopenia. It can lead to renal sequels in the long term and to end-stage renal disease.
MethodsThe aim of this retrospective study is to describe and analyze renal sequels and their prognostic factors in pediatric patients suffering from HUS in a Spanish tertiary hospital during the last 28 years.
Results43 children with this condition were admitted, with 38 of them having presented with diarrhea previously. Among those with a follow-up longer than 3 months, 21.6% (8/37) had a reduction in glomerular filtration rate (GFR) in the last visit. Including proteinuria and hypertension, we found up to 35.1% (13/37) prevalence of chronic kidney disease, with 8.1% (3/37) of the patients with end-stage renal disease. We found the following to be prognostic factors for renal injury in the long term in a univariate logistic regression: hypertension, a longer stay in the hospital, more prolonged anuria, more severe leukocytosis and lower GFR at discharge. Multivariate logistic regression showed an association with time in anuria.
ConclusionsApproximately one third of our cases of hemolytic uremic syndrome developed some degree of chronic kidney disease in the long term. A deeper and longer initial renal disfunction is associated with a higher probability of subsequent renal problems.
El síndrome hemolítico-urémico (SHU), fue descrito por primera vez por Gasser et al en 1955 como una enfermedad consistente en fallo renal agudo acompañado de anemia hemolítica no autoinmune y trombocitopenia1,2. Aunque esta enfermedad se puede ver en adolescentes y adultos, es típica su presentación en niños menores de 5 años y lactantes, donde ha supuesto, al menos hasta tiempos recientes, la principal causa no prerrenal de fracaso renal agudo3,4. El 90% de los casos de SHU en la infancia son secundarios a diarrea producida por Escherichia coli productora de toxina Shiga (Stx) o verotoxina (habitualmente serotipo O157:H7).
El mecanismo fisiopatológico varía dentro de las distintas formas, si bien tienen en común la microangiopatía trombótica localizada fundamentalmente a nivel renal.
La importancia de esta enfermedad radica tanto en la morbimortalidad del episodio agudo (fallecimiento por lesión encefálica, cardíaca o multiorgánica, fallo renal subsidiario de diálisis, necesidad de hospitalización prolongada), como en las secuelas a largo plazo, tanto a nivel renal (proteinuria, hipertensión arterial, insuficiencia renal crónica, terminal y trasplante) como neurológico (parálisis cerebral, epilepsia, déficit neurológicos)5–11 principalmente.
Se han descrito múltiples variables pronósticas de la función renal a largo plazo, con discrepancias entre diversos estudios, así como en la incidencia de complicaciones agudas. Los estudios de seguimiento de estos pacientes son de una calidad y duración irregular4. Para aportar información sobre el pronóstico y la evolución de estos pacientes, nos planteamos el siguiente estudio.
Pacientes y métodosLos objetivos de nuestro estudio son describir la aparición de posibles secuelas renales en la evolución de nuestros pacientes con SHU y buscar asociación estadística entre la presencia de afectación renal residual a largo plazo y las distintas variables recogidas.
Para ello, se diseñó un estudio retrospectivo, en el que se recogieron datos, mediante revisión de historias clínicas, de todos los casos de SHU que fueron diagnosticados y/o tratados en el Hospital Materno-infantil Doce de Octubre de Madrid desde 1980.
Se tomaron los siguientes criterios para definir el SHU:
- 1.
Hematocrito inferior al 30% con presencia de esquistocitos en sangre periférica.
- 2.
Plaquetas sanguíneas<150.000/μl.
- 3.
Creatinina o filtrado glomerular estimado (FGE) en plasma por encima de los límites de normalidad para la edad.
- 4.
Ausencia de otras razones que justifiquen este cuadro (por ejemplo, septicemia).
Las variables recogidas se pueden agrupar como: variables demográficas, presencia y tipo de pródromos del SHU, germen aislado durante el ingreso, diuresis; necesidad, tipo y duración de depuración extrarrenal, síntomas neurológicos y tipo, transfusión de hematíes, transfusión de plaquetas, valores de hemograma y bioquímica al ingreso y al alta y presencia de hematuria y proteinuria, hipertensión y función renal a los 6 meses, 1 año, 2 años, 5 años, 10 años y en la última revisión, y fallecimiento.
Se definió afectación renal residual o enfermedad renal crónica (ERC) en el último control como la existencia de disminución del FGE, proteinuria o hipertensión arterial en la última revisión.
Los siguientes conceptos se definieron como sigue:
- •
Anuria: diuresis menor a 0,5ml/kg/h
- •
Oliguria: diuresis menor de 0,5–1ml/kg/h.
- •
Proteinuria: más de 4mg/m2/h o más de una cruz en tiras reactivas.
- •
Hematuria: si presenta más de una cruz en una determinación de orina en por tira reactiva o más de 5 hematíes por campo en el sedimento urinario.
- •
Hipertensión arterial: tensión arterial sistólica o diastólica mayor del percentil 95 para la edad, sexo y talla, o si recibe tratamiento antihipertensivo.
- •
FGE: calculado mediante la fórmula de Schwartz12,13.
- •
Función renal normal: si presenta un FGE o un aclaramiento de creatinina mayor de 90ml/min/1,73m2, con ausencia de proteinuria o hipertensión arterial o hematuria. ERC estadio 1 si presenta un FGE mayor de 90ml/min/1,73m2 pero hipertensión arterial o proteinuria. Insuficiencia renal leve o estadio 2 si está comprendido entre 60–89ml/min/1,73m2; moderada o estadio 3 entre 30–59ml/min/1,73m2; grave o estadio 4 entre 15–29ml/min/1,73m2 y terminal o estadio 5, la menor de 15ml/min/1,73m2. La presencia de un filtrado glomerular disminuido, proteinuria o hipertensión arterial de forma mantenida más de 3 meses, fue definido como afectación renal o enfermedad renal crónica, según las guías KDOQI.
Para el procesamiento estadístico se utilizó el programa SPSS versión 15.0. Se realizó una estadística descriptiva de las variables referentes al episodio de SHU, así como de la evolución de los parámetros de afectación renal, usando medidas de tendencia central y de dispersión para las variables cuantitativas y distribuciones de frecuencias para las variables cualitativas. Se estimaron asociaciones entre variables clínicas y analíticas, seleccionadas según existencia de asociación en la literatura, y la presencia de afectación renal residual en la última revisión. Se utilizaron test Chi cuadrado o test exacto de Fischer cuando aquel no era aplicable, para estudiar asociación en el caso de variables cualitativas. Se empleó el test U de Mann-Whitney para comparación de medias al no encontrar condiciones de aplicabilidad el test t de Student. Se calculó la odds ratio para la estimación de riesgos en modelo univariante, considerando una asociación estadísticamente significativa, cuando el p<0,05. Se construyó un modelo multivariante de regresión logística para variables con p<0,20.
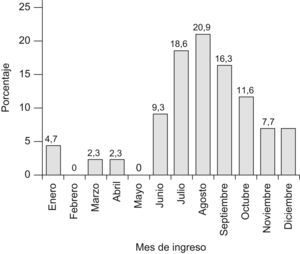
ResultadosDescripción de la muestraSe recogieron datos de 43 casos de SHU diagnosticados o tratados en nuestro hospital entre los años 1981–2006. De estos 21 eran niños (48,8%) y 22 niñas (51,2%). La edad media en el momento del ingreso fue de 3,1±2,2 años. El 76,7% de los ingresos se produjeron entre los meses de junio a octubre incluidos (fig. 1).
Evolución clínica durante su ingresoLos 43 pacientes diagnosticados de SHU ingresaron en el hospital durante una media de 26,4±19,4 días en el hospital. Un 95,3% (41) precisaron ingreso en UCIP. La mediana de ingreso en UCIP fue de 12,4 días (máximo 52, mínimo 1 días).
Se consideró que 41 pacientes (95,3%) presentaron algún tipo de pródromos; dentro de ellos, tenemos:Diarrea sanguinolenta 27 casos (66%) 9 casos (21,9%) 1 caso (2,4%) 1 caso (2,4%) 2 casos (4,9%) 1 caso (2,4%)
De los pacientes que presentaron diarrea como pródromos, la duración media de la misma fue de 4,5±2,9 días. Se obtuvo germen responsable de la diarrea en 6 de los 38 casos (15,8%):E. coli 0157:H7 3 casos (50%) 1 caso (16,6%) 1 caso (16,6%) 1 caso (16,6%)
Un 58% (25) ingresó con algún grado de oliguria o directamente en anuria. Del resto, 7 entraron posteriormente en oligoanuria. En total, 32/43 (74%) pacientes presentaron oligoanuria en algún momento de su evolución. El 42% (18) de los pacientes presentó hipertensión arterial en algún momento de su ingreso. Precisaron depuración extrarrenal 28 pacientes (65,12%) en algún momento del ingreso. Dos de ellos recibieron hemodiafiltración, el resto recibieron diálisis peritoneal. La duración de la depuración extrarrenal tuvo una mediana de 11 días, con rango intercuartílico 6–26,3 días.
El 21% (9) de los pacientes presentaron sintomatología neurológica durante o previamente al ingreso, sin secuelas posteriores:Crisis convulsivas 4 (9,3%) 2 (4,6%) 1 (2,3%) 1 (2,3%) 1 (2,3%)
Un 93% (40) de los pacientes recibió al menos una transfusión de sangre durante su ingreso, con una mediana de 2 transfusiones por paciente (rango=17–1). Un 23,3% (10) recibieron al menos una transfusión de plaquetas durante su ingreso (mediana=1; rango=6–1).
No observamos otras complicaciones menos frecuentemente descritas, como fallo cardíaco o pancreatitis.
Analítica y función renal al ingresoLos parámetros de la analítica al ingreso se resumen en la tabla 1.
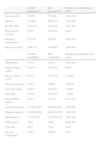
Resumen de la analítica sanguínea y función renal al ingreso
| n | Media | DE | Mínimo | Máximo | |
| Hemoglobina | 43 | 8,1 | 2,0 | 4,8 | 14,3 |
| Hematocrito | 43 | 23,6 | 5,50 | 14 | 42,3 |
| Leucocitos | 43 | 14.972 | 6.243 | 6.100 | 38.650 |
| Neutrófilos | 42 | 8.771,2 | 5.612 | 2.403 | 34.399 |
| Plaquetas | 41 | 61.065 | 51.126 | 12.000 | 300.000 |
| LDH | 36 | 2.351 | 1.289 | 808 | 6.499 |
| Proteínas Totales | 39 | 5,4 | 1,07 | 3,5 | 8,86 |
| Albúmina | 39 | 3,0 | 0,8 | 1,6 | 6,8 |
| Urea | 39 | 156,4 | 80,8 | 40 | 358 |
| Creatinina | 43 | 2,7 | 1,9 | 0,6 | 8,5 |
| Calcio | 36 | 8,3 | 0,9 | 6,2 | 10,2 |
| Fósforo | 43 | 5,7 | 1,8 | 2,7 | 9,9 |
| Sodio | 42 | 131 | 7,7 | 114 | 154 |
| Potasio | 43 | 4,9 | 1 | 3 | 7,9 |
| pH | 31 | 7,34 | 0,05 | 7,24 | 7,45 |
| Bicarbonato | 32 | 17,4 | 4,24 | 9,7 | 25 |
| Esquistocitos | Presentes en 41 casos. En 3 casos no fueron determinados al ingreso | ||||
| FGE | 43 | 24,9 | 23,0 | 1,21 | 90 |
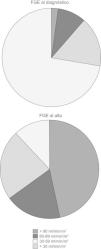
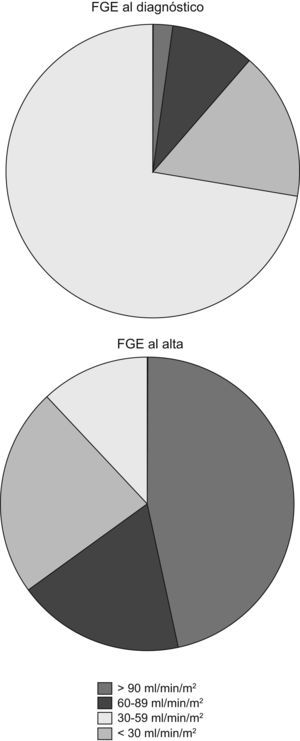
Solo 1 paciente fue diagnosticado de SHU con un FGE normal. El resto presentaban disminución del FGE en el momento del diagnóstico de SHU:
- •
Cuatro casos (9,3%) presentaban un FGE entre 60–89ml/min/1,73m2.
- •
Siete casos (16,3%), entre 30–59ml/min/1,73m2.
- •
Treinta y un casos (72,3%), menor de 30ml/min/1,73m2.
El 93% de los pacientes presentaban en el momento del ingreso algún grado de hematuria; el 83,7% de los pacientes presentaban algún grado de proteinuria.
Analítica y función renal al altaLos parámetros de la analítica sanguínea y la función renal quedan resumidos en la tabla 2.
Resumen de la analítica sanguínea y función renal al alta
| n | Media | DE | Mín. | Max. | Rango | |
| Hemoglobina | 43 | 9,7 | 1,3 | 6,9 | 12,8 | 5,9 |
| Hematocrito | 41 | 29,2 | 3,8 | 21,6 | 38,7 | 17,1 |
| Leucocitos | 42 | 7.583 | 3.002 | 680 | 17.430 | 16.750 |
| Neutrófilos | 42 | 3.243 | 2.224 | 252 | 12.550 | 12.298 |
| Plaquetas | 38 | 325.816 | 157.301 | 46.000 | 704.000 | 658.000 |
| LDH | 24 | 409,6 | 197,0 | 9,0 | 926,0 | 917,0 |
| Proteínas Totales | 39 | 6,4 | 0,7 | 4,4 | 8,0 | 3,6 |
| Albúmina | 38 | 3,6 | 0,6 | 1,3 | 5,0 | 3,7 |
| Urea | 38 | 58,2 | 43,9 | 24,0 | 241,0 | 217,0 |
| Creatinina | 43 | 1,0 | 0,9 | 0,2 | 4,2 | 4,0 |
| Calcio | 33 | 9,4 | 0,7 | 8,0 | 10,8 | 2,8 |
| Fósforo | 39 | 4,9 | 0,8 | 2,0 | 6,7 | 4,7 |
| Sodio | 42 | 140,1 | 3,2 | 133,0 | 147,0 | 14,0 |
| Potasio | 42 | 4,5 | 0,7 | 2,7 | 6,0 | 3,3 |
| pH | 14 | 7,4 | 0,1 | 7,3 | 7,5 | 0,3 |
| Bicarbonato | 16 | 22,4 | 4,3 | 16,0 | 31,3 | 15,3 |
| Esquistocitos | Solamente determinados en 20 casos al alta; 2 de ellos positivos | |||||
| FGE | 43 | 76,5 | 38,4 | 13,8 | 152 | 138,2 |
Veinte pacientes se fueron de alta con un FGE por encima de 90ml/min/1,73m2. El resto presentaban disminución del FGE en el momento del alta:
- •
Ocho casos (18,6%) presentaban un FGE entre 60–89ml/min/1,73m2.
- •
Diez casos (23,3%), entre 30–59ml/min/1,73m2.
- •
Cinco casos (11,6%), menor de 30ml/min/1,73m2.
Dieciocho pacientes (41,8%) se fueron de alta con algún grado de proteinuria; 16 pacientes (37,2%) presentaban en el momento del alta algún grado de hematuria. Los cambios en el filtrado glomerular al ingreso y al alta quedan reflejados en la figura 2.
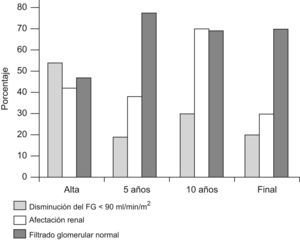
Datos de seguimientoNingún paciente falleció durante su estancia hospitalaria ni durante su seguimiento posterior. Se obtuvieron datos del seguimiento, más allá de 3 meses, de 37 de los 43 pacientes (86%). La duración media del seguimiento de estos pacientes fue de 6,6 años (mediana 5 años; rango intercuartílico [2–10 años]). Ocho pacientes (21,6%) presentaban algún grado de disminución del filtrado glomerular en el momento del último control y, si incluimos la proteinuria y la hipertensión arterial como secuelas renales o ERC, son 13 (35,1%) los pacientes con algún grado de afectación renal residual. Tres pacientes (8,1%) entraron en insuficiencia renal terminal durante su seguimiento. Hay que añadir otro paciente que fue trasladado a otro hospital sin recuperar función renal tras el brote. En un paciente se pudo retirar la diálisis peritoneal ambulatoria tras varios meses. Ver figura 3 y tabla 3.
Resumen de la función renal y afectación renal residual en el último control (n=37)
| n | % | |
| Función renal normal (FGE>90 ml/min/m2)+ausencia de proteinuria y HTA | 24 | 64,9 |
| Insuficiencia renal leve-estadio 2 (FGE 60–89ml/min/m2) | 2 | 5,4 |
| Insuficiencia renal moderada-estadio 3 (FGE 30–59ml/min/m2) | 3 | 8,1 |
| Insuficiencia renal grave-terminal-estadios 4 y 5 (FGE 0–29ml/min/m2) | 3 | 8,1 |
| Proteinuria (incluida microalbuminuria) | 4 | 10,8 |
| Proteinuria+HTA | 1 | 2,7 |
| Total | 37 | 100 |
| FGE<90ml/min/m2 | 8 | 21,6 |
| Afectación renal-enfermedad renal crónica (disminución FGE, pProteinuria, HTA) | 13 | 35,1 |
Buscando los posibles marcadores pronósticos de función renal, se investigaron las asociaciones de la ERC en la última revisión con las variables descritas en la tabla 4. Posteriormente, se realizó una regresión logística para calcular la odds ratio para ERC en la última revisión con respecto a las variables que resultaron significativas (tabla 5). Finalmente, se creó un modelo de regresión logística múltiple simplificando el número de variables (ver también tabla 5). Se eligieron variables cuya p<0,20 eliminando aquellas que fuesen claramente dependientes entre sí ya a priori. Este es el caso, por ejemplo, de duración de la estancia, duración de la depuración extrarrenal y filtrado glomerular al alta con duración de la anuria. Algunas de las variables no eran significativas en el análisis de regresión logística univariante pero están descritas en la literatura como asociadas a un peor pronóstico. Finalmente, se eliminó también la hipertensión arterial al demostrarse una clara asociación (p=0,001) con una anuria mayor de 5 días. El modelo multivariante muestra asociación de la afectación renal a largo plazo solamente con una anuria mayor de 5 días (tabla 5).
Características de los pacientes en la última revisión según ERC (n=24) o no ERC (n=13)
| No ERC (pacientes/%) | ERC (pacientes/%) | Significación estadística (p-valor) | |
| Sexo femenino | 12/50% | 7/53,8% | 0,823 NS |
| Diarrea | 24/100% | 10/83,3% | 0,105 NS |
| Recibió TDE | 12/52,2% | 11/84,6% | 0,052 NS |
| Hipertensión arterial | 6/25% | 10/76,9% | 0,002 |
| Síntomas neurológicos | 3/12,5% | 5/38,5% | 0,067 NS |
| Ingreso en UCIP | 22/91,7% | 13/100% | 0,285 NS |
| No ERC (media/DS) | ERC (media/DS) | Significación estadística (p-valor) | |
| Edad (años) | 3,4/2,3 | 2,6/2,2 | 0,192 NS |
| Días de ingreso totales | 17,0/7,8 | 39,3/21,5 | 0,001 |
| Días de ingreso UCIP | 9,5/7,0 | 23,8/13,0 | < 0,001 |
| Duración oliguria | 2,2/3,4 | 4,0/6,6 | 0,96 NS |
| Duración anuria | 2,0/3,8 | 16,4/19,3 | < 0,001 |
| Días TDE | 3,7/4,5 | 23,4/20,5 | < 0,001 |
| Hemoglobina ingreso | 8,1/1,7 | 8,4/2,6 | 0,774 NS |
| Leucocitos ingreso | 13.313/3.756 | 16.945/6.462 | 0,101 NS |
| Plaquetas Ingreso | 62.465/40.763 | 68.667/74.747 | 0,835 NS |
| LDH ingreso | 3.152/4.510 | 10.555/27.371 | 0,592 NS |
| FGE ingreso | 29/24 | 20/23 | 0,098 NS |
| FGE alta | 86/27 | 57/43 | 0,021 |
| Años de seguimiento | 5,3/4,2 | 9,0/5,6 | 0,037 |
TDE: técnicas depuración extrarrenal.
Estimación de factores de riesgo para ERC en última revisión
| Univariante | Multivariante | |||
| OR (IC95%) | Sig. | OR (IC95%) | Sig. | |
| Diarrea | No calculable | 0,999 NS | No calculable | 0,999 NS |
| HTA | 10 (2,05–48,90) | 0,04 | Eliminada (ver texto) | – |
| S. neurológicos | 4,38 (0,84–22,70) | 0,079 NS | 0,19 (0,01–5,10) | 0,321 NS |
| Edad<1 año | 9, 78 (0,96–99,94) | 0,055 NS | 2,84 (0,004–1896,19) | 0,753 NS |
| Anuria > 5 días | 36,67 (5,30–253,77) | <0,001 | 125,42 (4,01–3920,52) | 0,006 |
| Leucocitos>17.000 | 4,43 (1,02–19,27) | 0,047 | 8,89 (0,56–140,96) | 0,121 NS |
| OR (IC95%) | Sig. | |||
| Ingreso>25 días | 24,75 (3,83 –159,97) | 0,001 | ||
| UCIP > 10 días | 18,33 (2,02 –166,73) | 0,010 | ||
| TDE > 5 días | 15 (2,54 –88,70) | 0,003 | ||
| FGE alta <60 | 4,8 (1,13 –20,46) | 0,034 | ||
FGE alta<60: FGE al alta menor de 60ml/min/1,73m2; Ingreso>25 días: duración total del ingreso hospitalario mayor de 25 días; NS: no significativo estadísticamente; OR IC95%: intervalo de confianza para la odds ratio al 95%; Sig.: significación estadística expresada en p-valor; TDE> 5 días: aplicación de técnicas de depuración extrarrenal durante más de 5 días; UCIP>10 días: estancia en UCIP mayor de 10 días.
Dado el diseño retrospectivo y al ser el hospital en el que se ha realizado dicho estudio un centro al que se refieren pacientes de otras áreas y comunidades autónomas, es imposible hacer estimaciones de incidencia de la enfermedad. Sin embargo, sí permite obtener conclusiones adecuadas a nuestro entorno sociosanitario.
Nuestro estudio coincide con los resultados de múltiples estudios realizados sobre el SHU, en varias de sus conclusiones. La edad de nuestros pacientes fue similar a lo publicado previamente. Así, en cuanto al pico de incidencia de esta patología, en nuestro estudio el 76% de los casos fueron ingresados entre los meses de junio a octubre. Se sabe que este hecho tiene que ver con la mayor incidencia de la gastroenteritis por E. coli productor de verotoxina14. Asimismo, la mayoría de pacientes presentaban como antecedente diarrea, clasificándose en una forma típica de SHU, lo cual es coincidente con otros países de nuestro entorno. Es destacable la existencia de 2 casos con diagnóstico de infección urinaria, si bien acompañada de diarrea15,16. En nuestro caso solo hemos detectado 3 casos de este patógeno, debido a que se ha empezado a investigar en los últimos 8 años. Encontramos, en consonancia, un porcentaje de casos de SHU D+ del 88,73%, similar a otras series5,6,11,14.
Cabe destacar el elevado número de transfusiones de hemoderivados, tanto de concentrado de hematíes como de plaquetas, sensiblemente mayor que lo publicado. Las indicaciones de transfusión de concentrado de hematíes no difieren de las indicaciones generales. Por otra parte, la transfusión de plaquetas solo está indicada en caso de sangrado activo con trombopenia muy marcada6.
La incidencia de sintomatología neurológica fue similar a lo descrito previamente. Sin embargo, en nuestra revisión no hemos encontrado secuelas a largo plazo5–11. Debemos señalar que no se produjo ningún fallecimiento, cuando se describe habitualmente una mortalidad en fase aguda de un 3–5%5–11. Pudiera pensarse que hay un sesgo por las características de los pacientes. Sin embargo, el porcentaje de ellos en insuficiencia renal grave al ingreso, los que precisaron depuración extrarrenal, los que presentaron afectación neurológica y los pacientes SHU D-, por mencionar algunos parámetros que se encuentran en la literatura asociados a un mal pronóstico, es similar, incluso superior, a lo observado en otras publicaciones6.
Las variables descritas como pronósticas de la función renal a largo plazo son múltiples y todas ellas parecen sugerir un mayor grado de afectación sistémica y de daño renal durante el brote6. En nuestra serie de casos hemos encontrado asociación estadística con varias de las variables recogidas lo que, aun asumiendo todas las limitaciones que suponen los estudios retrospectivos, nos permite hablar de posibles factores y marcadores pronósticos de afectación renal. Coincidimos con otros estudios en la importancia de la duración de la anuria, descrita como uno de los predictores más fiables de afectación renal a largo plazo. Sin embargo, su ausencia no excluye las secuelas renales a largo plazo17. Esto se debe a los mecanismos de hiperfiltración desencadenados por la pérdida de masa renal en la fase aguda, que hacen progresar el daño.
No hemos encontrado asociación con otras variables descritas6,11,18 como son: sexo femenino, edad al debut, grado de anemia, el filtrado glomerular al ingreso, el SHU atípico o D- o la presencia de sintomatología neurológica. Es conveniente destacar que el tamaño muestral de nuestro estudio resulta limitante a la hora de emplear test estadísticos potentes y disminuye claramente la posibilidad de obtener resultados significativos, así como de obtener intervalos de confianza estrechos. Por ello, hay que tomar con cautela los resultados del análisis de riesgos para ERC en el último control.
La prevalencia de afectación renal a largo plazo es similar a la obtenida en un metanálisis reciente6,19 (centrado en los casos secundarios a diarrea), si bien es difícil comparar estudios por las diferencias en el tiempo de seguimiento y los criterios para definir dicha afectación. Creemos que nuestro estudio tiene una calidad aceptable en este aspecto, porque los criterios están bien definidos y porque el seguimiento es superior a 4 años, momento a partir del cual no parece aumentar la prevalencia de lesión residual, según este metaanálisis. Tomando como punto de corte los 5 y 10 años de seguimiento, se obtiene, en nuestro estudio, porcentajes de afectación renal y de estadios 2 o mayor de ERC mayores de los globales. La duración del seguimiento es significativamente mayor en el grupo de ERC, lo que sugiere un sesgo por pérdida de los pacientes con una evolución más favorable. Respecto al deterioro del filtrado glomerular, hay un porcentaje algo mayor de lo publicado habitualmente en estadio grave o terminal, y menor en leve o estadio 2, lo cual se observa en algunos de los estudios con mayor número de pacientes y en aquellos con mayor tiempo de seguimiento6,20 Encontramos discrepancias con otra revisión de casos española, publicada recientemente21, en la que solo un 1,7% (1/58) de los pacientes necesitaron un trasplante renal. Otras diferencias destacables con esta serie son la menor utilización de técnicas de depuración extrarrenal en fase aguda (48% por 65% en nuestra serie), lo cual podría explicarse por diferencias entre los pacientes o en los criterios de indicación de estas técnicas; y la existencia de secuelas neurológicas. Por el contrario, en esta revisión tampoco hay descritos fallecimientos.
Como conclusión podemos decir que una destacable proporción de un tercio de nuestros pacientes presentó ERCen su evolución a largo plazo. En este estudio se observa una asociación de esta evolución desfavorable con una afectación más prolongada y grave de la función renal durante el brote hemolítico-urémico, expresada como una anuria más prolongada.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.