El síndrome de apneas-hipopneas del sueño (SAHS) y la obesidad infantil son dos entidades con alta prevalencia que constituyen un problema de salud pública.
ObjetivoAnalizar la interacción entre ambas, comparando grupos de niños que presentaban o no ambas condiciones.
Pacientes y metodologíaEstudio prospectivo en niños (3-14 años), remitidos a la «Unidad Multidisciplinar de Sueño» por sospecha de SAHS, entre el 1/11/2015 y el 1/08/2017. Se evaluaron los siguientes parámetros: antropometría, síntomas, tensión arterial, exploración otorrinolaringológica, polisomnografía (PSG nocturna) y estudio analítico.
ResultadosSe valoraron 67 niños, 64% no obesos y 36% obesos.
Se observó que los obesos tenían más edad (p<0,001), dormían menos horas (p=0,028), realizaban menos ejercicio físico (p=0,029), comían menos en comedor escolar (p=0,009), tenían menor eficiencia del sueño y presentaban valores alterados en el metabolismo hidrocarbonado y lipídico.
Los niños que presentaban SAHS tenían menor edad (p=0,010), un mayor porcentaje de somnolencia diurna (p=0,001) y respiración bucal (p=0,006), mayor percentil de tensión arterial diastólica (p=0,019) y menor IGF-1 (p=0,003) que los que no presentaban SAHS.
La comparación de los grupos de SAHS no obesos frente SAHS obesos, reveló que los primeros eran de menor edad (p=0,010), roncaban más (p=0,012), tenían mayor severidad del SAHS (IAH 13,1 vs. 5,4, p=0,041) y mayor GOT (p≤0,001) y en el segundo grupo, se objetivó que dormían menos horas (p=0,038) y mostraban valores mayores de glucosa (p=0,039), insulina (p<0,001) y HOMA (p<0,001).
ConclusiónEl comportamiento del SAHS es diferente en los niños con y sin obesidad, presentando diferencias en la edad, características clínicas, severidad del SAHS y alteraciones metabólicas. Los niños con diagnóstico de SAHS tienen mayor percentil de tensión arterial diastólica. La obesidad conlleva una peor calidad de sueño y alteraciones en el metabolismo hidrocarbonado y lipídico.
Sleep apnoea-hypopnoea syndrome (SAHS) and childhood obesity are la high prevalence conditions that represent a public health challenge.
ObjectiveTo analyse the association between both and comparing child groups that had or did not have both conditions.
Patients and methodsA prospective study in children (3-14 years), referred to the “Multidisciplinary Sleep Unit” due to suspected SAHS, between 1 November 2015 and 1 August 2017. The following parameters were evaluated: anthropometry, symptoms, blood pressure, ear, nose, and throat examination, polysomnography (nocturnal PSG) and laboratory tests.
ResultsA total of 67 children were evaluated (64% non-obese and 36% obese.
It was observed that the obese were older (P<.001), slept less hours (P=.028), did less physical exercise (P=.029), ate less in the school dining room (P=.009), had la lower sleep efficiency, and had abnormal values in carbohydrate and lipid metabolism.
The children with SAHS were younger (P=.010), a high percentage of daytime sleepiness (P=.001), and breathing through the mouth (P=.006), greater percentile of diastolic blood pressure (P=.019) and a lower IGF-1 (P=.003) than those that did not have SAHS.
The comparison of the SAHS non-obese and SAHS obese groups, showed that the first group were younger (P=.010), snored more (P=.012), had a more severe SAHS (IAH 13.1 vs. 5.4, P=.041), and a higher GOT (P<.001). In the second group, they slept less hours P=.038) and showed lower values of glucose (P=.039), insulin (P<.001), and HOMA (P<.001).
ConclusionThe behaviour of SAHS is different in obese children and non-obese children, with differences in age, clinical characteristics, severity of SAHS, and metabolic changes. The children diagnosed with SAHS were in the higher percentile of diastolic blood pressure. Obesity was associated with worse sleep quality, and changes in carbohydrate and lipid metabolism.
Los trastornos respiratorios del sueño son muy frecuentes en población infantil, asociándose con importantes consecuencias para la salud, como alteraciones del crecimiento, metabólicas, cardiovasculares, neurocognitivas y calidad de vida.
El síndrome de apnea-hipopnea durante el sueño (SAHS) es el trastorno respiratorio más frecuente durante el sueño, afectando entre 2-4% de los niños entre 2-6 años, coincidiendo con la etapa de mayor hipertrofia fisiológica del tejido adenoamigdalar1, siendo dicha hipertrofia la causa más frecuente de SAHS infantil.
El diagnóstico de SAHS se basa en sospecha clínica, a través de anamnesis y exploración física, requiriendo para confirmación la realización de un estudio de sueño nocturno, poligrafía respiratoria o polisomnografía nocturna (PSG)2.
Por otra parte, existe asociación entre obesidad y SAHS en adultos, siendo esta asociación cada vez más evidente en niños. En el estudio NANOS realizado en España en niños obesos, la prevalencia de SAHS fue elevada, entre 21,5%-39,5%3.
La prevalencia de obesidad infantil a nivel mundial ha alcanzado niveles de epidemia, habiéndose convertido en un problema de salud pública4. La prevalencia de obesidad en nuestro país, al igual que en el resto del mundo, sigue aumentando y así, en el último estudio ALADINO en niños (6-9 años), el 20,4% de los niños y 15,8% de las niñas presentaban obesidad5.
Obesidad y SAHS son entidades que, en sí mismas, generan una acusada morbilidad. Nuestra hipótesis trata de verificar la interacción entre ambas, lo cual implicaría diferencias clínicas, polisomnográficas y metabólicas entre SAHS obesos y SAHS no obesos.
Así, el presente estudio tiene como objetivo describir las características de los niños derivados a la consulta de una Unidad del Sueño por sospecha de SAHS. Se trata de una cohorte con sujetos con y sin obesidad, lo que nos permite analizar las diferencias entre varios grupos: obesos (Ob) versus no obesos (NOb), SAHS versus no SAHS y SAHS Ob versus SAHS Nob.
Pacientes y métodoRealizamos un estudio prospectivo en niños de ambos sexos entre 3 y 14 años, remitidos por sospecha clínica de SAHS a la «Unidad Multidisciplinar de Sueño» de un Hospital Universitario de tercer nivel, habiendo sido aprobado por el Comité Ético de Investigación. Se obtuvo el consentimiento informado de padres y/o tutores legales y niños mayores de 12 años, de todos los niños incluidos en el estudio, asignándose un código a cada participante, con objeto de garantizar el anonimato y confidencialidad de los datos.
Fueron incluidos consecutivamente en el estudio los niños remitidos por sospecha clínica de SAHS (presencia de ronquido y/o pausas respiratorias), que cumplieran los criterios de inclusión y no presentaran ninguno de exclusión. Se definieron como criterios de inclusión: 1) niños/as entre 3 y 14 años procedentes de pediatría de Atención Primaria; 2) firma del consentimiento informado. Fueron excluidos niños con presencia de anomalías craneofaciales, síndromes dismórficos, retraso psicomotor y trastornos genéticos/neuromusculares, así como los tratados previamente con adenoamigdalectomía o de SAHS, y aquellos que no firmaron el consentimiento.
Se definió obesidad en función de edad y sexo, con un percentil de índice de masa corporal (IMC) ≥ 95 (gráficas de la Fundación Orbegozo 2004)6.
La población de estudio fue distribuida en dos grupos, en función de la presencia o no de obesidad: Grupo Ob y Grupo NOb.
A todos los niños se les realizó: 1) recogida de antecedentes generales (sexo, etnia, antecedentes perinatales). 2) Historia clínica general y cuestionario de sueño: Pediatric Sleep Questionnaire, versión española abreviada y validada (Cuestionario de Chervin)7. Una puntuación ≥ a 0,33 fue considerada sugestiva de SAHS8. 3) Exploración física y antropometría: peso (kg), talla (m) e IMC (kg/m2) y percentiles6; tensión arterial (TA) matutina con tensiómetro automático. Se realizaron tres determinaciones a intervalos, utilizándose para el análisis por percentiles, la media de las dos últimas determinaciones9. 4) Exploración otorrinolaringológica, valoración de hipertrofia adenoidea y amigdalar. El tamaño amigdalar graduado de 0 a IV, en función del tamaño y ocupación del espacio interamigdalar. Grado 0: ausencia de amígdalas; Grado I: hipertrofia amigdalar 0-25%; Grado II: 25-50%; Grado III: 50-75%; Grado IV: 75-100%10. Las adenoides se valoraron con rinoscopia anterior y fibroendoscopia.
A todos se les realizó una PSG vigilada en el laboratorio de la «Unidad Multidisciplinar de Sueño», con monitorización de electroencefalograma, electrooculograma derecho e izquierdo, electromiograma tibial y submentoniano, electrocardiograma, flujo oronasal mediante termistor, movimientos torácicos y abdominales mediante bandas, posición corporal mediante sensor de posición, saturación de oxígeno y frecuencia cardiaca mediante pulsioxímetro, ronquido y flujo aéreo mediante cánula nasal y registro continuo de dióxido de carbono (CO2) transcutáneo. Para la valoración de los estadios de sueño y de eventos respiratorios se siguieron los criterios AASM (2012)11. La proporción del tiempo total de sueño en cada estadio de sueño fue expresada mediante (%) del tiempo total de sueño. El índice de apnea (IA) e índice de apnea-hipopnea (IAH), se definieron como el número de apneas y número de apneas e hipopneas por hora de sueño respectivamente. Asimismo se calculó el IAH obstructivo (IAHo), IAH central (IAHc) y Respiratory Disturbance Index: número de apneas, hipopneas y Respiratory Event Related Arousals (RERAS) por hora de sueño.
Tomando como referencia los criterios del Documento de Consenso del síndrome de apneas hipopneas durante el sueño en niños2, tanto el diagnóstico como la indicación de tratamiento del SAHS están determinados por la presencia de un IAH ≥ 3, independientemente de si existe o no hipoventilación obstructiva en la PSG.
Se valoraron parámetros analíticos inflamatorios, metabólicos y endocrinológicos. La extracción sanguínea se efectuó a la mañana siguiente de la PSG.
Análisis estadísticoSe utilizó el software SPSS (versión 22, Chicago, IL). Los datos son expresados como mediana y rango intercuartil para variables cuantitativas y como número y porcentaje para las variables categóricas, comparando con otra variable dicotómica. Las variables continuas se compararon mediante la prueba U de Mann Whitney, y las variables categóricas mediante Chi cuadrado o prueba exacta de Fisher. El nivel de significación fue p ≤ 0,05.
ResultadosDurante el periodo 1/11/2015 a 1/08/2017 se incluyen 67 niños, 60% varones y 40% mujeres, remitidos por sospecha clínica de SAHS a la «Unidad Multidisciplinar del Sueño». La mediana de edad fue de 5,5 años (rango intercuartil 4,3-7,7). La etnia mayoritaria caucásica 86%, hispana 13% y 2% asiática.
El 64% (43), fueron NOb versus 36% (24) Ob. El 93% de los niños presentaban hipertrofia amigdalar (grado II-III-IV), 91% ronquido y 60% respiración bucal.
En la serie, 14 pacientes tenían antecedentes familiares de SAHS (16% padre, 2% madre y 5% hermanos). Como antecedentes familiares metabólicos, 28% de los padres eran obesos, 17% de las madres y 4% de los hermanos; asociaban dislipemia 16% de los padres, 5% de las madres y 2% de los hermanos, y HTA un 6% de los padres y 5% de las madres.
El Cuestionario de Chervin para el diagnóstico de trastornos respiratorios del sueño, fue positivo en el 70%. Mediante PSG, un 39% fueron diagnosticados de SAHS sin hipoventilación obstructiva, 4% SAHS con hipoventilación obstructiva, 24% limitaciones al flujo sin criterios diagnósticos de SAHS y 33% no presentaron patología respiratoria.
En cuanto al tratamiento, en un 39% se realizó adenoamigdalectomía y adenoidectomía en un 1%, tratamiento higiénico-dietético en 18%, farmacológico (corticoides tópicos nasales y antileukotrienos) en 5% y control evolutivo en 25 pacientes.
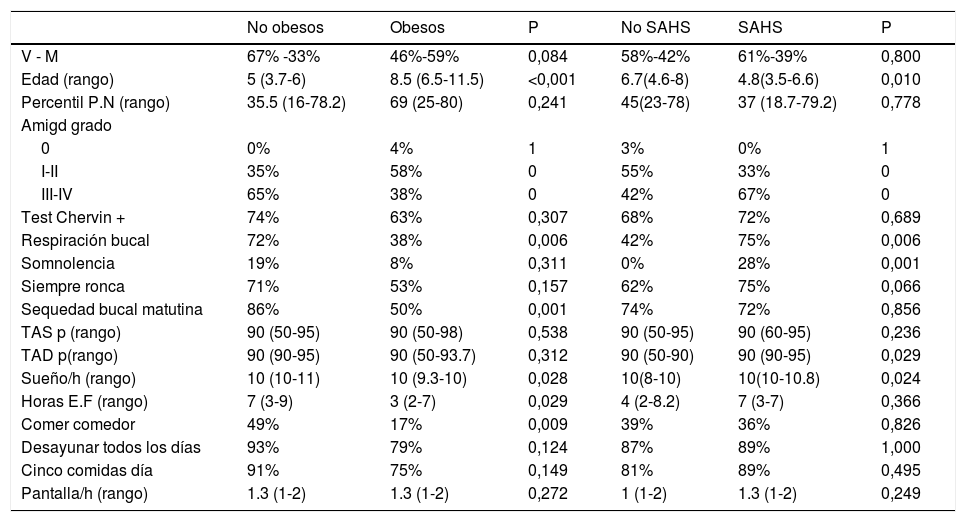
Valoración obesos vs. no obesosAl analizar las diferencias en función de la presencia de obesidad (tabla 1), niños Ob (24) versus NOb (43), se observaron diferencias significativas en cuanto a los siguientes parámetros: los NOb tenían menor edad, mayor presencia de respiración bucal y sequedad bucal matutina, mayor tamaño amigdalar, no encontrándose diferencias en cuanto al sexo, peso al nacimiento y puntuación en el cuestionario Chervin.
Características generales no obesos vs obesos y no SAHS vs SAHS
| No obesos | Obesos | P | No SAHS | SAHS | P | |
|---|---|---|---|---|---|---|
| V - M | 67% -33% | 46%-59% | 0,084 | 58%-42% | 61%-39% | 0,800 |
| Edad (rango) | 5 (3.7-6) | 8.5 (6.5-11.5) | <0,001 | 6.7(4.6-8) | 4.8(3.5-6.6) | 0,010 |
| Percentil P.N (rango) | 35.5 (16-78.2) | 69 (25-80) | 0,241 | 45(23-78) | 37 (18.7-79.2) | 0,778 |
| Amigd grado | ||||||
| 0 | 0% | 4% | 1 | 3% | 0% | 1 |
| I-II | 35% | 58% | 0 | 55% | 33% | 0 |
| III-IV | 65% | 38% | 0 | 42% | 67% | 0 |
| Test Chervin + | 74% | 63% | 0,307 | 68% | 72% | 0,689 |
| Respiración bucal | 72% | 38% | 0,006 | 42% | 75% | 0,006 |
| Somnolencia | 19% | 8% | 0,311 | 0% | 28% | 0,001 |
| Siempre ronca | 71% | 53% | 0,157 | 62% | 75% | 0,066 |
| Sequedad bucal matutina | 86% | 50% | 0,001 | 74% | 72% | 0,856 |
| TAS p (rango) | 90 (50-95) | 90 (50-98) | 0,538 | 90 (50-95) | 90 (60-95) | 0,236 |
| TAD p(rango) | 90 (90-95) | 90 (50-93.7) | 0,312 | 90 (50-90) | 90 (90-95) | 0,029 |
| Sueño/h (rango) | 10 (10-11) | 10 (9.3-10) | 0,028 | 10(8-10) | 10(10-10.8) | 0,024 |
| Horas E.F (rango) | 7 (3-9) | 3 (2-7) | 0,029 | 4 (2-8.2) | 7 (3-7) | 0,366 |
| Comer comedor | 49% | 17% | 0,009 | 39% | 36% | 0,826 |
| Desayunar todos los días | 93% | 79% | 0,124 | 87% | 89% | 1,000 |
| Cinco comidas día | 91% | 75% | 0,149 | 81% | 89% | 0,495 |
| Pantalla/h (rango) | 1.3 (1-2) | 1.3 (1-2) | 0,272 | 1 (1-2) | 1.3 (1-2) | 0,249 |
SAHS (Síndrome de apneas-hipopneas del sueño), V (varón), M (mujer), P.N (peso nacimiento), Amigd (amígdalas), IAH (índice apnea hipopnea), TAS p (tensión arterial sistólica percentil), TAD p (tensión arterial diastólica percentil), E.F (ejercicio físico), h (horas).
En el grupo de niños Ob, sus padres también lo eran un 50% y sus madres 30%, frente al 17% de padres y 10% de madres en NOb (p=0,005 y p=0,032).
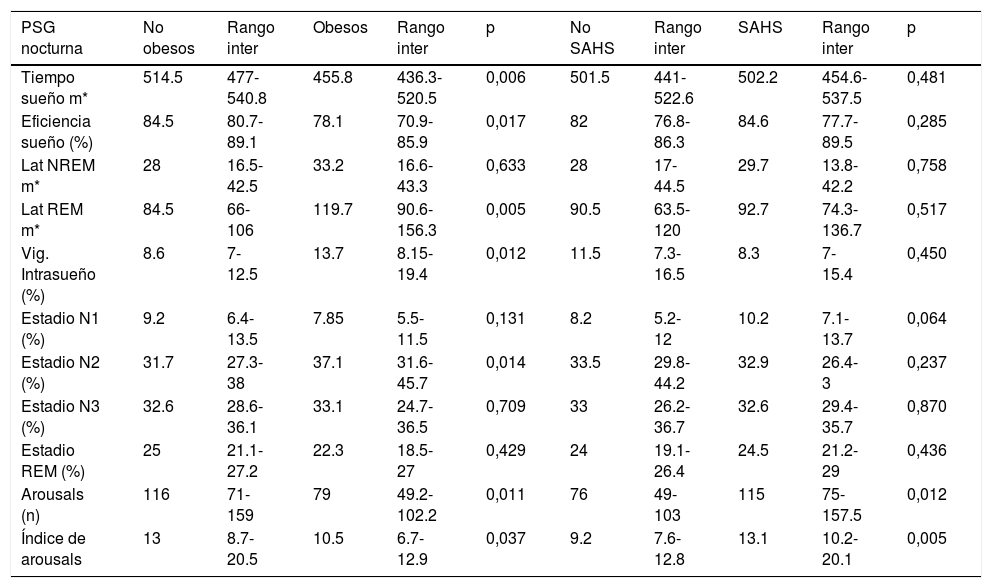
En los hábitos higiénico-dietéticos (tabla 1), al comparar Ob/NOb, hubo diferencias significativas, de forma que los Ob dormían menos horas, realizaban menos horas de ejercicio físico semanales y un menor porcentaje comían en comedor escolar. Al comparar los parámetros de la PSG nocturna (tablas 2 y 3) entre estos grupos, los niños obesos tenían menor TTS, menor eficiencia del sueño, menos arousals, menor IAH REM e IAHc, mayor latencia al sueño REM, mayor porcentaje de la vigilia intrasueño y estadio N2.
Parámetros polisomnográficos neurofisiológicos
| PSG nocturna | No obesos | Rango inter | Obesos | Rango inter | p | No SAHS | Rango inter | SAHS | Rango inter | p |
|---|---|---|---|---|---|---|---|---|---|---|
| Tiempo sueño m* | 514.5 | 477-540.8 | 455.8 | 436.3-520.5 | 0,006 | 501.5 | 441-522.6 | 502.2 | 454.6-537.5 | 0,481 |
| Eficiencia sueño (%) | 84.5 | 80.7-89.1 | 78.1 | 70.9-85.9 | 0,017 | 82 | 76.8-86.3 | 84.6 | 77.7-89.5 | 0,285 |
| Lat NREM m* | 28 | 16.5-42.5 | 33.2 | 16.6-43.3 | 0,633 | 28 | 17-44.5 | 29.7 | 13.8-42.2 | 0,758 |
| Lat REM m* | 84.5 | 66-106 | 119.7 | 90.6-156.3 | 0,005 | 90.5 | 63.5-120 | 92.7 | 74.3-136.7 | 0,517 |
| Vig. Intrasueño (%) | 8.6 | 7-12.5 | 13.7 | 8.15-19.4 | 0,012 | 11.5 | 7.3-16.5 | 8.3 | 7-15.4 | 0,450 |
| Estadio N1 (%) | 9.2 | 6.4-13.5 | 7.85 | 5.5-11.5 | 0,131 | 8.2 | 5.2-12 | 10.2 | 7.1-13.7 | 0,064 |
| Estadio N2 (%) | 31.7 | 27.3-38 | 37.1 | 31.6-45.7 | 0,014 | 33.5 | 29.8-44.2 | 32.9 | 26.4-3 | 0,237 |
| Estadio N3 (%) | 32.6 | 28.6-36.1 | 33.1 | 24.7-36.5 | 0,709 | 33 | 26.2-36.7 | 32.6 | 29.4-35.7 | 0,870 |
| Estadio REM (%) | 25 | 21.1-27.2 | 22.3 | 18.5-27 | 0,429 | 24 | 19.1-26.4 | 24.5 | 21.2-29 | 0,436 |
| Arousals (n) | 116 | 71-159 | 79 | 49.2-102.2 | 0,011 | 76 | 49-103 | 115 | 75-157.5 | 0,012 |
| Índice de arousals | 13 | 8.7-20.5 | 10.5 | 6.7-12.9 | 0,037 | 9.2 | 7.6-12.8 | 13.1 | 10.2-20.1 | 0,005 |
PSG: Polisomnografía; m* (minutos), Lat (latencia), Vig. (vigilia), n (número).
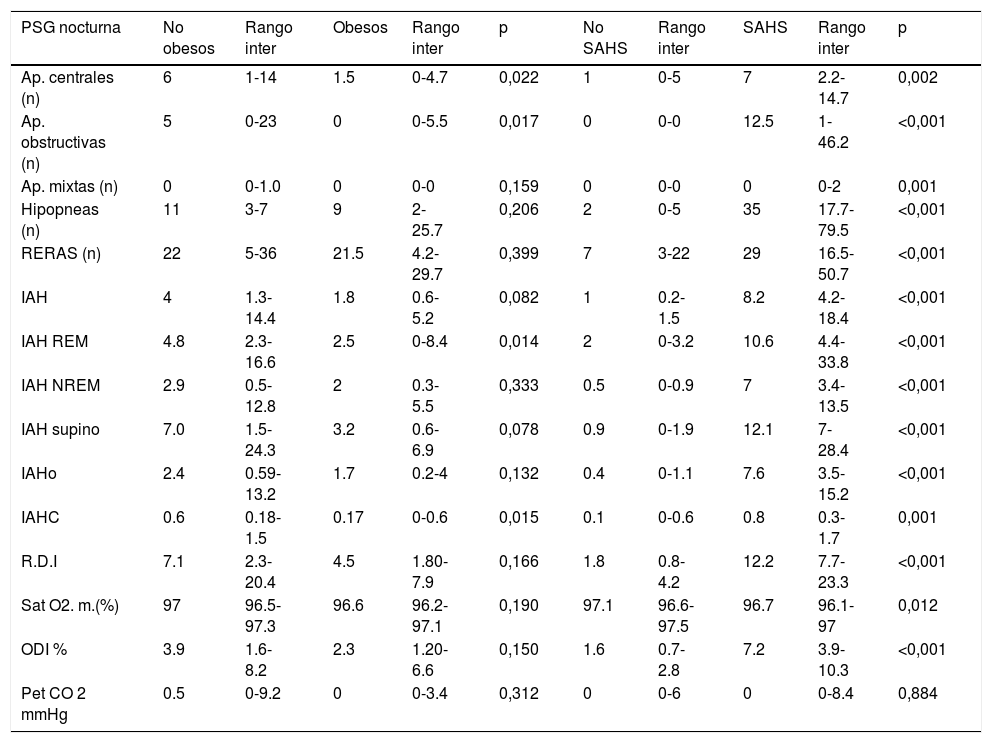
Parámetros polisomnográficos respiratorios
| PSG nocturna | No obesos | Rango inter | Obesos | Rango inter | p | No SAHS | Rango inter | SAHS | Rango inter | p |
|---|---|---|---|---|---|---|---|---|---|---|
| Ap. centrales (n) | 6 | 1-14 | 1.5 | 0-4.7 | 0,022 | 1 | 0-5 | 7 | 2.2-14.7 | 0,002 |
| Ap. obstructivas (n) | 5 | 0-23 | 0 | 0-5.5 | 0,017 | 0 | 0-0 | 12.5 | 1-46.2 | <0,001 |
| Ap. mixtas (n) | 0 | 0-1.0 | 0 | 0-0 | 0,159 | 0 | 0-0 | 0 | 0-2 | 0,001 |
| Hipopneas (n) | 11 | 3-7 | 9 | 2-25.7 | 0,206 | 2 | 0-5 | 35 | 17.7-79.5 | <0,001 |
| RERAS (n) | 22 | 5-36 | 21.5 | 4.2-29.7 | 0,399 | 7 | 3-22 | 29 | 16.5-50.7 | <0,001 |
| IAH | 4 | 1.3-14.4 | 1.8 | 0.6-5.2 | 0,082 | 1 | 0.2-1.5 | 8.2 | 4.2-18.4 | <0,001 |
| IAH REM | 4.8 | 2.3-16.6 | 2.5 | 0-8.4 | 0,014 | 2 | 0-3.2 | 10.6 | 4.4-33.8 | <0,001 |
| IAH NREM | 2.9 | 0.5-12.8 | 2 | 0.3-5.5 | 0,333 | 0.5 | 0-0.9 | 7 | 3.4-13.5 | <0,001 |
| IAH supino | 7.0 | 1.5-24.3 | 3.2 | 0.6-6.9 | 0,078 | 0.9 | 0-1.9 | 12.1 | 7-28.4 | <0,001 |
| IAHo | 2.4 | 0.59-13.2 | 1.7 | 0.2-4 | 0,132 | 0.4 | 0-1.1 | 7.6 | 3.5-15.2 | <0,001 |
| IAHC | 0.6 | 0.18-1.5 | 0.17 | 0-0.6 | 0,015 | 0.1 | 0-0.6 | 0.8 | 0.3-1.7 | 0,001 |
| R.D.I | 7.1 | 2.3-20.4 | 4.5 | 1.80-7.9 | 0,166 | 1.8 | 0.8-4.2 | 12.2 | 7.7-23.3 | <0,001 |
| Sat O2. m.(%) | 97 | 96.5-97.3 | 96.6 | 96.2-97.1 | 0,190 | 97.1 | 96.6-97.5 | 96.7 | 96.1-97 | 0,012 |
| ODI % | 3.9 | 1.6-8.2 | 2.3 | 1.20-6.6 | 0,150 | 1.6 | 0.7-2.8 | 7.2 | 3.9-10.3 | <0,001 |
| Pet CO 2 mmHg | 0.5 | 0-9.2 | 0 | 0-3.4 | 0,312 | 0 | 0-6 | 0 | 0-8.4 | 0,884 |
Ap. (apnea), RERAS (evento respiratorio relacionado con arousal), IAH (índice apnea-hipopnea), IAH REM (índice apnea-hipopnea REM), IAH NREM (índice apnea-hipopnea no REM), IAHo (índice apnea-hipopnea obstructiva), IAHc (índice apnea-hipopnea central), RDI (Respiratory Disturbance Index), Sat O2. m.(saturación oxigeno media), ODI (índice de desaturaciones de oxígeno), Pet CO2 (presión parcial de CO2 exhalado).
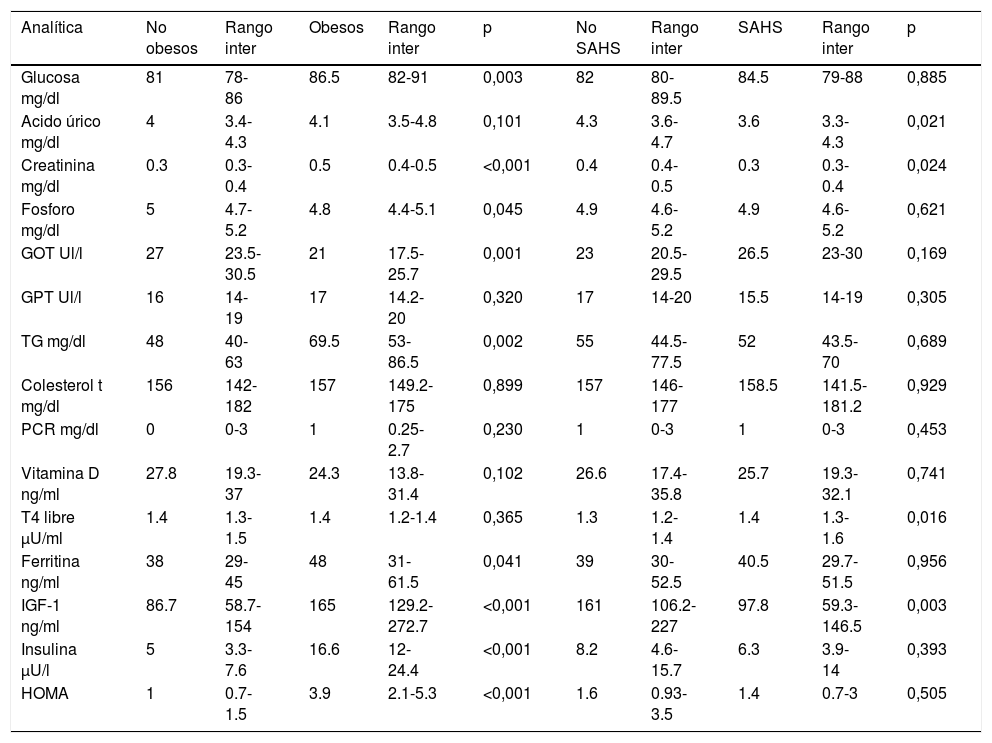
Respecto a los parámetros metabólicos (tabla 4), el grupo de niños Ob presentaron valores mayores de glucosa, creatinina, triglicéridos (TG), insulina basal e índice HOMA (índice de resistencia a insulina), ferritina y factor de crecimiento insulínico tipo1 (IGF-1).
Parámetros metabólicos no obesos vs obesos y no SAHS vs SAHS
| Analítica | No obesos | Rango inter | Obesos | Rango inter | p | No SAHS | Rango inter | SAHS | Rango inter | p |
|---|---|---|---|---|---|---|---|---|---|---|
| Glucosa mg/dl | 81 | 78-86 | 86.5 | 82-91 | 0,003 | 82 | 80-89.5 | 84.5 | 79-88 | 0,885 |
| Acido úrico mg/dl | 4 | 3.4-4.3 | 4.1 | 3.5-4.8 | 0,101 | 4.3 | 3.6-4.7 | 3.6 | 3.3-4.3 | 0,021 |
| Creatinina mg/dl | 0.3 | 0.3-0.4 | 0.5 | 0.4-0.5 | <0,001 | 0.4 | 0.4-0.5 | 0.3 | 0.3-0.4 | 0,024 |
| Fosforo mg/dl | 5 | 4.7-5.2 | 4.8 | 4.4-5.1 | 0,045 | 4.9 | 4.6-5.2 | 4.9 | 4.6-5.2 | 0,621 |
| GOT Ul/l | 27 | 23.5-30.5 | 21 | 17.5-25.7 | 0,001 | 23 | 20.5-29.5 | 26.5 | 23-30 | 0,169 |
| GPT Ul/l | 16 | 14-19 | 17 | 14.2-20 | 0,320 | 17 | 14-20 | 15.5 | 14-19 | 0,305 |
| TG mg/dl | 48 | 40-63 | 69.5 | 53-86.5 | 0,002 | 55 | 44.5-77.5 | 52 | 43.5-70 | 0,689 |
| Colesterol t mg/dl | 156 | 142-182 | 157 | 149.2-175 | 0,899 | 157 | 146-177 | 158.5 | 141.5-181.2 | 0,929 |
| PCR mg/dl | 0 | 0-3 | 1 | 0.25-2.7 | 0,230 | 1 | 0-3 | 1 | 0-3 | 0,453 |
| Vitamina D ng/ml | 27.8 | 19.3-37 | 24.3 | 13.8-31.4 | 0,102 | 26.6 | 17.4-35.8 | 25.7 | 19.3-32.1 | 0,741 |
| T4 libre μU/ml | 1.4 | 1.3-1.5 | 1.4 | 1.2-1.4 | 0,365 | 1.3 | 1.2-1.4 | 1.4 | 1.3-1.6 | 0,016 |
| Ferritina ng/ml | 38 | 29-45 | 48 | 31-61.5 | 0,041 | 39 | 30-52.5 | 40.5 | 29.7-51.5 | 0,956 |
| IGF-1 ng/ml | 86.7 | 58.7-154 | 165 | 129.2-272.7 | <0,001 | 161 | 106.2-227 | 97.8 | 59.3- 146.5 | 0,003 |
| Insulina μU/l | 5 | 3.3-7.6 | 16.6 | 12-24.4 | <0,001 | 8.2 | 4.6-15.7 | 6.3 | 3.9-14 | 0,393 |
| HOMA | 1 | 0.7-1.5 | 3.9 | 2.1-5.3 | <0,001 | 1.6 | 0.93-3.5 | 1.4 | 0.7-3 | 0,505 |
GOT (aspartato transaminasa), GPT (alanina aminotransferasa), TG (triglicéridos), t: total, PCR (proteína C reactiva), IGF-1 (factor de crecimiento insulínico tipo1), HOMA (índice de resistencia a la insulina)
Analizando las diferencias en función de la presencia de SAHS (36) frente a no SAHS (31) (tabla 1), los niños con SAHS eran de menor edad, tenían más somnolencia diurna y respiración bucal, así como mayor percentil de tensión arterial diastólica (TAD), de forma significativa con respecto a niños sin SAHS. Sin embargo, no se observaron diferencias en sexo, tamaño amigdalar y puntuación del cuestionario Chervin.
Analizando los hábitos higiénico-dietéticos (tabla 1) y los parámetros polisomnográficos (tablas 2 y 3) y metabólicos (tabla 4), se revelan diferencias significativas: los niños con SAHS dormían más h de sueño nocturno, presentaban mayor número de arousals e índice de arousals (sin otras diferencias en parámetros neurofisiológicos), presentaban parámetros respiratorios polisomnográficos típicos de SAHS y además este grupo tenía valores menores de ácido úrico, creatinina e IGF-1 y mayor T4 libre.
Valoración SAHS en no obesos y obesosDel total de los niños con diagnóstico de SAHS (36), 25 (69,4%) eran NOb y 11 (30,6%) Ob.
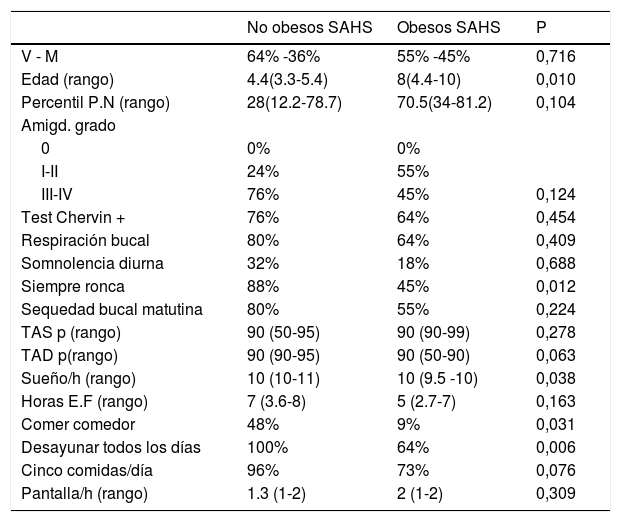
En la tabla 5 se muestran las características de SAHS NOb y SAHS Ob, el grupo SAHS NOb eran de menor edad y asociaban mayor porcentaje de ronquido, de manera significativa respecto a los SAHS Ob.
Características generales SAHS no obesos y SAHS obesos
| No obesos SAHS | Obesos SAHS | P | |
|---|---|---|---|
| V - M | 64% -36% | 55% -45% | 0,716 |
| Edad (rango) | 4.4(3.3-5.4) | 8(4.4-10) | 0,010 |
| Percentil P.N (rango) | 28(12.2-78.7) | 70.5(34-81.2) | 0,104 |
| Amigd. grado | |||
| 0 | 0% | 0% | |
| I-II | 24% | 55% | |
| III-IV | 76% | 45% | 0,124 |
| Test Chervin + | 76% | 64% | 0,454 |
| Respiración bucal | 80% | 64% | 0,409 |
| Somnolencia diurna | 32% | 18% | 0,688 |
| Siempre ronca | 88% | 45% | 0,012 |
| Sequedad bucal matutina | 80% | 55% | 0,224 |
| TAS p (rango) | 90 (50-95) | 90 (90-99) | 0,278 |
| TAD p(rango) | 90 (90-95) | 90 (50-90) | 0,063 |
| Sueño/h (rango) | 10 (10-11) | 10 (9.5 -10) | 0,038 |
| Horas E.F (rango) | 7 (3.6-8) | 5 (2.7-7) | 0,163 |
| Comer comedor | 48% | 9% | 0,031 |
| Desayunar todos los días | 100% | 64% | 0,006 |
| Cinco comidas/día | 96% | 73% | 0,076 |
| Pantalla/h (rango) | 1.3 (1-2) | 2 (1-2) | 0,309 |
V (varón), M (mujer), P.N (peso nacimiento), Amigd (amígdalas), IAH (índice apnea-hipopnea), TAS p (tensión arterial sistólica percentil), TAD p (tensión arterial diastólica percentil), E.F (ejercicio físico), h (horas).
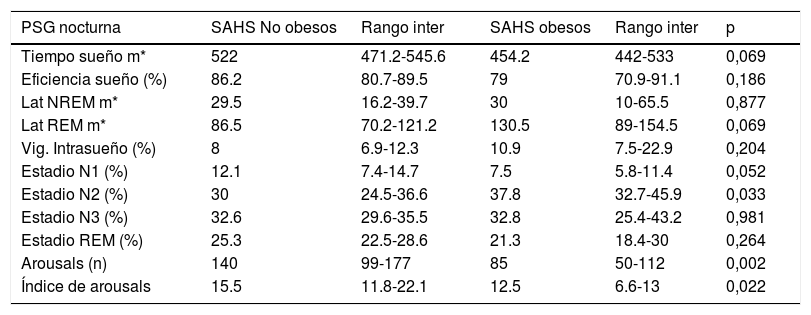
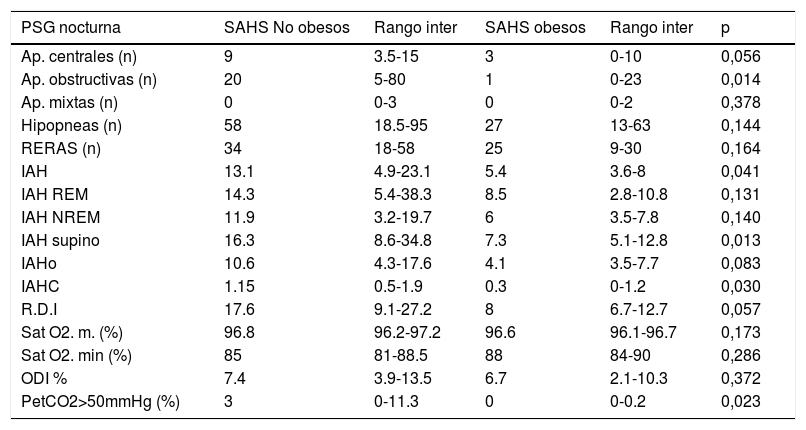
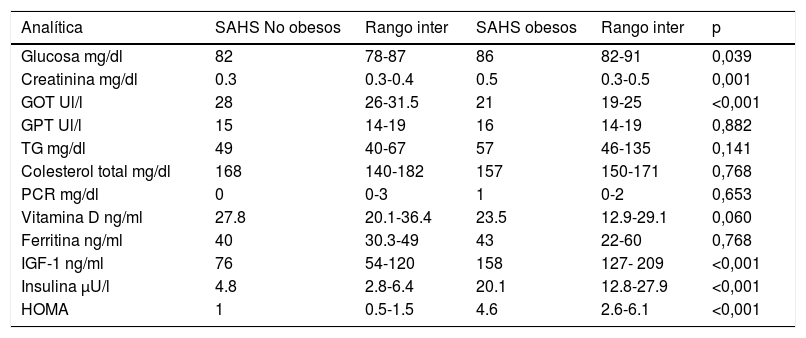
Respecto a los hábitos higiénico-dietéticos (tabla 5), los niños SAHS Ob dormían menos horas, comían menos en comedor escolar y no desayunaban siempre. En cuanto a los parámetros polisomnográficos (tablas 6 y 7) y metabólicos (tabla 8), los SAHS NOb presentaban más arousals y menor estadio N2 (%), además los SAHS NOb tenían mayor IAH, IAH supino, IAH central, índice de apneas y PetCO2> 50mmHg, de manera significativa; por otra parte los SAHS Ob tenían valores mayores de glucosa, creatinina, IGF-1, insulina y HOMA, pero menor GOT (aspartato transaminasa), respecto a los SAHS NOb, de manera significativa (tabla 8).
Parámetros polisomnográficos neurofisiológicos no obesos SAHS y obesos SAHS
| PSG nocturna | SAHS No obesos | Rango inter | SAHS obesos | Rango inter | p |
|---|---|---|---|---|---|
| Tiempo sueño m* | 522 | 471.2-545.6 | 454.2 | 442-533 | 0,069 |
| Eficiencia sueño (%) | 86.2 | 80.7-89.5 | 79 | 70.9-91.1 | 0,186 |
| Lat NREM m* | 29.5 | 16.2-39.7 | 30 | 10-65.5 | 0,877 |
| Lat REM m* | 86.5 | 70.2-121.2 | 130.5 | 89-154.5 | 0,069 |
| Vig. Intrasueño (%) | 8 | 6.9-12.3 | 10.9 | 7.5-22.9 | 0,204 |
| Estadio N1 (%) | 12.1 | 7.4-14.7 | 7.5 | 5.8-11.4 | 0,052 |
| Estadio N2 (%) | 30 | 24.5-36.6 | 37.8 | 32.7-45.9 | 0,033 |
| Estadio N3 (%) | 32.6 | 29.6-35.5 | 32.8 | 25.4-43.2 | 0,981 |
| Estadio REM (%) | 25.3 | 22.5-28.6 | 21.3 | 18.4-30 | 0,264 |
| Arousals (n) | 140 | 99-177 | 85 | 50-112 | 0,002 |
| Índice de arousals | 15.5 | 11.8-22.1 | 12.5 | 6.6-13 | 0,022 |
PSG: polisomnografía, m*(minutos), Lat (latencia), Vig. (vigilia), n (número).
Parámetros polisomnográficos respiratorios SAHS no obesos y SAHS obesos
| PSG nocturna | SAHS No obesos | Rango inter | SAHS obesos | Rango inter | p |
|---|---|---|---|---|---|
| Ap. centrales (n) | 9 | 3.5-15 | 3 | 0-10 | 0,056 |
| Ap. obstructivas (n) | 20 | 5-80 | 1 | 0-23 | 0,014 |
| Ap. mixtas (n) | 0 | 0-3 | 0 | 0-2 | 0,378 |
| Hipopneas (n) | 58 | 18.5-95 | 27 | 13-63 | 0,144 |
| RERAS (n) | 34 | 18-58 | 25 | 9-30 | 0,164 |
| IAH | 13.1 | 4.9-23.1 | 5.4 | 3.6-8 | 0,041 |
| IAH REM | 14.3 | 5.4-38.3 | 8.5 | 2.8-10.8 | 0,131 |
| IAH NREM | 11.9 | 3.2-19.7 | 6 | 3.5-7.8 | 0,140 |
| IAH supino | 16.3 | 8.6-34.8 | 7.3 | 5.1-12.8 | 0,013 |
| IAHo | 10.6 | 4.3-17.6 | 4.1 | 3.5-7.7 | 0,083 |
| IAHC | 1.15 | 0.5-1.9 | 0.3 | 0-1.2 | 0,030 |
| R.D.I | 17.6 | 9.1-27.2 | 8 | 6.7-12.7 | 0,057 |
| Sat O2. m. (%) | 96.8 | 96.2-97.2 | 96.6 | 96.1-96.7 | 0,173 |
| Sat O2. min (%) | 85 | 81-88.5 | 88 | 84-90 | 0,286 |
| ODI % | 7.4 | 3.9-13.5 | 6.7 | 2.1-10.3 | 0,372 |
| PetCO2>50mmHg (%) | 3 | 0-11.3 | 0 | 0-0.2 | 0,023 |
Ap. (apnea), RERAS (evento respiratorio relacionado con arousal), IAH (índice apnea-hipopnea), IAH REM (índice apnea-hipopnea REM), IAH NREM (índice apnea-hipopnea no REM), IAHo (índice apnea-hipopnea obstructiva), IAHc (índice apnea-hipopnea central), RDI (Respiratory Disturbance Index), Sat O2. m. (saturación oxigeno media), Sat O2. min (saturación de oxigeno mínimo), ODI (índice de desaturaciones de oxígeno), Pet CO2 (presión parcial de CO2 exhalado).
Parámetros metabólicos en SAHS no obesos vs SAHS obesos
| Analítica | SAHS No obesos | Rango inter | SAHS obesos | Rango inter | p |
|---|---|---|---|---|---|
| Glucosa mg/dl | 82 | 78-87 | 86 | 82-91 | 0,039 |
| Creatinina mg/dl | 0.3 | 0.3-0.4 | 0.5 | 0.3-0.5 | 0,001 |
| GOT Ul/l | 28 | 26-31.5 | 21 | 19-25 | <0,001 |
| GPT Ul/l | 15 | 14-19 | 16 | 14-19 | 0,882 |
| TG mg/dl | 49 | 40-67 | 57 | 46-135 | 0,141 |
| Colesterol total mg/dl | 168 | 140-182 | 157 | 150-171 | 0,768 |
| PCR mg/dl | 0 | 0-3 | 1 | 0-2 | 0,653 |
| Vitamina D ng/ml | 27.8 | 20.1-36.4 | 23.5 | 12.9-29.1 | 0,060 |
| Ferritina ng/ml | 40 | 30.3-49 | 43 | 22-60 | 0,768 |
| IGF-1 ng/ml | 76 | 54-120 | 158 | 127- 209 | <0,001 |
| Insulina μU/l | 4.8 | 2.8-6.4 | 20.1 | 12.8-27.9 | <0,001 |
| HOMA | 1 | 0.5-1.5 | 4.6 | 2.6-6.1 | <0,001 |
SAHS (Síndrome de apneas-hipopneas del sueño), GOT (aspartato transaminasa), GPT (alanina aminotransferasa), TG (triglicéridos), PCR (proteína C reactiva), IGF-1 (factor de crecimiento insulínico tipo1), HOMA (índice de resistencia a la insulina).
Este estudio evalúa prospectivamente las características clínicas, polisomnográficas y metabólicas en una cohorte clínica de niños obesos y no obesos remitidos por sospecha clínica de SAHS. En esta cohorte, los niños con SAHS presentaban aumento de la TAD matutina y se muestra cómo el cuestionario de Chervin no permite diferenciar SAHS. Además, los niños con obesidad presentan alteración del patrón de sueño y hábitos higiénico-dietéticos, así como mayor frecuencia de antecedentes familiares de obesidad y niveles más elevados de glucosa, insulina, HOMA y triglicéridos.
La duración insuficiente del sueño está asociada con mayor riesgo de obesidad12,13, describiéndose al tiempo en niños obesos, más trastornos del sueño14. En nuestra cohorte, los niños obesos tenían un patrón de sueño alterado (menor duración, menor eficiencia, mayor latencia al sueño REM). Por otro lado, la pérdida de horas de sueño origina somnolencia y cansancio diurno que pueden repercutir en realizar menos actividad física, como observamos en las horas de ejercicio físico referidas entre ambos grupos. Recientemente, se ha estudiado la asociación entre duración del sueño e influencia del estilo de vida; Konstantions et al.15 encuentran que la duración insuficiente del sueño se asoció con hábitos dietéticos poco saludables. Comer en comedor escolar se ha potenciado como protector de obesidad. En nuestro estudio los niños obesos comían menos en el comedor escolar5,16,17.
Numerosos estudios muestran asociación clara entre el IMC de los padres y el de los hijos18,19, coincidiendo con los resultados del presente estudio, en el que los progenitores obesos son más frecuentes en el grupo de niños con obesidad, poniendo de relieve la importancia de este factor.
Existen alteraciones metabólicas asociadas a la obesidad infantil desde edades precoces, de forma aislada o englobada bajo la definición de síndrome metabólico, como se demostró en un estudio colaborativo, Martos et al.20. De acuerdo con ello, en nuestro estudio observamos diferencias en el metabolismo hidrocarbonado (glucosa, insulina y HOMA) y lipídico (TG), presentando niveles mayores los niños obesos.
Los cuestionarios, como herramientas de screening de SAHS, han sido ampliamente estudiados. El cuestionario validado en español y utilizado fue el de Chervin. En nuestra muestra el cuestionario fue positivo en 72% de los SAHS vs. 68% no SAHS (p=0,689), lo cual pone en evidencia la capacidad de los cuestionarios como herramienta de diagnóstico; en este sentido, un reciente metanálisis21 valora la exactitud del test Chervin, observando menor sensibilidad y especificidad de lo comunicado y además, no encontraron utilidad en población obesa, al igual que otros estudios3.
Entre las morbilidades asociadas al SAHS, la cardiovascular es una de las más relevantes y la relación entre SAHS y HTA en niños ha sido ampliamente estudiada, pero hoy en día los datos son discordantes. En el presente estudio, los valores de TAD matutina fueron más elevados en los niños con SAHS, mostrando diferencias significativas. En este sentido, varios autores han encontrado que los niveles de TA aumentan con la gravedad del SAHS22,23. Además, estudios que han registrado la TA ambulatoria 24 h, muestran ausencia de la caída nocturna de TA (nocturnal dipping) y el marcado incremento de la TA matutina en SAHS24,25 y por tanto, un mayor riesgo cardiovascular.
Por otra parte, en las variables neurofisiológicas SAHS vs. no SAHS, solo encontramos diferencias en arousals, por lo que hoy en día se promueve la adecuación de la poligrafía respiratoria para el diagnóstico de SAHS, la cual no registra estas variables26.
Otro aspecto importante es la relación entre SAHS y alteraciones del crecimiento; en este sentido, en un estudio realizado en niños con SAHS y roncadores primarios, presentan valores menores de IGFBP-3 (proteína transportadora similar a la insulina tipo 3), aunque no encontraron diferencias en IGF-127. En nuestro estudio, al comparar SAHS vs. no SAHS, únicamente se encontraron diferencias en el valor de IGF-1, creatinina, ácido úrico y T4 libre, aunque se podrían explicar por la diferencia de edad entre grupos.
Analizando el grupo diagnosticado de SAHS, los SAHS NOb tienen menor edad, roncan siempre más y tienen valores más elevados de IAH que los SAHS Ob. No hay diferencias en tamaño amigdalar, aunque presentan un grado III-IV el 76% de SAHS NOb vs. 45% de SAHS Ob, describiendo la literatura en esta edad mayor grado de hipertrofia adenoamigdalar, pudiendo ser la causa1,2. Sin embargo, también hay que tener en cuenta que no todos los niños con hipertrofia adenoamigdalar desarrollan SAHS.
Aunque en adultos el SAHS se ha identificado como un factor de resistencia insulínica, en niños esta asociación no es clara. En estudios realizados fundamentalmente en adolescentes, se ha encontrado asociación entre síndrome metabólico y SAHS, sin embargo en niños más pequeños, el SAHS se asocia a aumento de resistencia insulínica cuando concurren SAHS y obesidad2,28. En nuestro estudio, el grupo de niños SAHS Ob presentaron mayores alteraciones en el metabolismo hidrocarbonado que los SAHS NOb, dichas alteraciones están presentes en el grupo obesos, por tanto la resistencia a la insulina parece estar determinada principalmente por la obesidad y no tanto por el SAHS, como también describen otros autores29. Asimismo se observa una mediana del HOMA de mayor valor en los SAHS obesos, frente al grupo de «solo obesos» lo que parece sugerir que el SAHS aumenta la contribución subyacente de la obesidad, hecho observado en otros estudios de mayor tamaño30.
Otra diferencia remarcable es la alteración en las enzimas hepáticas cuando se comparan los grupos SAHS NOb y SAHS Ob, siendo mayor en NOb (p<0,001), estos tenían un IAH mayor (p=0,041); en este contexto, los datos muestran concordancia con la literatura ya que la presencia y la severidad del SAHS se asocia con elevación de enzimas hepáticas e hígado graso no alcohólico, independiente del IMC31.
Una posible limitación del estudio es que es una cohorte clínica de niños Ob y NOb derivados por sospecha de SAHS, y no representan a toda la población pediátrica obesa, en la que existe infrasospecha e infradiagnóstico de SAHS como se ha demostrado en estudios3; otra limitación es el tamaño muestral al analizar SAHS NOb vs. SAHS Ob. En esta línea, otra posible limitación es el motivo de derivación: la presencia de ronquido. En nuestro estudio, el ronquido referido estaba presente en el 62% no SAHS vs. 75% de SAHS (p=0,066), mientras que en el estudio PSG (ronquido medido por cánula presión y/o presenciado) estaba presente en el 45% no SAHS vs. 77% SAHS (p=0,017), por tanto, aunque es síntoma guía, es necesario insistir en otros síntomas de SAHS, sobre todo en niños mayores y obesos.
ConclusionesEl estudio actual muestra un comportamiento diferente del SAHS en dos fenotipos de niños, con y sin obesidad, en los que se observan diferentes hallazgos según la edad, las características clínicas, polisomnográficas y metabólicas.
Los niños con obesidad presentan una alteración del patrón de sueño y de los hábitos higiénico-dietéticos, así como una alteración del metabolismo hidrocarbonado y lipídico.
El presente trabajo revela un aumento de la TAD matutina en los niños con SAHS, quedando patente este factor de riesgo cardiovascular.
Además, nuestros hallazgos resaltan la necesidad de mejorar los cuestionarios de detección de SAHS, debiendo ser específicamente diseñados para la población pediátrica obesa.
Por todo ello, consideramos la necesidad de ser conscientes del aumento del riesgo de morbilidad asociada al SAHS cuando la obesidad está presente, debiendo impulsarse desde AP la creación de programas de capacitación y sensibilización, que aumenten el conocimiento del SAHS en contexto de obesidad pediátrica. Estos programas permitirían disminuir el infradiagnóstico de SAHS, conduciendo a su tratamiento precoz y por tanto, a una disminución de la morbilidad asociada.
FinanciaciónProyecto de investigación en biomedicina seleccionado por la Gerencia Regional de Salud de Castilla y León, n.° expediente GRS 1116/A/15: «El síndrome de apneas-hipopneas durante el sueño en población infantil obesa y no obesa, implicaciones metabólicas».
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a los niños y padres su participación en el estudio. Los autores agradecen especialmente el legado y estímulo constante, así como el trabajo realizado en este estudio al Dr. Joaquín Terán Santos.
Este artículo ha sido presentado previamente a los siguientes congresos y reuniones. 67.° Congreso de la Asociación Española de Pediatría, Burgos, 6-8 de junio de 2019. XXVI Reunión Anual de la Sociedad Española de Sueño, Barcelona, 26-28 de abril de 2018. 52.° Congreso de la Sociedad Española de Neumología y Cirugía Torácica, Santiago Compostela, 13-16 de junio de 2019.