El seudohipoparatiroidismo tipo Ia (PHP-Ia) resulta de un déficit específico de la proteína Gsα, que se manifiesta por la resistencia a la parathormona y un fenotipo característico, denominado osteodistrofia hereditaria de Albright. Fueron identificadas varias mutaciones en el gen GNAS1 en los individuos con PHP-Ia y seudoseudohipoparatiroidismo. Una sola mutación del gen GNAS1 puede ser responsable de ambas enfermedades. Cuando la anomalía es transmitida por el padre dará lugar a un fenotipo de seudoseudohipoparatiroidismo y cuando lo es por la madre, se manifestará como un PHP-Ia.
Los autores presentan el caso de un varón adolescente con PHP-Ia. El estudio del gen GNAS1 reveló la mutación c.899A >.Lys300Ile en el exón 11. Hemos identificado la misma mutación en la madre, que solo presentaba alteraciones somáticas no asociadas a resistencia a la hormona seudoseudohipoparatiroidismo. Esta es una mutación original, aún no descrita en la literatura.
Pseudohypoparathyroidism Ia (PHP-Ia) results from a specific deficiency of the α subunit of stimulatory G protein, manifested by resistance to parathormone and a characteristic phenotype, referred to as Albright hereditary osteodystrophy (AHO). Several mutations were identified in the GNAS1 gene in individuals with PHP-Ia and pseudopseudohypoparathyroidism (PPHP). A single GNAS1 mutation may be responsible for both PHP-Ia e PPHP in the same family, when inherited from the maternal and the paternal allele, respectively.
The authors present the case of a teenage boy with PHP- Ia. The study revealed the GNAS1 mutation c.899A>T (p.Lys300Ile) in exon 11. After the genetic study of his parents, we have identified the same mutation in the mother, who had only somatic alterations (AHO), not associated with hormone resistance (PPHP). This is an original mutation, not yet described in the literature.
El seudohipoparatiroidismo (PHP) incluye un grupo heterogéneo de enfermedades caracterizadas por la resistencia de los órganos diana (hueso y riñón) a la acción de la paratohormona (PTH), por lo que se encuentra, además de la hipocalcemia y la hiperfosfatemia, una tasa sérica de PTH elevada en la mayoría de los casos1,2. El PHP se ha clasificado en varios tipos (Ia, Ib, Ic y II) según las manifestaciones clínicas, los parámetros bioquímicos y el mecanismo molecular subyacente a la resistencia hormonal1–4.
El tipo más común es PHP-Ia, transmitido con carácter autosómico dominante, con expresión variable1–4. La resistencia a la PTH resulta de un déficit específico de la subunidad α de la proteína G activadora (Gsα)1–8 y puede ser confirmado por la ausencia de elevación de la excreción de AMP-c urinario y fosfaturia que se produce en sujetos normales tras la infusión intravenosa de PTH exógena3,4. La proteína Gsα activa la producción de AMP cíclico intracelular en varios tejidos del sistema endocrino, lo que explica por qué muchos pacientes con el PHP-Ia también muestran resistencia a otras hormonas, la mayoría de las veces a la hormona tiroestimulante (TSH) y gonadotrofinas1,4. Estas personas todavía tienen un fenotipo característico, denominado osteodistrofia hereditaria de Albright, caracterizado por una cara de luna llena, obesidad, talla baja, calcificaciones s.c. (así como en los riñones y el cerebro), deformidades óseas (rodilla valga, coxa vara, cúbito valgo) y braquidactilia, más frecuentes en 4.°–5.° dedos1,3,4. Entre el 50–75% de los pacientes con PHP-Ia tienen un retraso mental leve a moderado1,3. El fenotipo se manifiesta en el primer año de vida, pero se hace evidente solo después de los 4 años de edad. Por mecanismos desconocidos, la mayoría de los sujetos con PHP-Ia rara vez presentan hipocalcemia antes de los 3 años de edad1.
La presentación de la enfermedad puede tener lugar en 2 formas: únicamente con alteraciones dismorfogénicas, sin alteraciones hormonales, en cuyo caso se designa como seudoseudohipoparatiroidismo, o bien alteraciones dismorfogénicas asociadas a resistencia hormonal (PTH, TSH, gonadotrofinas y glucagon) que se designa como PHP-Ia1–8.
El tratamiento de PHP es similar a la de hipoparatiroidismo primario3. El tratamiento con calcitriol permite superar el bloqueo enzimático y cuando se asocia con los suplementos de calcio, permite lograr normocalcemia1,3.
El gen GNAS1, localizado en el cromosoma 20q13, contiene 13 exones que codifican la proteína Gsα2,4. Se han descrito varias mutaciones en heterocigosis en el gen GNAS1 en pacientes con PHP-Ia y seudoseudohipoparatiroidismo, que interrumpen la síntesis de tales proteínas o de su ARNm5. Los autores describen una nueva mutación en heterocigosis en el exón 11 identificados en un varón adolescente y su madre.
Observación clínicaPaciente varón, de 14 años, primer hijo de una pareja joven, sana, no consanguínea, nació prematuramente a las 35 semanas, con un peso y una longitud adecuada para la edad gestacional. El cribado neonatal del hipotiroidismo congénito realizado en el 8.° día de vida fue normal. A los 7 meses de edad se constató retraso del desarrollo psicomotor y a los 12 meses obesidad, sin alteraciones dismorfogénicas asociadas. Para el estudio etiológico y para la eliminación de las causas genéticas, incluyendo el síndrome de Prader Willi, se realizó cariotipo y estudio de genética molecular que fueron normales y pruebas de función tiroidea que reveló valores elevados de TSH (10,7uIU/ml), sin elevación en las concentraciones de tiroxina (T4L).
A los 20 meses de edad fue enviado a la consulta de endocrinología pediátrica por hipotiroidismo primario (TSH 8,79μU/ml y T4L 5,8mg/dl). La ecografia de la glándula tiroides reveló una glándula en posición eutópica, moderadamente aumentada, sin nódulos. Los Ac antitiroideos fueron negativos. Inició terapia de sustitución con levotiroxina.
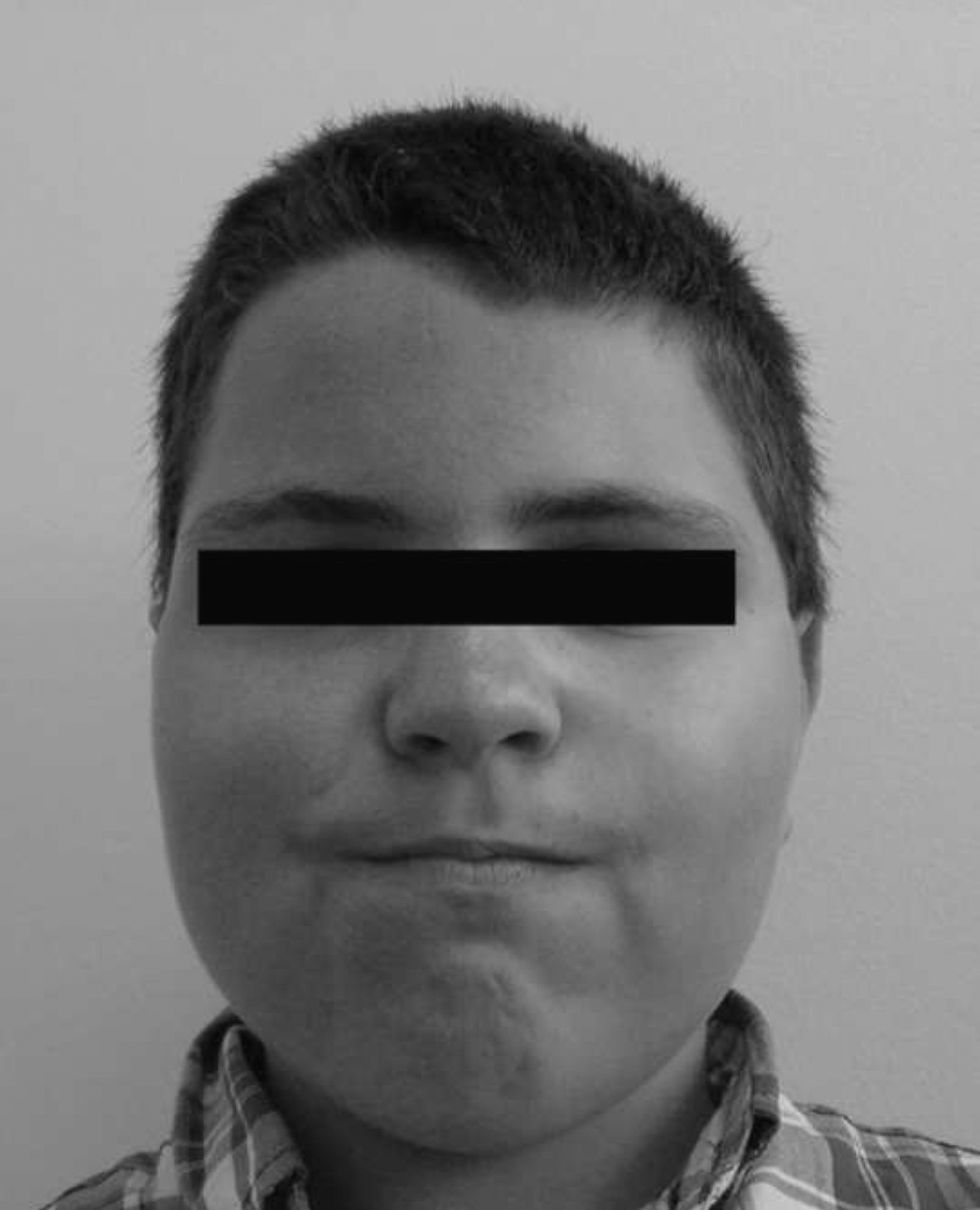
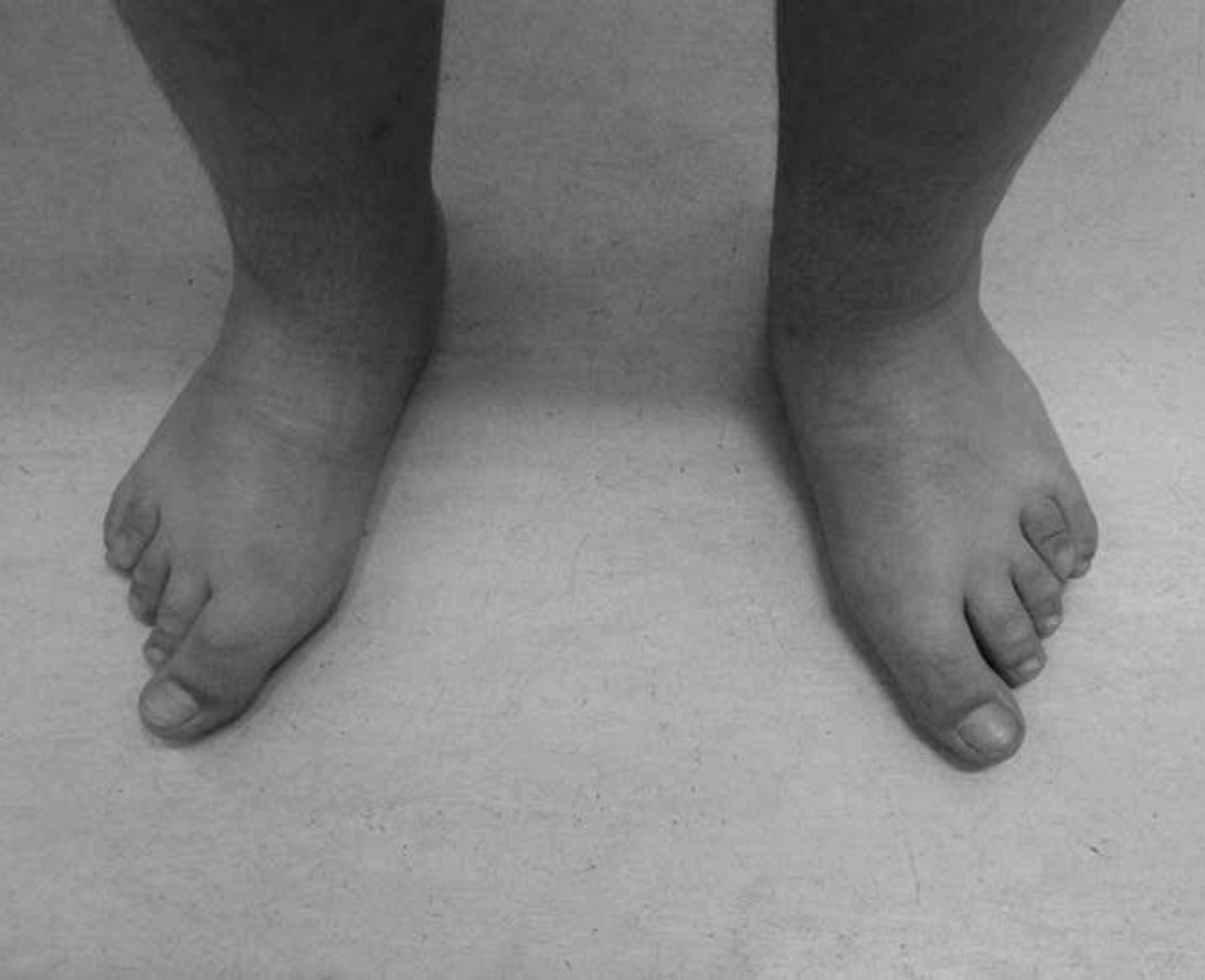
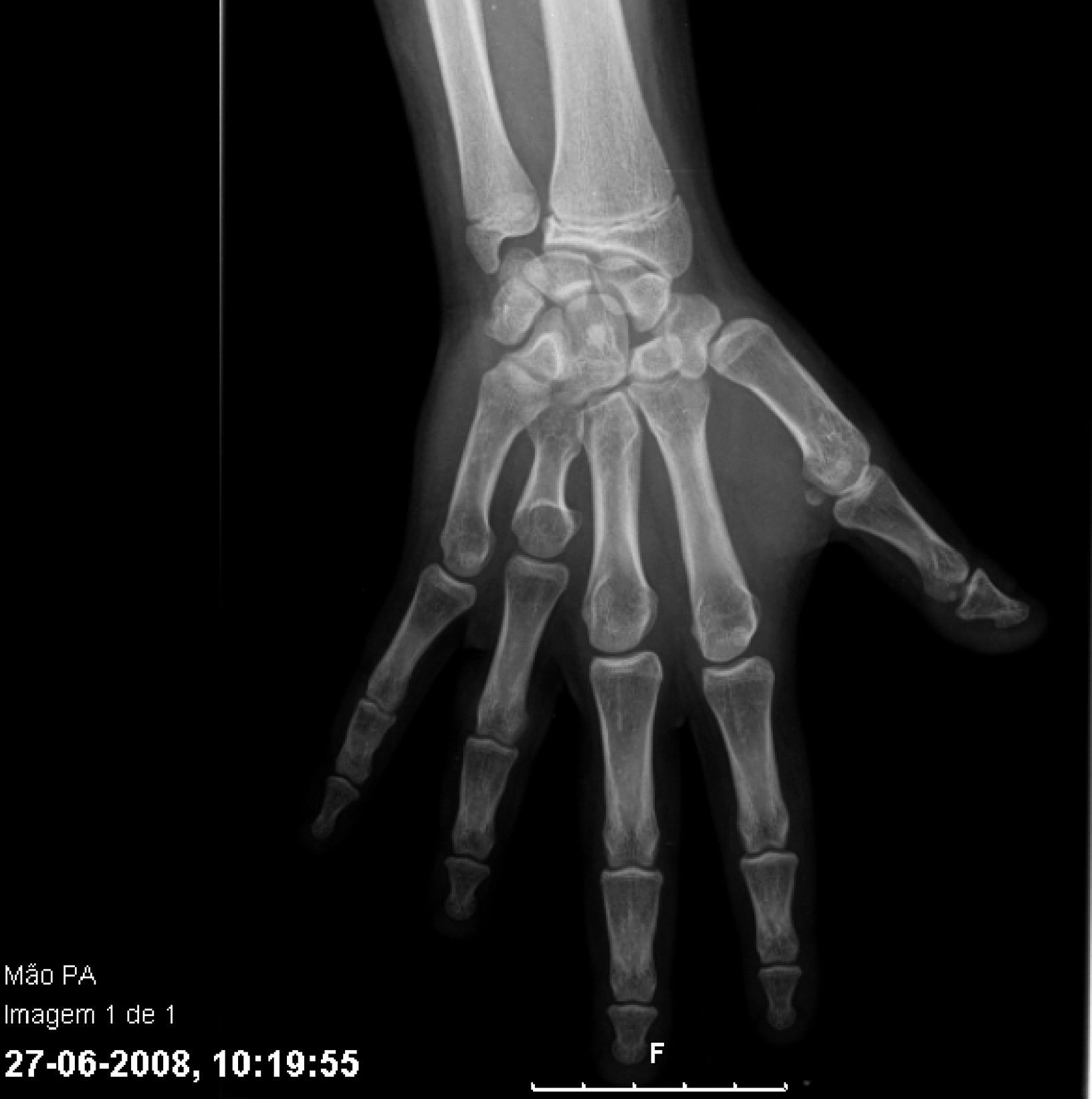
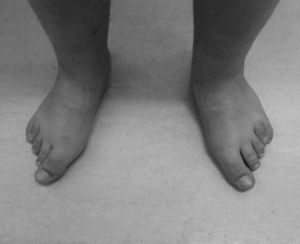
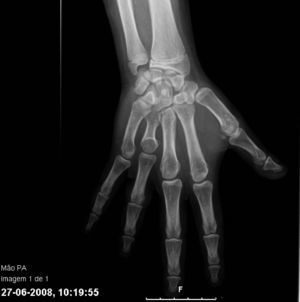
Con los años se acentuaron las alteraciones somáticas y a los 6 años presentaba un fenotipo característico indicativo de osteodistrofia hereditaria de Albright: cara de luna llena (fig. 1), miembros cortos, genu valgo, deformidades de los dedos de las manos y de los pies (fig. 2) y persistencia de la obesidad. Fue realizada Rx de las manos y de los pies, que mostró braquidactilia de los 4 dedos de las manos y de los pies y adelanto de la edad ósea (edad ósea de 13 años y edad cronológica de 9 años y 2 meses) (fig. 3). La Rx de cráneo no mostró calcificaciones anormales. Analíticamente se detectó hipocalcemia (2,18mmol/l), hiperfosfatemia (1,57mmol/l) y aumento de la PTH (181pg/ml). La determinación de 25-hidroxicolecalciferol fue normal (31,2mg/ml). Fue diagnosticado PHP-Ia y comenzó tratamiento con calcitriol. Presenta estadio pubertario grado IV de Turner por lo que es posible excluir resistencia periférica a las gonadotrofinas. A los 12 años fue objetivado retraso mental, a través de la evaluación cognitiva, con el cociente intelectual total de 45, muy por debajo de la media.
Se procedió al estudio de los padres, que no presentaban alteraciones hormonales, de calcio o fósforo séricos. La madre mostraba algunos rasgos dismorfogénicos: una cara redonda y talla baja, sin braquidactilia.
En 2007 se llevó a cabo el estudio molecular del gen GNAS1 del paciente a partir de ADN genómico obtenido a partir de leucocitos de sangre periférica. Los 13 exones fueron amplificados utilizando primers específicos del gen GNAS1 y analizados por secuenciación directa. Ha sido identificada la mutación c.899A> T (p.Lys300Ile) en el exón 11. En el estudio genético de los padres se encontró que la madre presentaba la misma mutación. Por último, se llevó a cabo el estudio genético de los abuelos maternos que fue normal.
El análisis del gen GNAS1 en el paciente, padres y abuelos maternos permite concluir que es una mutación de novo en la madre, transmitida con carácter autosómico dominante. Después del análisis en el software «Polyphen», fue considerada una mutación patogénica, ya que la misma altera un aminoácido conservado.
DiscusiónEn los pacientes con PHP-Ia se asocian con frecuencia resistencia a otras hormonas además de a la PTH, siendo la más frecuente la resistencia a la TSH, aunque puede afectar a cualquier hormona que utilice la Gs y la adenilato ciclase para generar AMP-c como segundo mensajero celular. Las alteraciones tiroideas son, sin embargo, asintomáticas, se escapan a menudo del despistaje neonatal y cuando se observen hay que pensar en este cuadro clínico.
Como el fenotipo del PHP-Ia se manifiesta en el primer año de vida pero se hace evidente solo después de los 4 años de edad y la hipocalcemia, en la mayoría de los sujetos rara veces se presenta antes de los 3 años de edad, puede causar un retraso en el diagnóstico, como en nuestro caso clínico.
El padrón de herencia dominante del PHP, así como la resistencia hormonal selectiva y la variabilidad fenotípica han llevado a la hipótesis del gen GNSA1 ser un imprinting gene, ya mencionado por varios autores1–8. El presente caso apoya esta hipótesis. En estos casos, la transmisión paterna de la mutación del gen GNAS1 dará lugar a un fenotipo seudoseudohipoparatiroidismo, mientras que la transmisión materna origina alteraciones dismorfogénicas asociadas a resistencia hormonal a varias hormonas (PTH, THS, gonadotrofinas y glucagón). La variabilidad fenotípica se explicaría por un mecanismo de impronta genómica, específico para cada tejido, siendo el alelo materno expresado principalmente en el túbulo renal distal y en la glándula tiroides. En la mayoría de los tejidos el gen se expresa en una forma bialélica. Las mutaciones en el alelo materno conducen a la pérdida de expresión de la proteína Gsα en los túbulos dístales y por tanto, a la pérdida de la acción de la PTH en el riñón, mientras que las mutaciones del alelo paterno tienen poco efecto sobre la acción de la PTH3,4.
La identificación de pacientes con PHP causados por nuevas mutaciones y la investigación clínica y de laboratorio, ayudan a aumentar el conocimiento sobre esta enfermedad poco frecuente. Estos estudios van a permitir determinar si existen diferencias con respecto al cuadro clínico y el pronóstico de acuerdo a la mutación encontrada.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.