Actualmente el escenario terapéutico del cáncer contempla la irrupción de nuevas herramientas procedentes del campo de la inmunoterapia celular. Su máximo exponente es la terapia celular CAR-T (del inglés Chimeric Antigen Receptor T Cell), un medicamento perteneciente a las terapias avanzadas de tipo terapia génica, designado por la Sociedad Americana de Oncología Clínica como el principal avance clínico en el 20171. Esta terapia consiste en la modificación genética ex vivo de linfocitos T autólogos a partir de una aféresis, para permitir la expresión en su superficie de un receptor quimérico específico de membrana capaz de reconocer un antígeno diana en las células tumorales2.
En noviembre del 2018 se aprobó el Plan Nacional de abordaje de las Terapias Avanzadas en el Sistema Nacional de Salud: medicamentos CAR-T3, cuyo objetivo fundamental es organizar la utilización de los medicamentos CAR-T, dirigida a 2patologías: la leucemia aguda linfoblástica B (LLA-B) en pacientes hasta 25 años y el linfoma B difuso de células grandes en adultos, ambas en situación de recaída o refractariedad.
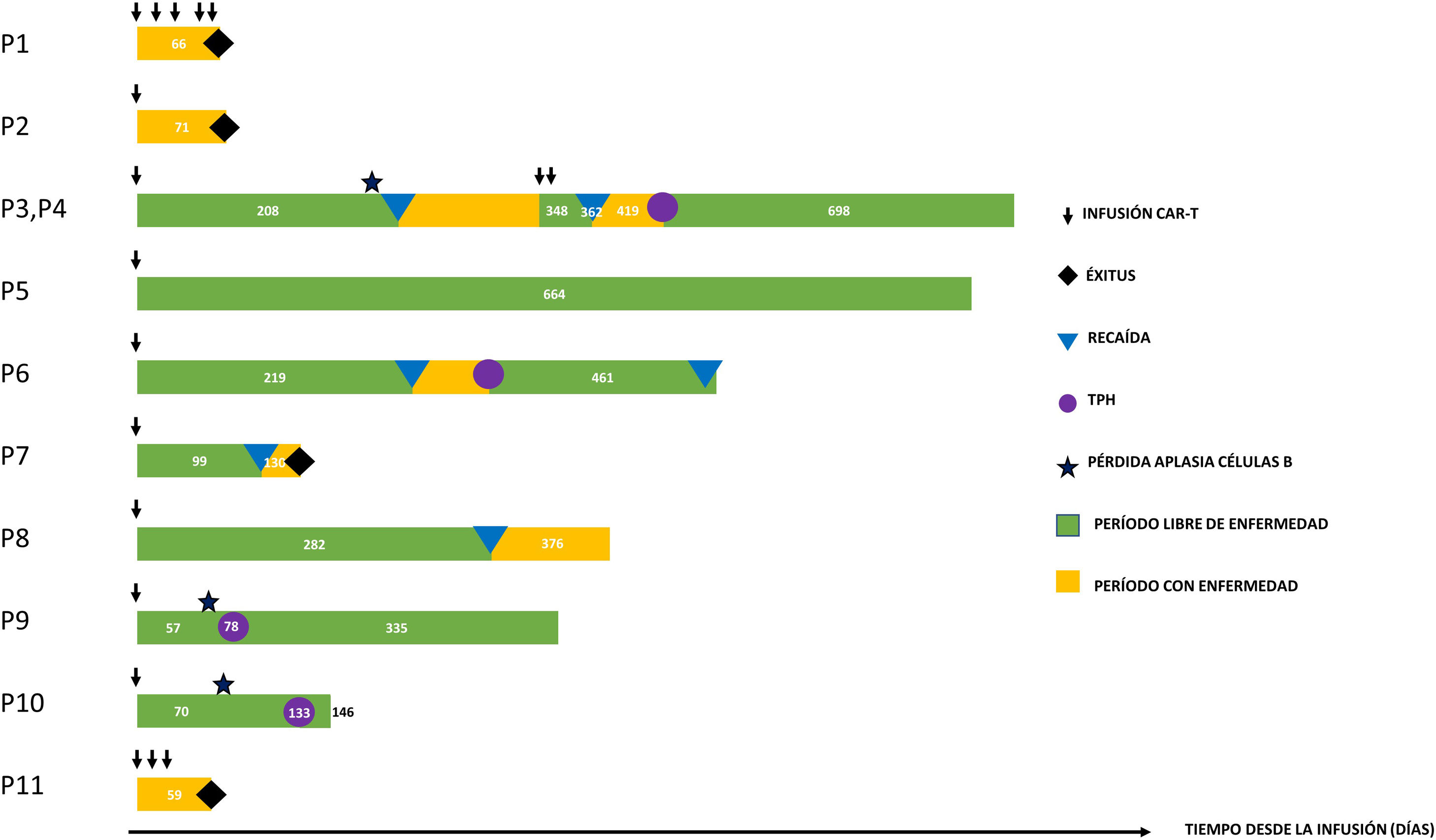
A través de esta carta presentamos la experiencia de nuestro centro desde diciembre del 2017 hasta septiembre del 2021. Se realizaron un total de 21 infusiones en 14 pacientes. Un total de 7 infusiones fueron con tisagenlecleucel (Kymriah®, Novartis) bajo indicación aprobada (LLA-B) CD19+, 3 pacientes recibieron tisagenlecleucel en ensayo clínico y se realizaron 11 infusiones con terapia CAR-T académica de fabricación in house. De ellos, 2 pacientes recibieron 6 infusiones de CART45RA-NKG2D alogénico, 2 pacientes recibieron 5 infusiones del CAR-T dual biespecífico CD19/CD22 autógeno, ambos bajo uso compasivo y previa aprobación por la Agencia Española del Medicamento y Productos Sanitarios, al no ser candidatos a tisagenlecleucel o haber recaído tras su administración (tabla 1) (fig. 1).
Tabla resumen de las características de los pacientes CAR-T
| Paciente | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| CAR-T | NKG2D | NKG2D | Dual CD19/CD22 | Tisagenlecleucel | Tisagenlecleucel | Tisagenlecleucel | Tisagenlecleucel | Tisagenlecleucel | Tisagenlecleucel | Tisagenlecleucel | Dual CD19/CD22 |
| Patología de base e indicación CAR-T | LFM recaída postsegundo haplo-TPH | LLA-B recaída postsegundo haplo-TPH | LLA-B recaída combinada post-CAR-T CD19 | LLA-B recaída combinada tras 2líneas de tratamiento | LLA-B recaída post-TPH DNE | LLA-B recaída post-TPH DNE | LLA-B refractaria | LLA-B lactante recaída post-TPH | LLA-B Ph-like recaída post-TPH | LLA-B en segunda recaída medular tras recibir segunda línea de tratamiento | LLA-B en recaída tras CAR-T CD19 y haplo-TPH |
| Tratamiento puente | No | No | TIT | PRED+VCR+TIT | PRED+ARA-C+PEG-ASP+VCR+VBL+TIT | DEX+VCR+PEG ASP+TIT | DEX+VCR+ARA-C+CFM | DEX+VCR+PEG-ASP+TIT | PRED+VCR+PEG-ASP+CFM+ARAC+TIT | TIT | PRED |
| % blastos en médula ósea pre CAR-T | 50 | 87 | 0,01 | 0,01 | 30 | 60 | 5,5 | 84 | 0,01 | 1,3 | 4,56 |
| Régimen linfodepleción | No | FluCy | FluCy600 | FluCy | FluCy | FluCy | FluCy | FluCy | FluCy | FluCy | FluCy |
| Tiempo (días) desde solicitud a la infusión | 21 | 20 | 112 | 43 | 42 | 48 | 49 | 41 | 55 | 54 | 20 |
| Dosis CAR-T/kg infundida | 5×107 (5 alícuotas) | 1×107(1 alícuota) | 3×106 (2 alícuotas) | 2,8×106 | 1,7×106 | 2,3×106 | 2,6×106 | 2,7×106 | 3,28×106 | 2,5×106 | 4,2×107 (3 alícuotas) |
| CRS (grado ASBMT) | No | Grado 2 | Grado 1 | Grado 1 | Grado 1 | Grado 3 | Grado 3 | Grado 1 | No | Grado 1 | No |
| ICANS (grado ASBMT) | No | No | No | No | No | Grado 3 | No | No | No | No | No |
| HLH | No | No | No | No | No | Sí | Sí | No | No | No | No |
| Infecciones | No | IFI | No | No | No | No | TBC, adenovirus | No | No | No | No |
| Respuesta día+30 | Progresión | Progresión | RC | RC | RC | RC | RCi | RC | RC | RC | Progresión |
| Pérdida de aplasia B | N/A | N/A | Sí | No | No | No | No | No | Sí | Sí | No |
| Recaída (lugar y fenotipo) | Progresión | Progresión | Combinada (medular y SNC CD19+ | Combinada (medular y SNC) CD19+ | No | Medular CD19– | Medular CD19– | Ganglionar CD19+ | No | No | Medular CD19– |
| Tiempo desde infusión del CAR-T hasta recaída/pérdida de aplasia células B (meses) | N/A | N/A | 1.4 | 7 | N/A | 7,3 | 3,3 | 9,4 | 1,9 | 2,33 | N/A |
| Tratamiento tras recaída | Paliativo | Paliativo | Haplo-TPH | CAR-T dual CD19/22 | No | Haplo-TPH y ribociclib | Paliativo | Haplo-TPH | Haplo-TPH | Haplo-TPH | Paliativo |
| Seguimiento (meses) | 2,2 | 2,4 | 12,6 | 23,26 | 22,13 | 15,36 | 4,3 | 15,3 | 12,53 | 4,86 | 1,96 |
| Estado actual | Fallecimiento | Fallecimiento | Vivo en RC | Vivo en RC | Vivo en RC | Vivo en recaída | Fallecimiento | Vivo en RC | Vivo en RC | Vivo en RC | Fallecimiento |
Se excluye a los 3 pacientes tratados en el ensayo clínico CCTL019C2202.
ARA-C: citarabina; CAR-T: receptor antigénico quimérico en linfocitos T; CFM: ciclofosfamida; CRS: síndrome de liberación de citocinas; DEX: dexametasona; DNE: donante no emparentado; FluCy=fludarabina (30mg/m2×4dosis), ciclofosfamida (500mg/m2×2 dosis); FluCy600: fludarabina (30mg/m2×4dosis), ciclofosfamida (600mg/m2×2 dosis); HLH: linfohistiocitosis hemofagocítica; ICANS: síndrome de neurotoxicidad inmunomediada; IFI: infección fúngica invasiva; LFM: leucemia de fenotipo mixto; LLA-B: leucemia linfoblástica aguda de precursores B; N/A: no aplicable; PEG-ASP: asparraginasa pegilada; PRED: prednisona; RC: remisión completa; RCi: remisión completa con recuperación hematológica incompleta; SNC: sistema nervioso central; TBC: infección tuberculosa; TIT: triple terapia intratecal; TPH: trasplante de progenitores hematopoyéticos; VBL: vinblastina; VCR: vincristina.
Todas las aféresis se realizaron sin incidencias y sin fallos en la producción del medicamento. Tras la infusión, se observaron 8 episodios de síndrome de liberación de citocinas, 1 síndrome de neurotoxicidad inmunomediada y 2 síndromes hemofagocíticos. Todo ello condicionó en 4 pacientes su ingreso en la Unidad de Cuidados Intensivos. Sin embargo, no se registró ningún fallecimiento relacionado con toxicidad asociada a la terapia CAR-T.
La tasa de remisión obtenida con tisagenlecleucel y con el CAR-T dual CD19/CD22 fue del 100 y el 50%, respectivamente. Se observó en 3 de los pacientes tratados con tisagenlecleucel, pérdida de aplasia de linfocitos B en sangre periférica. Esto sucedió durante los primeros 6meses en 2 pacientes, motivo por el que fueron tratados mediante trasplante de progenitores hematopoyéticos (TPH) temprano como estrategia de consolidación, sin reaparición de la enfermedad documentada. En el otro paciente, con pérdida de aplasia de células B, en este caso tras los 6primeros meses, se adoptó conducta expectante, diagnosticándose finalmente de recaída medular CD19+. Esto pone de manifiesto que la pérdida de aplasia de células B es marcador pronóstico de recaída, sobre todo durante el primer año.
De los pacientes con LLA-B en remisión completa tratados con tisagenlecleucel, observamos 4 recaídas, 3 medulares y una extramedular (ganglionar). La actitud de los pacientes que recaen tras terapia CAR-T es controvertida. En nuestra serie, 2 pacientes pudieron ser rescatados con un segundo TPH y otro paciente con un CAR-T dual 19/22. Sin embargo, creemos necesario identificar qué pacientes precisarían recibir TPH como consolidación postisagenlecleucel, incluso en presencia de aplasia de linfocitos B para evitar una futura recaída. Adicionalmente, la monitorización del quimerismo de poblaciones linfocitarias en los pacientes que recibieron tisagenlecleucel tras recibir TPH, frente a la monitorización de la aplasia de células B, podría ser una herramienta diagnóstica temprana para identificar el riesgo de recaída y realizar estrategias preventivas como la inmunoterapia adoptiva4.
A pesar de que se ha descrito un buen perfil de seguridad en hemopatías y en tumores sólidos in vitro con el CART-NKG2D5, los resultados clínicos aún son limitados, y en nuestra experiencia poco alentadores.
Los datos obtenidos hasta el momento con la terapia CAR-T ofrecen un buen perfil de seguridad y eficacia en enfermos de edad pediátrica con LLA-B en recidiva o refractaria1. Sin embargo, tanto la pérdida del CAR-T como las recidivas tras la terapia CAR-T siguen siendo frecuentes y desfavorables. Es necesario profundizar en el conocimiento de los resultados derivados de la aplicación de la terapia en la práctica clínica habitual, así como optimizar los mismos y proponer estrategias de consolidación tras la terapia CAR-T. Todo ello permitiría la aumentar la supervivencia en este grupo de pacientes y ampliar su indicación a otros tumores pediátricos6.
FinanciaciónLos autores muestran su agradecimiento a los Fondos FEDER (FIS) PI18/01301, así como al Instituto de Salud Carlos III y a la Fundación Cris contra el Cáncer (http://criscancer.org) por su apoyo.