La restricción del crecimiento intrauterino (RCIU) y la prematuridad se han aso-ciado con una mayor morbimortalidad perinatal, así como con una reprogramación fetal a nivel cardiovascular. Sin embargo, son escasos los estudios sobre el impacto de la RCIU de causa placentaria en los resultados perinatales y en biomarcadores cardiovasculares de recién nacidos prematuros.
ObjetivosDeterminar las diferencias en morbimortalidad neonatal y biomarcadores de disfunción cardiovascular en sangre de cordón entre prematuros con RCIU de origen placentario y sin RCIU, así como estudiar su relación con la gravedad de la RCIU según el estudio Doppler fetal.
Material y métodosEstudio prospectivo de cohortes: prematuros con RCIU de causa placentaria y prematuros sin RCIU adecuadamente apareados. Clasificación de la gravedad de la RCIU según el Doppler. Análisis comparativo de resultados perinatales, de morbimortalidad neonatal y de niveles en sangre de cordón de biomarcadores de disfunción cardiovascular.
ResultadosLos prematuros con RCIU presentan un menor peso, longitud, perímetro craneal y Apgar al nacimiento, así como un aumento de la morbilidad neonatal y de los niveles de biomarcadores de disfunción cardiovascular, comparado con los prematuros sin RCIU. Estas diferencias aumentan con la gravedad de la RCIU determinada por el estudio hemodinámico Doppler prenatal.
ConclusionesLos prematuros afectados de RCIU de causa placentaria presentan un incremento de la morbimortalidad neonatal independiente de la prematuridad, que aumenta de forma estadísticamente significativa con la gravedad de la RCIU. La afectación placentaria y su gravedad también determinan la alteración de biomarcadores de disfunción cardiovascular al nacimiento.
Intrauterine growth restriction (IUGR) and prematurity have been associated with increased perinatal morbidity and mortality and also with cardiovascular foetal programming. However, there are few studies on the impact of placenta-related IUGR on perinatal outcomes and cardiovascular biomarkers in pre-term infants.
ObjectivesTo determine differences in neonatal morbidity, mortality and cord blood biomarkers of cardiovascular dysfunction between pre-term placenta-related IUGR and non-IUGR new-borns, and to analyse their relationship with the severity of IUGR according to foetal Doppler evaluation.
Material and methodsProspective cohort study: pre-term infants with placenta-related IUGR and matched pre-term infants without IUGR. A Doppler scan was performed, and placenta-IUGR was classified according to severity. Comparative analysis of perinatal outcomes, neonatal morbidity and mortality, and cord blood levels of biomarkers of cardiovascular dysfunction was performed.
ResultsIUGR new-borns present lower weight, length, head circumference, and Apgar score at birth, as well as increased neonatal and cardiovascular dysfunction biomarker levels, compared with pre-term new-borns without IUGR. These differences increase with the severity of IUGR determined by prenatal umbilical artery Doppler scan.
ConclusionsPlacenta-related-IUGR pre-term infants, irrespective of gestational age, present increased neonatal morbidity and mortality that is significantly proportional to the severity of IUGR. Placental impairment and severity also determine levels of cardiovascular dysfunction biomarkers at birth.
La prematuridad y la restricción del crecimiento intrauterino (RCIU) representan, junto con las malformaciones congénitas, las infecciones y la anoxia, los problemas más importantes de la medicina fetal y son los principales responsables de la morbimortalidad perinatal. Se estima que la incidencia de RCIU grave es del 3-5% de los embarazos1.
Varios estudios describen un aumento de la morbimortalidad perinatal y neonatal en recién nacidos con RCIU o bajo peso, así como un aumento de la morbilidad cardiovascular en la vida adulta, conocido como programación fetal de enfermedades del adulto2-23. La morbimortalidad neonatal descrita en estos pacientes incluye complicaciones relacionadas con la prematuridad (distrés respiratorio, broncodisplasia pulmonar, enterocolitis necrosante, sepsis, test de Apgar bajo a los 5 min, alteración de la termorregulación, retinopatía de la prematuridad [ROP], hemorragia intraventricular, leucomalacia periventricular y muerte neonatal) y complicaciones tanto hematológicas como metabólicas (trombocitopenia, coagulopatía, leucopenia, hipoglucemia inicial, hiperglucemia posterior, alteraciones lipídicas en sangre de cordón, colestasis e ictericia)2-23.
Tanto el aumento de la morbimortalidad neonatal como los fenómenos de reprogramación fetal pueden ser debidos a la hipoxia-isquemia que presentan estos pacientes afectados de RCIU intraútero. La hipoxia-isquemia determina un fenómeno de adaptación hemodinámica que afecta a la maduración de los órganos, preservando prioritariamente cerebro, corazón y suprarrenales11,14,16,24. Aun así, algunos estudios parecen demostrar que esta redistribución hemodinámica no impide que los órganos más preservados presentan también consecuencias de la hipoxia-isquemia y déficit de nutrientes25-32. Se han descrito alteraciones cardiovasculares tanto a nivel de ecocardiografía fetal como de biomarcadores de disfunción cardiovascular en sangre de cordón en pacientes RCIU, concretamente un aumento de los niveles de péptido natriurético B (BNP)25-27. Estas alteraciones podrían guardar relación con los mecanismos de reprogramación fetal de la enfermedad cardiovascular en la edad adulta.
En cuanto a la relación de la morbimortalidad neonatal con la gravedad de la RCIU, disponemos de escasos estudios en la literatura. En el estudio de Damodaram et al. se ha descrito un aumento tanto del riesgo de muerte intraútero y neonatal, como de hemorragia intraventricular, en los fetos y recién nacidos afectados de RCIU que presentan alteración del Doppler arterial y venoso respecto a los que presentan tan solo alteración del Doppler arterial3.
El principal problema de la literatura actual es que la mayoría de los estudios de morbimortalidad neonatal en relación con la RCIU están realizados en recién nacidos con «bajo peso para la edad gestacional», sin identificar claramente las verdaderas RCIU de causa placentaria, que son las que están sometidas a fenómenos de hipoxia-isquemia. Otro problema es que la mayoría de estos estudios son retrospectivos y cuentan con una cohorte control de peso adecuado poco seleccionada (a menudo, sin excluir fetos con anomalías congénitas o aneuploidías, ni corioamnionitis)4,8-13. Y por último, apenas disponemos de estudios sobre marcadores plasmáticos precoces de disfunción cardiovascular en los pacientes afectados de RCIU, y tampoco sobre el impacto de la gravedad de la RCIU tanto en los resultados perinatales como en el grado de alteración de los biomarcadores de disfunción cardiovascular.
ObjetivosLos objetivos de nuestro estudio fueron: determinar las diferencias en la morbimortalidad neonatal y en los niveles de biomarcadores metabólico-cardiovasculares en sangre de cordón entre 2 cohortes bien definidas de prematuros con y sin RCIU, así como estudiar la relación de dichas variables con la gravedad de la RCIU según el estudio Doppler fetal.
Material y métodosEstudio prospectivo de cohortes: cohorte de prematuros RCIU de causa placentaria y cohorte de prematuros no RCIU apareados por edad gestacional y género. La cohorte RCIU está formada por niños prematuros con diagnóstico clínico prenatal de RCIU de causa placentaria según curvas de peso de referencia y estudio Doppler fetal33,34 (peso fetal estimado [PFE] inferior al percentil 3 y/o en percentil 3-10 con alteración del Doppler), monitorizados y nacidos en el Hospital Vall d’Hebron entre 2007 y 2010. La cohorte no RCIU está formada por niños prematuros sin RCIU (PFE y al nacer superior al percentil 10 pero inferior al percentil 90 según curvas de referencia33, sin alteración del estudio Doppler y sin preeclampsia), debidamente apareados y nacidos en el mismo centro entre 2007 y 2010.
Los criterios de exclusión para ambas cohortes fueron: negación de los padres a participar, enfermedades que afectan al potencial de crecimiento (embriopatías, infecciones congénitas, cromosomopatías, enfermedades genéticas, malformaciones fetales), determinadas patologías maternas (diabetes mellitus tipo 1, neuropatía, drogodependencia, virus de la inmunodeficiencia humana), corioamnionitis, gestaciones múltiples monocoriales, gestaciones no monitorizadas o sin estudio ecográfico-Doppler en el Hospital Vall d’Hebron.
De todos los pacientes incluidos en el estudio (129 prematuros: 72 RCIU, 57 no RCIU), se recogieron datos maternos, obstétricos, de estudio Doppler, perinatales y de morbimortalidad neonatal. Se definió la variable morbilidad neonatal grave por la presencia de una o varias de las siguientes complicaciones: distrés respiratorio grave (definido por el que requiere de intubación), hemorragia intraventricular grados 3-4, persistencia del conducto arterioso tratada, disfunción renal, enterocolitis necrosante, perforación intestinal, sepsis vertical, sepsis nosocomial, retinopatía de la prematuridad (ROP) tratada con láser, displasia broncopulmonar, leucomalacia periventricular, administración de corticoides posnatales, administración de drogas inotrópicas y/o muerte.
Se clasificaron las RCIU según la gravedad del estudio Doppler, considerando RCIU graves las que presentan en el Doppler al final de la gestación una o varias de las siguientes alteraciones: arteria umbilical con diástole ausente/reversa y/o ductus venoso alterado por aumento del índice de pulsatilidad o diástole ausente/reversa.
También en los casos en que fue posible se realizó recogida de sangre de cordón para análisis de biomarcadores lipídicos (colesterol y triglicéridos) y de disfunción cardiovascular (N-terminal pro péptido natriurético tipo B [NT-pro-BNP], isoforma cardiaca de la troponina T [cTnT], «heart-type fatty acid binding protein» [hFABP]), previa firma por parte de la madre del consentimiento informado (ver anexo). Todos los datos se introdujeron en una ficha única para cada paciente y posteriormente en una base de datos Excell diseñada para el estudio. Se realizó un análisis estadístico comparando todas las variables entre ambas cohortes y en función de la gravedad en la cohorte RCIU, con el soporte de la Unidad de Soporte en Metodología para la Investigación Biomédica, y mediante el programa STATAv.11
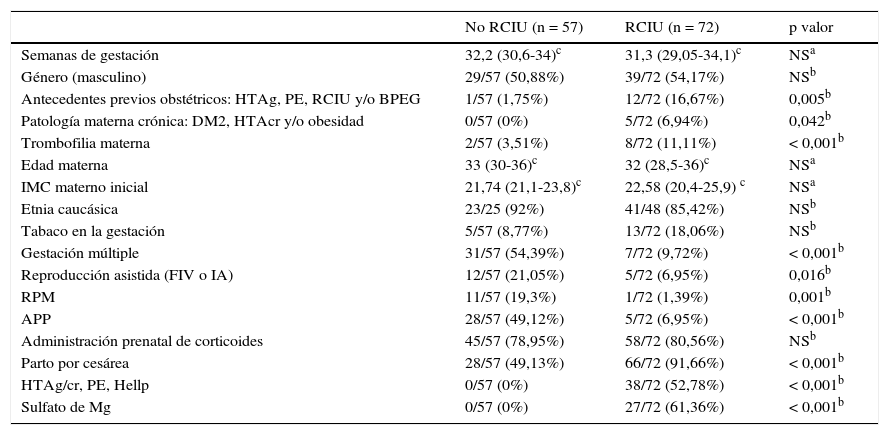
ResultadosCaracterísticas materno-fetales de las cohortesEn la tabla 1 se aprecia que ambas cohortes son comparables en función de edad gestacional y género. Existen diferencias estadísticamente significativas entre ambas cohortes en todas las variables de antecedentes maternos y obstétricos previos relacionados con RCIU y/o preeclampsia, así como en algunas variables maternas y obstétricas de la gestación actual relacionadas con la prematuridad (tasa superior en la cohorte no RCIU de gestación múltiple, reproducción asistida, rotura prematura y prolongada de membranas y amenaza de parto prematuro) y con la RCIU (tasa superior en la cohorte RCIU de hipertensión arterial gestacional, hipertensión arterial crónica, preeclampsia, síndrome de Hellp, parto por cesárea y administración prenatal de sulfato de magnesio).
Características perinatales y materno-obstétricas de ambas cohortes
| No RCIU (n = 57) | RCIU (n = 72) | p valor | |
|---|---|---|---|
| Semanas de gestación | 32,2 (30,6-34)c | 31,3 (29,05-34,1)c | NSa |
| Género (masculino) | 29/57 (50,88%) | 39/72 (54,17%) | NSb |
| Antecedentes previos obstétricos: HTAg, PE, RCIU y/o BPEG | 1/57 (1,75%) | 12/72 (16,67%) | 0,005b |
| Patología materna crónica: DM2, HTAcr y/o obesidad | 0/57 (0%) | 5/72 (6,94%) | 0,042b |
| Trombofilia materna | 2/57 (3,51%) | 8/72 (11,11%) | < 0,001b |
| Edad materna | 33 (30-36)c | 32 (28,5-36)c | NSa |
| IMC materno inicial | 21,74 (21,1-23,8)c | 22,58 (20,4-25,9) c | NSa |
| Etnia caucásica | 23/25 (92%) | 41/48 (85,42%) | NSb |
| Tabaco en la gestación | 5/57 (8,77%) | 13/72 (18,06%) | NSb |
| Gestación múltiple | 31/57 (54,39%) | 7/72 (9,72%) | < 0,001b |
| Reproducción asistida (FIV o IA) | 12/57 (21,05%) | 5/72 (6,95%) | 0,016b |
| RPM | 11/57 (19,3%) | 1/72 (1,39%) | 0,001b |
| APP | 28/57 (49,12%) | 5/72 (6,95%) | < 0,001b |
| Administración prenatal de corticoides | 45/57 (78,95%) | 58/72 (80,56%) | NSb |
| Parto por cesárea | 28/57 (49,13%) | 66/72 (91,66%) | < 0,001b |
| HTAg/cr, PE, Hellp | 0/57 (0%) | 38/72 (52,78%) | < 0,001b |
| Sulfato de Mg | 0/57 (0%) | 27/72 (61,36%) | < 0,001b |
APP: amenaza de parto prematuro; BPEG: bajo peso para la edad gestacional; DM2: diabetes mellitus tipo 2; FIV: fecundación «in vitro»; Hellp: síndrome de Hellp; HTAcr: hipertensión arterial crónica; HTAg/cr: hipertensión arterial gestacional/crónica; HTAg: hipertensión arterial gestacional; IA: inseminación artificial; IMC: índice de masa corporal; Mg: magnesio; PE: preeclampsia; RCIU: restricción de crecimiento intrauterino; RPM: rotura prematura de membranas.
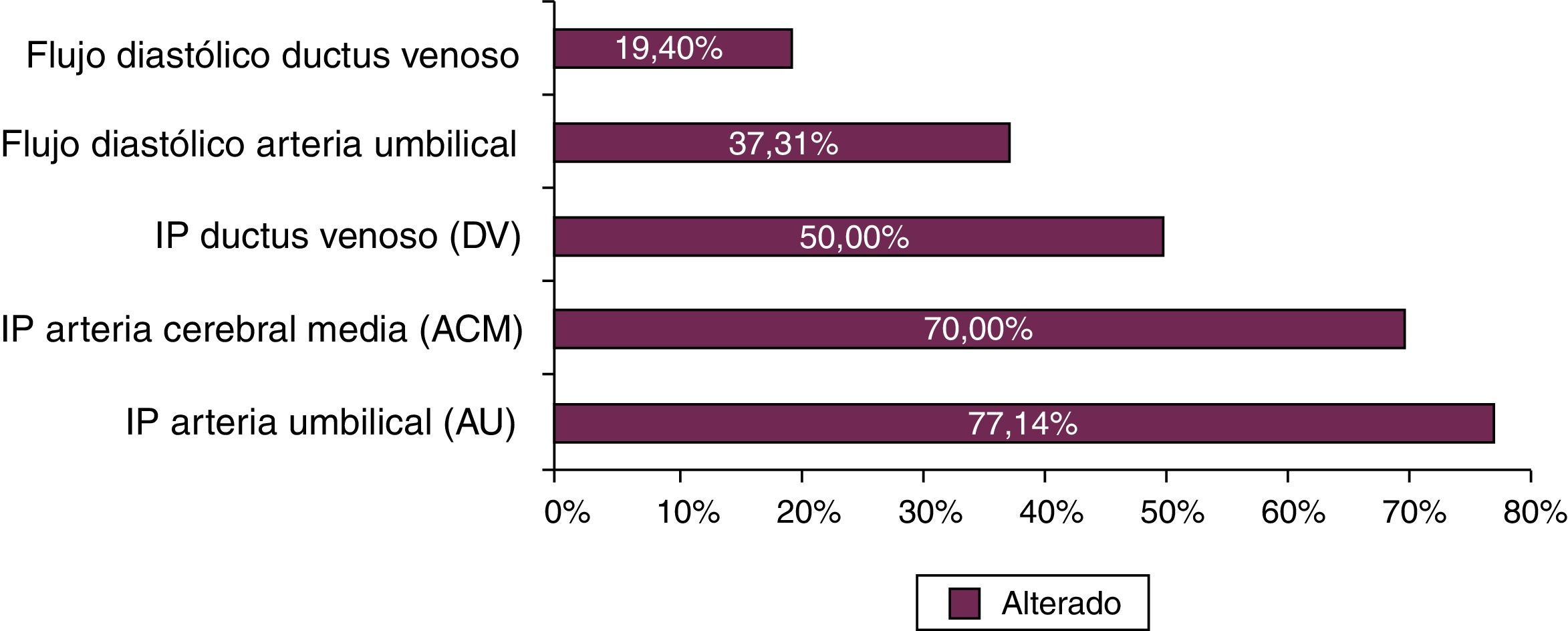
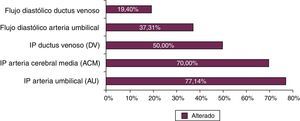
En la cohorte RCIU un 56% de los pacientes fueron considerados graves en función del estudio Doppler. En la figura 1 se detallan las características del Doppler fetal de la cohorte RCIU al final de la gestación, donde se refleja que un 19,4% presentaba afectación hemodinámica muy grave por alteración diastólica del ductus venoso.
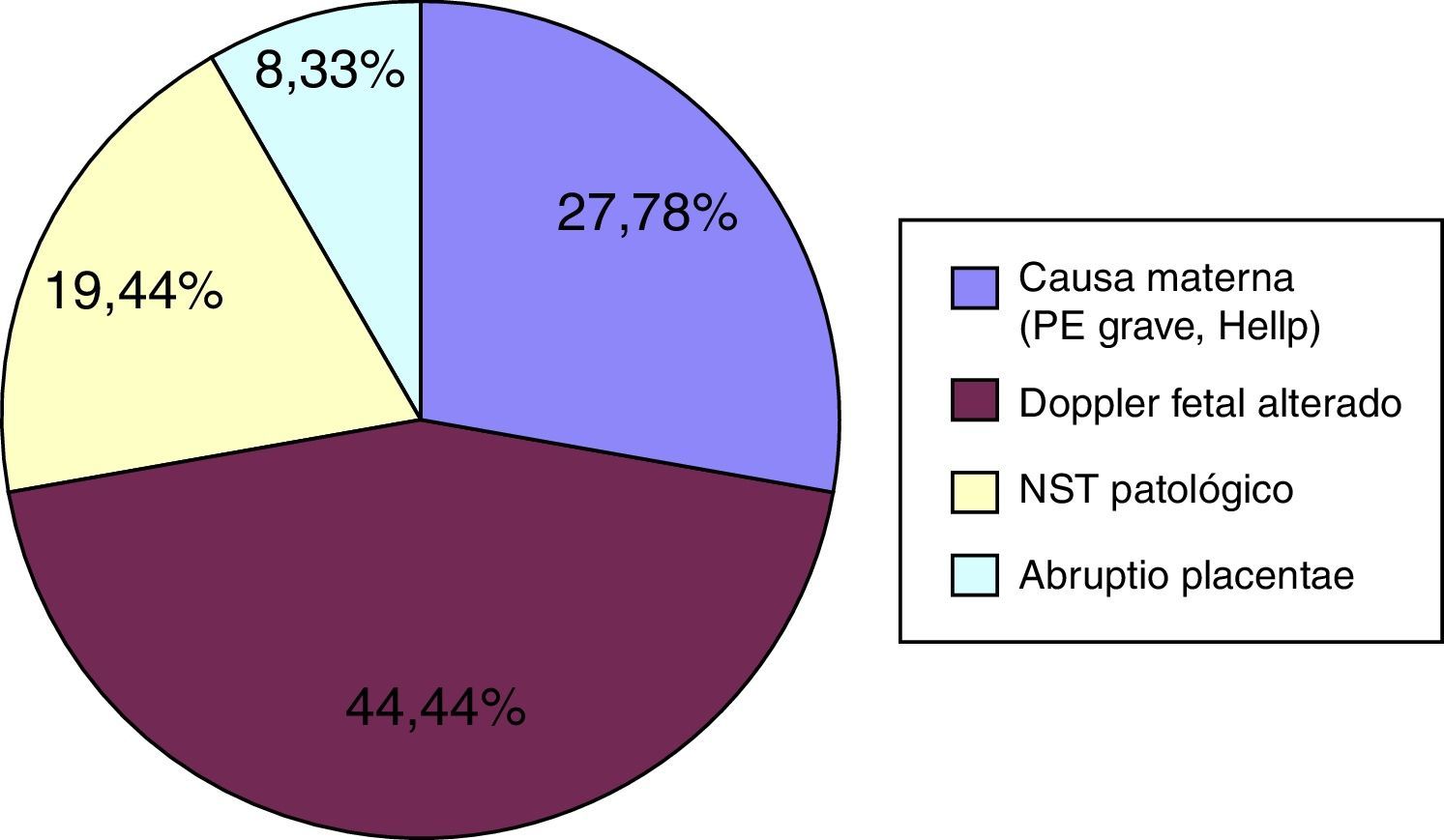
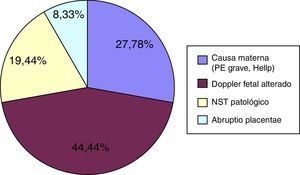
La figura 2 muestra que la causa más frecuente de finalización de la gestación en la cohorte RCIU fue de origen fetal (alteración del Doppler o del registro cardiotocográfico fetal [NST]), seguido por causa materna (preeclampsia grave o síndrome de Hellp) y por causa placentaria (desprendimiento de placenta). En la cohorte no RCIU la causa más frecuente de finalización de la gestación fue la amenaza de parto prematuro no frenable (59,65% de los casos), seguida de la alteración del otro feto en gestaciones múltiples (12,28% de los casos) y de la gestación triple (8,77% de los casos). El resto de las causas suponen ≤ 5% cada una: placenta previa sangrante, NST alterado, riesgo de rotura uterina y desprendimiento de placenta.
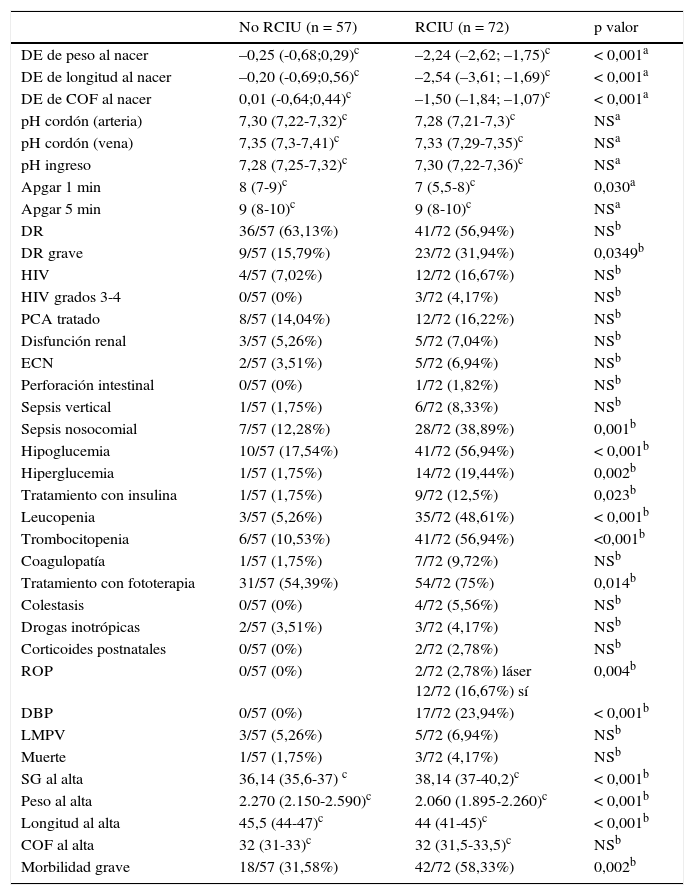
Diferencias en la morbimortalidad neonatal y niveles de biomarcadores de disfunción cardiovascular y metabólica en sangre de cordón entre las cohortes de pacientes prematuros con y sin retraso de crecimiento intrauterinoEn la tabla 2 se detallan las diferencias existentes en la antropometría al nacer y en la morbimortalidad neonatal entre ambas cohortes. La cohorte RCIU presenta de forma estadísticamente significativa una menor desviación estándar de peso, longitud y perímetro craneal al nacer, así como una mayor edad gestacional corregida al alta (mayor estancia hospitalaria), y un peso y longitud menores al alta.
Morbimortalidad neonatal en ambas cohortes
| No RCIU (n = 57) | RCIU (n = 72) | p valor | |
|---|---|---|---|
| DE de peso al nacer | –0,25 (-0,68;0,29)c | –2,24 (–2,62; –1,75)c | < 0,001a |
| DE de longitud al nacer | –0,20 (-0,69;0,56)c | –2,54 (–3,61; –1,69)c | < 0,001a |
| DE de COF al nacer | 0,01 (-0,64;0,44)c | –1,50 (–1,84; –1,07)c | < 0,001a |
| pH cordón (arteria) | 7,30 (7,22-7,32)c | 7,28 (7,21-7,3)c | NSa |
| pH cordón (vena) | 7,35 (7,3-7,41)c | 7,33 (7,29-7,35)c | NSa |
| pH ingreso | 7,28 (7,25-7,32)c | 7,30 (7,22-7,36)c | NSa |
| Apgar 1 min | 8 (7-9)c | 7 (5,5-8)c | 0,030a |
| Apgar 5 min | 9 (8-10)c | 9 (8-10)c | NSa |
| DR | 36/57 (63,13%) | 41/72 (56,94%) | NSb |
| DR grave | 9/57 (15,79%) | 23/72 (31,94%) | 0,0349b |
| HIV | 4/57 (7,02%) | 12/72 (16,67%) | NSb |
| HIV grados 3-4 | 0/57 (0%) | 3/72 (4,17%) | NSb |
| PCA tratado | 8/57 (14,04%) | 12/72 (16,22%) | NSb |
| Disfunción renal | 3/57 (5,26%) | 5/72 (7,04%) | NSb |
| ECN | 2/57 (3,51%) | 5/72 (6,94%) | NSb |
| Perforación intestinal | 0/57 (0%) | 1/72 (1,82%) | NSb |
| Sepsis vertical | 1/57 (1,75%) | 6/72 (8,33%) | NSb |
| Sepsis nosocomial | 7/57 (12,28%) | 28/72 (38,89%) | 0,001b |
| Hipoglucemia | 10/57 (17,54%) | 41/72 (56,94%) | < 0,001b |
| Hiperglucemia | 1/57 (1,75%) | 14/72 (19,44%) | 0,002b |
| Tratamiento con insulina | 1/57 (1,75%) | 9/72 (12,5%) | 0,023b |
| Leucopenia | 3/57 (5,26%) | 35/72 (48,61%) | < 0,001b |
| Trombocitopenia | 6/57 (10,53%) | 41/72 (56,94%) | <0,001b |
| Coagulopatía | 1/57 (1,75%) | 7/72 (9,72%) | NSb |
| Tratamiento con fototerapia | 31/57 (54,39%) | 54/72 (75%) | 0,014b |
| Colestasis | 0/57 (0%) | 4/72 (5,56%) | NSb |
| Drogas inotrópicas | 2/57 (3,51%) | 3/72 (4,17%) | NSb |
| Corticoides postnatales | 0/57 (0%) | 2/72 (2,78%) | NSb |
| ROP | 0/57 (0%) | 2/72 (2,78%) láser 12/72 (16,67%) sí | 0,004b |
| DBP | 0/57 (0%) | 17/72 (23,94%) | < 0,001b |
| LMPV | 3/57 (5,26%) | 5/72 (6,94%) | NSb |
| Muerte | 1/57 (1,75%) | 3/72 (4,17%) | NSb |
| SG al alta | 36,14 (35,6-37) c | 38,14 (37-40,2)c | < 0,001b |
| Peso al alta | 2.270 (2.150-2.590)c | 2.060 (1.895-2.260)c | < 0,001b |
| Longitud al alta | 45,5 (44-47)c | 44 (41-45)c | < 0,001b |
| COF al alta | 32 (31-33)c | 32 (31,5-33,5)c | NSb |
| Morbilidad grave | 18/57 (31,58%) | 42/72 (58,33%) | 0,002b |
COF: circunferencia occipito-frontal; DE: desviación estándar; DBP: displasia broncopulmonar; DR: distrés respiratorio; ECN: enterocolitis necrosante; HIV: hemorragia intraventricular; LMPV: leucomalacia periventricular; PCA: persistencia del conducto arterioso; ROP: retinopatía de la prematuridad; SG: semanas de gestación.
Asimismo, la cohorte RCIU presenta de forma estadísticamente significativa una tasa de morbilidad neonatal grave superior, un test de Apgar al minuto inferior y un aumento de la frecuencia de las siguientes complicaciones neonatales: distrés respiratorio grave, sepsis nosocomial, hipoglucemia, hiperglucemia, necesidad de tratamiento con insulina, leucopenia, trombocitopenia, ictericia, necesidad de tratamiento con fototerapia, ROP y displasia broncopulmonar (tabla 2).
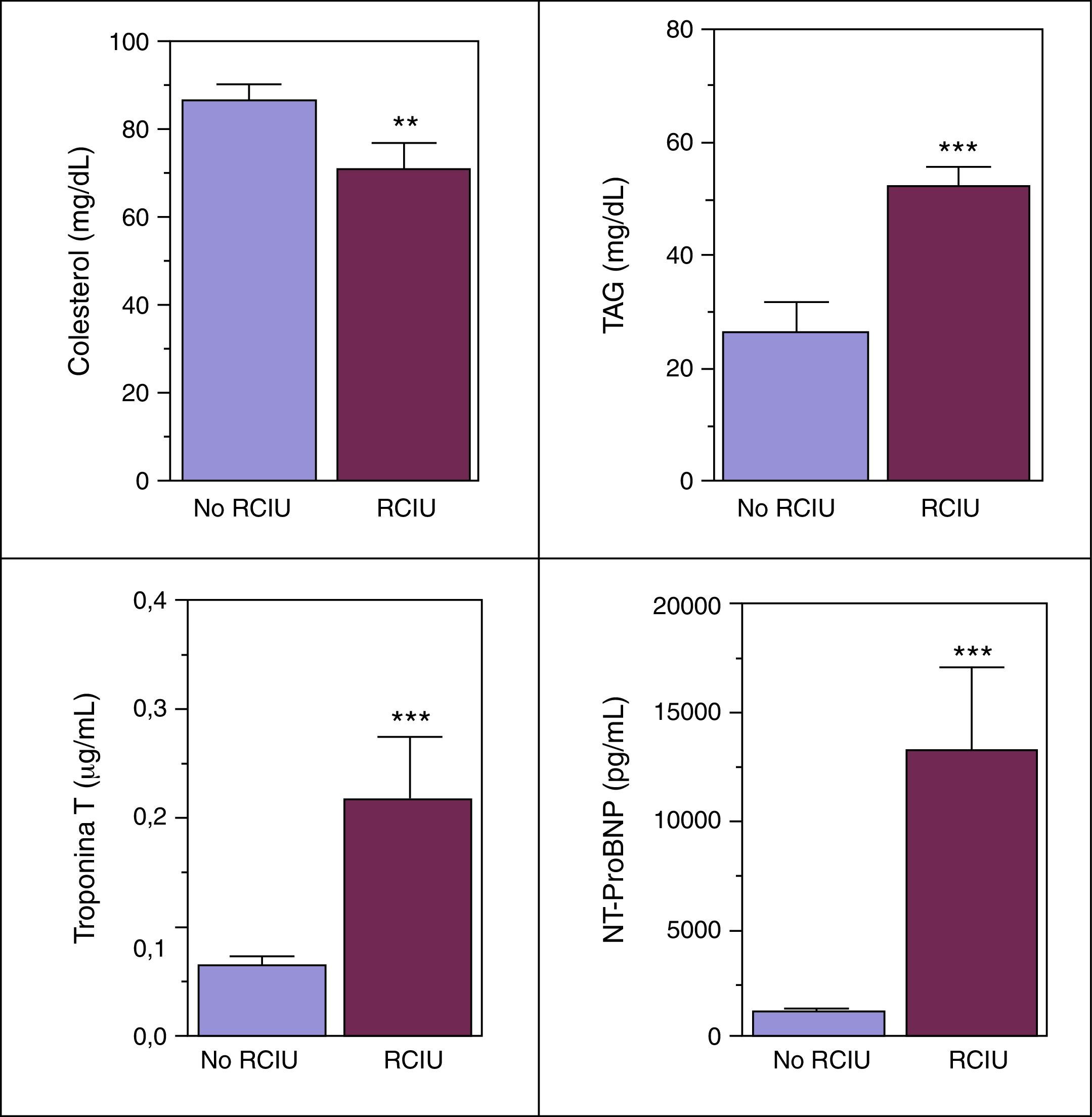
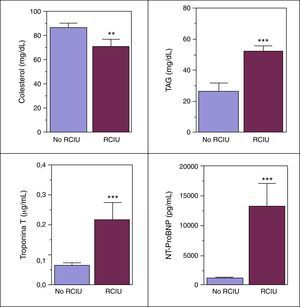
La figura 3 muestra que, a nivel de sangre de cordón, detectamos en la cohorte RCIU niveles superiores estadísticamente significativos de los biomarcadores triglicéridos, cTnT y NT-pro-BNP; así como niveles inferiores estadísticamente significativos de colesterol total.
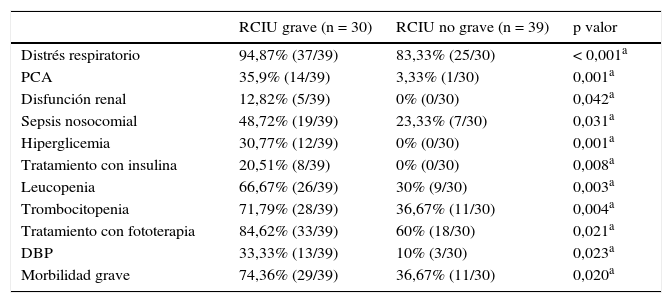
Relación de la morbimortalidad neonatal y niveles de biomarcadores de disfunción cardiovascular en sangre de cordón con la gravedad de la restricción del crecimiento intrauterinoEn la tabla 3 se describen las diferencias estadísticamente significativas en la tasa de determinadas morbilidades neonatales entre RCIU graves y no graves. Los prematuros con RCIU grave presentan un aumento de: morbilidad grave, distrés respiratorio, displasia broncopulmonar, persistencia del conducto arterioso, disfunción renal, sepsis nosocomial, hiperglicemia, insulina, leucopenia, trombocitopenia, ictericia y necesidad de fototerapia. También observamos, tal y como se describe en la tabla 4, una relación entre una mayor alteración de cada parámetro del Doppler fetal al final de la gestación con el aumento estadísticamente significativo de diversos resultados neonatales adversos.
Morbimortalidad neonatal según la gravedad del RCIU (n = 69)
| RCIU grave (n = 30) | RCIU no grave (n = 39) | p valor | |
|---|---|---|---|
| Distrés respiratorio | 94,87% (37/39) | 83,33% (25/30) | < 0,001a |
| PCA | 35,9% (14/39) | 3,33% (1/30) | 0,001a |
| Disfunción renal | 12,82% (5/39) | 0% (0/30) | 0,042a |
| Sepsis nosocomial | 48,72% (19/39) | 23,33% (7/30) | 0,031a |
| Hiperglicemia | 30,77% (12/39) | 0% (0/30) | 0,001a |
| Tratamiento con insulina | 20,51% (8/39) | 0% (0/30) | 0,008a |
| Leucopenia | 66,67% (26/39) | 30% (9/30) | 0,003a |
| Trombocitopenia | 71,79% (28/39) | 36,67% (11/30) | 0,004a |
| Tratamiento con fototerapia | 84,62% (33/39) | 60% (18/30) | 0,021a |
| DBP | 33,33% (13/39) | 10% (3/30) | 0,023a |
| Morbilidad grave | 74,36% (29/39) | 36,67% (11/30) | 0,020a |
DBP: displasia broncopulmonar; PCA: persistencia del conducto arterioso.
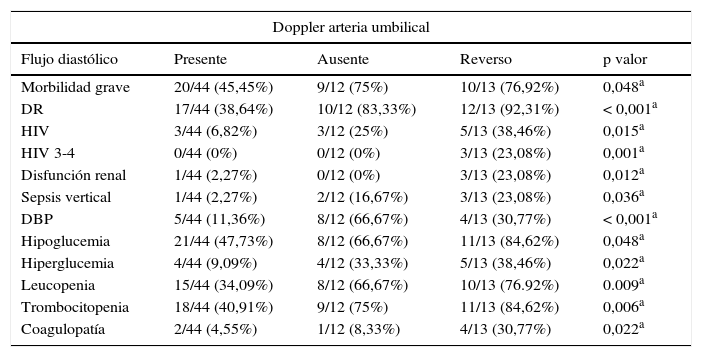
Diferencias en la morbimortalidad neonatal según el Doppler final
| Doppler arteria umbilical | ||||
|---|---|---|---|---|
| Flujo diastólico | Presente | Ausente | Reverso | p valor |
| Morbilidad grave | 20/44 (45,45%) | 9/12 (75%) | 10/13 (76,92%) | 0,048a |
| DR | 17/44 (38,64%) | 10/12 (83,33%) | 12/13 (92,31%) | < 0,001a |
| HIV | 3/44 (6,82%) | 3/12 (25%) | 5/13 (38,46%) | 0,015a |
| HIV 3-4 | 0/44 (0%) | 0/12 (0%) | 3/13 (23,08%) | 0,001a |
| Disfunción renal | 1/44 (2,27%) | 0/12 (0%) | 3/13 (23,08%) | 0,012a |
| Sepsis vertical | 1/44 (2,27%) | 2/12 (16,67%) | 3/13 (23,08%) | 0,036a |
| DBP | 5/44 (11,36%) | 8/12 (66,67%) | 4/13 (30,77%) | < 0,001a |
| Hipoglucemia | 21/44 (47,73%) | 8/12 (66,67%) | 11/13 (84,62%) | 0,048a |
| Hiperglucemia | 4/44 (9,09%) | 4/12 (33,33%) | 5/13 (38,46%) | 0,022a |
| Leucopenia | 15/44 (34,09%) | 8/12 (66,67%) | 10/13 (76.92%) | 0.009a |
| Trombocitopenia | 18/44 (40,91%) | 9/12 (75%) | 11/13 (84,62%) | 0,006a |
| Coagulopatía | 2/44 (4,55%) | 1/12 (8,33%) | 4/13 (30,77%) | 0,022a |
| Doppler ductus venoso | ||||
|---|---|---|---|---|
| Flujo diastólico | Presente | Ausente | Reverso | p–valor |
| Morbilidad grave | 28/56 (50%) | 7/8 (87,5%) | 5/5 (100%) | 0,019a |
| DR | 28/56 (50%) | 7/8 (87,5%) | 5/5 (100%) | 0,019a |
| Disfunción renal | 1/56 (1,79%) | 1/8 (12,5%) | 3/5 (60%) | < 0,001a |
| Sepsis vertical | 3/56 (5,36%) | 1/8 (12,5%) | 2/5 (40%) | 0,029a |
| Hiperglucemia | 9/56 (16,07%) | 1/8 (12,5%) | 3/5 (60%) | 0,049a |
| Tratamiento con insulina | 5/56 (8,93%) | 1/8 (12,5%) | 3/5 (60%) | 0,005a |
| Coagulopatía | 3/56 (5,36%) | 2/8 (25%) | 2/5 (40%) | 0,016a |
| Corticoides posnatales | 0/56 (0%) | 1/8 (12,5%) | 1/5 (20%) | 0,009a |
| Índice de pulsatilidad | Normal | Aumentado | p valor |
|---|---|---|---|
| Morbilidad grave | 14/35 (40%) | 25/34 (73,53%) | 0,013a |
| DR | 15/35 (42,86%) | 24/34 (70,59%) | 0,046a |
| DR grave | 5/15 (33,33%) | 17/24 (70,83%) | 0,039a |
| ECN | 1/35 (2,86%) | 3/34 (8,82%) | 0,001a |
| Leucopenia | 11/35 (31,43%) | 22/34 (64,71%) | 0,013a |
| Trombocitopenia | 14/35 (40%) | 24/34 (70,59%) | 0,025a |
| Colestasis | 1/35 (2,86%) | 2/34 (5,88%) | < 0,001a |
DBP: displasia broncopulmonar; DR: distrés respiratorio; ECN: enterocolitis necrosante; HIV: hemorragia intraventricular.
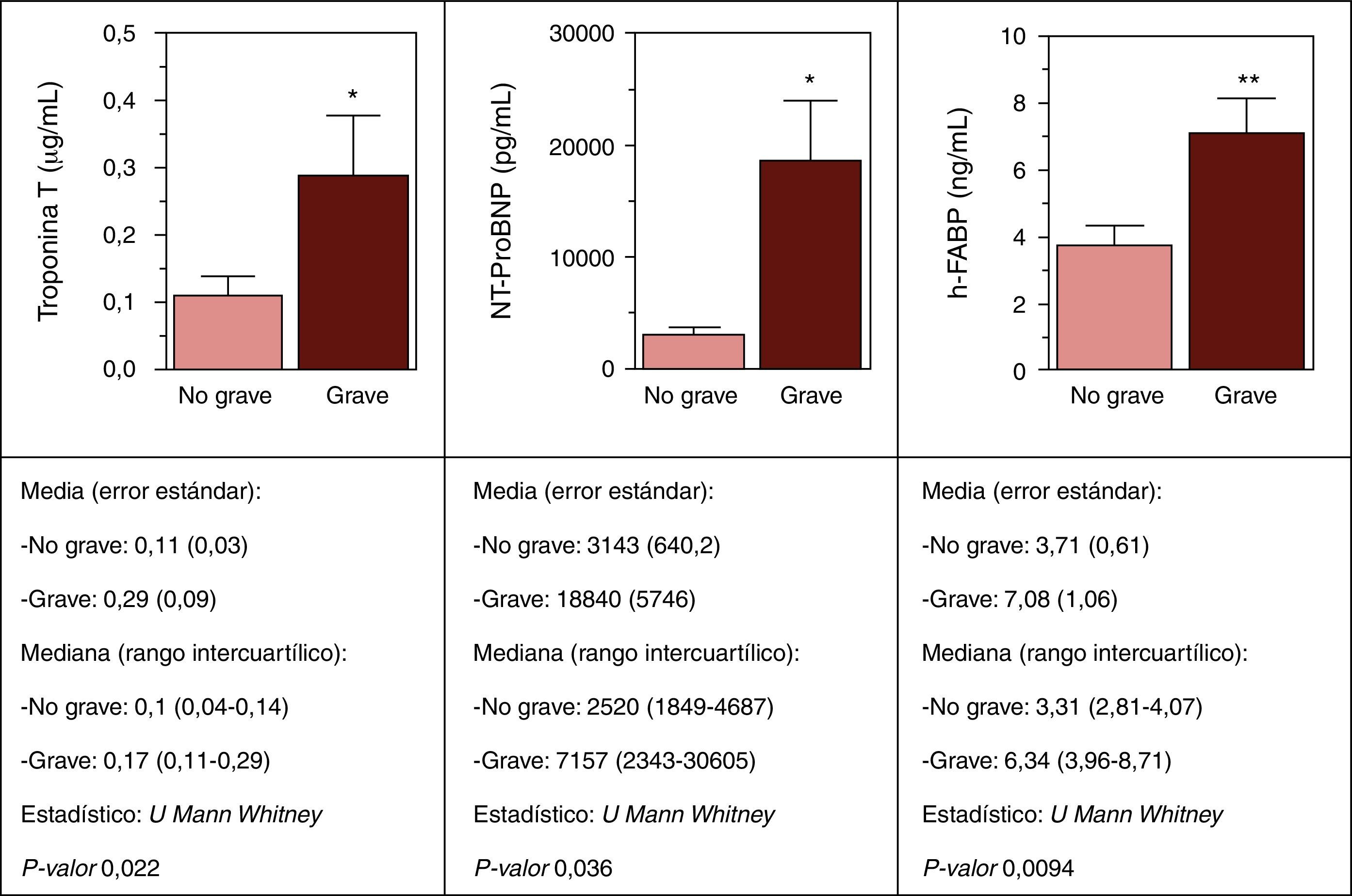
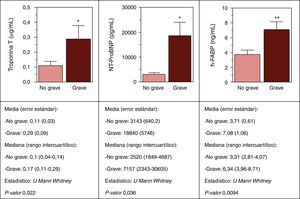
En la figura 4 se muestran los resultados del análisis de biomarcadores cardiovasculares en sangre de cordón en relación con la gravedad de la RCIU, observando unos niveles más elevados estadísticamente significativos de cTnT, NT-pro-BNP y h-FABP en las RCIU más graves respecto al resto.
DiscusiónEn este estudio los prematuros con RCIU de causa placentaria han presentado un aumento de la morbimortalidad neonatal, así como una somatometría inferior y una mayor estancia hospitalaria (edad gestacional corregida al alta superior), respecto a los prematuros sin RCIU.
La tendencia a presentar una mayor morbimortalidad neonatal en los prematuros RCIU es consistente con la mayoría de estudios publicados en la literatura2-14. Concretamente, la cohorte RCIU presenta una mayor frecuencia de morbilidad grave y de determinadas morbilidades íntimamente relacionadas con la prematuridad: Apgar menor al minuto de vida3,9 y mayor incidencia de sepsis nosocomial3,11,14, de complicaciones respiratorias2-4,8-10 y retionpatía de la prematuridad (o ROP)2,4. Sin embargo, a diferencia de lo descrito en la literatura3,4,9,10, no se han observado diferencias estadísticamente significativas en la mortalidad neonatal ni en la tasa de enterocolitis necrosante2-4,8,9,11. En cuanto a la hemorragia intraventricular y la leucomalacia periventricular, los datos de la literatura son contradictorios. En este estudio, no se han detectado diferencias entre RCIU y no RCIU, de forma consistente con parte de lo descrito en la literatura3,8,15. En cuanto a las complicaciones neonatales de tipo metabólico y hematológico, varios estudios refieren, al igual que el nuestro, un aumento de las mismas en los pacientes RCIU, concretamente: mayor incidencia de hipoglucemia, hiperglucemia, tratamiento con insulina, leucopenia, trombocitopenia e ictericia tratada con fototerapia2,14,16-18.
Sin embargo, como ya hemos comentado en la introducción, la mayoría de los estudios existentes en la literatura actual son retrospectivos y no definen de forma estricta el grupo RCIU. Y aquí radica una de las principales ventajas del presente estudio, puesto que se trata de un estudio prospectivo y que incluye exclusivamente RCIU de causa placentaria. Además, ambas cohortes están bien definidas con criterios restrictivos y son comparables por edad gestacional y género. Las diferencias detectadas en las características maternas y obstétricas entre ambas cohortes son inherentes a las propias patologías de cada cohorte (RCIU y otras causas de prematuridad) y consistentes con lo descrito en la literatura y, por lo tanto, no deberían ser una limitación para el estudio1,5,35-37. También son consistentes con lo descrito en la literatura las características en la cohorte RCIU del estudio Doppler y de la causa fetal como causa más frecuente de finalización de la gestación7,36,37.
Sin embargo, una limitación de este estudio es el tamaño muestral final, en relación en gran parte con los criterios restrictivos utilizados para la selección de ambas cohortes.
Otra aportación importante del presente estudio es la detección en sangre de cordón de diferencias en biomarcadores metabólicos y de disfunción cardiovascular precoz entre prematuros RCIU y no RCIU. Estas alteraciones podrían guardar relación con los mecanismos de reprogramación fetal de la enfermedad cardiovascular en la edad adulta. Hay pocos estudios en este mismo sentido, pero las diferencias del metabolismo lipídico observadas en sangre de cordón en los recién nacidos con RCIU de este estudio concuerdan con lo descrito en la literatura. Así, en sangre de cordón los recién nacidos con RCIU presentan una proporción más alta de triglicéridos con unos niveles más bajos de colesterol16,17. Del mismo modo, también la alteración de los biomarcadores de disfunción cardiovascular cTnT y NT-pro-BNP en los recién nacidos RCIU de este estudio concuerda con lo descrito en la literatura. Concretamente, los pacientes con RCIU al nacer presentan niveles aumentados de péptido natriurético y de cTnT respecto a recién nacidos sin RCIU38-40. La confirmación de la alteración de estos biomarcadores es relevante, puesto que avalaría la presencia de una afectación cardiovascular precoz en las RCIU, que podría estar en relación con los mecanismos de reprogramación fetal de la enfermedad cardiovascular en la edad adulta. Sería interesante estudiar la relación de estas alteraciones plasmáticas con la evolución de los pacientes con RCIU a largo plazo.
Por último, es importante señalar que se ha observado una relación directa tanto de la morbimortalidad neonatal, como de los niveles de biomarcadores cardiovasculares en sangre de cordón, con la gravedad de la alteración hemodinámica Doppler de los pacientes con RCIU.
Estos peores resultados perinatales y de biomarcadores de disfunción cardiovascular en las RCIU graves, se pueden justificar por su mayor hipoxia-isquemia, reflejada por una mayor alteración del estudio Doppler fetal. Esta hipoxia-isquemia más grave condicionaría una mayor afectación de los órganos intraútero que incrementaría su disfunción y el consecuente aumento del riesgo de morbilidades relacionadas, tanto en el periodo neonatal como en la edad adulta2,14,16-18.
A pesar de la escasez de estudios sobre esta relación, Damodaram et al. ya describen un aumento del riesgo de determinadas morbilidades en aquellos pacientes RCIU con mayor alteración del Doppler prenatal3.
En cuanto a los biomarcadores de sangre de cordón, los resultados del presente estudio concuerdan con el único estudio que valora biomarcadores cardiovasculares en sangre de cordón en función de la gravedad de la RCIU definida por Doppler38. En este caso, además de detectar niveles superiores de NT-pro-BNP (péptido natriurético), también se ha observado un aumento de los biomarcadores de disfunción cardiovascular cTnT y h-FABP en sangre de cordón en los pacientes con RCIU más graves. Este hallazgo es significativo y novedoso, a pesar de que la muestra es pequeña, puesto que podría poner de manifiesto la utilidad de estos biomarcadores no solamente en relación con la gravedad de la RCIU y su repercusión perinatal, sino también en relación con la posible afectación cardiovascular de estos pacientes presente y futura.
Finalmente, y como conclusión, las principales aportaciones de este estudio son: la confirmación del aumento de morbimortalidad neonatal en los prematuros con RCIU de causa placentaria, la detección de alteraciones de biomarcadores lipídicos y cardiovasculares en sangre de cordón en estos pacientes y la existencia de una relación directa entre mayor riesgo de morbimortalidad neonatal y alteración de biomarcadores en sangre de cordón con la gravedad de la RCIU definida por el Doppler. De este modo, el presente estudio confirma la utilidad de la evaluación hemodinámica Doppler en el manejo y la estadificación de los casos con RCIU, y pone de manifiesto la necesidad de estudios prospectivos con mayor número de pacientes con una adecuada caracterización de la función placentaria prenatal y su correlación con la morbimortalidad a corto y a largo plazo.
Financiación- –
Estudio enmarcado en el proyecto FIS PI07/1095 (2007-2010) financiado por el Fondo de Investigación Sanitaria con el título «La gestación como situación de estrés para el desarrollo de enfermedad cardiovascular: evaluación de marcadores de riesgo hemodinámicos y bioquímicos para la enfermedad aterosclerótica en madres y fetos con preeclampsia y/o retraso de crecimiento intrauterino» (investigadora principal: Elisa Llurba Olivé).
- –
Contrato beca predoctoral post-MIR otorgado por el VHIR (Institut de Recerca Vall d’Hebron) a la doctoranda Júlia Candel Pau (2011-2014).
Los autores declaran no tener ningún conflicto de intereses.