Analizar la eficacia y la seguridad del tratamiento con hormona de crecimiento (GH) durante 3 años en niños pequeños para la edad gestacional (PEG) sin crecimiento recuperador, diagnosticados y tratados en el Servicio de Endocrinología del Hospital Infantil Universitario Niño Jesús de Madrid entre 2003 y 2011.
Sujetos y métodosSe estudiaron retrospectivamente los datos antropométricos y analíticos de 52 pacientes PEG tratados con GH (dosis media: 0,035mg/kg/día), determinando su influencia sobre el crecimiento, composición corporal, maduración ósea, metabolismo de carbohidratos y lípidos, perfilhormona tiroideo y tensión arterial.
ResultadosEl tratamiento con GH determinó un incremento significativo de la velocidad de crecimiento, máximo en los primeros 12 meses de su administración y en niños menores de 5 años de edad. Los niveles de IGF-I aumentaron significativamente, junto con una aceleración de la maduración ósea, permaneciendo ambos dentro de los límites de la normalidad. Se evidenció un aumento progresivo de los niveles de glucemia en ayunas, HbA1c, insulina basal e índice HOMA (homeostasis model assessment). Se constató una disminución significativa de c-LDL y un aumento de c-HDL. Asimismo, los cocientes colesterol total/c-HDL y c-LDL/c-HDL descendieron de forma significativa.
ConclusiónEl tratamiento con GH, además de promover el crecimiento físico en pacientes PEG, genera una cierta resistencia a la acción de la insulina y una mejoría de los cocientes de riesgo aterogénico a lo largo del seguimiento, tras 3 años de terapia. Es necesario un seguimiento a talla adulta.
To analyze the effectiveness and safety of growth hormone (GH) treatment, administered over a 3 year period to children small for gestational age (SGA) without catch-up growth, followed up in the Department of Endocrinology at the University Hospital Niño Jesús in Madrid between 2003 and 2011.
Patients and methodsAnthropometric and analytical data from 52 SGA patients receiving GH therapy (mean dose: 0.035mg/kg/day) were retrospectively examined in order to determine its influence on linear growth, body composition, bone maturation, carbohydrate and lipid metabolism, thyroid hormone profile and blood pressure.
ResultsGH treatment induced a significant increase in growth velocity, with the highest rise occurring during the first 12 months of its administration and in children under 5 years of age. Insulin-like growth factor-I levels increased significantly, along with a significant acceleration in bone maturation, with both parameters remaining within normal limits. A progressive rise in fasting glucose levels, glycosylated hemoglobin, baseline insulin, and homeostasis model assessment index, were also found. Low density lipoprotein cholesterol (LDL-c) levels decreased and high density lipoprotein cholesterol levels (HDL-c) increased significantly. The atherogenic ratios of total-cholesterol/HDL-c and LDL-c/HDL-c also decreased significantly.
ConclusionGH treatment promotes physical growth in SGA patients, generates certain resistance to the action of insulin, and improves atherogenic risk ratios after 3 years of therapy. Long-term monitoring is required until adult height is reached.
Se estima que entre un 3 y un 5% de los recién nacidos son pequeños para la edad gestacional (PEG). En 2001 se definió el PEG por el International SGA (Small for Gestational Age) Advisory Board Consensus Development Conference como aquel recién nacido con un peso y/o longitud al menos 2 desviaciones estándar (DE) por debajo de la media para la edad gestacional, ya sea a término o pretérmino, según datos de su población de referencia1.
Las causas de un crecimiento fetal insuficiente son atribuidas a factores fetales, maternos, placentarios y, en un 40% de los casos, idiopáticas2. Un 80-90% de los PEG efectuarán un crecimiento recuperador normalizando su altura hacia los 2 años de edad (en algunos casos, y especialmente en prematuros, puede extenderse hasta los 4 años). No obstante, entre un 10-20% de ellos no lo realizarán, desconociéndose la causa3, pasando a formar parte del 20-30% de los sujetos adultos con talla por debajo de −2DE.
Los niños PEG constituyen un grupo heterogéneo con amplio espectro clínico. Pueden tener un riesgo mayor de alteraciones en la composición corporal y en la pubertad, retraso del desarrollo neurológico y aprendizaje, pubarquia prematura e hiperandrogenismo ovárico, así como el desarrollo de un síndrome metabólico (conjunto de factores de riesgo predictores de enfermedad cardiovascular), entre otros.
El tratamiento de los niños PEG sin crecimiento recuperador es actualmente una indicación de empleo de hormona de crecimiento (GH), aprobada por la FDA y la EMA. Los estudios muestran que el 85% de ellos alcanzan una talla adulta normal superior a -2DE, y un 98% una talla dentro del rango de su talla genética. Además del efecto sobre el crecimiento lineal, la GH muestra un efecto normalizador sobre el índice de masa corporal (IMC) y se asocia con descenso de la tensión arterial (TA) y con mejoría en el perfil lipídico al disminuir los niveles de colesterol total y de c-LDL4,5. El inicio de la pubertad, su progresión y la aparición de la menarquia es comparable con los PEG que no recibieron tratamiento. Ningún estudio ha identificado un aumento en la tasa de diabetes tipo 2 o alteración de la tolerancia a la glucosa en niños tratados con GH, aunque se ha constatado la existencia de insulinemia en ayunas elevada así como un 60% de reducción en la sensibilidad a la insulina, ambos fenómenos reversibles al finalizar el tratamiento5–7.
La experiencia a largo plazo en estos pacientes es aún limitada, pero hasta la fecha, los consensos elaborados por las sociedades internacionales de Endocrinología Pediátrica concluyen que la terapia con GH es segura y eficaz1.
Objetivos- 1.
Analizar la eficacia (aproximación a los valores de talla estándar para cada edad) y seguridad (maduración ósea, TA, metabolismo de los hidratos de carbono y lípidos) del tratamiento con GH durante 3 años, en niños PEG tratados en el Servicio de Endocrinología del Hospital Infantil Universitario Niño Jesús de Madrid entre 2003 y 2011.
- 2.
Investigar la influencia de distintas variables consideradas al nacimiento y antes de iniciar el tratamiento en la ganancia de talla; en particular, el efecto de la edad de inicio del tratamiento.
Los pacientes incluidos cumplían los criterios requeridos por el Comité Asesor para la GH del Ministerio de Sanidad, Servicios Sociales e Igualdad para niños PEG:
- 1.
Longitud y/o peso al nacimiento por debajo de −2DE para su edad gestacional y respecto a su población de referencia.
- 2.
No haber alcanzado a los 4 años de vida recuperación de crecimiento.
- 3.
En el momento del inicio del tratamiento, encontrarse la talla por debajo de −2,5DE y de −1 DE ajustada a la talla parental media.
Se estudiaron retrospectivamente los siguientes parámetros:
Clínicos y auxológicos- -
Al nacimiento: edad gestacional, peso, longitud, tallas de los progenitores y talla genética.
- -
Antes de iniciar el tratamiento con GH y en cada revisión anual: edad cronológica (EC), edad ósea (EO), relación EO/EC, peso, talla, IMC, estadio puberal, velocidad de crecimiento (VC) según EC, y TA. Se determinaron la dosis de GH (mg/kg/día), la predicción de talla y los efectos secundarios.
Antes de iniciar el tratamiento, y cada año una vez en terapia, se analizaron en ayunas: hemograma, ionograma con perfil hepático y renal, colesterol total, lipoproteínas y triglicéridos (NCEP-ATP III)8, función tiroidea, IGF-I (factor de crecimiento semejante a la insulina I) e IGFBP-3 (proteína transportadora de factores de crecimiento 3). También se determinaron la glucemia, la insulina y la hemoglobina glucosilada (HbA1c). Para las alteraciones del metabolismo de la glucosa se utilizaron los criterios de la American Diabetes Association de 20119, calculándose, asimismo, el índice HOMA10.
Análisis estadísticoPara describir las características basales de la muestra, así como las medidas de eficacia y seguridad del tratamiento en cada momento del seguimiento, se calculó la media y la DE (variables continuas) y la distribución de frecuencias (variables categóricas). El análisis de la evolución de las medidas de eficacia y seguridad a lo largo de los 3 puntos del seguimiento se realizó mediante análisis de medidas repetidas con las pruebas no paramétricas de Wilcoxon y Friedman. La asociación entre las características basales y el grado de respuesta al tratamiento se valoró mediante el test de correlación de Spearman o la prueba U de Mann-Whitney (para estudiar el efecto de la edad categorizada en ≥5 años y<5 años). Se consideraron estadísticamente significativos valores de p<0,05. Para realizar el análisis estadístico se utilizó el paquete estadístico SPSS® 15.0.
ResultadosCaracterísticas basalesLa muestra está compuesta por 52 sujetos: 29 niñas (55,8%) y 23 niños (44,2%).
- -
Al nacimiento: la media de edad gestacional fue 36,8±3,25 semanas con unos datos auxológicos medios de 41,9±4,56cm de longitud (rango: −3,47±2,07DE) y 1,97±0,61kg de peso (−2,45±0,78DE). La media para la talla genética fue 163,4±9,11cm (−0,73±0,86DE).
- -
Al inicio del tratamiento: la EC media fue 5,90±2,29 años y la talla media -3,12±0,62DE. En la tabla 1 se observa que los datos auxológicos y de TA basales están en promedio y, a excepción de la talla, dentro de los rangos normales para su edad. Los niveles de IGF-I medios se situaron entre −0,93±1,24DE, y el resto de parámetros analíticos pretratamiento, en promedio, también se hallaban dentro de los límites de la normalidad.
Tabla 1.Parámetros auxológicos al inicio del tratamiento
Media Desviación estándar Mínimo Máximo Percentil 25 Mediana Percentil 75 Edad cronológica (años) 5,90 2,29 4,00 12,2 4,25 4,83 6,50 Edad ósea (años) 4,38 2,39 2,00 12,0 3,00 3,50 5,12 Edad ósea/edad cronológica 0,72 0,15 0,48 1,10 0,59 0,71 0,83 Peso (kg) 15,5 6,10 9,50 35,8 11,4 13,4 18,5 Peso (DE) −1,95 0,92 −3,59 0,92 −2,50 −2,03 −1,53 IMC (kg/m2) 15,1 2,42 11,8 23,8 13,4 14,8 16,1 IMC (DE) −0,80 1,29 −2,98 2,45 −1,77 −0,99 −0,05 Talla (cm) 99,5 12,5 85,9 131,6 90,9 93,9 106,7 Talla (DE) −3,12 0,62 −4,70 −2,30 −3,56 −3,00 −2,63 Velocidad de crecimiento según EC (cm/año)a 5,59 1,57 3,10 10,0 4,33 5,40 6,40 Velocidad de crecimiento (DE)a −0,94 1,83 −3,90 4,70 −1,91 −1,22 −0,33 Tensión arterial sistólica (DE)b 0,47 0,89 −0,99 2,91 −0,13 0,40 0,71 Tensión arterial diastólica (DE)b −0,21 0,92 −1,50 3,66 −0,88 −0,41 0,31 Estadio de Tanner 1 0,0 1 1 1 1 1 Datos disponibles para 52 pacientes.
DE: desviación estándar; IMC: índice de masa corporal.
La mediana del tiempo de seguimiento fue de 2,5 años (existiendo información disponible a los 36 meses de tratamiento para 26 pacientes).
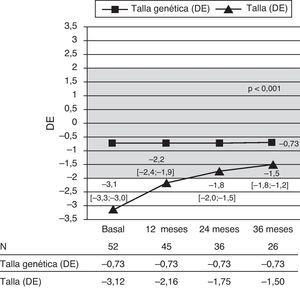
Evolución de los datos auxológicosLa talla presentó un incremento estable durante el seguimiento, que fue significativo tanto a los 12 como a los 36 meses (p<0,001). Se hizo evidente la aproximación paulatina de la talla (DE) de los pacientes a su talla genética (DE) (fig. 1). La ganancia de talla media completados los 36 meses de tratamiento fue de 1,68±0,61DE (mínimo y máximo: 0,50-3,20DE).
Se evidenció una correlación negativa estadísticamente significativa (p<0,05) entre la edad de inicio del tratamiento (tanto EC como EO) y la ganancia de talla, tanto a los 12 meses (correlación débil) como a los 24 (moderada), lo que indica que a menor edad de inicio de tratamiento, mayor ganancia de talla. A los 36 meses la correlación observada no fue estadísticamente significativa.
Por grupos de edad, se apreció que aquellos que iniciaron el tratamiento antes de los 5 años de EC presentaban una ganancia de talla de 9±1,95cm (IC 95%: 8,1-9,9cm), y los mayores de 5 años ganaban 7,69±2,16cm (IC 95%: 6,8-8,5cm) a los 12 meses, siendo esa diferencia significativa (p<0,05).
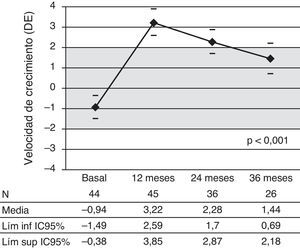
La VC aumentó de forma significativa a los 12 meses (periodo de máximo crecimiento) así como a los 36 (p<0,001) (fig. 2). Se encontró una correlación positiva moderada-fuerte entre la VC durante el primer año de tratamiento y la ganancia de talla en DE tanto a los 24 como a los 36 meses (p<0,001).
El peso presentó un incremento estable durante todo el seguimiento, que fue significativo a los 12 y a los 36 meses con medias respectivas de −1,43±0,74DE (IC 95%: −1,65≈−1,20) y −1,14±0,68DE (IC 95%: −1,41≈−0,86) (p<0,001). Existe correlación significativa entre la ganancia de peso y la ganancia de talla a los 12 meses (p<0,001). El IMC en DE no presentó cambio significativo al año ni a los 36 meses de tratamiento.
No se encontró una correlación significativa con la ganancia en talla (DE) en ninguno de los 3 momentos del seguimiento para las variables edad gestacional, peso y longitud (DE) al nacer o la talla de los padres.
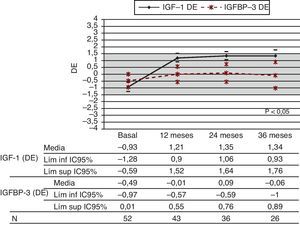
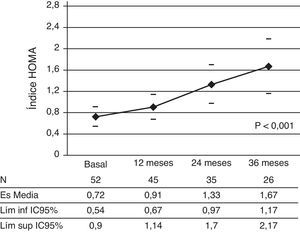
SeguridadLos niveles de IGF-I aumentaron de forma significativa a los 12 meses (periodo de mayor ascenso), e igualmente a los 36 meses (p<0,05), manteniéndose siempre niveles de seguridad medios por debajo de+1,5DE (fig. 3). Los niveles de IGFBP-3 aumentaron de forma significativa a los 12 meses y globalmente a los 36 meses (p<0,05).
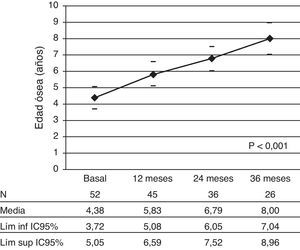
La EO sufrió un incremento significativo a los 12 y 36 meses (p<0,001) (fig. 4). El cociente EO/EC también se incrementó de forma significativa; la media a los 12 meses fue 0,81±0,13DE (IC 95%: 0,77-0,85) y a los 36 meses de 0,91±0,12DE (IC 95%: 0,86-0,96) (p<0,001), permaneciendo en todo momento el promedio inferior a 1.
La glucemia en ayunas presentó un incremento significativo desde los niveles basales hasta los 12 meses con valores medios de 91,0±6,57mg/dl (IC 95%: 88,9-93,0) y a los 36 meses de 92,1±7,69mg/dl (IC 95%: 89,0-95,2) (p<0,05). En todos los casos la glucemia en ayunas permaneció dentro del rango normal.
La HbA1c mostró diferencias significativas con respecto a la basal, siendo a los 12 meses 5,56±0,33% (IC 95%: 5,46-5,66) y a los 36 meses 5,48±0,50% (IC 95%: 5,28-5,68) (p<0,05), hallándose la media siempre dentro de valores normales.
Los niveles de insulina presentaron diferencias significativas con respecto a la basal, siendo a los 12 meses la media de 4,31±3,09μUI/ml (IC 95%: 3,34-5,27) (p<0,05) y a los 36 meses 7,27±5,24μUI/ml (IC 95%: 5,16-9,39) (p<0,001), permaneciendo en niveles dentro del rango de la normalidad. El índice HOMA aumentó de forma significativa desde los niveles basales hasta los 12 y 36 meses (p<0,001), permaneciendo sus valores dentro del rango normal (fig. 5).
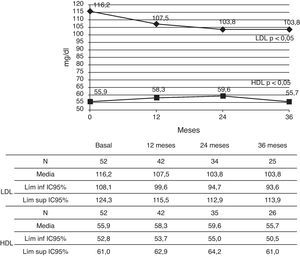
La TA sistólica y diastólica, el colesterol total y los triglicéridos no presentaron a lo largo del tratamiento cambios significativos (tabla 2). El c-LDL presentó un descenso evolutivo a los 12 y 36 meses (p<0,05). El c-HDL no mostró diferencias significativas a los 12 meses, pero sí a los 24 meses, con media de 59,8±13,3mg/dl (IC 95%: 53,8-65,8) (p<0,05) (tabla 2). Los cocientes colesterol total/c-HDL y c-LDL/c-HDL descendieron de forma significativa (p<0,05 y p<0,001, respectivamente) durante los 36 meses (fig. 6). La T4L media permaneció dentro del rango normal durante todo el estudio.
Perfil lipídico y tensional a lo largo del tratamiento
| Basal (N=52) | 12 meses (N=45) | 24 meses (N=36) | 36 meses (N=26) | Valor p (prueba de Friedman) | |
| Colesterol total (mg/dl) | 181,5±28 | 175,9±29 | 173,0±27 | 169,2±29 | 0,076 |
| Colesterol total/c-HDL | 3,4±0,9 | 3,1±0,7 | 3,0±0,6 | 3,1±0,6 | 0,014 |
| c-LDL/c-HDL | 2,2±0,8 | 2,0±0,7 | 1,8±0,5 | 1,9±0,6 | <0,001 |
| Triglicéridos (mg/dl) | 44,6±16 | 49,4±28 | 52,9±18 | 53,7±19 | 0,083 |
| TA sistólica (DE) | 0,47±0,89 | 0,51±0,87 | 0,33±0,90 | 0,05±0,92 | 0,113 |
| TA diastólica (DE) | −0,21±0,92 | −0,28±0,69 | −0,31±0,72 | −0,42±0,82 | 0,432 |
Los valores representan la media±desviación estándar.
c-HDL: colesterol ligado a lipoproteínas de alta densidad; c-LDL: colesterol ligado a lipoproteínas de baja densidad; DE: desviación estándar; TA: tensión arterial.
Ningún paciente presentó intolerancia o efectos adversos al tratamiento. Un paciente mostró a los 12 meses niveles de IGF-I de+4,2DE, reduciéndose entonces la dosis de GH por motivos de seguridad a 0,025mg/kg/día. Sus controles posteriores se mantuvieron dentro de límites normales.
DiscusiónSe presentan los resultados de un estudio retrospectivo, descriptivo, sobre los efectos a 36 meses de tratamiento con GH en niños PEG, sin crecimiento recuperador a los 4 años de EC. Numerosos estudios en los últimos 20 años han mostrado la efectividad en ganancia de crecimiento del tratamiento con GH en estos niños, incluso en aquellos con respuesta normal a los tests de estimulación con GH y en los que no se ha hallado la causa de la ausencia de crecimiento recuperador.
Este estudio confirma la ganancia de talla en aquellos niños PEG tras 3 años de tratamiento con GH, a dosis 0,033-0,045mg/kg/día. Esto concuerda con la evidencia publicada sobre estos pacientes1. Se halló correlación entre menor edad al inicio del tratamiento y mayor ganancia estatural; así mismo, estratificando por edades se demostró que aquellos pacientes que habían iniciado el tratamiento antes de los 5 años de edad presentaban una mayor ganancia de talla que aquellos que lo habían iniciado después de los 5 años. Esta evidencia es acorde a lo reflejado en otro estudio que señala un mayor beneficio en la talla incluso en los tratados entre los 2 y los 5 años de edad, con dosis de 0,06mg/kg/día11, aunque este posible beneficio debe verificarse en estudios a largo plazo.
La diferencia en ganancia de talla durante el tratamiento puede ser explicada por factores como la edad al inicio, la duración y la dosis de GH empleada. Parece claro que el crecimiento es mayor cuando el tratamiento tiene lugar al menos 2 años antes de la pubertad12. Algunos estudios advierten que cuando se inicia el tratamiento entre los 7 y los 8 años de edad la ganancia de talla adulta es de+2DE, mientras que solo es de+0,6DE si el tratamiento se inicia entre los 10 y los 12 años de edad13–16.
Buena parte de los pacientes incluidos habían sido recién nacidos prematuros, en los que se comprueba una mejoría significativa en ganancia de talla y peso con el tratamiento. Los pocos estudios disponibles sobre el tratamiento con GH en prematuros muestran una respuesta de crecimiento similar a la de los nacidos a término17.
El tratamiento con GH originó un incremento significativo de la VC, máximo en los 12 primeros meses de tratamiento, aproximándose así las estaturas de los pacientes a sus tallas diana. Ello coincide con lo publicado para otros pacientes tratados, incluyendo aquellos con deficiencia de GH18,19. Es de esperar un crecimiento de mantenimiento tras haber efectuado el correspondiente crecimiento recuperador tras un periodo de 1-3 años de tratamiento con GH, sin experimentar un incremento de talla tan pronunciado como el que se produjo durante el primer año de tratamiento.
Estos resultados indican una aceleración significativa, pero no patológica, en la EO a lo largo del estudio, manteniéndose una relación EO/EC media menor de 1. Ello concuerda con los resultados expuestos por otros autores11,13,20.
En este estudio se aprecia un aumento paulatino del peso partiendo de unos valores basales en el límite bajo de la normalidad. Mediante estudios con resonancia magnética para estimar la masa muscular y la grasa subcutánea se ha visto que ambos componentes en niños PEG eran inferiores a los de otros grupos de pacientes con talla baja21. Diversos estudios han descrito el efecto normalizador ponderal tras tratamiento con GH22.
Es conocida la respuesta dosis-dependiente de GH sobre el incremento en los niveles de IGF-I e IGFBP-313, y el que haya suscitado preocupación sobre los posibles efectos adversos de unas concentraciones elevadas de IGF-I de forma mantenida en el tiempo23,24. En este estudio, los niveles de IGF-I y los de IGFBP-3 aumentaron significativamente a lo largo del tratamiento, manteniéndose la media siempre inferior a+1,5DE para la EC. El mayor incremento se produjo en los primeros 12 meses de tratamiento. Asimismo, el resto de estudios constatan el referido aumento dosis-dependiente en las concentraciones séricas de IGF-I e IGFBP-3, siendo mayor el incremento de IGF-I y, consiguientemente, también se eleva la relación molar IGF-I/IGFBP-3. Se recomienda mantener niveles de IGF-I en rango normal sin superar aquel entre+1,5 y+2DE25, si bien no existe un consenso internacional a este respecto. Hoy sabemos que los pacientes PEG tratados con dosis de GH altas (0,066-0,1mg/kg/día) pueden producir niveles de IGF-I por encima del rango normal para la edad, y su seguridad a largo plazo precisa ser determinada23.
Esta aceleración del crecimiento se acompañó de un aumento progresivo, no patológico, de la insulina en ayunas, índice HOMA, glucosa y HbA1c tanto a los 12 como a los 36 meses de tratamiento. Otros estudios muestran también, y de forma predominante en el primer año de tratamiento, un incremento de la insulinemia en ayunas y de la glucosa-estimulada por la insulina, indicando cierta resistencia insulínica6,26. Igualmente, se ha publicado que tras 6 años de tratamiento no se produce mayor incremento de la glucemia en ayunas, no habiendo desarrollado ningún paciente diabetes mellitus, permaneciendo la HbA1c dentro de los límites de la normalidad durante todo el tratamiento6. Además, varios estudios demuestran que la glucemia e insulinemia se normalizan tras suspender el tratamiento5,27,26.
En esta cohorte, parámetros como la TA sistólica y diastólica, el colesterol total y los triglicéridos no presentaron cambios durante el tratamiento. El c-LDL descendió durante el seguimiento y el c-HDL aumentó, junto con el descenso en los cocientes colesterol total/c-HDL y c-LDL/c-HDL, implicando una mejoría en el perfil aterogénico. Este hecho es relevante dado el riesgo inherente de la población PEG per se de enfermedad cardiovascular y dislipidemia. Algunos estudios con poco tiempo de tratamiento muestran ligeros beneficios en el perfil lipídico26, si bien otros, con tratamientos más prolongados en el tiempo, muestran beneficio al descender además la TA y el colesterol total4,5, así como una conservación de la morfología del ventrículo izquierdo y su normofunción27. Estas últimas publicaciones refieren que este beneficio persiste durante y tras la discontinuación del tratamiento con GH28. Es posible que se precise un mayor tiempo de tratamiento con GH para obtener cambios significativos en el perfil lipídico y beneficios persistentes tras la discontinuación del mismo.
Aunque los datos de talla final de esta cohorte son necesarios, los resultados mostrados en este estudio sugieren que la terapia con GH a dosis 0,033-0,045mg/kg/día es eficaz y segura en niños PEG como agente promotor de crecimiento, como ha sido demostrado en otros estudios29–31.
En conclusión, los datos incluidos en este estudio demuestran que el tratamiento con GH favorece el crecimiento en los niños PEG (recuperación y mantenimiento), observándose su máximo efecto en los primeros 12 meses. El inicio del mismo antes de los 5 años de edad permite una mayor ganancia de talla en los primeros 12 meses de su administración.
En él se observa, asimismo, una cierta resistencia a la insulina, dentro del rango de la normalidad, y una mejoría de los cocientes de riesgo aterogénico. Estos hechos requieren una especial valoración durante la pubertad y al alcanzar la talla adulta.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.