Conocer la prevalencia de sobrepeso en pacientes pediátricos con fibrosis quística (FQ) y su importancia como factor de resistencia insulínica diabetogénica y riesgo de hipertrigliceridemia.
Material y métodosCiento nueve pacientes con FQ (47% varones) de 5-18 años se calificaron por su índice de masa corporal (IMC): desnutridos, normales o con sobrepeso. Se determinaron colesterol, triglicéridos y proteína C reactiva (PCR), glucohemoglobina y los índices HOMA-IR y QUICKI y en la sobrecarga oral de glucosa (SOG) su índice insulinogénico e ISI composite y áreas bajo la curva (ABC) de glucosa e insulina.
ResultadosSeis pacientes (5,5%) tenían sobrepeso. Su edad, distribución sexual y base genética son similares al resto; aunque la proporción de suficientes pancreáticos (3/6; 50%) es superior (p=0,003). Los trastornos glucídicos no son más frecuentes que en el resto; pero la insulina basal, HOMA-IR, y la insulina durante la SOG (pico máximo y ABC) identifican su hiperinsulinismo, diferenciándolos de los otros dos grupos. Todos los pacientes muestran en la SOG respuesta insulínica tardía, sin diferencias en los índices derivados.
ConclusionesEntre los pacientes FQ con sobrepeso no hay mayor incidencia de trastornos glucídicos pero sí de hiperinsulinismo y resistencia insulínica, con el consiguiente riesgo añadido a la tendencia diabetogénica inherente a estos pacientes.
To determine the prevalence of overweight in paediatric patients with cystic fibrosis (CF) and to analyse its role as diabetogenic insulin resistance factor and risk of hypertriglyceridaemia.
Patients and methodsA total of 109 CF patients (47% males) between 5 and 18 years were divided into 3 groups according to body mass index (BMI): underweight, normal and overweight. Total cholesterol, triglycerides, C- reactive protein (CRP), glycosylated haemoglobin, HOMA-IR and QUICKI index were determined. Insulinogenic index, ISI composite and areas under the curve (AUC) for glucose and insulin were obtained by oral glucose tolerance test (OGTT).
ResultsSix patients (5.5%) were overweight. All groups had similar distribution by age, sex and CFTR mutation, although the proportion of pancreatic sufficient (3/6, 50%) was higher in overweight patients (P=.003). The prevalence of glycaemic disorders was similar between groups. Baseline insulin, HOMA-IR, and insulin during the OGTT (peak and AUC) were higher in overweight patients. All patients had a delayed insulin response in OGTT.
ConclusionsOverweight CF patients do not have a higher incidence of glycaemic disorders, but their hyperinsulinism and insulin resistance may be additional diabetogenic risk factors.
Los avances en el diagnóstico precoz y el tratamiento integral de la FQ han propiciado un incremento en la supervivencia de estos pacientes, desde los 10 años de promedio en la década de los setenta hasta los 35-40 años de la actualidad1. Uno de los factores que contribuyen a este fenómeno ha sido la mejoría nutricional, gracias a la intervención intensiva con dietas hipercalóricas, suplementos nutricionales, eventualmente nutrición enteral, y la adecuada sustitución con enzimas pancreáticos para evitar la esteatorrea.
Por otra parte, el sedentarismo creciente de la sociedad actual, del cual no están exentos los pacientes FQ, junto con los suplementos nutricionales y la mejor evolución propiciada por el tratamiento médico preventivo, hacen temer una tendencia a la ganancia excesiva de peso de parte de ellos2. El índice de masa corporal (IMC) de los pacientes FQ con sobrepeso-obesidad, a diferencia de la población general, se correlaciona positivamente con la función pulmonar3. Es necesario estudiar la consecuencia del exceso nutricional sobre el otro factor determinante del pronóstico de estos enfermos: la diabetes mellitus debida a la FQ (DRFQ).
Nos propusimos conocer la prevalencia de sobrepeso en una muestra amplia de pacientes FQ infanto-juveniles y analizar la relación de esta condición con el equilibrio glucídico y la resistencia insulínica y con la hipertrigliceridemia que puede afectarles.
Material y métodosEn un estudio multicéntrico descriptivo y transversal, desde 2007 a 2010, se reclutó de forma retrospectiva, en cinco hospitales universitarios nacionales, un grupo de 109 pacientes con FQ, con edades entre 5 y 18 años. Se aceptaron únicamente aquellos que hubiesen permanecido libres de agudización respiratoria y tratamiento glucocorticoide oral, al menos desde la anterior revisión periódica (cuatro o más meses).
Cada paciente se identificó con un código asignado al hospital y al caso, registrándose su fecha de nacimiento, sexo, edad de debut de la enfermedad, forma clínica y estudio genético del gen CFTR.
Los investigadores obtuvieron directamente de cada paciente, descalzo y en ropa interior, el peso y la talla matutinos mediante instrumentos con exactitud de 50 g y 0,5cm respectivamente, calculando el IMC. Todos los datos somatométricos fueron tipificados (puntuación Z) según las referencias de la Fundación Orbegozo4.
El estado nutricional de cada paciente se clasificó (subnutrido, normal o con sobrepeso), según los criterios consensuados por las sociedades norteamericana y europea de FQ5,6, utilizando los puntos de corte de Cole et al para definir el sobrepeso. Así, se consideran desnutridos los pacientes con IMC inferior al percentil 10 para su edad y sexo, y con sobrepeso o en riesgo de obesidad aquellos con IMC superior al punto de corte equivalente a un IMC de 25 a los 18 años de edad (International Obesity Task Force)7, que en nuestra población es muy próximo al percentil 80.
La función pancreática se estudió midiendo la elastasa-1(E-1) fecal, considerando insuficientes pancreáticos a aquellos con concentración menor de 200μg/g8.
La presión arterial casual se midió en el brazo derecho, tras 5 min de sedestación, mediante manómeno digital, calificándola según las referencias de la Task Force for Blood Pressure in Children9.
El equilibrio glucídico se evaluó mediante la glucohemoglobina sanguínea (HbA1c) determinada cromatográficamente y una prueba de sobrecarga oral con glucosa, de 120 min (extracciones cada 30 min), aplicando las especificaciones y criterios de la American Diabetes Association10. Para conocer la sensibilidad/resistencia insulínica, se calcularon los índices Quantitative Insulin Sensitivity Check Index (QUICKI)11(11), Homeostasis Model Assesment (HOMA-IR)12 y el ISI composite13. También se calcularon el índice insulinogénico14 y las áreas bajo la curva mediante método trapezoidal15.
En la extracción sanguínea basal, mediante métodos automatizados, se determinaron el colesterol total, los triglicéridos, la aspartato aminotransferasa (AST), la alanina aminotransferasa (ALT) y la proteína C reactiva (PCR).
Análisis estadístico de los resultadosLos datos recogidos se explotaron mediante la aplicación informática SPSS versión 15.0. Se aplicaron técnicas descriptivas básicas, expresando los resultados como media±desviación estándar. La comparación de proporciones se basó en la prueba de la χ2 de Pearson. Para la comparación de medias se aplicó la ANOVA de un factor y pruebas post hoc de Bonferroni. Se consideran significativos los valores de p<0,05.
ResultadosSe reunió un grupo de 109 pacientes con FQ de entre 5 y 18 años de edad (12,65±3,21), el 47% de ellos, varones. La tabla 1 muestra sus datos descriptivos.
Datos epidemiológicos y antropométricos de los 109 pacientes
| Ítem | Valor |
| Sexo | 53% F; 47% M |
| Edad (media±DE [rango]) | 12,65±3,21 (5,2 a 17,8) años |
| Edad al diagnóstico (media±DE [rango]) | 1,05±1,72 (0-9) años |
| Mutación CFRT | |
| Homocigoto delta F | 45 (41%) |
| Heterocigoto delta F | 51 (47%) |
| Otras mutaciones | 13 (12%) |
| Suficientes pancreáticos | 15% |
| Metabolismo glucídico | |
| Normal | 58 (53%) |
| Anormal | 51 (47%) |
| DRFQ | 7 (6,4%) |
| Otros | 43 (39%) |
| Somatometría | |
| Peso±DE | –0,62±0,78 (–2,36 a 1,42) |
| Talla±DE | –0,20±1,18 (–2,46 a 3,05) |
| IMC±DE | –0,32±0,84 (–2,23 a 2,02) |
DRFQ: diabetes relacionada con fibrosis quística.
Once pacientes (10%) estaban desnutridos, la nutrición de 92 (84,5%) era normal y 6 pacientes (5,5%) presentaban sobrepeso.
Este grupo con sobrepeso, con representación sexual paritaria, que incluye 4 portadores de la mutación delta F508 (2 homocigotos), tenía en ese momento entre 12 y 17 años (media de 14,5±1,98); todo ello en semejante proporción a los otros dos grupos. Sin embargo, la proporción de enfermos con suficiencia exocrina pancreática (3 de los 6; 50%) es superior al resto (p=0,003).
La tabla 2 muestra datos de cada uno de los grupos nutricionales y la comparación de los del grupo con sobrepeso respecto a los otros dos. No hay diferencias en la cuantificación enzimática, lipídica, de la PCR ni en la presión arterial. Todos los pacientes con sobrepeso tenían tensión arterial inferior al percentil 95.
Valores de resistencia insulínica y otros factores de riesgo cardiovascular clasificados según el estado nutricional, expresados como media±DE, y comparados entre grupos mediante ANOVA
| Ítem | Grupo con sobrepeso | Otros grupos nutricionales | Valor | p |
| PAS (mmHg) | 112±5 | Normonutridos | 107±11 | NS |
| Desnutridos | 98±18 | NS | ||
| PAD (mmHg) | 57±7 | Normonutridos | 57±10 | NS |
| Desnutridos | 59±12 | NS | ||
| Colesterol (mg/dl) | 139±38 | Normonutridos | 130±27 | NS |
| Desnutridos | 129±35 | NS | ||
| Triglicéridos (mg/dl) | 69±33 | Normonutridos | 78±33 | NS |
| Desnutridos | 72±43 | NS | ||
| ALT (U/ml) | 29±18 | Normonutridos | 30±13 | NS |
| Desnutridos | 29±15 | NS | ||
| AST (U/ml) | 25±7 | Normonutridos | 28±8 | NS |
| Desnutridos | 31±14 | NS | ||
| PCR (mg/dl) | 0,62±0,55 | Normonutridos | 0,69±0,96 | NS |
| Desnutridos | 1,22±1,33 | NS | ||
| HbA1C (%) | 5,7±0,8 | Normonutridos | 5,6±1,1 | NS |
| Desnutridos | 5,5±1,1 | Ns | ||
| Glucemia basal (mg/dl) | 91±11 | Normonutridos | 91±13 | NS |
| Desnutridos | 85±15 | NS | ||
| Glucemia 120min (mg/dl) | 111±19 | Normonutridos | 128±48 | NS |
| Desnutridos | 161±70 | NS | ||
| Insulinemia basal (mU/ml) | 17±15 | Normonutridos | 6,7±5 | 0,000 |
| Desnutridos | 6,7±4 | 0,003 | ||
| Insulinemia 120min (mU/ml) | 82±62 | Normonutridos | 42±34 | 0,028 |
| Desnutridos | 40±23 | NS (0,06) | ||
| Índice HOMA-IR | 3,7±2,7 | Normonutridos | 1,5±1,2 | 0,000 |
| Desnutridos | 1,6±1,2 | 0,022 | ||
| Índice QUICKI | 0,33±0,03 | Normonutridos | 0,38±0,04 | 0,006 |
| Desnutridos | 0,33±0,05 | NS | ||
| ABC glucemia (mg/dl/120min) | 19.735±2.694 | Normonutridos | 20.420±4.243 | NS |
| Desnutridos | 28.155±8.756 | 0,006 | ||
| ABC insulinemia | 8.769±7.036 | Normonutridos | 4.466 ±3.042 | 0,012 |
| (mU/ml/120min) | Desnutridos | 3.937±2.734 | 0,05 | |
| Glucemia, pico (mg/dl) | 170±44 | Normonutridos | 181±46 | NS |
| Desnutridos | 185±66 | NS | ||
| Pico insulinemia (mU/ml) | 110±81 | Normonutridos | 61±40 | 0,030 |
| Desnutridos | 36±16 | 0,007 | ||
| Pico insulinemia (min) | 75±37 | Normonutridos | 89±27 | NS |
| Desnutridos | 100±25 | NS | ||
| Índice insulinogénico | 12,7±13,1 | Normonutridos | 8,2±8,5 | NS |
| Desnutridos | 7,9±12,1 | NS | ||
| Índice ISI de Matsuda | 3,65±1,42 | Normonutridos | 8,55±4,83 | NS |
| Desnutridos | 9,21±9,61 | NS |
ABC: área bajo la curva; NS: diferencia no significativa; PAD: presión arterial diastólica; PAS: presión arterial sistólica; PCR: proteína C reactiva.
Tampoco hay diferencias en HbA1c, en la glucemia basal ni durante la sobrecarga oral con glucosa (área bajo la curva, glucemia máxima ni el tiempo en que esta se alcanza). Solo un paciente con sobrepeso tiene alteración del metabolismo glucídico (alteración de la glucemia basal), según los criterios de la ADA10. Es una proporción (1/6=17%) menor, aunque no significativa (χ2=0,175) que la registrada en los normonutridos (43/92=47%) y que los subnutridos (8/11=73%).
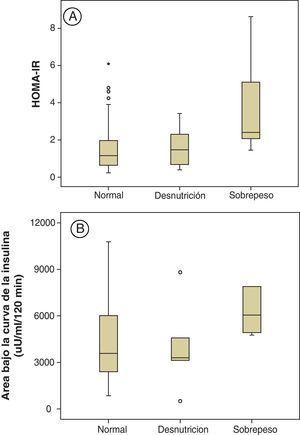
La insulina basal y el HOMA-IR, así como la respuesta dinámica de la insulina (pico máximo y área bajo la curva) identifican un hiperinsulinismo en este grupo, que resulta diferencial con los otros dos (fig. 1A y B).
DiscusiónLa obesidad y el sobrepeso infantiles se han convertido en una auténtica epidemia que, en los países desarrollados. ha duplicado su prevalencia en los últimos 20 años. En España tiene sobrepeso el 30% y obesidad el 10% de los niños entre 6 y 12 años de edad16. El fenómeno se relaciona causalmente con el aumento de la energía ingerida y la reducción de la actividad física. Esta tendencia en el estilo de vida no es exclusiva de la población sana, sino que afecta también a los pacientes con enfermedades crónicas.
Son escasos los datos sobre la verdadera prevalencia de este problema en los pacientes con FQ. Entre los británicos, el 10% de los pacientes infantiles y el 20% de los adultos tienen sobrepeso. La obesidad afecta al 1%2,3. Es apreciablemente más del 5,5% observado en este estudio, en el que son duplicados aún por los desnutridos, en un conjunto en el que se ha logrado que el 85% de los pacientes estén bien nutridos.
Los pacientes FQ tienen reducida su secreción insulínica, independientemente de su equilibrio glucídico17. Este hecho es patente en todos nuestros pacientes, comprobándose el retraso del pico de insulinemia que, debiendo aparecer hacia los 60 min, lo hace a los 75 o después. El índice insulinogénico de Wareham14, que explora la secreción precoz de insulina en la sobrecarga oral, es también similar en todos los grupos. Por tanto, no hay retraso secretorio específico de los pacientes con sobrepeso.
A esta base patogénica de la DRFQ se suma la resistencia insulínica, que en esta enfermedad puede tener diversas causas (frecuentemente asociadas), encabezadas por la inflamación aguda y crónica17, que también valoramos.
En nuestra serie, que únicamente recoge pacientes infanto-juveniles en situación estable, los que tienen sobrepeso no se diferencian en edad, sexo ni en la base genética de su proceso, de los otros grupos. La hipertrigliceridemia, más frecuente en adultos, aunque también esporádicamente en edades juveniles18,19, no es relevante en ninguno de nuestros grupos de estudio. Sí hay mayor proporción de individuos con suficiencia pancreática, sin esteatorrea (50%), por lo que, aunque el grupo es pequeño, es una información considerable, dada la aparente congruencia patogénica.
El estudio del metabolismo glucídico se ha planteado comparando al grupo con sobrepeso frente a los normonutridos y los desnutridos por separado, dada la reconocida labilidad metabólica al respecto de estos últimos10. Nuestros datos lo corroboran.
Como grupo, los pacientes con sobrepeso son indiferenciables de los otros dos en todas las mediciones glucémicas (basal, valor a los 120 min y área bajo la curva). Sin embargo, las determinaciones de insulina indican evidentemente su hiperinsulinismo (en insulinemia basal y en el pico máximo y área bajo la curva en la sobrecarga). Estas diferencias son también identificadas por el índice HOMA-IR, que puede resultar muy útil para la vigilancia clínica de esta complicación.
Finalmente, no hay diferencias en la calificación obtenida por el índice ISI, probablemente por el escaso número del grupo de sobrepeso.
Parece llamativa la escasa presencia de alteración glucídica en los pacientes con sobrepeso. Sin embargo, no debe entenderse que su situación sea inocua: sus índices de hiperinsulinismo y resistencia insulínica son manifiestamente adversos, por lo que de mantenerse su situación nutricional, tendrán repercusión glucémica próximamente.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.