En nuestro hospital asistimos a un incremento inesperado en la incidencia de enterocolitis necrosante (ECN). Por si nuestra política de alimentación estaba influyendo, se realizó e implementó una guía de práctica clínica (GPC) de alimentación enteral del recién nacido de muy bajo peso al nacimiento (RNMBP).
ObjetivoValorar el impacto del nuevo régimen de alimentación en la incidencia de ECN.
MétodoEstudio antes (2011) y después (mayo del 2012-abril del 2013) de la introducción del nuevo protocolo de alimentación, que incluye: inicio de la alimentación enteral en ausencia de problema hemodinámico; periodo de nutrición trófica de 5-7 días, incrementos posteriores de 20-30ml/kg/día; leche materna/banco desde el inicio. No se utilizaron probióticos. La variable principal a estudio fue la incidencia de ECN ≥ II de Bell. Variables secundarias: perforación focal, mortalidad global y atribuida a ECN, sepsis nosocomial; peso a los 28 días y 36 semanas; % de RN con peso<p10 al alta; estancia hospitalaria.
ResultadosDoscientos setenta RNMBP, 155 antes y 115 después. La ECN descendió significativamente (12/155 vs. 1/115, p=0,008); la mortalidad se redujo (17,4% vs. 7,8%, p=0,02); en 4 casos la ECN formó parte de la secuencia que condujo a la muerte en la primera cohorte; ninguno en la segunda. No hubo diferencias en la incidencia de perforación intestinal focal ni en las otras variables secundarias analizadas.
ConclusionesLa protocolización del régimen de alimentación enteral con la máxima evidencia disponible produce un descenso en incidencia de ECN sin incrementar la estancia hospitalaria o la incidencia de sepsis.
An unexpected increase in the incidence of necrotising enterocolitis (NEC) cases was observed in our hospital. Just in case, our feeding policy could be responsible, it was decided to conduct a systematic review and develop a clinical guideline regarding enteral nutrition of very low birth weight infants (VLBW).
ObjectiveTo assess the impact of the new feeding protocol in the incidence of NEC.
MethodA “before” (2011) and “after” (May 2012 - April 2013) study was performed on the new feeding protocol. This included initiation of enteral feeding in the absence of haemodynamic problems, a trophic feeding period of 5-7 days, and subsequent increments of 20-30ml/kg/day, of breast milk/donor human milk from the beginning. Probiotics were not administered. Primary outcome: incidence of NEC II 2 Bell's stage. Secondary outcomes: focal intestinal perforation, overall mortality and mortality due to NEC, nosocomial sepsis; weight at 28 days and 36 weeks; % of infants with weight
ResultsOf the 270 VLBW infants, 155 were included in the “before” group, and 115 in the “after” group. NEC significantly decreased (12/155 vs 1/115, P=.008). A decrease in mortality rate was also observed (17.4% vs 7.8%, P=.02). In four cases NEC was part of the sequence of events that led to death in the first cohort, with none in the second. There was no difference in the incidence of focal intestinal perforation or of the other secondary variables analysed.
ConclusionsImplementation of an evidence-based enteral feeding protocol leads to a decrease in incidence of NEC, without increasing hospital stay or the incidence of sepsis.
El recién nacido prematuro nace durante un periodo crítico de su crecimiento. La nutrición constituye un pilar básico de su tratamiento pero se ve dificultada por la inmadurez de los sistemas metabólico y digestivo, y por las patologías intercurrentes que presentan. El resultado es que en muchos casos ocurre un retraso en el crecimiento extrauterino que con frecuencia agrava un retraso intrauterino previo1. La tendencia actual intenta reducir la restricción del crecimiento extrauterino mediante una nutrición parenteral agresiva y precoz (con nutrientes cercanos a los que recibiría el feto a través de la placenta) y una alimentación enteral lo más temprana posible2,3.
Pero esto no es fácil. A menudo el neonatólogo se mueve en la duda de mantener más tiempo una nutrición parenteral que asegure los aportes nutricionales pero que aumenta el riesgo de sepsis asociada a catéter o de acelerar el paso a una alimentación enteral que podría asociar un mayor riesgo de enterocolitis necrosante (ECN).
La literatura muestra una gran variabilidad en las tasas de ECN entre centros, como la hay en el modo en que se inicia y se continúa la alimentación enteral. Esta variabilidad está descrita entre países, entre hospitales e incluso entre profesionales del mismo centro, y se explica por el amplio grado de incertidumbre que rodea a muchos de estos procedimientos4,5.
En nuestro hospital asistimos en los años 2010 y 2011 a un incremento inesperado en la incidencia de ECN. Por si nuestra política de alimentación estaba influyendo, decidimos realizar una guía de práctica clínica sobre alimentación enteral del RNMBP. Con ello introdujimos una serie de cambios que se concretaron en un nuevo protocolo de alimentación en la unidad. El objetivo de este estudio es valorar el impacto que su implantación ha supuesto en la incidencia de ECN de nuestro centro.
MétodosDiseñoEstudio cuasiexperimental, prospectivo, de intervención con medida antes/después. La intervención está constituida por el conjunto de medidas descritas en el protocolo de alimentación del RNMBP en nuestra unidad que se resume en la tabla 1; consideramos de alto riesgo de ECN no solo a los de peso más bajo, sino también las situaciones de asfixia y el diagnóstico por parte del obstetra de una restricción del crecimiento intrauterino con alteración en el Doppler en arteria umbilical y/o cerebral media fetal (con independencia de que tras el nacimiento el percentil de peso fuera inferior al P10). El protocolo se presentó en la unidad en abril del 2012, si bien en los meses previos se habían introducido algunos de los puntos en él referidos, motivo por el que se evitaron estos meses en el estudio. Durante el periodo analizado previo, no había un protocolo escrito sobre el modo de administrar la alimentación enteral.
Protocolo de alimentación enteral en la cohorte «después»
| Cuándo empezar | Hemodinámicamente bien (sin fármacos vasoactivos y buena perfusión últimas 24 h). Sin asfixia Si inestable, mantener dieta absoluta | ||
| Método | Continua Bolusa durante periodo de trófica y en caso de IPPVn | ||
| Tipo leche recomendada | Calostro; leche de banco (si no hay, valorar demorar inicio) | ||
| Periodo de trófica | Alto riesgo ECN 0,3ml/kg/h×3 d 0,5ml/kg/h×3 d 1ml/kg/h×1 d | 750-1.000g 0,5ml/kg/h×3 d 1ml/kg/h×3 d | 1.000-1.500g 1ml/kg/h×5 d |
| Incrementos posteriores | 10ml/kg cada 12h en<1.000 (20ml/kg/día) 15ml/kg cada 12h en>1.000 (30ml/kg/día) | ||
| Volumen máximo | 160ml/kg/día | ||
| Duración trófica | 5-7 días | ||
| Definición intolerancia | Árbol decisión. Residuo + examen clínico | ||
| Fortificante | Desde 100ml/kg (100ml: 1g %; 120ml: 2g %; 140ml: 3g %; 160ml: 4g %). Individualizar por BUN | ||
| Estreñimiento | Enema suero fisiológico si no deposiciones en 24h | ||
BUN: nitrógeno ureico en sangre; ECN: enterocolitis necrotizante; IPPVn: ventilación con presión positiva intermitente nasal.
Alto riesgo ECN incluye 3 situaciones:<750g y/o<25 s; asfixia; diagnóstico obstétrico de CIR+Doppler patológico.
Hubo además 2 cambios en torno al manejo del paciente con ductus hemodinámicamente significativo. Así, en el primer periodo era frecuente asociar omeprazol al tratamiento con ibuprofeno, y mantener la alimentación enteral en función de la tolerancia digestiva; en cambio, en el segundo periodo se suspendía la alimentación y se dejó de asociar omeprazol. No hubo otros cambios relevantes en la práctica asistencial entre los 2 periodos.
El fortificante utilizado fue Enfamil Fortifier® durante ambos periodos. Se añadía en el momento en que la madre traía su leche, se separaba en biberones con la cantidad a administrar en cada toma y se almacenaba refrigerada hasta su uso. Se iniciaba al alcanzar los 100ml/kg/día a una concentración de 1g % y se incrementaba cada día en 1 g hasta alcanzar los 4g/100ml.
Grupos de estudioGrupo I (antes): nacidos en el año 2011.
Grupo II (después): nacidos desde el 1 de mayo del 2012 hasta el 30 de abril del 2013.
Población de estudioSe incluyó a todos los recién nacidos de menos de 1.500g atendidos en nuestra unidad, incluyendo también a los nacidos en otro centro y que fueron trasladados durante su primera semana de vida. Se excluyó a aquellos que habían sido derivados exclusivamente para alguna prueba diagnóstica o terapéutica y devuelto a su centro de origen tras la misma.
Variables de estudioVariable principal: tasa de ECN (grado ii de Bell o superior).
Variables secundarias: perforación focal, mortalidad global y atribuida a ECN (cuando la ECN formó parte de la secuencia de acontecimientos que condujo a la muerte), sepsis nosocomial, peso a los 28 días y a las 36 semanas de edad corregida, % de RN con un peso<p10 en el momento del alta hospitalaria, días de estancia (excluyendo los fallecimientos y los trasladados).
Las distintas variables atienden a la misma definición que en la red SEN 15006. Además, para la variable principal del estudio, la ECN, y para diagnosticados como perforación focal se realizó una revisión por pares de todos los casos tanto de la historia clínica como de las imágenes radiológicas.
Análisis de resultadosPara las variables cuantitativas se comprobó primero la normalidad de la distribución mediante el test de Kolmogorov-Smirnov. Según los resultados se recurrió a una prueba paramétrica (t de Student) si la variable seguía una distribución normal, o no paramétrica (U de Mann-Whitney) en caso contrario.
Para definir la estancia hospitalaria se utilizaron la mediana y el rango intercuartil para evitar la influencia de los valores extremos.
Para las variables cualitativas, se realizó una comparación de porcentajes para muestras independientes mediante chi al cuadrado. Cuando la proporción de un resultado fue inferior al 5% se utilizó el test de Fisher. Se consideró significativo un error alfa inferior a 0,05.
El análisis se realizó mediante el programa estadístico EPIDAT (versión 4.1).
ResultadosEl número absoluto de casos en la primera cohorte fue mayor que en la segunda (155 vs. 115). En la tabla 2 se resumen las principales características basales de los 2 grupos. No se encontraron diferencias en ninguna de las variables analizadas.
Datos demográficos perinatales y características neonatales de los niños incluidos en el estudio
| Antes (n=155) | Después (n=115) | Significación | |
|---|---|---|---|
| Edad gestac., días | 204 (19,47) | 206 (19) | N.S. |
| (en sem.+días) | (29+1) | (29 +3) | |
| Peso al nacer, g | 1.097 (287) | 1.148 (273) | N.S. |
| PEG | 59 (37%) | 44 (38%) | N.S. |
| Varón | 79 (51%) | 57 (49,6%) | N.S. |
| Cesárea | 125 (80%) | 89 (77,3%) | N.S. |
| Parto múltiple | 48 (31%) | 32 (28%) | N.S. |
| Gemelos | 32 | 29 | N.S. |
| Trillizos | 16 | 3 | N.S. |
| Corticoides prenatales | |||
| Completo | 100 (64,5%) | 84 (73%) | N.S. |
| Parcial | 33 (21,3%) | 17 (14,8%) | N.S. |
| No esteroides | 18 (11,6%) | 10 (8,7%) | N.S. |
| No consta | 4 (2,6%) | 4 (3,5%) | N.S. |
| Apgar 5min | |||
| < 4 | 1 (0,6%) | 1 (0,8%) | N.S. |
| 4-6 | 20 (12,9%) | 11 (9,6%) | N.S. |
| > 6 | 134 (86,5%) | 103 (89,6%) | N.S. |
| CRIB | 2,98 (3,44), n=152 | 2,56 (3), n=100 | N.S. |
| Malformaciones mayores | 7 (4,5%) | 4 (3,5%) | N.S. |
| Hipotensión en 1.asem. | 39 (24,4%) | 20 (17,4%) | N.S. |
| Corticoides 1.asem. | 2 (1,2%) | 0 (0%) | N.S. |
| Antibiótico prenatal | 59 (36,9%) | 48 (41,7%) | N.S. |
N.S.: no significativo.
Las variables cualitativas se expresan con el valor absoluto y el porcentaje (entre paréntesis). Las variables cuantitativas se expresan mediante la media±desviación estándar (entre paréntesis).
En la tabla 3 se muestran los resultados para las variables clínicas a estudio. Se encontró una menor incidencia de ECN ≥ II (0,9 vs. 7,7% %) y una menor mortalidad en la segunda cohorte (7,8 vs 17,4%), pero no en la tasa de perforación focal o de sepsis nosocomial. Si bien la tasa de ductus fue similar en ambos periodos, el uso de ibuprofeno muestra una tendencia a ser utilizado con más frecuencia en el primero y el cierre quirúrgico ocurrió significativamente con más frecuencia.
Principales variables clínicas a estudio, n (%)
| «Antes», n=155 | «Después», n=117 | Significación | |
|---|---|---|---|
| PDA | 68 (42,5%) | 41 (35,6%) | N.S. |
| Ibuprofeno | 59 (38%) | 32 (27,8%) | N.S. |
| Cierre qco. | 15 (9,7%) | 4 (3,5%) | p = 0,04 |
| Perforación focal | 3 (1,8%) | 3 (2,6%) | N.S. |
| ECN ≥ II | 12 (7,7%) | 1 (0,9%) | p=0,008 |
| ECN con cirugía | 7 | 1 | N.S. |
| Mortalidad | 27 (17,4%) | 9 (7,8%) | p=0,02 |
| Muerte atribuible a ECN | 4 | 0 | N.S. |
| Sepsis nosocomiala | 64 (41,3%) | 45 (39,1%) | N.S. |
| Staf. coagulasa neg. | 50 (31,9%) | 41 (35,7%) | N.S. |
| Otras bacterias | 18 (11,2%) | 13 (11,3%) | N.S. |
| Hongos | 3 (1,9) | 0 (0%) | N.S. |
| Gramnegativos | 17 (10,6%) | 7 (6,1%) | N.S. |
ECN: enterocolitis necrotizante; N.S.: no significativo; PDA: persistencia de ductus arterioso hemodinámicamente significativo (confirmado por ecocardiografía en base a la ratio AI/Ao, tamaño ductal y «robo ductal» en la aorta descendente).
Con el objeto de comparar la incidencia de cada tipo de sepsis entre las 2 cohortes, se muestra el porcentaje de cada uno referido al tamaño muestral de la cohorte. Un paciente puede presentar sepsis por más de un tipo de germen, motivo por el que la sumatoria de cada tipo supera el número de niños con sepsis nosocomial.
La tabla 4 resume algunos aspectos referidos al peso y la necesidad de nutrición parenteral a los 28 días y a las 36 semanas de edad corregida, así como a la estancia hospitalaria. Debido a las altas que ocurren antes de los 28 días y de la semana 36 (por fallecimiento, por traslado o por ser dados de alta antes de esa edad corregida), el tamaño muestral para las distintas variables es inferior. Ninguno de los trasladados o dados de alta lo hicieron con nutrición parenteral. No hubo diferencia significativa en la ganancia ponderal valorada a los 28 días o a las 36 semanas, ni tampoco en la estancia hospitalaria.
Peso y nutrición parenteral a los 28 días y a las 36 semanas de edad corregida; estancia hospitalaria
| «Antes», n=155 | «Después», n=115 | Significación | |
|---|---|---|---|
| 28 días de vida | n=110a | n=92a | |
| Peso, g (media ± DS) | 1.449 (328,8) | 1.527,7 (345,5) | N.S. |
| N. parenteral | 15/110 (13,6%) | 14/92 (15,2%) | N.S. |
| Aumento peso diario | 12,1g | 12,8 | N.S. |
| 36 sem. edad corr. | n=84a | n=78a | |
| Peso, g (media ± DS) | 1.730 (276,3) | 1.796,9 (297,8) | N.S. |
| Peso a las 36 semanas<P10 | 76/84 (90%) | 68/78 (87%) | N.S. |
| Estancia hospitalaria | n=112a | n=105a | |
| Mediana e intervalo intercuartil | 44 días (35-66) | 48 días (32-61) | N.S. |
N.S.: no significativo.
El único caso de ECN en el grupo «después» ocurrió poco tiempo después de presentarse el protocolo y no siguió las pautas del mismo; corresponde a un prematuro de 32 semanas y 1.430g con CIR y Doppler patológico pero que al nacer presentaba un estado general muy bueno, inició enteral desde las primeras horas para evitar canalizarle una vía y lo hizo con fórmula por no disponer de leche de banco en ese momento; la clínica de ECN comenzó a los 4 días.
En la tabla 5 se describen las características más relevantes de los casos de ECN de la primera cohorte. La ECN en este primer periodo ocurrió más en los niños de menor peso, pero también en otros, mayores, que mostraban CIR. Se había iniciado la alimentación pronto, generalmente con fórmula artificial, en ocasiones mientras recibía tratamiento inotrópico y se pasó con frecuencia a incrementar los aportes de leche sin apenas periodo de alimentación trófica. El ductus estuvo presente en un porcentaje alto, pero similar al esperable por la edad gestacional de los pacientes y se usó ibuprofeno y omeprazol en muchos de ellos. En ningún caso se administró hidrocortisona ni otro esteroide posnatal. Pocos casos habían recibido antibioterapia prenatal y sí, la mayoría, posnatal.
Características más relevantes de los casos de ECN de la primera cohorte
| Pesob | 6/12<750g 4/12 750-999g 2/12 1.000-1.500 | |
| Estratificación de riesgo según criterios del nuevo protocolo | 8/12 alto riesgo 3/12 riesgo medio 1/12 bajo riesgo | De los de alto riesgo, 6 lo eran por<750g y 2 por CIR (uno con Doppler pat.; otro un gemelar; peso 940 y 1.320g) |
| Inestabilidad hemodinámica al iniciar alimentación enteral | 2/12 | Dos casos habían iniciado alimentación enteral mientras aún recibían tto. inotrópico |
| Diagnóstico obstétrico de CIR | 2/12 | Ambos con Doppler patológico en arteria umbilical |
| Inicio de la enteral con fórmula artificial | 10/12 | |
| Ductus arterioso hemodinámicamente significativo | 8/12 | Siete de ellos recibieron ibuprofeno |
| Omeprazol | 7/11a | Cinco de ellos lo recibieron al tratar el ductus arterioso |
| Esteroides postnatales (p. ej., hidrocortisona) | 0/12 | |
| Día inicio alimentación enteral | Mediana: día 2 | En 5 casos en día 1 En 4 casos en día 2 En 2 casos en día 3 y uno en día 6 |
| Días que se mantuvo alimentación trófica (aportes<24ml/kg/día) | Mediana: 1 díaa | En 2 casos 0 días En 6 casos 1 día En 2 casos 2 días Un caso 3 días |
| Antibioterapia preparto | 3/11a | Los 3 casos por corioamnionitis |
| Antibióticos 1.a semana | 10/12 | |
| Edad al inicio de la ECN Mediana (rango) | 9 (3-30) |
La introducción del nuevo protocolo de alimentación, basado en las mejores prácticas que encontramos en la literatura, se ha acompañado de un descenso muy importante en la incidencia de ECN en nuestro hospital, así como del porcentaje de niños que requieren cirugía por este motivo. Paralelamente, hemos encontrado una reducción en la mortalidad, incluso superior al que podríamos atribuir directamente al descenso de ECN, y para el cual no encontramos una explicación clara. A pesar de que la introducción de la alimentación es más lenta, no hubo aumento en la incidencia de infección nosocomial, ni una peor ganancia ponderal o una estancia más prolongada.
El descenso en la tasa de ECN en relación con una modificación en la práctica alimentaria, no es un fenómeno nuevo; en un metaanálisis de estudios antes-después se señalaba un descenso global en la incidencia de ECN del 87%7. Varios estudios posteriores han publicado descensos clínicamente muy relevantes8-10.
Es difícil discernir cuál o cuáles de las modificaciones que todos estos trabajos incluyen son las que provocan la reducción de la ECN y el peso que tendrían de forma aislada cada uno de ellos. Los protocolos de alimentación que se utilizaron no son totalmente coincidentes, pero sí lo son en destacar una introducción prudente de la alimentación enteral, tanto más en los niños de mayor riesgo de ECN, y en el uso preferente de la leche materna.
Los cambios introducidos respecto a nuestra práctica previa fueron varios y se basaron en la revisión que habíamos realizado para la elaboración de una guía de práctica clínica sobre alimentación enteral del prematuro11. Es importante señalar que en las 2 series que hemos comparado no se había introducido el uso de probióticos en ningún caso, por lo que el efecto beneficioso del protocolo solo puede achacarse al modo en que se realizó la alimentación y al tipo de leche utilizada. Una actualización posterior de la guía de práctica clínica sí incluye ya el uso de probióticos pero su uso se inició después de las 2 series que se incluyeron en este trabajo. En ella se pueden consultar los criterios utilizados para la búsqueda bibliográfica y los resultados (evidencias y grados de recomendación)12,13.
Inicio de la alimentaciónEl comienzo precoz de la alimentación enteral parece ser beneficioso14. En cambio, el momento en que se inicia no parece tener un efecto en la tasa de ECN, al menos cuando se hace en prematuros hemodinámicamente estables. En nuestro protocolo, generalmente la alimentación se inició en el primer o segundo día, pero no se hacía si el paciente se mostraba hemodinámicamente inestable. A este respecto hay que señalar que en casi todos los ensayos que compararon el ayuno con el inicio de alimentación incluso si era trófica, específicamente se excluía a los neonatos hemodinámicamente inestables, por lo que se desconoce si es o no seguro. Es probable que en la cohorte anterior al protocolo hubiera niños en los que se inició alimentación trófica cuando aún estaban hemodinámicamente inestables, práctica que actualmente consideramos incorrecta. Consideramos que en esta situación se produce una redistribución vascular con vasoconstricción a nivel cutáneo (que observamos como mala perfusión periférica) pero también en otros territorios, como el intestinal (que favorecería la ECN).
Periodo de alimentación tróficaLa administración de cantidades pequeñas de leche (≤ 20-24ml/kg), sin incrementarlas o haciéndolo por debajo de ese límite durante 5-7 días, es tan segura como mantener al prematuro en ayunas durante ese tiempo, y acorta el tiempo hasta alcanzar la enteral completa15. En cambio, los incrementos diarios desde el inicio o una rapidez excesiva en estos podrían favorecer la aparición de ECN16,17. En el periodo anterior al protocolo realizábamos incrementos desde el comienzo, o poco tiempo después, en función de la tolerancia digestiva, con objeto de retirar pronto la parenteral y reducir el riesgo de sepsis asociada a catéter. Por el contrario, en el segundo periodo las cantidades tróficas se mantenían como tales por un periodo entre 5 y 7 días. Los estudios antes/después referidos coinciden en mantener un periodo de alimentación trófica, variable pero prolongado, antes de comenzar los incrementos9,10.
Periodo de incrementosTras un periodo de trófica, incrementos de 30-35ml/kg/día no aumentan el riesgo de ECN respecto a volúmenes de 20ml/kg/día18 y acortan el tiempo en alcanzar enteral completa. Nosotros en el periodo anterior usábamos incrementos de 20ml/kg/día, mientras que en el segundo periodo manteníamos esos 20ml en los menores de 1.000g, pero subíamos a 30ml/kg/día en los mayores de ese peso, sin que ello incrementara la incidencia de ECN. Otra diferencia es que en el segundo periodo los incrementos los realizábamos en 2 momentos del día, obligándonos a reevaluar la tolerancia digestiva antes de realizarlos. Es posible que esta forma de hacerlo nos permitiera detectar problemas de una forma más precoz que lo que lo hacíamos antes.
Ausencia de deposicionesEl estreñimiento ha sido señalado como un posible factor de riesgo de ECN debido a que favorecería el sobrecrecimiento bacteriano en las asas intestinales paréticas. Pietz et al. publicaron una amplia serie de casos con una tasa de ECN muy baja (0,8%) e incidían en la importancia que daban a este punto; ellos utilizan glicerina si no hay deposiciones en 24 h8. En nuestro hospital usamos enemas con suero fisiológico; el único cambio a este respecto ha sido que en el segundo periodo se prescribía sistemáticamente su aplicación si no había deposiciones en 24 h, mientras que previamente su uso era más discrecional.
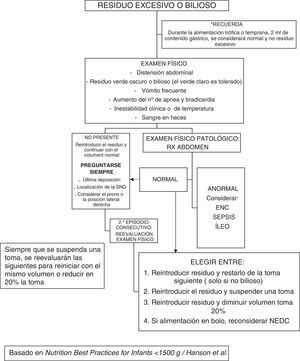
Intolerancia digestivaLa medición del residuo gástrico se ha propuesto como método para monitorizar la tolerancia de la alimentación, pero su uso sistemático es motivo de controversia19. Esta práctica era solo ocasional en el primer periodo del estudio; en el segundo, se proponía como método de valoración durante el periodo de trófica o de incrementos, pero su utilización en la práctica quedó a discreción de su médico. En general, no se realizaba medición del volumen de residuo si el abdomen no mostraba distensión alguna. El árbol de decisión (anexo 1) estaba basado en el publicado por Hanson et al. en 201120. Es posible que la sospecha de una ECN cuando aún no presenta neumatosis pueda evitar su progresión a fases más avanzadas, si detenemos la alimentación y asociamos antibioterapia, tal y como se propone en el estadio i de Bell.
Tipo de lecheSiguiendo trabajos publicados previamente21-23, en este protocolo se potenció el uso de leche materna desde el inicio de la alimentación. Se intentó utilizar calostro materno, y si no era posible, leche de banco. En el periodo previo se solía prescribir «leche materna o fórmula de prematuros»; esto conducía con mucha frecuencia a iniciar la alimentación con fórmula, con lo que la colonización inicial del intestino probablemente no era la más adecuada. La disponibilidad de leche de banco permitió iniciarla con calostro fresco o con leche de banco en casi todos los casos. Creemos que el beneficio de la leche materna es mucho mayor si se utiliza desde el principio; de hecho, en nuestro hospital, durante los años anteriores, la tasa de uso de leche de su propia madre medida en el momento del alta había venido aumentando, hasta alcanzar un 74% en 2011 (44,5% de forma exclusiva), sin que esa mejora hubiera llevado aparejado reducción alguna en la tasa de ECN.
ProtocolizaciónUn estudio reciente sobre prácticas de alimentación enteral del prematuro mostraba una gran variabilidad entre países, entre hospitales y entre neonatólogos de un mismo hospital4. Es probable que este hecho explique en parte la gran variación que existe también en la tasa de ECN entre centros7. Es posible que la reducción de la variabilidad dentro de cada centro, ocasionada por el ejercicio mismo de la protocolización, tenga un impacto en sí mismo8,9,24.
OmeprazolDurante el periodo anterior, era práctica habitual la asociación de omeprazol como protector gástrico desde el inicio del tratamiento con ibuprofeno. La ranitidina ya había sido descartada anteriormente por asociar un incremento en la incidencia de sepsis y muerte entre los RNMBP25. Dado que no encontramos ningún beneficio con esta práctica y que aparecieron trabajos que planteaban riesgos similares con el uso del omeprazol, decidimos restringir su uso a situaciones de sangrado digestivo activo, retirándolo pronto cuando el sangrado cediera.
FortificanteLa adición de fortificantes ha demostrado mejorar el crecimiento a corto plazo de los prematuros alimentados con leche materna. No se ha asociado a un aumento de la incidencia de ECN26. Durante los 2 periodos analizados, el fortificante se administró de un modo similar, por lo que descartamos que pueda haber influido en los resultados.
LimitacionesLos criterios de diagnóstico de ECN y de perforación focal fueron los mismos en todo el periodo del estudio y los casos se recogían de forma prospectiva de cara al envío de datos para SEN-1500. Podría ocurrir que la definición de los casos de ECN en el segundo periodo hubiera sido más exigente que en el primero y que algunos de los casos de perforación focal hubieran sido diagnosticados de ECN en el periodo inicial; para evitar este posible sesgo se han revisado retrospectivamente los diagnósticos de ECN y de perforación focal, reevaluando los estudios de imagen y la anatomía patológica en caso de cirugía; solo se han incluido los casos confirmados. El descenso de las formas con presencia de neumatosis en la radiografía (grado II de Bell) y, paralelamente, de las formas que precisaron cirugía, confirma el descenso real de la enfermedad.
ConclusionesLas prácticas sobre la forma de alimentar por vía enteral a un prematuro tienen consecuencias sobre el riesgo de ECN.
La implementación de un protocolo de alimentación enteral del RNMBP y/o<32 semanas, basado en la mejor evidencia disponible, y que detalle el modo en que debe administrarse la alimentación, reduce la incidencia de ECN, sin aumentar la incidencia de sepsis nosocomial ni la estancia hospitalaria.
FinanciaciónEste trabajo no dispone de ninguna fuente de financiación.
Conflicto de interesesEste trabajo no tiene conflictos de intereses que declarar.
La realización de este trabajo no habría sido posible sin la estrecha colaboración del Banco de Leche del Hospital Virgen de las Nieves de Granada y, sobre todo de nuestras madres donantes, a las que estamos profundamente agradecidos.
- -
Medir antes de cualquier toma (1 o 2 v/día, especialmente en periodo de trófica y de incrementos y en niños con tolerancia dudosa). Se define residuo excesivo, aquel ≥ 50% de la toma previa (o del volumen de las 3 h previas si NEDC)*
- -
Si residuo de aspecto normal y volumen ≤ 50%, se reintroducirá y se administrará la toma completa