Cada año un gran número de niños viajan en avión y se desplazan a lugares con altitud significativa. La mayoría de estos viajes se producen sin incidentes reseñables. Debido a los numerosos cambios socioeconómicos recientes, también ha aumentado la cantidad de pacientes con patología cardiopulmonar previa que realizan este tipo de desplazamientos. Los cambios ambientales en estos entornos, en especial la hipoxia, puede conllevar un riesgo de sucesos adversos importantes. El pediatra debe de conocer las patologías susceptibles de complicaciones en altitud, así como los estudios previos necesarios y las recomendaciones de prevención y tratamiento de las complicaciones en estas circunstancias. El Grupo de Trabajo de Técnicas de la Sociedad Española de Neumología Pediátrica se propuso la elaboración de un documento que revisara la literatura publicada sobre el tema, estableciendo unas recomendaciones de utilidad en el manejo de estos pacientes.
Every year a large number of children travel by plane and/or to places with high altitudes. Most of these journeys occur without incident. Immigration and recent socioeconomic changes have also increased the number of patients with cardiopulmonary disease who travel. Environmental changes in these places, especially lower oxygen, can lead to a risk of significant adverse events. The paediatrician must be aware of the diseases that are susceptible to complications, as well as the necessary preliminary studies and recommendations for treatment in these circumstances. The Techniques Group of the Spanish Society of Paediatric Chest Diseases undertook to design a document reviewing the literature on the subject, providing some useful recommendations in the management of these patients.
Durante los últimos 20 años se ha incrementado la exposición de niños sanos y con patología pulmonar a entornos de altitud donde la presión parcial de oxígeno (PaO2) es menor de lo normal. El transporte aéreo ha crecido una media del 4,8% anualmente. Cada año vuelan aproximadamente más de 4.000 millones de pasajeros de todas las edades en todo el mundo y en España en el año 2008 se produjeron 203 millones de desplazamientos por avión. La previsión actual es que el tráfico aéreo crezca durante los próximos 20 años una media de un 5% anualmente.
Aunque desconocemos la proporción de niños que utilizan el transporte aéreo en nuestro país, se estima que aproximadamente 4,6 millones de niños menores de 2 años vuelan cada año en Estados Unidos1. En las últimas décadas hemos asistido a fenómenos sociales que han hecho aumentar el número de niños que viajan en avión desde una edad de pocos días de vida hasta la adolescencia. Factores como el aumento en la población inmigrante y emigrante, mayor movilidad de los trabajadores, cambios en la estructura familiar tradicional y disminución de los precios de los billetes aéreos contribuyen a este incremento de desplazamientos.
Por otra parte, España es uno de los países más montañosos del mundo y aunque las alturas no son excesivas, tanto en nuestro país como en muchos otros destinos con altitud significativa pueden presentarse los cuadros de mal de montaña como la enfermedad aguda de la montaña (EAM), el edema pulmonar de alta montaña (EPA) y el edema cerebral de alta montaña (ECM). La posibilidad de hipoxemia aumenta con la altura y con la presencia de enfermedades de base que la favorezcan2. La incidencia de estos trastornos está parcialmente estudiada en individuos sanos, pero existe muy poca información sobre pacientes con afectación pulmonar preexistente y aun menos en niños. Otros aspectos relacionados con el tiempo de ocio, la popularización de deportes relacionados con la montaña y la mejoría socioeconómica generalizada también se pueden relacionar con el aumento en los viajes terrestres a zonas de altitud. Además, los medios de comunicación como el avión, el tren o las carreteras de alta montaña acercan estas zonas a personas no aclimatadas en poco tiempo de viaje.
Por todo ello, es razonable asumir que en el futuro habrá una mayor cantidad de niños, algunos de ellos con enfermedades respiratorias crónicas que se expongan a viajes de dichas características.
Aunque la mayor parte de estos desplazamientos son seguros, los pediatras debemos de ser conscientes de los riesgos fisiológicos y ambientales potenciales que implican, con el objetivo de aconsejar correctamente a los pacientes y sus familiares. Los métodos de evaluación y los criterios de recomendación de oxígeno varían ampliamente3, por lo que sería aconsejable la elaboración de unas guías que ayuden a normalizar estas prácticas.
Con este fin, el Grupo de Trabajo de Técnicas de la Sociedad Española de Neumología Pediátrica acordó la elaboración de unas recomendaciones para el manejo de los pacientes con enfermedad respiratoria que prevean un viaje en avión comercial o en altitud. Los objetivos de este documento son proporcionar información sobre los riesgos del viaje en avión o a grandes alturas en los niños, determinar las enfermedades preexistentes que pueden complicarse y recomendar medidas preventivas que puedan minimizar los riesgos potenciales durante el viaje. Las recomendaciones actuales se derivan de una revisión de la literatura, aunque se encuentran limitadas por la falta de estudios que aporten una evidencia suficiente para la realización de unas guías formales.
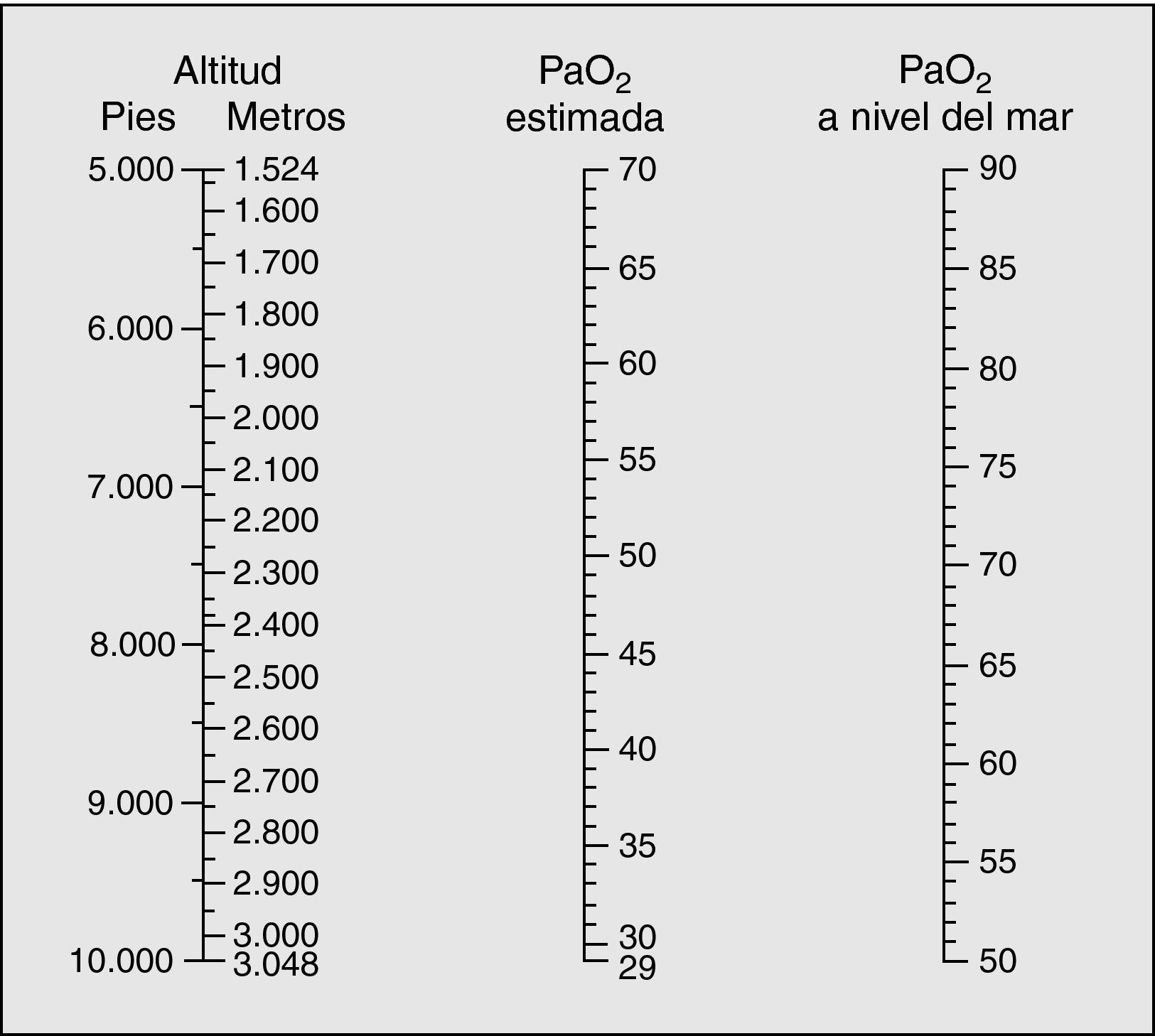
Cambios del ambiente en aviones comerciales y en altitudLos cambios ambientales que se derivan de la altitud son: disminución de la humedad, incremento en la irradiación solar, cambios en la PaO2, la temperatura y la presión atmosférica. De todos estos efectos, la caída en la PaO2 es lo que se asocia potencialmente con unas consecuencias más graves. A nivel del mar, la presión barométrica es de 760 mmHg con una PaO2 de 149 mmHg, lo que representa una fracción de oxígeno inspirado en aire (FiO2) del 21%. Como la presión parcial de un gas está en función de su concentración y de la presión total, la presión de oxígeno cae de forma exponencial al ascender. La mayoría de los aviones comerciales vuelan a una altitud de crucero de 10.000-13.000 m. Respirar aire a esta altura sería equivalente a respirar a nivel del mar una mezcla hipóxica con un 4% de oxígeno, algo incompatible con la vida. Para compensar este hecho, los aviones deben de ser presurizados tomando el aire ambiente y comprimiéndolo. Este proceso implica un aumento en los costes estructurales y energéticos del avión, por lo que aunque sería posible mantener una presión equivalente a la del nivel del mar, la legislación internacional establece unos límites más moderados, determinando que la presión mínima en cabina no debería ser inferior a la presión equivalente a una altitud de 2.438 m (8.000 pies).
Por otra parte, existen diferencias en las presiones de cabina de diferentes tipos de aviones a similar altitud. En un estudio que midió la presión de cabina de 204 vuelos comerciales regulares con 16 tipos de aeronaves en 28 líneas aéreas, se comprobó que las condiciones se correspondían con una altitud entre 1.800-2.400 m, con una altitud media de 1.894 m. Los aviones más pequeños presentan presiones menores a una altitud equivalente y la presión de cabina no es constante durante el vuelo, sino que presenta una relación fija entre aumento en la altitud de crucero y disminución en la presión de la cabina4.
A la máxima altitud permitida en cabina (2.438 m) le corresponde una presión atmosférica de 565 mmHg, lo que supone una PaO2 de 108 mmHg. Esto es el equivalente a respirar un aire con una FiO2 del 15,1% a nivel del mar.
Además, el aire comprimido desde fuera del avión a gran altura es extremadamente seco, lo que hace disminuir la humedad dentro del avión a un 10-20%, provocando mayor sequedad de las secreciones en la vía aérea5.
Respuesta fisiológica normal durante el vuelo y en alturaExiste una relación entre la altitud y la PaO2 (fig. 1). En individuos adultos sanos respirar oxígeno al 15% implica una caída de la PaO2 de 98 a 55 mmHg, dependiendo de la edad y de la respuesta ventilatoria a la hipoxia, que presenta una considerable variabilidad individual. Esta disminución de la PaO2 estimula los quimiorreceptores carotídeos y causa un incremento en la ventilación por minuto, mediada fundamentalmente por el incremento en el volumen tidal más que por el aumento en la frecuencia respiratoria. También se presentan otras respuestas fisiológicas, como el aumento en la frecuencia cardiaca, el gasto cardiaco y en la perfusión pulmonar, acompañado de una vasoconstricción de la arteria y arteriolas pulmonares. Dicho fenómeno redistribuye el flujo sanguíneo pulmonar a las regiones apicales del pulmón que se encuentran pobremente perfundidas al nivel del mar, lo que puede reducir el desequilibrio de la ventilación/perfusión y ayudar a mantener la PaO2 en un nivel aceptable a esta altitud.
En niños mayores y adultos sanos estos efectos producen una pequeña caída en la saturación de oxígeno medida mediante pulsioximetría (SatO2) que no se considera clínicamente significativa. Existen varios estudios que incluyen a niños de 6 m a 14 años estudiados en vuelos con mediciones de la SatO2, en los que se observa una disminución en la SatO2 media desde el 97-98% (93-100%) al nivel del mar hasta el 93-94% (85-98%) después de hasta 7h de vuelo6,7. No se produjo ninguna aclimatación durante el vuelo, disminuyendo la SatO2 a medida que aumentaba la duración del viaje y reduciéndose un poco más cuando los niños dormían (93,4% versus 94,8%). Aunque esta disminución es bien tolerada en los individuos sanos, en los pacientes con trastornos respiratorios crónicos puede ocurrir una caída mucho más acusada de la SatO2.
Los recién nacidos y los niños menores de 1 año presentan unas características anatómicas y fisiológicas que implican una respuesta a la exposición a la altitud distinta de la de los adultos y que contribuyen a un mayor riesgo de hipoxia. Estas características son: presencia de hemoglobina fetal (lo que implica un desplazamiento de la curva de disociación de oxígeno hacia la izquierda), caja torácica con mayor complianza, aumento en la proporción de arteriolas musculares en el lecho vascular pulmonar, menor diámetro de la vía aérea y un menor número de alvéolos. Todo ello implica una tendencia a un desequilibrio en la ventilación-perfusión, a la vasoconstricción pulmonar y a la broncoconstricción ante la hipoxia8.
Se han realizado escasos estudios sobre los efectos de la hipoxia en vuelo en los recién nacidos sanos; destaca el de Parkins et al9. En dicho estudio se simuló el ambiente hipóxico de los vuelos, exponiendo a 34 lactantes sanos con una edad media de 3 meses (rango 1-6 meses) a un ambiente con FiO2 del 15% durante una media de 6,3h. La SatO2 media disminuyó del 97,6 al 92,8%, acompañándose de un aumento significativo en la frecuencia cardiaca. La respuesta individual fue impredecible, ya que la saturación de oxígeno basal no se correlacionó con el índice de caída en la SatO2. Por otra parte, el 62% de los lactantes presentó un patrón de respiración irregular, con un incremento de 3,5 veces de las apneas periódicas, y en algunos casos desaturaciones graves menores del 80%.
Los trabajos realizados en niños con patología pulmonar de origen neonatal son más escasos y presentan datos controvertidos. En un estudio retrospectivo de 20 niños menores de 5 años de dichas características expuestos a una prueba de simulación hipóxica con FiO2 del 15%, se observó que 8 de ellos presentaron una caída en la SatO2 < 90%10. Más recientemente, se ha realizado un estudio en un grupo de 46 recién nacidos ex prematuros, con una edad media corregida de 35,8 semanas. El 35% de ellos presentó una SatO2 < 85% durante el vuelo, requiriendo oxígeno suplementario11.
Por otra parte, en los primeros meses de vida puede aparecer una respuesta paradójica a la hipoxia con inhibición del centro respiratorio, lo que puede desencadenar hipoventilación y apnea en casos de hipoxia o infección. Esta respuesta desaparece normalmente después de las 6-8 semanas de vida, aunque puede persistir durante más tiempo en los recién nacidos pretérmino12. La mayor preocupación es saber si un periodo corto de hipoxia puede conllevar un mayor riesgo de muerte súbita o de episodios aparentemente letales (EAL) en el lactante. Aunque se han descrito algunos casos esporádicos de muerte súbita y de EAL después de viajes en avión13, los estudios controlados de casos y controles no han demostrado ninguna relación entre los vuelos y la muerte súbita del lactante14. Por ello, el viaje en avión se considera seguro normalmente para los niños sanos durante el primer año de vida. En cualquier caso, se debería tener precaución en los casos de ex prematuros y niños menores de 1 año de edad con infección respiratoria que tengan previsto un desplazamiento en avión.
El último efecto de consideración es el aumento en el volumen de los gases a medida que disminuye la presión durante el ascenso, según la ley de Boyle. Los gases corporales atrapados en el pulmón que no pueden comunicarse con el exterior pueden causar problemas graves15, lo que ha de tenerse en cuenta en caso de bullas pulmonares o cirugía reciente.
Los estudios sobre los cambios en la oxigenación, ventilación y función pulmonar durante el viaje con exposición a altitud son aún más escasos, por lo que se carece de datos consistentes sobre las respuestas reales de adaptación en la edad pediátrica16.
Las enfermedades con aumento del riesgo de problemas relacionados con la hipoxia se detallan en la tabla 1.
Enfermedades con aumento del riesgo de problemas relacionados con hipoxia
| Enfermedad pulmonar crónica del prematuro |
| Lactantes < 6m, principalmente ex prematuros de < 32 semanas de gestación, con infección respiratoria aguda de origen vírico |
| Fibrosis quística |
| Neumopatías intersticiales |
| Enfermedades restrictivas neuromusculares y cifoescoliosis |
| Pacientes con enfermedad pulmonar y anemia grave |
| Infecciones como tuberculosis o síndrome agudo respiratorio grave |
| Síndrome de apneas del sueño |
| Tromboembolismo venoso |
| Pacientes sometidos a cirugía torácica reciente |
| Cardiopatías con hipertensión pulmonar, arritmias no controladas y síndrome de Eisenmenger |
| Anemia falciforme |
| Otras comorbilidades preexistentes (enfermedades cerebrovasculares, insuficiencia cardiaca…) |
Existe un grupo de patologías agudas relacionadas con la altitud entre las que destacan las siguientes.
Enfermedad aguda de la montaña o mal de montañaLa EAM es un síndrome clínico que ocurre en personas sanas que ascienden rápidamente a la alta montaña. Dado que la aclimatación a la altitud toma tiempo, se cree que la rapidez del ascenso es el factor fundamental en el desarrollo de la EAM. Pero también la altitud conseguida es importante, ya que este síndrome es raro por debajo de los 2.500 m de altitud. Por otro lado, el tiempo de exposición también influye, ya que estar menos de 24h hace difícil que se presenten síntomas graves.
Aunque no hay mayor incidencia según sexo o estrés físico, los niños por encima de 2 años de edad tienen una especial susceptibilidad. A mayor altitud, la frecuencia aumenta incluso en lactantes. Recientemente se ha estudiado su prevalencia y evolución en niños y adolescentes tras un rápido ascenso17. El síntoma más común de la EAM es el dolor de cabeza, que ocurre en la mayoría de personas que la desarrollan. Otros síntomas incluyen insomnio, anorexia, nausea, vértigo, disnea excesiva durante el ejercicio o incluso en reposo, oliguria, cansancio, vómitos e incoordinación.
La cefalea es típicamente frontal y ocurre entre las pocas horas del ascenso a la altitud o al levantarse después de haber realizado un primer descanso, primera noche en altitud. Existen escalas de puntuación clínica y funcional para el diagnóstico como la del Lake Louis (tabla 2).
Puntuación Lake Louise para la enfermedad aguda de la montaña (EAM)
| Síntomas reportados* | |
| Cefalea | |
| 0 | No |
| 1 | Leve |
| 2 | Moderada |
| 3 | Grave-incapacitante |
| Gastrointestinales | |
| 0 | No |
| 1 | Poco apetito o náusea |
| 2 | Moderada náusea o vómito |
| 3 | Graves-incapacitantes |
| Fatiga y/o debilidad | |
| 0 | No |
| 1 | Leve |
| 2 | Moderada |
| 3 | Grave |
| Vértigo o mareo | |
| 0 | No |
| 1 | Leve |
| 2 | Moderado |
| 3 | Grave-incapacitante |
| Dificultad para dormir | |
| 0 | Como siempre |
| 1 | No como siempre |
| 2 | Despertares frecuentes |
| 3 | No duerme |
| Signos observados* | |
| Cambios estado mental | |
| 0 | No |
| 1 | Letargia o laxitud |
| 2 | Desorientado o confuso |
| 3 | Estupor |
| 4 | Coma |
| Ataxia | |
| 0 | No |
| 1 | Maniobras compensadoras |
| 2 | Pasos fuera de la línea |
| 3 | Caídas frecuentes |
| 4 | Imposibilidad estar de pie |
| Edema periférico | |
| 0 | No |
| 1 | En una localización |
| 2 | En 2 o más localizaciones |
| Puntuación funcional | |
| Cómo afecta la actividad | |
| 0 | No reducción |
| 1 | Leve |
| 2 | Moderada |
| 3 | Grave (está en cama) |
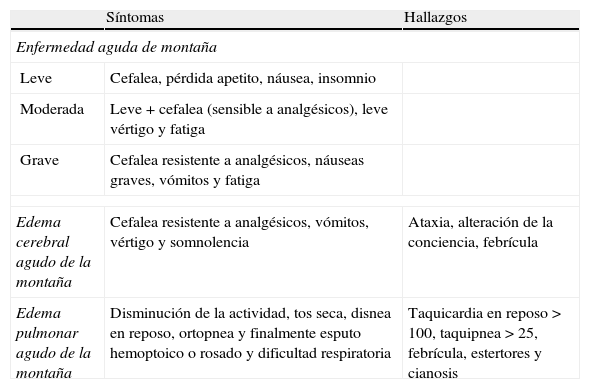
Complicaciones que pueden poner en peligro la vida son el edema pulmonar de la alta montaña y el edema cerebral de la alta montaña, probablemente extremos patofisiológicos de la EAM (tabla 3).
Enfermedades agudas relacionadas con la altitud
| Síntomas | Hallazgos | |
| Enfermedad aguda de montaña | ||
| Leve | Cefalea, pérdida apetito, náusea, insomnio | |
| Moderada | Leve+cefalea (sensible a analgésicos), leve vértigo y fatiga | |
| Grave | Cefalea resistente a analgésicos, náuseas graves, vómitos y fatiga | |
| Edema cerebral agudo de la montaña | Cefalea resistente a analgésicos, vómitos, vértigo y somnolencia | Ataxia, alteración de la conciencia, febrícula |
| Edema pulmonar agudo de la montaña | Disminución de la actividad, tos seca, disnea en reposo, ortopnea y finalmente esputo hemoptoico o rosado y dificultad respiratoria | Taquicardia en reposo > 100, taquipnea > 25, febrícula, estertores y cianosis |
Es una entidad clínica que suele aparecer durante los 3 primeros días del ascenso a altitudes importantes. La rapidez del ascenso se cree que contribuye a su desarrollo. Las personas afectas tienden a ser jóvenes preparados físicamente y sin enfermedad pulmonar ni cardiaca de base. Los hombres son más frecuentemente afectados y pueden presentarse síntomas de edema pulmonar sin otros síntomas de EAM.
La incidencia es superior en personas jóvenes y niños. Mientras que en este grupo la incidencia es del 6,5%, en mayores es de 0,45%, siendo raro en menores de 2 años.
Los síntomas clínicos iniciales son disnea al ejercicio, fatiga y debilidad. Posteriormente tos seca y cianosis periférica. La ortopnea y la dificultad para dormir se observan frecuentemente.
La disnea, taquipnea, taquicardia, producción de esputo rosado, cianosis central y ocasionalmente hemoptisis se observan en los casos graves. En los niños, son frecuentes los vómitos y la anorexia. La presencia de fiebre de más de 38,5°C es frecuente, por lo que puede ser confundido con una neumonía. Se pueden escuchar estertores inicialmente en el lóbulo medio, pudiéndose observar infiltrados bilaterales, de predominio derecho en la radiografía de tórax. El derrame pleural y la cardiomegalia son raros, mientras que un aumento de la vasculatura hiliar es frecuente. Los cambios radiológicos mejoran rápidamente tras el tratamiento.
El hemograma es normal o se observa una leve leucocitosis con desviación a la izquierda. En la gasometría arterial se detecta una hipoxia y una alcalosis respiratoria con un gradiente de oxígeno alvéolo/arterial más amplio.
El electrocardiograma evidencia una sobrecarga del ventrículo y aurícula derechos. Algunos estudios del lavado broncoalveolar presentan un aumento de hematíes y de leucocitos, así como de proteínas, lo que indica un aumento de la permeabilidad capilar como causa del EPA.
La hipoxia produciría una vasoconstricción que podría aumentar la presión capilar con un aumento de la permeabilidad, esto junto a la mala gestión de líquidos y a lesiones en el endotelio capilar vascular podría explicar el edema pulmonar.
Edema cerebral de alta montañaEs raro y generalmente afecta a menos del 2% de las personas en riesgo. Es una complicación grave de la EAM con disfunción cerebral. El edema cerebral es el hallazgo más reseñable.
Los síntomas se mezclan con las manifestaciones neurológicas del EAM, pero en el ECM la alteración de la conciencia, ataxia, papiledema y hemorragias retinianas son más significativos. Como en todo este síndrome hay una amplia variabilidad de intensidad de síntomas. Una vasodilatación cerebral con un aumento del flujo vascular secundario a la hipoxia con un aumento de la presión en la microvasculatura sería el responsable del edema cerebral observado.
Tratamiento de la enfermedad aguda de la montaña, el edema pulmonar de alta montaña y el edema cerebral de alta montañaEl aspecto más importante en el tratamiento de la EAM y sus complicaciones graves es el reconocimiento precoz de los síntomas en la persona que ha ascendido rápidamente a una altitud considerable.
El tratamiento definitivo es el descenso a una altitud menor. Mientras que un descenso mínimo es suficiente en pacientes con EAM o EPA, descensos más importantes son necesarios en el ECM. Aunque la administración de oxígeno es importante en el EPA, su utilidad en el ECM no está establecida.
Varias medicaciones se han utilizado en el tratamiento de la EAM pero pocas se han estudiado a doble ciego y controlado con placebo. Los tratamientos recomendados se expresan en la tabla 418.
Prevención y tratamiento de las enfermedades relacionadas con la altura
| Prevención | Tratamiento | |
| EAM | Ascenso gradual. Por encima de 2.500 m no subir más de 300-600 m/día | |
| Pasar una noche a mediana altitud | ||
| Evitar el ejercicio extremo | ||
| Acetazolamida 125 mg/día, iniciándose 24 h antes de la ascensión o dexametasona 2-4 mg/12 h | ||
| EAM leve | Parar el ascenso, minimizar el ejercicio, permanecer a la misma altura para aclimatarse | |
| Tratamiento con analgésicos y antieméticos si precisa | ||
| EAM moderada | Estar en la misma altura 24-48 h hasta conseguir la aclimatación o volver a más baja altitud. Azetazolamida 250 mg/12 h hasta que comience el descenso | |
| EAM grave | Descenso inmediato mínimo de 500 m. Si no es posible, administrar oxígeno 2-4 l por minuto en cánulas o mascarilla | |
| Si ambos no son posibles, iniciar tratamiento con dexametasona 8 mg/iv seguidos de 4mg orales cada 6 h, o acetazolamida o ambos hasta que los síntomas se resuelvan | ||
| Si se dispone de cámara hiperbárica portátil, se recomienda su empleo | ||
| ECM | Misma que EAM | Descenso inmediato o evacuación |
| Si no es posible: oxígeno 2-6 l por minuto, cámara hiperbárica y dexametasona. Valorar añadir azatazolamida si se retrasa el descenso | ||
| EPA | Misma que EAM y considerar tomar nifedipino 20-60 mg/día en fórmula retardada. Valorar terapia inhalada con corticoides y broncodilatadores de acción prolongada | Oxígeno para mantener SatO2 > 90%, o cámara hiperbárica, descenso lo antes posible. Dependiendo de la presión arterial, administrar nifedipino 10-20mg inicialmente y después 30-60 mg/día en fórmula retardada. Dexametasona para la EAM |
EAM: enfermedad aguda de montaña; ECM: edema cerebral agudo de la montaña; EPA: edema pulmonar agudo de la montaña.
La estrategia más eficaz para prevenir los trastornos relacionados con la altitud es un ascenso gradual que permita el tiempo suficiente para la aclimatación. Por encima de 2.500 m, se recomienda un ascenso diario máximo de 300-600 m, aunque no se base en una evidencia científica muy robusta. Se debe añadir un día extra por cada incremento de 600-1.200 m en esta altitud. Si hay signos de enfermedad de las alturas y una apropiada aclimatación no es posible por problemas logísticos, se puede usar tratamiento médico preventivo2,18.
Evaluación clínica previa al vuelo y métodos de predicción de la presión arterial de oxígenoLas guías de la British Thoracic Society (BTS) y la Canadian Paediatric Society19,20 establecen unos criterios para la evaluación y el manejo de los pacientes con riesgo antes de que realicen un vuelo. En ellas se destaca la importancia de una evaluación médica previa al viaje con realización de pruebas de función pulmonar y gasometría arterial y SatO2 basal, la estimación de la PaO2 durante el vuelo, y la valoración de la necesidad de oxígeno suplementario durante el viaje.
La SatO2 a nivel del mar no es un buen predictor de la PaO2 durante el vuelo, especialmente en menores de 1 año y ex prematuros, y así lo demuestran trabajos como el de Udomittinpong21. Partiendo de esa premisa se hace necesaria una prueba que permita reproducir las condiciones durante el vuelo. Lo más parecido a la realidad sería una cámara hipobárica que simulase la hipoxia hipobárica presente en los aviones; sin embargo, la poca disponibilidad de dichas cámaras hace este método muy poco asequible. En 1984 Gong22 describió el método denominado prueba de simulación hipóxica, que consiste en hacer respirar al paciente una mezcla de gases reproduciendo la hipoxia en altitud (FiO2 15%), pero a nivel del mar (presión normobárica). La correlación entre los resultados de esta prueba con los obtenidos en la cámara hipobárica es muy buena23. La sistemática y la interpretación de esta prueba han sido revisadas recientemente24.
La FiO2 del 15% se consigue con una mezcla de gases, aumentando la concentración de nitrógeno hasta disminuir la fracción de oxígeno inspirada a los niveles deseados. La administración puede realizarse principalmente de dos maneras, mediante mascarilla o mediante una cabina cerrada de pletismografía.
En el primer caso la mascarilla facial se puede conectar a una válvula de no retorno y una bolsa reservorio, respirando de cilindros presurizados con una mezcla de oxígeno al 15% y nitrógeno. También se puede conseguir dicha FiO2 respirando mediante una mascarilla tipo Venturi al 35%-40%, utilizando nitrógeno puro como gas conductor en lugar de oxígeno25. En el paciente pediátrico este sistema presenta dificultades, sobre todo en neonatos y lactantes, pues el sellado es especialmente importante para no contaminar la mezcla con aire ambiente, y la tolerancia de la mascarilla en estas edades es mala.
La otra posibilidad es el empleo de una cabina pletismográfica, en la que se aumenta la concentración de nitrógeno mediante un flujo controlado de este gas, midiendo la FiO2 interior con un oxímetro hasta conseguir el valor deseado (15%). Este método permite la realización de la prueba, con el niño sentado en la cabina directamente o en brazos de los padres, presentando mucha mejor tolerancia. La prueba debe interrumpirse a los 20min o si la SatO2 cae por debajo de 85%. En caso de hipoxia durante la misma, se podría titular la cantidad de O2 necesaria a administrar mediante cánulas nasales para mantener una SatO2 adecuada, y así ofrecer unas recomendaciones para el vuelo en caso precisar oxigenoterapia. El aumento en los niveles de CO2 no constituye un problema, ya que no supera normalmente el 0,5%10. La realización de una función pulmonar es de gran ayuda en cierto tipo de niños colaboradores. Estos valores son importantes en pacientes con restricciones de la caja torácica o afectos de fibrosis quística. En estos últimos pacientes, se ha observado que un volumen espiratorio forzado en el primer segundo (FEV1) < 50% predice saturaciones inferiores al 90% durante el vuelo mejor que la prueba de simulación hipóxica26.
En adultos se han desarrollado ecuaciones de predicción simples de la PaO2 en altura a partir de la PaO2 del paciente a nivel del mar, asociado o no al FEV127,28.
Sus principales limitaciones son la falta de validación en la edad pediátrica y la gran amplitud de sus límites de confianza (± 7,5 mmHg). Por otra parte, el tipo de pacientes en los que han sido realizadas es fundamentalmente individuos con enfermedad pulmonar obstructiva crónica, por lo que sus datos no son extrapolables a los enfermos pediátricos.
Recomendaciones durante el vuelo y en alta montañaUna vez explicadas las peculiaridades ambientales del vuelo y la alta montaña, debemos analizar la fisiopatología de cada problema del paciente que desea viajar, y ayudándonos de los métodos descritos anteriormente y otras pruebas complementarias dar unas recomendaciones concretas. Así, concretando por patologías:
AsmaEl paciente afectado de asma bronquial no presenta contraindicaciones para el vuelo pero debe realizarlo con la medicación necesaria a bordo. Se recomienda tener a mano el inhalador presurizado (MDI) con la cámara espaciadora adecuada o un dispositivo de polvo seco inhalado (DPI), y una dosis de corticoides orales, sobre todo en los vuelos largos. Los nebulizadores con batería pueden utilizarse a bordo previo aviso a la compañía, pero dada la similar eficacia respecto a los MDI o DPI, éstos son más recomendables.
En montaña, los pacientes con enfermedad leve intermitente o persistente pueden ascender a altitudes de hasta 5.000 metros. Habría que desaconsejar el viaje a pacientes con enfermedad más grave, especialmente en zonas particularmente remotas. Mantener el tratamiento de base y llevar los tratamientos de rescate necesarios para las exacerbaciones. Considerar utilizar algún tipo de mascarilla sobre la boca para calentar y humedecer el aire ambiental.
Fibrosis quísticaAlgunos trabajos realizados en estos pacientes han observado una desaturación significativa en condiciones de hipoxia29,30. A pesar de ello, también se ha comprobado una mejor tolerancia a la hipoxia tanto en exposiciones agudas31, como en permanencia en altitud32.
Aunque inicialmente se encontró que la espirometría y la SatO2 basal subestimaban el riesgo de hipoxia en comparación con la prueba de simulación hipóxica29; más recientemente se ha publicado un estudio de los mismos autores con resultados contrarios26, como se mencionó anteriormente.
Reagudizaciones recientes, o la necesidad de oxigenoterapia en los meses previos, son otros puntos que se deben tener en cuenta para realizar recomendaciones concretas, y en casos dudosos sería prudente realizar la prueba de simulación hipóxica. La indicación de oxigenoterapia debería basarse conjuntamente en dicha prueba, la función pulmonar y la situación clínica. Llevar en cabina los inhaladores con tratamiento broncodilatador y un informe médico con la medicación habitual y de rescate son otras recomendaciones prácticas.
En viajes a alta montaña valorar la necesidad de suplementos de O2 en todos los pacientes, y si la previsión es que la PaO2 sea < 50-55 mmHg, administrarlo durante la estancia. Si la predicción es de una PaO2 > de 50-55 mmHg, considerar suplementar oxígeno si el FEV1 es < 50% del predicho. Continuar con los tratamientos previos de fisioterapia, mucolíticos y antibióticos.
Malformaciones pulmonares quísticasEn caso de quiste intrapulmonar con comunicación con la vía aérea no existe riesgo; sin embargo, en caso de algunas malformaciones congénitas cerradas, el descenso de la presión puede aumentar el aire intralesional con riesgo de rotura y neumotórax o embolismo aéreo secundario33. Los casos descritos hasta la fecha son muy escasos, por lo que el riesgo teórico es muy bajo. La información que se debe dar a los padres de los pacientes estará de acuerdo a lo reseñado, insistiendo en que existe una posibilidad de complicaciones aunque ésta sea muy infrecuente.
NeumotóraxEn caso de neumotórax, las compañías aéreas recomiendan 6 semanas de espera antes de volar; sin embargo, son recomendaciones no basadas en la evidencia científica19. Aunque la presencia de un neumotórax activo es una contraindicación absoluta para el vuelo, actualmente se establece que es posible el transporte aéreo tras un mínimo de 1 semana después del drenaje y resolución de un neumotórax34. En caso de neumotórax traumático, cirugía torácica no complicada o derrame pleural, parece más conveniente esperar 2 semanas para cualquier viaje con exposición a altitud. Siempre es necesario obtener una radiografía de tórax previa al viaje que confirme la expansión pulmonar. Los pacientes estables con una fístula broncopleural persistente podrían volar siempre que tuvieran colocada una válvula de Heimlich35.
El riesgo de recurrencia tras un primer neumotórax espontáneo es muy alto en el primer año de evolución (50% aproximadamente), especialmente en pacientes con enfermedad pulmonar preexistente. Por ello se recomienda evitar el vuelo durante este periodo. En caso de pleurodesis quirúrgica o por talco, no existen dichas restricciones ya que el riesgo es extremadamente bajo36.
Considerar cribar a los pacientes con riesgo alto de neumotórax secundario espontáneo mediante una tomografía computarizada antes del viaje, por la posible presencia de neumotórax oculto37.
InfeccionesEl espacio confinado y la ventilación limitada aumentan el riesgo de transmisión de enfermedades, aunque según la Organización Mundial de la Salud éste no difiere del viaje en un autobús o el tren38. Las recomendaciones concretas para tuberculosis son de no volar en la fase bacilífera, aunque en los episodios de posible transmisión por viaje aéreo estudiados se ha establecido que la posibilidad de contagio es muy baja. En el caso del síndrome agudo respiratorio grave (SARS) o gripe aviaria, se debe evitar volar en dos supuestos principales: paciente procedente de zona de riesgo con sintomatología compatible, y haber estado en contacto los 10 días antes con un caso sospechoso o confirmado de SARS. En lo que respecta al virus influenza, presenta una alta capacidad infectiva, por lo que aunque se han documentado pocos estudios, puede llegar a enfermar hasta el 25-70% de los pasajeros.
Neumopatía crónica del prematuroLas guías de la BTS recomiendan que cualquier lactante con historia de problema respiratorio neonatal debe consultar con su pediatra antes del vuelo y que habría que valorar la realización de una prueba de hipoxia simulada. En la revisión del año 2004 el punto de corte para considerar una desaturación significativa durante la prueba y para indicación de oxígeno fue corregido del 85 al 90%34. Estos valores son controvertidos, ya que no existen estudios que establezcan los valores de normalidad de la prueba de hipoxia en niños sanos de estas edades. Un trabajo reciente de Martin concluye que el punto de corte de 90% no discrimina entre lactantes sanos y aquellos con neumopatía crónica de la prematuridad, y es más conveniente utilizar la saturación del 85% como límite más adecuado39. Por otra parte, la utilidad de la prueba de hipoxia simulada como predictiva de riesgo de hipoxia durante el vuelo también parece discutible en lactantes ex prematuros11. En cualquier caso, parece recomendable realizar una prueba de hipoxia simulada para titulación de oxígeno en los pacientes oxigenodependientes y en aquellos que hayan suspendido la oxigenoterapia menos de 6 meses antes del viaje40.
CardiopatíaNo existen guías que establezcan el riesgo de los pacientes con cardiopatías congénitas. Se recomienda que los niños con hipertensión no controlada, taquicardia supraventricular no controlada y los afectados de síndrome de Eissenmenger no se desplacen en avión35. A pesar de ello, los trabajos realizados en adultos con cardiopatías no cianosantes o síndrome de Eisenmenger no han encontrado sucesos adversos41. En cuanto a las cardiopatías cianosantes, se desconoce el riesgo que supone una disminución en la SatO2 en pacientes que ya la tienen crónicamente baja, aunque algunas guías recomiendan el empleo de oxígeno durante el vuelo35.
Los pacientes con hipertensión pulmonar primaria o secundaria presentan un gran riesgo de complicaciones. Debido a la variabilidad individual en la vasoconstricción pulmonar inducida por la hipoxia, incluso un leve aumento en la hipoxia puede causar una gran elevación en las resistencias vasculares pulmonares en ciertos pacientes, con fallo cardiaco derecho y disminución del gasto cardiaco. La hipertensión pulmonar grave (clase III y IV) se considera una contraindicación para el vuelo. En aquellos sujetos en los que la afectación sea más leve (clase I y II) se recomienda la utilización de oxígeno a un flujo de 2-4 l por minuto en todos los vuelos, así como evitar toda actividad durante los mismos42. Desaconsejar viajes en altitud a dichos pacientes. Si el viaje en altitud no se puede evitar, dar información sobre los riesgos y como reconocer los síntomas y signos de un edema pulmonar de la altura. Administrar suplementos de oxígeno en viajes por encima de 2.000 m incluso en pacientes que no precisen suplementos de oxígeno de base. En pacientes sin tratamiento de base, realizar profilaxis con nifedipino.
Discrasias sanguíneasEn niños no hay un aumento del riesgo de tromboembolismo, excepto aquellos con factores de riesgo como trombofilia, antecedentes de tromboembolismo, leucosis o cirugía mayor reciente que pueden necesitar profilaxis con heparina de bajo peso molecular.
Los pacientes afectados de drepanocitosis tienen un riesgo aumentado de crisis durante el vuelo, por lo que se recomienda una hidratación abundante y en algunos casos profilaxis con aspirina. Si han sufrido una crisis reciente, deben esperar 10 días para volar y en caso de anemia importante, valorar la oxigenoterapia durante el vuelo.
Enfermedades neuromusculares restrictivas o con afectación de la caja torácicaEstos pacientes presentan también riesgo de hipoxia durante el vuelo, como se ha demostrado durante la prueba de hipoxia simulada43. A pesar de ello, existen pocos casos descritos de problemas44.
Previo al vuelo, si la SatO2 en situación estable basal es del 92-95%, se recomienda la realización de una prueba de hipoxia simulada e indicar oxígeno en función de ella. En caso de haber tenido un ingreso por exacerbación en las 6 semanas previas, se recomienda el empleo de oxígeno, incluso aunque no tengan otra indicación. En los pacientes oxigenodependientes se debe aumentar el flujo de oxígeno durante el vuelo al menos un 33%42.
En caso de viaje en montaña, se debe estudiar la presencia de trastornos respiratorios durante el sueño y, si existen, tratar con ventilación mecánica no invasiva (VMNI) con dos niveles de presión durante la estancia en altitud. Estudiar la hipoventilación de base, y si existe, viajar con soporte de VMNI.
Administrar suplementos de oxígeno nocturno en pacientes con historia de desaturaciones nocturnas, pero evitar la sobreoxigenación para prevenir la supresión del centro ventilatorio.
Descartar en los pacientes con cifoescoliosis la presencia de hipertensión pulmonar y, si está presente, administrar suplemento de oxígeno y aconsejar profilaxis con nifedipino.
Si no pueden evitar el viaje, en los pacientes con parálisis bilateral diafragmática se les aconseja soporte con VMNI.
Enfermedad pulmonar intersticialLas recomendaciones en vuelo son similares a las del apartado previo. Para el viaje en altura, valorar la necesidad de suplementos de oxígeno y administrarlo durante la estancia si la PaO2 predicha es inferior a 50-55 mmHg.
Valorar la presencia de hipertensión pulmonar y, si está presente, administrar suplementos de oxígeno y profilaxis con nifedipino.
Hipoventilación por obesidadDesaconsejar el viaje a altitud. Si el viaje no se puede evitar, administrar oxígeno suplementario tanto durante el día como por la noche. Informar de los riesgos y de los síntomas de la enfermedad aguda de la altura y iniciar profilaxis con acetazolamida 125mg o 250mg/2 veces al día.
En pacientes con prescripción previa de VMNI con presión positiva continua de la vía aérea (CPAP), viajar con el aparato habitual. Los aparatos actuales suelen tener ajuste de presión corregido por altura, pudiendo activarse de manera automática o manual. En este último caso, es necesario realizar los ajustes de presión anteriormente al viaje.
Apneas obstructivas y centralesViajar a la altitud con el aparato de CPAP con los ajustes de presión previamente reseñados. Para los pacientes con apneas centrales durante el sueño, considerar acetazolamida 250mg/2 veces al día. Continuar la terapia nocturna con oxígeno preexistente.
En los pacientes con hipoxemia diurna evaluar la posible presencia de hipertensión pulmonar y si está presente, iniciar profilaxis con nifedipino. Optimizar el régimen de fallo cardiaco en los pacientes con apneas centrales durante el sueño debidas a cardiomiopatías.
Ventilación no invasivaNo existe contraindicación específica para volar en estos pacientes. Es posible llevar el respirador a bordo, previo contacto con la compañía aérea. En algunos casos, dependiendo de la compañía y el avión, será necesario desconectar el respirador durante las fases de despegue y aterrizaje, por lo que si el paciente es totalmente dependiente del respirador debe haber en cabina alguien adiestrado en el manejo de la ventilación manual con ambú.
Logística del viaje con oxígeno: aspectos prácticosUna buena planificación del viaje resulta primordial para que éste se realice de manera segura y confortable. Para ello es indispensable la coordinación entre los médicos que habitualmente atienden a los pacientes y los servicios médicos de las diferentes compañías aéreas.
La International Air Transport Association (IATA) publicó, en junio de 2004, un manual médico con el objetivo de ofrecer una información actualizada a sus miembros sobre temas médicos en relación con el transporte aéreo45.
Según estas orientaciones, el certificado médico expedido por el médico responsable del paciente deberá ser valorado por el propio departamento médico de cada compañía aérea antes de decidir si el pasajero es apto o no para realizar el vuelo, y qué tipo de asistencia especial podría ser ofrecida por la compañía aérea.
Se deberá realizar la reserva con la mayor antelación posible, como mínimo 48h antes del inicio del viaje, especificando las condiciones especiales requeridas por cada paciente.
Al realizar la reserva se deberá cumplimentar un impreso (MEDIF/INCAD, en http://www.lan.com/files/pdf/medif_es.pdf), que consta de dos partes; una primera, en la que la agencia de viajes o la oficina de reservas de la compañía especificará el itinerario aéreo del paciente y si necesita de algún tipo de asistencia o logística específica, y una segunda parte, que deberá ser cubierta, con el mayor detalle posible, por el médico responsable del paciente, incluida su opinión sobre la aprobación para la realización del vuelo según las condiciones del paciente y las recomendaciones necesarias para realizar el trayecto. Los pasajeros con una enfermedad crónica estable podrán recibir una tarjeta denominada FREMEC. Esto evita la necesidad de obtener autorización médica para cada viaje y describe las necesidades médicas de los pasajeros y requisitos especiales de manipulación.
Las anteriores recomendaciones prohíben el transporte de oxígeno líquido al ser considerado mercancía peligrosa. Los pasajeros no pueden llevar sus propios dispensadores de oxígeno por motivos de seguridad, salvo que las bombonas o mochilas estén completamente vacías.
La mayoría de las compañías aéreas pueden proporcionar oxígeno a los pasajeros durante el vuelo. El suministro suele ser fijo a flujos de 2 o 4 l/min y generalmente se realiza mediante cilindros de gas. El coste de este servicio extraordinario es variable entre compañías, debido probablemente a la carencia de regulaciones en este tema. Asimismo tienen el derecho a rechazar esta petición.
Los transportes en ambulancia o desde hospitales deberán tramitarse por el pasajero o por el médico responsable.
El oxígeno puesto a disposición por la compañía aérea sólo se suministrará dentro del avión, por lo que se deberán realizar las gestiones necesarias para obtener suministro de oxígeno en el punto de destino, así como en los lugares donde se haga escala durante el viaje, pensando en los posibles tiempos de espera.
En los últimos años han aparecido concentradores portátiles de oxígeno que han facilitado el viaje aéreo. Estos aparatos, de poco peso y volumen, aportan un gas enriquecido en oxígeno excluyendo parte del nitrógeno del aire ambiente. Se suele permitir su empleo durante el despegue y el aterrizaje, y en los movimientos por la cabina. También permiten al paciente su uso continuo de la terminal al avión y durante las escalas. En la actualidad, existen 7 tipos de aparatos fabricados por distintas compañías. Pueden utilizar baterías recargables o ser conectados a la red, y su coste es asumido por el Sistema Nacional de Salud, tramitándose a través de los proveedores establecidos en cada comunidad autónoma. Igualmente, los pacientes que deseen emplearlo en los vuelos deben comunicarlo con antelación a las compañías aéreas, solicitando su autorización.
En la página web de la European Lung Foundation (http://www.european-lung-foundation.org/index.php?id=4059) se puede encontrar un resumen de la normativa de las distintas compañías aéreas que operan en Europa, así como el coste del desplazamiento con oxígeno.
ConclusiónEl número de pacientes pediátricos con patología preexistente dispuestos a viajar en avión o a lugares con altitud significativa seguirá incrementándose en los próximos años. Es necesario que el pediatra efectúe una evaluación previa al viaje y, teniendo en consideración su historia clínica, antecedentes, función pulmonar y SatO2 basal, considere la realización de pruebas específicas de hipoxia simulada y aconseje sobre los riesgos y medidas terapéuticas necesarias. Se precisa de un número mayor de estudios que evalúen la prueba de hipoxia simulada en lactantes y niños con distintas patologías, así como valorar la repercusión de la hipoxia a corto y largo plazo, tanto durante el vuelo como en los viajes a altitud.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
D. Álvarez Gil (Hospital Infanta Margarita, Cabra, Córdoba); V. Alzina de Aguilar (Clínica Universitaria de Navarra, Pamplona); A. Andrés Martín (Hospital Universitario de Valme, Sevilla); C. Antelo Landeira (Hospital Universitario La Paz, Madrid); O. Asensio de la Cruz (Corporació Sanitària Parc Taulí, Sabadell, Barcelona); I. Barrio Gómez de Agüero (Hospital Universitario La Paz, Madrid); J. Blanco González (Hospital Universitario Príncipe de Asturias, Alcalá de Henares, Madrid); M. Bermejo Pastor (Hospital Materno-Infantil de Badajoz); A. Bonillo Perales (Hospital Torrecárdenas, Almería); M. Bosque García (Corporació Sanitària Parc Taulí, Sabadell, Barcelona); G. Cabrera Roca (Hospital Universitario Materno-Infantil, Las Palmas de Gran Canaria); M. Carrasco Zalvide (Hospital Juan Ramón Jiménez, Huelva); I. Cortell Aznar (Hospital Universitario La Fe, Valencia); J. Elorz Lambarri (Hospital Basurto, Bilbao); A. Escribano Montaner (Hospital Clínico Universitario, Valencia); J. Figuerola (Hospital de Son Dureta, Mallorca); M.D. Frías Morales (Madrid); D. Gómez-Pastrana Durán (Hospital de Jerez, Jerez de la Frontera, Cádiz); S. Liñán Cortés (Hospital Materno-Infantil Vall d’Hebron, Barcelona); M. Machuca Contreras (Hospital Virgen del Rocío, Sevilla); C. Martínez (Hospital Universitario La Paz, Madrid); A. Moreno Galdó (Hospital Materno-Infantil Vall d’Hebron, Barcelona); C. Oliva Hernández (Hospital Nuestra Señora de la Candelaria, Santa Cruz de Tenerife, Canarias); B. Osona Rodríguez de Torres (Hospital Son Dureta, Mallorca); M.T. Pascual Sánchez (Hospital de Sant Joan, Reus, Tarragona); L. Pardos Rocamora (CAP Balaguer, Lleida); J. Pérez Frías (Hospital Materno-Infantil Carlos Haya, Málaga); G. Pérez Pérez (Hospital Universitario Virgen de la Macarena, Sevilla); E. Pérez Ruiz (Hospital Materno-Infantil Carlos Haya, Málaga); C. Reverté Bover (CAP Amposta, Tarragona); A. Salcedo Posadas (Hospital Infantil Universitario Niño Jesús, Madrid); J. Sánchez Jiménez (Hospital de Sant Jaume, Calella, Barcelona); E. Sánchez Sánchez (CAP Premià de Mar, Barcelona); L. Sanz Borrell (Hospital de Sant Joan, Reus, Tarragona); A. Sequeiros González (Hospital Infantil Universitario Niño Jesús, Madrid); J. Sirvent Gómez (Complejo Hospitalario Juan Canalejo, A Coruña); J.M. Tabarés Lezcano (Hospital Cristal-Piñor, Orense); J.M. Torres Simón (Hospital de Palamós, Girona); M.I. Ubeda Sansano (CAP Godella, Valencia); J.R. Villa Asensi (Hospital Infantil Universitario Niño Jesús, Madrid).
El listado de los miembros del Grupo de Trabajo de Técnicas de la Sociedad Española de Neumología Pediátrica se presenta en el anexo 1.