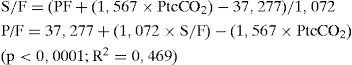Evaluar si la inclusión de la medición transcutánea de CO2 (PtcCO2) mejora el modelo de predicción del índice presión arterial de oxígeno/ fracción inspirada de oxígeno [PaO2/FiO2 (P/F)] a partir del índice saturación de oxígeno/FiO2 [SpO2/FiO2 (S/F)].
MétodosAnálisis retrospectivo de datos gasométricos correspondientes a niños críticamente enfermos. Se incluyen PaO2, SpO2, FiO2 y PtcCO2 de 40 muestras en 8 pacientes. Se calculó un modelo de regresión lineal múltiple para predecir el índice P/F a partir del índice S/F y la PtcCO2. Con la fórmula obtenida se obtuvieron los valores de índice S/F correspondientes con los valores de índice P/F de 200 y 300 para distintos niveles de PtcCO2. Se determinaron las curvas de características operador receptor para los valores corte del índice P/F (200 y 300).
ResultadosEl modelo de regresión lineal fue: P/F=37,277+(1,072×S/F) – (1,567×PtcCO2); p<0,0001; R2=0,469. Con esta ecuación, para una PtcCO2 de 40 mmHg, valores de índice P/F de 200 y 300 correspondieron respectivamente a valores de índice S/F de 295,1 y 426,5. Un índice P/F calculado menor de 256,7 equivaldría a un índice P/F real menor de 200 (sensibilidad 84,6%; especificidad 85,2%) y un índice P/F calculado menor de 297,6 equivaldría a un índice P/F real menor de 300 (sensibilidad 89,7%; especificidad 82%).
ConclusiónLa PtcCO2 modifica la predicción del índice P/F a partir del índice S/F. Son necesarios estudios prospectivos que validen en una muestra más amplia los resultados encontrados en este estudio.
To evaluate if the inclusion of the transcutaneous CO2 tension measurement (PtcCO2) can improve partial pressure of oxygen/ fraction of inspired oxygen ratio [PaO2/FiO2 (P/F)] prediction from pulse oximetry saturation/FiO2 ratio [SpO2/FiO2 (S/F)].
MethodsRetrospective analysis of blood gas data from critically ill children. PaO2, SpO2, FiO2 and PtcCO2 from 40 samples in 8 patients were analysed. A multiple linear regression model was performed to predict P/F ratio from S/F ratio and PtcCO2. Using the equation obtained, S/F ratio values were calculated for P/F ratios of 200 and 300 and different levels of PtcCO2. Receiver Operator Characteristic (ROC) curves were made to analyse the diagnostic values of P/F ratio (200 and 300).
ResultsThe linear regression model was: P/F=37.277+(1.072×S/F) – (1.567×PtcCO2); P<.0001; R2=0.469. Using the equation, for a PtcCO2 value of 40 mmHg, P/F ratios of 200 and 300 corresponded to S/F ratios of 295.1 and 426.5, respectively. Computed P/F ratio less than 256.7 had 84.6% sensitivity and 85.2% specificity for the diagnosis of P/F ratio less than 200. Computed P/F ratio less than 297.6 had 89.7% sensitivity and 82% specificity for the diagnosis of P/F ratio less than 300.
ConclusionPtcCO2 has a significant influence on the prediction of P/F ratio from S/F ratio. Prospective studies with more patients are needed to validate these results.
La oxigenación del niño enfermo puede ser objetivada de dos maneras diferentes en la práctica clínica diaria. La primera consiste en la determinación de la presión parcial de oxígeno (PaO2) en una muestra de sangre arterial. La segunda, más habitual y no cruenta es la monitorización transcutánea de la saturación pulsioximétrica de la hemoglobina (SpO2)1.
El índice P/F [PaO2/fracción inspirada de oxígeno (FiO2)] ha sido utilizado clásicamente para definir la lesión pulmonar aguda (LPA) y el síndrome de distrés respiratorio agudo (SDRA). Según la American-European Consensus Conference en SDRA, la instauración aguda de infiltrados pulmonares difusos bilaterales en la radiografía de tórax en ausencia de hipertensión en aurícula izquierda junto con un P/F menor de 300 y de 200 definen la LPA y el SDRA respectivamente2.
Estos criterios obligan a obtener una muestra arterial para la confirmación diagnóstica, lo que puede provocar que algunos casos pasen desapercibidos3. En el SDRA el tratamiento que ha demostrado disminuir la morbilidad y mortalidad es la ventilación mecánica convencional (VMC) optimizada con una estrategia de protección pulmonar4.
En los últimos años la ventilación mecánica no invasiva (VNI) está siendo utilizada con mayor frecuencia en el tratamiento de la insuficiencia respiratoria. Los factore predictores de fracaso de la VNI más importantes son la insuficiencia respiratoria tipo 1 o hipoxémica5, un índice P/F bajo6 y el diagnóstico de SDRA7.
La VNI en el SDRA tiene una controvertida utilidad. Su aplicación se ha relacionado con un aumento en la mortalidad6. Además, un P/F menor de 175 tras una hora de VNI se considera un factor predictor de fracaso8. Así ante el diagnóstico de SDRA con un índice P/F menor de 175 se debería valorar la VMC.
Por todo ello parece necesario contar con un indicador fiable, fácil de monitorizar y no cruento que nos permita en la práctica clínica discernir en qué pacientes debemos evitar la VNI y pasar a ventilación mecánica convencional.
En 2007 Rice et al9 demostraron que el índice S/F se correlacionaba con el índice P/F en pacientes adultos con LPA o SDRA siendo útil tanto para el diagnóstico como para el seguimiento de este tipo de pacientes. En 2009 Khemani et al10 realizando un estudio similar en pacientes pediátricos apuntaron al índice S/F como un marcador no invasivo fiable del índice P/F identificando a los niños con LPA y SDRA con aceptables sensibilidad (93 y 68%) y especificidad (43 y 84%). Recientemente Thomas eta al11 demostraron que tanto el índice S/F como el de saturación de oxígeno [(FiO2 x Presión media vía aérea)/SpO2] son métodos no invasivos utilizables para definir LPA y SDRA.
La relación entre la SpO2 y la PaO2 viene definida por la curva de disociación de la hemoglobina. Esta curva se desplaza, variando la afinidad de la hemoglobina por el oxígeno, según el pH, la presión parcial de dióxido de carbono (PCO2), temperatura y concentración de 2,3-difosfoglicerato (2,3-DPG)12. Estos factores deberían ser tenidos en cuenta si queremos predecir con mayor fiabilidad la PaO2 de manera no invasiva13.
La PCO2 modifica la curva de disociación de la hemoglobina desplazándola hacia la derecha. Un aumento de la PCO2 favorece la liberación de oxígeno a los tejidos. Para una determinada PaO2, la SpO2 será más baja cuando tengamos una PCO2 mayor.
La medición transcutánea de la PCO2 (PtcCO2) constituye un método no invasivo, fiable y continuo en el niño críticamente enfermo14,15.
La hipótesis de nuestro trabajo fue que la inclusión de la PtcCO2 en el modelo de predicción del índice P/F a partir del índice S/F puede mejorar su capacidad predictiva.
Material y métodosSe revisaron los datos gasométricos arteriales de los pacientes ingresados durante el periodo 2004-2008 en la UCI Pediátrica del Hospital Universitario Central de Asturias (altitud 227 metros sobre el nivel del mar). Los datos fueron recogidos en una base de datos diseñada a tal efecto en el momento de la realización de la gasometría arterial. Incluimos en el estudio aquellos valores gasométricos arteriales que tuvieran pareados valores simultáneos de SpO2, PtcCO2 y FiO2. Los casos con SpO2 mayor del 97% fueron excluidos, al igual que en otros estudios9-11, debido a que a partir de ese valor la relación entre SpO2 y PaO2 deja de ser lineal y la disociación de la hemoglobina apenas cambia a pesar del aumento de la PaO2. La PtcCO2 se midió con el monitor TOSCA 500 (Linde Medical Sensors, Basilea, Suiza).
En el análisis de los datos se utilizó la regresión lineal múltiple calculando la significación estadística mediante el test F de Snedecor y el coeficiente de coeficiente de determinación R2. Se incluyeron las interacciones estadísticamente significativas (p<0,05), se comprobó la normalidad y se eligió el modelo con mejor R2. La exactitud de nuestro modelo se estudió con el método de Bland-Altman.
Con la fórmula obtenida fueron calculados los valores del índice S/F que corresponderían a los valores corte del índice P/F (200 y 300) para distintos niveles de PtcCO2 (25, 35, 40, 45 y 60 mmHg). Se midió la capacidad diagnóstica de nuestra ecuación calculando el valor de índice P/F con mejor sensibilidad y especificidad para predecir un índice P/F real menor de 200 y de 300. Se generaron las curvas Receiver Operator Characteristic (ROC) y fue calculada el área bajo la curva de las mismas para los valores corte del índice P/F (200 y 300).
Se compararon las curvas ROC de nuestro modelo con las descritas por Khemani et al10.
Posteriormente se calculó los valores del índice P/F con la fórmula descrita por Khemani et al10 a partir de los valores del índice S/F de nuestra muestra y se determinaron la sensibilidad y especificidad para predecir un P/F real menor de 200 y menor de 300.
Igualmente, con los valores de corte del índice S/F para el diagnóstico de SDRA y LPA descritos por Thomas et al11 se determinaron la sensibilidad y especificidad en nuestra muestra para el diagnóstico de un índice P/F menor de 200 y 300.
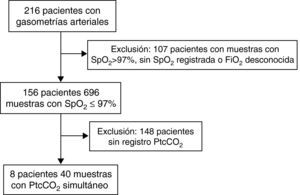
ResultadosSe obtuvieron gasometrías arteriales en 216 pacientes. Ciento siete pacientes fueron excluidos por no tener ninguna muestra con SpO2 registrada, porque su valor fuera mayor de 97% o porque la FiO2 no fuera conocida. Otros 148 pacientes fueron excluidos por no tener mediciones de la PtcCO2. Se analizaron las 40 muestras de 8 pacientes en las que se encontraba recogido un valor de PtcCO2 y cumplían el resto de condiciones (fig. 1).
La edad mediana al ingreso fue 4,62 años (rango intercuartílico 0,09 – 7,44). Dos pacientes tenían menos de 6 meses de vida (17 y 33 días de vida respectivamente el día de su ingreso). La patología de estos pacientes se refleja en la tabla 1. Se diagnosticó un SDRA en un paciente. Un paciente no mostraba patología pulmonar (postoperatorio de angiofibroma de cavum).
Patología de los pacientes incluidos
| N° | Patología |
| 1 | Quilotórax. Atelectasia LSD |
| 2 | Neumonía en paciente con DBP |
| 3 | LPA con derrame pleural |
| 4 | Neumonía |
| 5 | Contusión pulmonar. SDRA |
| 6 | Bronquiolitis. Sobreinfección bacteriana |
| 7 | Angiofibroma de cavum |
| 8 | Bronquiolitis |
DBP: displasia broncopulmonar; LPA: lesión pulmonar aguda; LSD: lóbulo superior derecho; SDRA: síndrome de distrés respiratorio agudo.
Los valores medios y desviación típica de las variables analizadas se describen en la tabla 2.
Se analizó la correlación entre la PaCO2 y la PtcCO2 en nuestra muestra. La PaCO2 media fue 55,9 mmHg con una desviación típica de 13,3. La PtcCO2 media fue 58,1 con una desviación típica de 16,2. El coeficiente de coeficiente de correlacíón lineal de Pearson (r) fue 0,828 (p<0,0001).
Se halló un modelo de regresión lineal capaz de predecir el índice P/F a partir del índice S/F y ajustado por la PtcCO2:
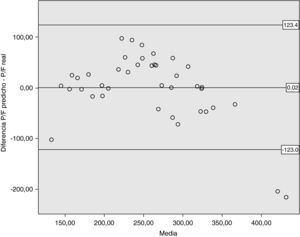
El análisis de Bland-Altman mostró una media de las diferencias de 0,02 (IC 95%: -21,28 - 21,32). Los límites de acuerdo para dos desviaciones estándar fueron –123 y 123,4. El gráfico se muestra en la figura 2.
Con esta ecuación un índice P/F de 200 corresponde a un índice S/F de 295,1 corregido para una PtcCO2 de 40 mmHg. Un índice P/F de 300 correspondería con un índice S/F de 426,5 para una PtcCO2 de 40 mmHg. Los valores de S/F calculados para otros niveles de PtcCO2 y correspondientes a los límites diagnósticos del índice P/F se muestran en la tabla 3.
Valores calculados de índice S/F para valores diagnósticos de índice P/F (200 y 300) correspondientes a distintos niveles de CO2 transcutáneo
| PtcCO2 (mmHg) | P/F | S/F |
| 25 | 200 | 264,6 |
| 35 | 200 | 285,1 |
| 40 | 200 | 295,4 |
| 45 | 200 | 305,7 |
| 60 | 200 | 336,5 |
| 25 | 300 | 395,7 |
| 35 | 300 | 416,2 |
| 40 | 300 | 426,5 |
| 45 | 300 | 436,7 |
| 60 | 300 | 467,6 |
Un valor de índice P/F, calculado con nuestro modelo, menor de 256,7 demostró una sensibilidad de 84,6% y una especificidad de 85,2% para el diagnóstico de un P/F real menor de 200 (SDRA).
Un valor de índice P/F, calculado con nuestro modelo, menor de 297,6 obtuvo una sensibilidad de 89,7% y especificidad del 82% para el diagnóstico de un P/F real menor de 300 (LPA).
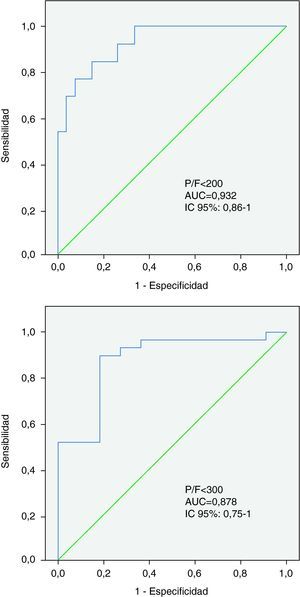
El área bajo la curva para el diagnóstico con nuestra fórmula de un P/F menor de 200 fue 0,932 (error típico=0,04; intervalo de confianza al 95%: 0,86 - 1) que corresponde a un nivel de discriminación excelente. El área bajo la curva para un P/F menor de 300 fue 0,878 (error típico=0,06; intervalo de confianza al 95%: 0,75 - 1) que corresponde a un nivel de discriminación bueno (fig. 3).
Mediante una prueba de homogeneidad de áreas no se encontraron diferencias estadísticamente significativas entre las curvas ROC de este trabajo y las de Khemani et al10 (Ji cuadrado 0,63; p=0,4274) para el diagnóstico de un índice P/F menor de 200.
En nuestra muestra con la fórmula de Khemani et al10 un índice P/F calculado menor de 374,7 mostró una sensibilidad de 84,6% y una especificidad de 81,5% para un valor de índice P/F real menor de 200. El área bajo la curva ROC fue de 0,949 (error típico 0,03; intervalo de confianza al 95% 0,89-1) que corresponde a un nivel de discriminación excelente.
Un índice P/F calculado con la fórmula de Khemani menor de 396,2 obtuvo una sensibilidad de 89,7% y una especificidad de 72,7% para un valor de índice P/F real menor de 300 en nuestra muestra. El área bajo la curva ROC fue de 0,873 (error típico 0,06; intervalo de confianza al 95% 0,76-0,99) que corresponde a un nivel de discriminación bueno.
Fueron analizados en nuestra muestra los valores de corte del índice S/F del estudio de Thomas et al11 para el diagnóstico de SDRA y LPA. Así, el valor de corte del índice S/F de 212 para el diagnóstico de un índice P/F menor de 200 identificó correctamente 9 de las 13 muestras con P/F menor o igual a 200 (sensibilidad 69,2%) y las 27 muestras con un índice P/F mayor de 200 (especificidad 100%). El valor de corte del índice S/F de 253 para el diagnóstico de un índice P/F menor de 300 identificó correctamente 9 de las 29 muestras con P/F menor o igual a 300 (sensibilidad 31%) y las 11 muestras con un índice P/F mayor de 200 (especificidad 100%).
DiscusiónEn el momento actual existe una tendencia a disminuir las técnicas invasivas en el manejo del niño críticamente enfermo: aumentando la utilización de la VNI, disminuyendo el volumen y el número de extracciones sanguíneas16,17 así como la canalización de vías centrales. Este descenso en la agresividad diagnóstica y terapéutica no debe tener como consecuencia un peor pronóstico y debe basarse en la evidencia científica actual16,17.
La valoración objetiva de la oxigenación siempre ha estado determinada por una técnica invasiva: una gasometría arterial. Sin embargo en los últimos años el índice S/F ha mostrado una buena correlación con el índice P/F tanto en adultos como en niños con LPA y SDRA9-11. En nuestro estudio hemos comprobado dicha relación en una muestra más heterogénea en la que solamente dos pacientes cumplían los criterios diagnósticos para LPA y SDRA respectivamente.
El SDRA tiene una frecuencia baja en la población pediátrica, entre 2 y 3 casos por cada 100.000 niños y año18,19, pero su reconocimiento precoz es fundamental. Disponer de un índice fiable, fácil de monitorizar y no invasivo que sea capaz de predecir un índice P/F menor de 200 puede servir como punto de sospecha inicial para el diagnóstico de un SDRA (P/F<200, infiltrados pulmonares bilaterales y ausencia de fallo cardiaco izquierdo). En el momento actual la utilización de la VNI en el tratamiento de la insuficiencia respiratoria es cada vez más frecuente. En el paciente con VNI habitualmente no disponemos de una vía arterial y valoramos su oxigenación de manera no invasiva (SpO2). En esta situación predecir el índice P/F a partir del índice S/F con la mayor fiabilidad posible puede permitir reconocer un SDRA precozmente. En ese caso la retirada de la VNI y la aplicación de la VMC con una estrategia de protección pulmonar puede conllevar una disminución en la mortalidad4,6. Sin embargo, queremos remarcar que la oxigenación no es el único parámetro a considerar en la decisión de instaurar o mantener la VNI. Existen datos clínicos (tipo de insuficiencia respiratoria, edad, peso, puntuación de gravedad, evolución de frecuencia respiratoria y frecuencia cardiaca, patología de base)5,6 probablemente más importantes que los obtenidos a partir de parámetros analíticos. Aún así, en determinados pacientes con alto riesgo de fracaso (insuficiencia respiratoria tipo 1 y en particular con LPA o SDRA)5,7 se hace imprescindible contar con métodos objetivos que nos orienten hacia la posibilidad de fracaso y la necesidad de aumentar el nivel de monitorización con una gasometría arterial.
La posible modificación de la correlación entre los índices S/F y P/F por los factores que desplazan la curva de disociación de la hemoglobina no había sido analizada previamente. En nuestro estudio hemos hallado una nueva fórmula introduciendo en el modelo la PtcCO2. En la práctica clínica los pacientes con insuficiencia respiratoria presentan grandes variaciones en la PCO2. Si no tenemos en cuenta el nivel de CO2 para valorar la oxigenación con la SpO2 podemos cometer errores. Así teóricamente en un paciente con hipoventilación que produce hipercapnia la afinidad del oxígeno por la hemoglobina estará disminuida y tendrá una PaO2 más alta para una misma SpO2.
Con la ecuación calculada en este trabajo, se obtienen unos valores de sensibilidad y especifidad buenos para el criterio diagnóstico de hipoxemia del SDRA (P/F<200) y de LPA (P/F<300). Lo cual indica que podría ser útil como prueba de cribado o índice de sospecha para posteriormente confirmarlo con el índice P/F.
Queremos destacar que la ecuación obtenida por Khemani et al es más sencilla al no precisar un monitor de PtcCO2 y su coeficiente de correlación (R2=0,61) es superior al del presente estudio. Sin embargo su capacidad diagnóstica parece similar a la de nuestro modelo, puesto que el área bajo la curva ROC para el diagnóstico de un índice P/F<200 es 0,898 (en nuestro estudio 0,932) y el área bajo la curva ROC para el diagnóstico de un índice P/F menor de 300 es 0,848 (en nuestro estudio 0,878).
Este trabajo constituye el primer estudio que incluye la PtcCO2 como modificador de la predicción del índice P/F a partir del índice S/F y sirve de base para futuros estudios que validen una fórmula con mayor valor predictivo.
Existen limitaciones en el diseño de este estudio. Primero, aunque los datos fueron recogidos de manera prospectiva en el momento de la realización de la gasometría arterial, el análisis de los mismos fue retrospectivo. Si la forma de la curva de SpO2 no era adecuada por movimiento del paciente o del transductor es posible que el valor de la SpO2 sea menos exacto del real. Segundo, nuestra muestra es muy pequeña debido al gran número de muestras no incluidas por no tener registrada una SpO2 simultánea, una FiO2 conocida y sobre todo por la escasa utilización de la monitorización del PtcCO2. A pesar de ello, la correlación estadística es similar al de trabajos con mayor muestra. Tercero, otros factores como la temperatura o el pH que influyen en la curva de disociación de la hemoglobina, no se han analizado en este estudio por no incluirse en el protocolo de recogida de datos o ser su medición invasiva. No obstante, su papel es menor que el de la PaCO2. Una última limitación podría ser el rango estrecho de valores de FiO2 (entre 30 y 50%), por lo que habría que confirmar la correlación en una muestra con más variabilidad en este aspecto.
En resumen, la PtcCO2 modifica la predicción del índice P/F a partir del índice S/F, probablemente debido a su influencia en la curva de disociación de la hemoglobina. La utilización de una fórmula ajustada por la PtcCO2 mejora la fiabilidad en la predicción del índice P/F a partir del índice S/F. La ecuación descrita puede ser una herramienta útil para el diagnóstico precoz y fiable del criterio de hipoxémica grave del SDRA (índice P/F<200) en la práctica clínica. Debido a las limitaciones comentadas son necesarios estudios prospectivos que validen en una muestra más amplia los resultados encontrados en este estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.