Introducción
En la actualidad, los consumidores están cada vez más concienciados de la relación que hay entre la dieta y la salud, lo que ha impulsado el desarrollo y la comercialización de diversos alimentos con propiedades beneficiosas. Sin embargo, es necesario establecer científicamente las bases en las que se apoyan las alegaciones funcionales y que se demuestren sus efectos beneficiosos en las cantidades que normalmente se consumirían en el marco de una dieta global1.
En este contexto, cada vez es más frecuente la incorporación de ingredientes funcionales de origen lácteo y no lácteo en la leche y alimentos de base láctea, que incluyen bacterias probióticas, ácidos grasos omega-3, vitaminas, minerales y carbohidratos prebióticos.
El mercado de prebióticos se encuentra en rápida expansión. La adición de prebióticos en fórmulas infantiles, de larga tradición en Japón, aunque mucho más reciente en Europa, ha permitido imitar los efectos de la leche materna (LM) en la flora de los lactantes, aunque no hay datos suficientes para establecer unos contenidos máximos o mínimos en las fórmulas infantiles2.
Concepto de efecto prebiótico
El término prebiótico se refiere a "un ingrediente alimentario no digerible que afecta beneficiosamente al huésped mediante la estimulación selectiva del crecimiento y/o actividad de una o un número limitado de bacterias en el colon"3, es decir, se trata de influir positivamente en la microflora intestinal mediante la dieta. El primer ejemplo de alimento con efecto prebiótico es la LM, cuyo contenido elevado en oligosacáridos (0,8-1,2 g/100 ml, en la LM madura) y la naturaleza de estos se considera la causa de la mayor proporción de bifidobacterias que se encuentra en el tracto gastrointestinal de los niños alimentados con LM frente a los alimentados con fórmulas infantiles. Este hallazgo se ha correlacionado con un riesgo menor de presentar infecciones gastrointestinales4.
La eficacia de los prebióticos está ligada a su capacidad de resistir la digestión en el intestino delgado y alcanzar el intestino grueso, donde un restringido grupo de microorganismos los utilizaría de un modo selectivo, fundamentalmente bifidobacterias y lactobacilos. Por ello, para que un componente alimenticio se considere prebiótico debe cumplir los criterios siguientes5:
1. No debe ser hidrolizado ni absorbido en la parte superior del tracto digestivo.
2. Tiene que ser un sustrato selectivo de uno o de un número limitado de bacterias colónicas beneficiosas, y estimular su número o actividad metabólica.
3. Debe mantener el equilibrio de la flora colónica en favor de una composición mejor.
4. Debe producir efectos beneficiosos en el organismo que lo ingiere mediante la producción de energía, sustratos metabólicos y micronutrientes útiles.
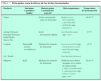
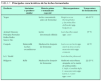
Después de múltiples estudios, se ha observado que sólo un grupo de oligosacáridos puede considerarse prebiótico. En la tabla 1 se muestran los hidratos de carbono que pueden cumplir estos requisitos y que son objeto de investigación. Entre ellos, la inulina y sus derivados, los fructooligosacáridos (FOS) han demostrado actividades prebióticas en un número aceptable de estudios y están disponibles comercialmente. Dentro de los prebióticos de origen lácteo destacan los galactooligosacáridos (GOS), la lactulosa, el lactitol y la lactosacarosa, todos derivados de la lactosa, con efectos bifidogénicos establecidos, aunque en menor número de estudios que los anteriores6.
Fructooligosacáridos
Son oligosacáridos lineales, de cadena media o corta, formados por moléculas de fructosa unidas con enlaces glucosídicos β-1,2 unidos o no a una molécula de glucosa y con diferentes grados de polimerización. Los FOS son fermentados en la parte inferior del colon por la mayor parte de las especies de bifidobacterias existentes allí7.
Los estudios de digestibilidad indican que los enlaces glucosídicos β-1,2 son resistentes a todas las enzimas digestivas humanas. Se encuentran de forma natural en frutas y verduras (puerro, cebolla, ajo, alcachofa).
Galactooligosacáridos
Son oligosacáridos presentes en la LM, que están formados por moléculas de galactosa unidas a una molécula de glucosa mediante enlaces glucosídicos β-1,4. Son fermentados en la parte superior del colon y los estudios de digestibilidad de los GOS realizados in vitro demuestran que son estables en pH ácido y la lactasa y otras enzimas digestivas no los hidrolizan7.
Una mezcla especialmente seleccionada de FOS (10%) y GOS (90%) adicionada a las fórmulas infantiles consigue parecerse a los oligosacáridos de la LM en tamaño y distribución molecular, sobre todo por su elevado contenido en galactosa, y consiguen el mismo efecto en la flora intestinal, favorecer el desarrollo de las especies de bifidobacterias y lactobacilos propias del niño8-10.
Prebióticos y leche materna
Como ya se ha comentado en capítulos anteriores, todo individuo tiene una flora intestinal única que hereda de la madre en el momento del parto. Los niños nacidos mediante cesárea se colonizan inicialmente por bacterias procedentes del medio ambiente hospitalario11. En el adulto, una serie de microorganismos de diferente naturaleza constituye la flora intestinal: un grupo de bacterias con efectos beneficiosos en el huésped como bifidobacterias, lactobacilos y eubacterias; otro grupo potencialmente perjudicial, como Clostridium, Staphilococcus o Proteus, y un tercer grupo que puede tener efectos beneficiosos o perjudiciales, como bacteroides, Escherichia coli y Streptococcus3.
Pero en el lactante se han encontrado diferencias fundamentales entre los recién nacidos alimentados con lactancia materna y los alimentados con lactancia artificial. Los niños alimentados al pecho tienen una flora en la que predominan bifidobacterias y bacterias productoras de ácido láctico, con pocos bacteroides, coliformes y Clostridium, de gran importancia para la protección frente a microorganismos patógenos y para la maduración de las funciones inmunitarias intestinales; mientras que la flora de los alimentados con fórmulas infantiles tiene un mayor número de bacteroides, Clostridium y otras bacterias entéricas, más parecida a la flora de los adultos12.
La lactosa es el principal azúcar de la LM. Asimismo, ésta contiene elevadas cantidades de más de 130 oligosacáridos complejos distintos, y éstos constituyen el tercer mayor soluto, después de la lactosa y los lípidos, por encima de las proteínas. Contiene también glucosa (1,5 mmol/l) y galactosa (15 mmol/l) libres.
La LM madura contiene como promedio entre 6 y 7 g/100 ml de lactosa, aunque esta cantidad varía durante la lactancia. Con la duración de la lactancia la lactosa aumenta, mientras que el contenido en oligosacáridos disminuye. La lactosa favorece el crecimiento de una flora lactobacilar y facilita la absorción intestinal de calcio. Una proporción de la lactosa escapa a la digestión y a la absorción en el intestino delgado y alcanza el colon, donde es fermentada. Esto sucede tanto en los lactantes alimentados con leche materna como en los que reciben una fórmula infantil.
El 10% restante del contenido en azúcares corresponde a oligosacáridos. Éstos son una combinación de cinco monosacáridos distintos: glucosa, galactosa, ácido siálico, fucosa y N-acetil-glucosamina.
El espectro de oligosacáridos y el contenido en la LM está determinado genéticamente y relacionado con su estado secretor y los determinantes de grupo sanguíneo ABO y Lewis. También influye en el contenido en oligosacáridos el momento del día, la duración de la lactancia o si se trata de leche de madre de un niño a término o pretérmino. Durante la lactancia el contenido va disminuyendo de alrededor de 20 g/l en la primera semana a 13 g/l al tercer mes, al mismo tiempo que varía su distribución; mientras que la N-acetil-glucosamina continúa siendo el monosacárido dominante, el ácido siálico deja su segundo lugar a la fucosa. Asimismo, la proporción de oligosacáridos es mayor en la leche de pretérmino que en la de niño a término13.
Aunque puede haber un cierto grado de absorción de estos oligosacáridos, la mayoría no se absorbe y llega al colon donde es fermentada por la flora intestinal. Por lo tanto, su función exclusiva no es convertirse en fuente de energía o proporcionar monosacáridos para formar parte de las glucoproteínas o glucolípidos de las membranas celulares. Por una parte, compiten con los receptores de membrana para las bacterias y virus patógenos en el epitelio intestinal, y así protegen al lactante frente a las infecciones; por otra, ejercen su acción bifidogénica al convertirse en la principal fuente de energía y de carbono para las bacterias del género Bifidobacterium bifidus. Éste es su papel como prebióticos14. Otra función de los oligosacáridos de la LM es proporcionar ácido siálico, elemento importante de los gangliósidos que forman parte de las membranas de las células neuronales. El contenido en ácido siálico de las secreciones en lactantes alimentados al pecho es superior al de los lactantes con alimentación mediante fórmulas infantiles15-18.
Prebióticos y fórmulas infantiles
Cuando una madre no puede amamantar a su hijo, las fórmulas infantiles comerciales son la mejor alternativa como fuente de alimentación. El diseño de las fórmulas infantiles sigue, como modelo, la composición de la LM, aunque la tendencia actual es buscar los efectos funcionales que ésta proporciona.
Tanto desde el punto de vista científico como desde la perspectiva comercial, hay un gran interés por el papel y los efectos que ejercen los prebióticos de la LM en la flora intestinal19,20. La estructura hidrocarbonada de los oligosacáridos hace poco probables las reacciones alérgicas, su similitud con los presentes en la LM disminuyen el riesgo de toxicidad, pero además no generan resistencias microbianas, son solubles en agua y pueden esterilizarse fácilmente13.
Desde hace algunos años la adición a las fórmulas infantiles de GOS similares a los presentes en la LM se realiza en Japón. Es probable que la inclusión de moderadas cantidades de estos prebióticos pudiera ayudar a los lactantes alimentados con una fórmula infantil a adquirir una flora intestinal con más bifidobacterias y menor número de Clostridium, coliformes y bacteroides. Por lo general, dosis de 4-20 g/día han demostrado ser eficaces. Dosis superiores podrían producir una sobrecarga de hidratos de carbono y originar síntomas gastrointestinales, como diarrea o flatulencia21,22. Debe tenerse en cuenta también que una dieta normal en Europa o Estados Unidos ya aporta entre 1 y 10 g/ día de galactooligosacáridos6. Una cuestión importante, aún no resuelta, es cuánto tiempo persiste el efecto bifidogénico cuando se interrumpe una dieta rica en prebióticos23.
Hay una tendencia progresivamente mayor a incorporar en el mismo alimento tanto una bacteria viva con efecto probiótico como prebióticos. En el mercado existen distintos tipos de fórmulas infantiles comercializadas que las podemos clasificar según lleven adicionados prebióticos únicamente (FOS o GOS), prebióticos + probióticos o probióticos de forma exclusiva7:
1. Fórmulas con mezcla de FOS y GOS: favorecen el crecimiento de las especies de bifidobacterias propias de cada niño, tanto en la parte superior del colon como en la parte inferior, y debido a que el desarrollo de la flora es propia de cada niño se pueden incluir tanto en fórmulas de inicio, de continuación y de crecimiento.
2. Fórmulas con FOS: van a producir la fermentación única y exclusivamente en la parte inferior del colon, por lo que el efecto no será global.
3. Fórmulas con GOS: producen la fermentación única y exclusivamente en la parte superior del colon. Efecto parcial.
4. Fórmulas con FOS + probióticos: por su contenido en probióticos sólo existen fórmulas de continuación. Al no incorporar GOS no actúan en la parte superior del colon.
5. Fórmulas con GOS + probióticos: por su contenido en probióticos sólo existen en fórmulas de continuación. Al no incorporar FOS no actúan en la parte inferior del colon.
6. Fórmulas con probióticos: sólo un número limitado de especies se puede emplear como probióticos; debido a las condiciones físico-químicas del tubo digestivo, así como por los procesos de fabricación de las fórmulas infantiles, muchas de las bacterias que se incluyen en las fórmulas se perderán, llegando al colon un número muy inferior del añadido a ésta. Además son especies diferentes de las de la propia flora intestinal del niño, por lo que debido al estado del sistema inmunológico del recién nacido sólo puede haber fórmulas de continuación con probióticos.
En la tabla 2 se muestra la relación de fórmulas comerciales suplementadas con prebióticos, probióticos o la combinación de ambos.
Normativa y seguridad del uso de prebióticos
Si bien en Japón en 1991 ya se estableció el concepto de "Alimentos para Uso Específico en la Salud" (Foods for Specified Health Use [FOSFHU]) y los requisitos que deben cumplir éstos, en la Unión Europea no hay una legislación uniforme sobre las alegaciones de salud. De hecho, la legislación europea relativa al etiquetado prohíbe hacer referencia a las propiedades preventivas, terapéuticas o curativas de los alimentos, incluso aunque haya pruebas científicas que las avalen.
Los aspectos reguladores y de etiquetado han de comprender dos consideraciones fundamentales: seguridad y consolidación de la alegación funcional o beneficio para la salud que comporta el consumo del alimento. En este sentido, se admite que las alegaciones funcionales deberían estar apoyadas en datos científicos basados en la totalidad de la evidencia (es decir, no restringidos a la alegación en concreto), obtenidos en ensayos clínicos realizados en humanos, doble ciegos al azar y con un grupo control (placebo). Además, tales estudios deben cumplir requerimientos estrictos, ser confirmados por grupos de investigación independientes y publicados en revistas de prestigio24,25.
Según la Acción concertada FUFOSE, puesta en marcha en 1995 como respuesta de la Comisión Europea a la expansión de los alimentos funcionales en el mercado, se distinguirán dos tipos de alegaciones de salud:
Alegaciones funcionales de mejora: asociadas a determinadas funciones fisiológicas y psicológicas y a actividades biológicas que van más allá de su papel establecido en el crecimiento, el desarrollo y otras funciones normales del cuerpo.
Alegaciones de reducción de riesgo de enfermedad: que se asocian a la reducción del riesgo de experimentar una determinada enfermedad o afección.
En cuanto a los prebióticos en sí mismos, los GOS son reconocidos como ingredientes alimentarios y no como aditivos por las autoridades de la Comunidad Europea. Los FOS también se clasifican legalmente como alimentos o ingredientes alimentarios naturales, reconocidos así por las autoridades legales de todos los países de la Comunidad Europea, pues se encuentran de forma natural en muchos de los alimentos de consumo habitual en la dieta de cualquier adulto (por ejemplo, puerro, ajo, cebolla, achicoria, etc.). Se les ha adjudicado el estatus de GRAS (Generally Recognised As Safe).
El 13 de diciembre de 2001 el Comité Científico de Alimentación de la Comunidad Europea redactó el "Informe adicional del uso de hidratos de carbono resistentes de cadena corta, oligofructosilsacarosa (FOS) y oligogalactosil-lactosa (GOS), en fórmulas de inicio y continuación"26 en el cual se concluye que:
No existe base científica que indique la existencia de efectos adversos por la inclusión de la mezcla de FOS y GOS en fórmulas de inicio y continuación.
No existe objeción en el uso de estos componentes en las fórmulas infantiles, tanto de inicio como de continuación, aunque se solicita que se presenten los resultados de los estudios que estaban en marcha en ese momento para ver el efecto a largo plazo.
Dichos estudios concluyeron con resultados positivos en la salud del lactante, lo que llevó al Comité Científico de Alimentación de la Comunidad Europea a concluir que la adición a las fórmulas infantiles de una mezcla de prebióticos en una concentración de 0,8 g/dl es segura (http://europe.eu.int/comm-food).
Estudios clínicos
Se ha realizado numerosos estudios clínicos tanto en adultos como en niños para ver el efecto prebiótico de los FOS y GOS27-32. Todos los estudios demostraron que los FOS y GOS son oligosacáridos prebióticos y tienen el potencial de incrementar el índice de bifidobacterias en el colon.
Pretérminos
Un estudio doble ciego, aleatorizado, realizado en niños pretérminos de aproximadamente 31 semanas de edad gestacional, comparó el efecto en el número de bifidobacterias fecales y lactobacillus tras la ingestión de una fórmula estándar o de una fórmula suplementada con 1 g/dl de prebiótico. Durante los 28 días que duró el estudio, el número de bifidobacterias fecales y lactobacillus aumentó en el grupo que recibió la fórmula infantil suplementada hasta valores similares a los que tenían los niños alimentados con LM. La diferencia en la composición de la flora fecal entre los dos grupos, fórmula estándar frente a fórmula con prebióticos, fue altamente significativa. De la misma manera, la consistencia y la frecuencia de las deposiciones fueron similares en el grupo con lactancia materna y el suplementado con prebióticos27.
A término
Un estudio doble ciego, aleatorizado, en el que 90 niños a término fueron alimentados bien con una fórmula estándar o con una fórmula suplementada con 0,4 o 0,8 g/dl de una mezcla de oligosacáridos que contenía inulina (10%) y GOS (90%). Los datos obtenidos se compararon con los de un grupo paralelo alimentado con LM. Tras los 28 días del estudio, el número de bifidobacterias fecales aumentó significativamente de modo dependiente de la dosis en el grupo de niños con fórmula suplementada. También aumentó significativamente el número de lactobacilos fecales en ese grupo, pero no fue dependiente de la dosis. El pH de las heces fue significativamente más bajo al final del estudio en los dos grupos con fórmula suplementada, respecto al grupo estándar, mientras que la consistencia y la frecuencia se incrementaron en un patrón dependiente de la dosis10,28.
Los niños que tomaron la fórmula estándar tenían las heces más duras y compactas en comparación con los que recibieron las fórmulas suplementadas, cuyas deposiciones tenían una consistencia más parecida a los alimentados con LM. Asimismo se comprobó que los niños que recibieron la fórmula suplementada con prebióticos a dosis de 0,8 g/dl tenían las heces más blandas que los que recibieron la fórmula suplementada con 0,4 g/dl.
De estos resultados se podría concluir que con una fórmula suplementada en 0,4 g/dl con una mezcla de oligosacáridos se consigue prevenir el estreñimiento, mientras que si lo que se quiere es tratar este estreñimiento se necesita administrar un fórmula con 0,8 g/dl de estos prebióticos7.
A pesar de estos resultados positivos y la supuesta inocuidad de la adición de prebióticos a las fórmulas infantiles, hasta la fecha son pocos los estudios publicados4. Rigo et al29 y Boehm et al8 señalan en sus series que el crecimiento cualitativo y cuantitativo en lactantes que recibieron una fórmula con prebióticos fue similar al de lactantes que recibieron lactancia materna o una fórmula estándar. Saavedra y Tschernia30 han apuntado una disminución en la incidencia de diarrea de origen viral y en las infecciones respiratorias de vías altas en lactantes que recibieron cereales suplementados con oligofructosa (1,1 g/día) entre los 4 y los 24 meses de edad.
En la revisión del contenido en nutrientes de las fórmulas infantiles, realizado por el panel de expertos de la Sociedad Americana de Ciencias de la Nutrición, se señala que hasta el momento no hay datos suficientes para establecer unos contenidos máximos o mínimos en las fórmulas infantiles2. Lo mismo ocurre para las fórmulas de pretérmino31. El Comité de Nutrición de la Sociedad Europea de Gastroenterología, Hepatología y Nutrición (ESPGHAN) se manifestó en 2004 de forma similar32.
Conclusiones
La colonización del intestino del recién nacido por una flora bifidógena es beneficiosa para el bebé. Le confiere propiedades protectoras frente a infecciones enterales y tiene también un efecto inmunomodulador en el sistema inmunitario intestinal. La LM es rica en oligosacáridos que favorecen el desarrollo de una flora bifidógena. Cuando se pretende conseguir este efecto en una fórmula infantil, es preciso recurrir a una mezcla de GOS y FOS. Su administración parece segura, aunque se precisan más estudios clínicos que avalen su eficacia en el tratamiento de lactantes con problemas digestivos. La Comisión Europea recomienda no superar los 0,8 g/100 ml, de una mezcla de 90% GOS y 10% FOS.