Ecología intestinal
Introducción
El ser humano vive rodeado de un medio con elevado contenido bacteriano. Una relación cordial, simbiótica, con estos microorganismos parece, pues, clave para la supervivencia. El intestino humano es el hábitat natural de un gran número de estas bacterias que constituyen la flora intestinal o microbiota (colectividad de comunidades microbianas que pueblan superficies mucosas). Esta flora intestinal está compuesta por alrededor de 1014 bacterias de 400 especies distintas y que llegan a alcanzar un peso de entre 300 y 600 g1. Mientras que el estómago y el intestino delgado contienen sólo un escaso número de bacterias adheridas al epitelio o en tránsito, más del 95% vive en la luz del colon.
La presencia de bacterias vivas en la luz del colon tiene un impacto importante en la fisiología del individuo: intervienen en el mantenimiento del epitelio colónico, en la integridad de la mucosa y en la absorción de vitaminas y minerales entre otras funciones. El hombre no podría vivir sin su flora. Animales de experimentación criados en condiciones de asepsia total, es decir, que no han adquirido su flora natural, no se desarrollan normalmente. La flora normal es un elemento clave en el desarrollo y el mantenimiento de la inmunidad sistémica y de las mucosas.
En algunas ocasiones, algunos elementos de la flora intestinal pueden ser fuente de infección y producir enfermedades, sobre todo cuando hay una alteración física o funcional de la barrera mucosa intestinal. Pero además, cambios cuantitativos en la flora intestinal pueden tener efectos importantes en las citocinas de la pared intestinal que, a su vez, influirán en el tipo de respuesta de células T que se generan ante los antígenos orales. Llama poderosamente la atención la explosión de enfermedades alérgicas y atópicas presente en los países desarrollados con alto nivel de higiene doméstica. Los recién nacidos nacen con un sistema inmunitario de predominio de células T helper (Th) 2. En edades muy tempranas, ante la exposición a las bacterias intestinales y a otros patógenos, la respuesta cambia a Th1, por la inducción de la interleucina (IL) 2. Se especula que, en ausencia de infecciones de la infancia, este cambio no se produce y se mantiene el tipo de respuesta Th2 con consecuencias clínicas manifiestas2.
Desarrollo de la flora intestinal normal
En la vida intrauterina, el intestino es un medio estéril, pero al nacer el recién nacido adquiere bacterias como bifidobacterias y lactobacilos del canal del parto. Los niños nacidos mediante cesárea se colonizan inicialmente por bacterias procedentes del medio ambiente hospitalario3. En recién nacidos por vía vaginal, encontramos bacterias en sus heces en el primer día de vida, generalmente Escherichia coli y Enterococcus spp. inicialmente, seguidos de Bifidobacterium spp. en los primeros 5 días4.
La composición de la flora intestinal del lactante es la siguiente: los niños que reciben lactancia materna tienen una flora en la que predominan bifidobacterias y bacterias productoras de ácido láctico, con pocos bacteroides, coliformes y clostridios. Por el contrario, los que reciben fórmulas infantiles tienen un mayor número de bacteroides, clostridios y otras bacterias entéricas. No obstante, el tamaño de estas poblaciones es muy variable5.
El conocimiento de la composición de la flora intestinal del recién nacido pretérmino es muy pobre, si lo comparamos con el recién nacido a término. Sus características principales son: un número bajo de especies bacterianas, típicamente tres especies en los primeros 10 días de vida6; las especies que se encuentran con mayor frecuencia son enterobacterias como E. coli y Klebsiella spp., enterococos como E. faecalis y estafilococos como Staphylococcus epidermidis, S. aureus y S. haemolyticus, y que persisten por largos períodos en la floral fecal de estos niños, mientras que el establecimiento de la flora anaerobia, en especial las bifidobacterias, es más tardío. Además el tipo de parto, a diferencia de lo que ocurre en el término, influye poco en el tipo de colonización, mientras que la alimentación con leche materna sí favorece el desarrollo de una flora bifidógena7.
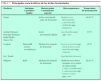
Hay un balance dinámico entre la comunidad bacteriana, la fisiología del huésped y la dieta: todos influyen en la colonización inicial, el desarrollo posterior y la estabilidad del ecosistema intestinal8. Los mecanismos que determinan el perfil de bacterias presentes en el intestino son poco conocidos. Algunos factores presentes en la leche materna, como la N-acetil-glucosamina, la glucosa, la lactoferrina, la galactosa, la fructosa y otros factores bifidogénicos pueden favorecer el crecimiento de bifidobacterias. El bajo contenido proteico parece ayudar en esta relación9. Estas diferencias tienden a desaparecer con la introducción de la alimentación complementaria, momento en el que comienza a aparecer la flora intestinal del adulto, más compleja. Los bacteroides y otras bacterias gramnegativas comienzan a predominar. A los 2 años de edad la flora establecida es ya prácticamente definitiva y permanece estable durante la vida del individuo (tabla 1). Existen, sin embargo, grandes variaciones cualitativas y cuantitativas entre individuos. Se conoce muy poco sobre los factores que controlan esta heterogenicidad. El uso de antibióticos o algunos cambios dietéticos producen cambios transitorios en esta composición.
Las técnicas habituales de cultivo sólo permiten conocer entre el 15 y el 50% de las bacterias presentes en el colon. Las nuevas técnicas de biología molecular (sondas de ácido ribonucleico, hibridación in situ, citometría de flujo o reacción en cadena de la polimerasa) proporcionan herramientas fiables para la identificación y la cuantificación de especies, lo que está contribuyendo a conocer con mayor profundidad las características individuales de la flora y su modificación por factores externos10.
Funciones de la microflora intestinal
Las bacterias del colon generan una gran acción metabólica, de tal manera que en su conjunto se constituyen en un órgano metabólico similar al hígado. Son diversas las acciones derivadas de la presencia de bacterias en el intestino grueso11,12.
La interacción de la microflora con el intestino tiene un impacto considerable tanto en los sistemas del huésped como en otras poblaciones bacterianas. Se ha podido estudiar estas complejas relaciones mediante el uso de animales libres de gérmenes, que han permitido comparar el efecto de las bacterias en estructuras o funciones fisiológicas, bioquímicas, anatómicas o inmunológicas (concepto MAC/GAC [Microflora-associated characteristics/germ-free animals characteristics])13.
Resistencia a la colonización
La microflora normal del intestino tiene la capacidad de impedir la implantación de patógenos. Esta función se conoce como efecto barrera intestinal. Esta resistencia a la colonización es un mecanismo inespecífico de defensa, mediado por mecanismos indirectos como el reconocimiento de los microbios a los que se ve expuesto tras el parto, y por mecanismos directos: competición por el mismo sustrato o por el mismo nicho ecológico, producción de sustancias tóxicas (bacteriocinas) o consumo de un microbio más pequeño (predación) o de mayor tamaño (parasitismo)14. El funcionamiento íntimo de estos mecanismos es poco conocido.
Factores que influyen en la colonización
El ecositema intestinal está formado por tres componentes principales en contacto permanente y con interacciones complejas: células del huésped, las bacterias intestinales y los nutrientes. La mayoría de la microflora no se adhiere directamente a la pared, sino que vive en biofilms asociada a partículas de comida, a moco o a células exfoliadas.
El moco lubrica y protege al epitelio intestinal de las bacterias y de la acción de la digestión. Está compuesto de mucinas capaces de atrapar a las bacterias de forma selectiva o indiscriminada. Los polímeros de mucina que constituyen el moco contienen glucoproteínas, cuya parte hidrocarbonada está formada por restos de diferentes azúcares: fucosa, galactosa, N-acetilglucosamina, N-acetilgalactosamina y ácido siálico. Esta porción de hidratos de carbono sirve como nutriente para la microflora, pero también como receptor para toxinas microbianas y como proteína de superficie. Hay un control genético individual de este repertorio de hidratos de carbono y es uno de los modos por los que los genes del huésped pueden utilizar la conducta de los microbios intestinales.
El sistema inmunológico intestinal
El sistema inmunológico intestinal, conocido también como tejido linfoide asociado a intestino (GALT), se encarga de procesar los antígenos que interaccionan con la mucosa intestinal y de diseminar la respuesta inmunitaria. Existen dos compartimentos separados en el GALT: los sitios inductivos, donde se inicia la respuesta inmunitaria tras la estimulación por parte de un antígeno y los sitios efectivos, que se ocupan de ejecutar y finalizar la respuesta inmunológica. Las placas de Peyer serían sitios inductivos, mientras que el epitelio intestinal se comportaría como un sitio efectivo. Además de los linfocitos de las placas de Peyer (células B-2) hay otros linfocitos peritoneales (células B-1) que tienen acción inductiva. En la mucosa intestinal se distinguen dos tipos de poblaciones linfocitarias: a) los linfocitos de la lámina propia, y b) los linfocitos intraepiteliales, situados entre los enterocitos a lo largo de la vellosidad.
La síntesis de anticuerpos requiere la cooperación de tres estirpes celulares. Las células presentadoras de antígeno (células dendríticas, células B y macrófagos) son capaces de capturar el antígeno, digerirlo y presentarlo a las células Th. Las células Th activadas actúan sobre los linfocitos B por medio de las citocinas excretadas. Dependiendo del tipo de señal, la célula B produce un tipo de anticuerpo (inmunoglobulina [Ig] G, IgA o IgE).
Hay varios tipos de células Th que se diferencian según el perfil de citocinas excretado. Las células Th1 producen fundamentalmente interferón alfa (IFN-α) y llevan a una producción inefectiva de anticuerpos por la célula B (IgG2). Las células Th1 están involucradas sobre todo en la inmunidad celular. Por el contrario, las células Th2 secretan un tipo diferente de citocinas que influyen directamente en la producción de anticuerpos por la célula B (IgG1). Ambas poblaciones son excluyentes.
La diferenciación de linfocitos T a Th1 o Th2 depende de señales específicas. Así, los macrófagos y las células dendríticas están involucrados en la diferenciación de Th0 a Th1 mediante la IL-12 y los linfocitos citolíticos realizan su papel produciendo IFN-α.
Para evitar el rechazo del feto durante el embarazo, el feto se mantiene en un contexto Th2 y debe desarrollar Th1 tras el nacimiento. Se desconoce el mecanismo que desencadena este cambio, aunque las bacterias intestinales pueden ser un factor importante. Si no se produce este cambio a Th1 en el período neonatal pueden presentarse problemas de alergia.
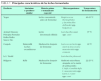
A diferencia de otras mucosas, el sistema inmunológico intestinal tiene que distinguir no sólo entre lo propio y lo no propio, sino también entre antígenos extraños peligrosos y antígenos alimentarios y responder en consecuencia. Se desconoce con exactitud cómo se desarrolla este mecanismo, pero en parte involucra la selección cuidadosa de poblaciones linfocitarias apropiadas y la expresión de citocinas. Hay que considerar además el papel relevante que desempeña la IgA secretora en la exclusión de antígenos de la luz intestinal. Estas características indican que el desarrollo y la expresión del sistema inmunológico intestinal difieren en gran medida de la inmunidad sistémica (tabla 2)15.
Junto con una respuesta celular, la función inmunitaria en el intestino se centra en dos respuestas específicas importantes:
Un papel protector, previniendo las respuestas inmunitarias a las proteínas de la dieta y evitando sensibilizaciones, en especial alergias y enfermedad inflamatoria intestinal (EII).
Inducción de respuestas inmunitarias específicas mediante la IgA secretora, excretada a la luz y con un papel relevante en la protección frente a la colonización por patógenos.
Interacciones entre el huésped y la microflora intestinal
La flora indígena y el intestino interaccionan de dos modos. Por una parte, la microflora es la principal carga antigénica que recibe el intestino, con la activación de las células B y T y la estimulación de su producción y, por otra, el establecimiento de un "diálogo" con receptores específicos de membrana en el enterocito, con una función inmunomoduladora.
Inducción del sistema inmunitario de la mucosa
El sistema inmunitario de individuos sanos está muy activado en respuesta a los antígenos alimentarios, a los patógenos y a la flora normal. Esto resulta en unos linfocitos de las placas de Peyer muy activados, una abundancia de células T CD8+ en el epitelio y de T CD4+ y células plasmáticas IgA en la lámina propia. Los datos procedentes de estudios en animales dejan claro que es la flora normal la que desencadena esta respuesta, y no los patógenos o los antígenos alimentarios16.
Los estudios sobre el sistema inmunitario de la mucosa de los recién nacidos permiten llegar a conclusiones semejantes a las obtenidas a partir de estudios con animales libres de gérmenes17,18. Al nacimiento ya hay placas de Peyer, pero sólo tienen folículos primarios de células B. Los centros germinales aparecen después de unas pocas semanas. El número de linfocitos intraepiteliales es bajo al nacimiento, pero alcanza los valores normales en pocos meses, especialmente los de las subclases αβ. Las células plasmáticas IgA no existen al nacimiento, pero aumentan en el primer año de vida; además en individuos normales las bacterias de las heces están recubiertas con IgA.
Interacciones entre la flora normal y el sistema inmunitario de la mucosa
El huésped está aislado y protegido del contenido intestinal potencialmente tóxico por una capa única de células epiteliales intestinales. La colaboración entre las bacterias comensales y el epitelio intestinal ayuda a crear un ecosistema complejo, con la modificación de la biología celular del epitelio del huésped19. Una característica de esta relación es que se produce una respuesta frente a organismos enteropatógenos, mientras que no ocurre frente a los microorganismos de la flora indígena. El mecanismo último no se conoce. En circunstancias de inflamación intestinal crónica, como ocurre en la EII, esta homeostasis puede romperse y los agentes de la flora microbiana habitual pueden convertirse en patógenos20.
Se precisa de la acción combinada de una serie de receptores presentes en la membrana extracelular conocidos como toll-like receptors (TLR) y de una familia de sensores proteicos intracelulares (nucleotide-binding oligomerization domain/ caspase recruitment domain [NOD/ CARD] para detectar las señales moleculares microbianas y para la inducción de la respuesta inmunitaria encaminada a mantener o restaurar la homeostasis en el huésped. Hay más de 10 TLR y más de 20 NOD, de las cuales sólo se conoce el ligando específico en unas cuantas. En los últimos años se ha descubierto que también las bacterias comensales actúan activando estos TLR, y que esta interacción es necesaria para mantener la integridad estructural de la mucosa intestinal. Quedan muchas preguntas por responder. ¿Cuál es el impacto fisiológico de la activación de los TLR por las bacterias no patógenas? ¿Qué vías de activación dependientes de TLR y qué genes participan en la homeostasis intestinal y, por el contrario, cuáles promueven la inflamación intestinal?
Tolerancia oral y alergia. La teoría de la higiene
La incidencia de enfermedades alérgicas se ha incrementado de forma importante en los últimos años. El desarrollo de estas enfermedades depende de factores hereditarios y de factores ambientales, como la exposición temprana a determinados alérgenos.
La inducción de tolerancia oral (hiporrespuesta inmunológica antígeno-específica) es la reacción normal tras la exposición a un antígeno alimentario y tiene un papel importante en la prevención de la alergia alimentaria. Tanto las placas de Peyer como el epitelio intestinal actúan como el sitio de inducción de la tolerancia oral. El antígeno va a interactuar con una célula presentadora del antígeno que, a su vez, los presenta a una célula Th (CD4+) nativa. Cuando se trata de un organismo patógeno, se induce una inflamación local debido a los efectos de productos derivados de los patógenos mediados por receptores específicos de membrana (los TLR) que se expresan en células mesenquimales, macrófagos y células epiteliales. El resultado es que las células dendríticas, tras capturar al antígeno, experimentan una maduración y producen IL-12, que favorece la diferenciación de las células CD4+ nativas hacia células Th1 que producen IFN-γ, más inflamación y, en menor medida, diferenciación también hacia células Th2 que producen IL-4 e IL-5, promotores de la respuesta local de IgA. Cuando, por el contrario, lo que capturan las células dendríticas son antígenos alimentarios o productos de la microflora intestinal, en ausencia de inflamación, se liberan PGE2 (células mesenquimales y macrófagos) y TGF-β (células epiteliales) que promueven la maduración parcial de células dendríticas. Éstas presentan el antígeno a células T CD4+ que se diferencian a células T reguladoras productoras de IL-10 y células Th3 que producen TGF-β. El resultado final es la producción local de IgA, la tolerancia sistémica y la homeostasis inmunológica local.
Cuando se produce un desequilibrio en este proceso, especialmente en recién nacidos o en lactantes pequeños con elevado riesgo alérgico, la exposición a una concentración elevada de proteínas extrañas puede aumentar el riesgo de sensibilización y desencadenar la respuesta alérgica.
Los cambios en las condiciones higiénicas y en los hábitos nutricionales son dos factores ambientales estrechamente relacionados con el estilo de vida occidental. Asistimos a un descenso en la incidencia de estimulación microbiana por enfermedades infecciosas como resultado de la mejora de las condiciones higiénicas, las campañas de vacunación y la medicación antimicrobiana. La dieta humana actual contiene una carga bacteriana considerablemente inferior a la que tradicionalmente tenía, fruto de la mejora del procesado industrial y de la conservación de los alimentos. Como resultado de estos cambios, los componentes de nuestro medio ambiente bacteriano no patogénico han cambiado de forma considerable. Este cambio podría ser la base del incremento notable de las enfermedades de causa inmunitaria, en especial las alergias, que venimos experimentando en los últimos años (teoría de la higiene).
La utilización de los probióticos en la prevención de alguna de estas enfermedades, en especial la atopia, cobra relevante interés21. La microbiota intestinal puede contribuir al procesado de antígenos alimentarios en el intestino y los prebióticos podrían modificar la estructura de antígenos potenciales y disminuir su capacidad inmunogénica. Además, la microflora intestinal contribuiría a la generación de una población de células Th capaces de inducir tolerancia oral22.