Los tumores primarios cerebrales son la neoplasia sólida más frecuente en la infancia. La base fundamental del tratamiento de estos pacientes es la cirugía, cuyo postoperatorio requiere ingreso en la unidad de cuidados intensivos pediátricos (UCIP). Los objetivos de nuestro trabajo son: conocer la epidemiología de los tumores que ingresan en nuestra unidad y analizar el postoperatorio de estos niños.
Pacientes y métodosEstudio prospectivo y retrospectivo de todos los niños intervenidos de tumor cerebral desde enero de 1998 hasta enero de 2007 en nuestro hospital. Se recogen datos referentes a filiación, características clínicas, tipo de intervención y postoperatorio.
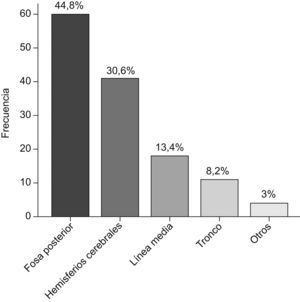
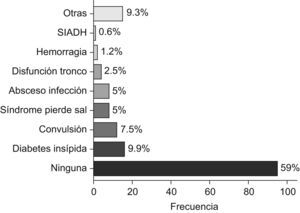
ResultadosSe revisan 161 postoperatorios, correspondientes a 134 pacientes (el 54,5%, varones). La media±desviación estándar de edad es 7 años y 8 meses±5 meses. La localización más frecuente es la fosa posterior (44,8%). El tipo histológico principal es el astrocitoma de grado bajo/intermedio (44,7%). La complicación más frecuente es la diabetes insípida (9,9%). La resección es total en el 58,4% de los pacientes. La mediana de estancia en UCIP es de 2 días (0-61 días). Fallecieron 3 pacientes tras la intervención.
ConclusionesLa epidemiología del grupo de pacientes que llega a UCIP es similar a la población general. La complicación más frecuente es la diabetes insípida.
Primary brain tumors are the most common solid tumors in children. Surgery is the basis of treatment for these patients, who require postoperative admission to the ICU-P. The aim of this study was to at the epidemiology of brain tumors of patients admitted to our ICU-P and to analyze the progress of these children in the postoperative period.
Patients and methodsRetrospective-prospective study of children admitted to our unit after brain tumor surgery between January 1998 and January 2007. We collected information such as, personal details, clinical characteristics, type of intervention and postoperative period.
ResultsWe reviewed 161 postoperative periods, corresponding to 134 patients (54.5% male). The mean age was 7 years and 8 months±5 months. The most common location was the posterior fossa (44.8%). The most common histological type was low grade/intermediate astrocytoma (44.7%). The most frequent complication was diabetes insipidus (9.9%). Resection was complete in 58.4% patients. The median stay in the ICU-P was 2 days (0–61 days). 3 patients died after surgery.
ConclusionsThe epidemiology of the group of patients admitted to our ICU-P is similar to the general population. The most common complication is diabetes insipidus.
Los tumores primarios del sistema nervioso central son la segunda neoplasia maligna más frecuente en niños y adolescentes. La mortalidad de estos pacientes, sin tratamiento, se aproxima al 45%1. Además, presentan la morbilidad más importante, sobre todo neurológica, de todos los tumores malignos infantiles1. No obstante, el pronóstico ha mejorado con el tiempo, sobre todo por el avance en las técnicas de neurocirugía y en la radioterapia y por la introducción de la quimioterapia como opción terapéutica2–6.
El tratamiento de estos pacientes es multidisciplinario, y la resección quirúrgica es su base fundamental. El postoperatorio requiere prácticamente siempre ingreso en unidad de cuidados intensivos pediátricos (UCIP) para monitorizar la evolución y tratar las complicaciones que puedan surgir7.
Las complicaciones postoperatorias dependen fundamentalmente del estado clínico antes, durante y en el postoperatorio, la localización y el tipo de cirugía realizada8–10.
Entre los cuidados generales que deben tenerse ante un paciente operado de tumor cerebral que llega a la UCIP procedente del quirófano destaca mantener la cabeza elevada en 30° en posición centrada, sedoanalgesia con fármacos de vida media corta que permitan valorar el estado de conciencia del niño, control estrecho de los electrolitos con soluciones de perfusión adecuadas que permitan mantener concentraciones de Na >135mEq/l, asegurar la normoventilación y la normooxigenación, mantener la presión arterial normal evitando cambios bruscos que puedan alterar la perfusión cerebral, administrar, si se considera necesario (cirugía cortical), medicación antiepiléptica, protección gástrica con ranitidina, profilaxis antibiótica, corticoterapia si hay riesgo de edema cerebral o herniación trastentorial y control de los drenajes8,11–13.
La monitorización neurológica de estos pacientes debe ser estrecha, el paciente habitualmente llega a la UCIP sedado e intubado, por lo que la valoración clínica en un primer momento puede estar limitada a la respuesta a estímulos verbales y dolorosos y a la reactividad pupilar. En cuanto se pueda retirar los sedantes se debe evaluar la escala de Glasgow, los pares craneales, la motilidad y el tono muscular y la sensibilidad14.
Asimismo, hay que realizar un control estrecho de la frecuencia cardíaca, electrocardiograma, frecuencia respiratoria, pulsioximetría, diuresis (balance hídrico), presión arterial y, en algunos casos, presión venosa, así como controles analíticos (hemograma, ionograma, osmolaridad en sangre y orina, coagulación), y vigilar de manera especial la aparición de alteraciones hidroelectrolíticas, sobre todo hiponatremia8.
Si hay riesgo de hipertensión endocraneal debe monitorizarse la presión intracraneal (PIC)8.
Los objetivos del trabajo son conocer la epidemiología de los tumores cerebrales que ingresan en nuestra UCIP y analizar la evolución habitual en el postoperatorio de estos niños.
Pacientes y métodosSe trata de un estudio doble vía sistemático, retrospectivo, desde enero de 1998 hasta junio de 2004, y prospectivo, desde julio de 2004 hasta enero de 2007, de todos los niños intervenidos de tumor cerebral en el Hospital Pediátrico de Sant Joan de Déu de Esplugues de Llobregat, en Barcelona.
Se recoge la filiación del paciente, la presencia o no de hidrocefalia y la necesidad de derivación ventricular previa a la cirugía, el tipo y localización del tumor, el tipo de resección, tratamiento administrado en UCIP (profilaxis anticonvulsiva, antibiótica y antiedematosa), complicaciones en el postoperatorio, necesidad de reintervención inmediata, días hasta la extubación y hasta el alta definitiva de UCIP y Glasgow Outcome Scale (GOS) al alta de UCIP y a los 6 meses.
Los datos son analizados mediante el programa estadístico SPSS (versión 15.0).
ResultadosSe revisa un total de 161 postoperatorios que corresponden a 134 pacientes, 9 de ellos habían sido intervenidos por primera vez antes de 1998.
Hay un predominio de varones (54,5%). La media±desviación estándar de edad es de 7 años y 8 meses±5 meses.
La estancia en UCI tras la intervención tiene una mediana de 2 (intervalo, 0-61) días.
La localización de los tumores se muestra en la figura 1.
El tipo histológico más frecuente es el astrocitoma de bajo grado/intermedio (44,7%), seguido de meduloblastoma (10,4%), astrocitoma de alto grado (7,5%), gliomas mixtos (7,5%) y tumores ependimarios (6,7%).
Un 48,4% de los tumores intervenidos presentaba hidrocefalia secundaria previa a la cirugía y a un 78,2% de éstos había sido necesario practicarles derivación de LCR (derivación externa o ventriculoperitoneal) antes de la intervención.
La mediana de días hasta la extubación fue 1 día (intervalo, 0–92 días).
Presentaron complicaciones el 41% de las intervenciones (fig. 2). La complicación más frecuente fue la diabetes insípida (n=16; 9,9%) que se dio principalmente en astrocitomas de fosa posterior (n=6) y en tumores de línea media (n=5). Respecto a las otras complicaciones hidroelectrolíticas, se dieron 8 casos de síndrome de pérdida de sal en astrocitomas de fosa posterior (n=6) y hemisferios cerebrales (n=2). Por último, hubo un único caso de SIADH en un astrocitoma pilocítico de fosa posterior.
La resección fue total en el 58,4% de los pacientes. La resección suele ser completa en los tumores de hemisferios cerebrales (77,8%) y fosa posterior (60%), mientras que en los de tronco se practicaron resecciones parciales en el 87,5% de los pacientes y en los de línea media, en el 64,7%.
No hubo que realizar reintervenciones inmediatas (primeras 48 horas tras la intervención quirúrgica), aunque se tuvo que reintervenir a 2 pacientes a los 4 días por hematoma epidural secundario a la intervención, ambos tenían tumores de fosa posterior. La evolución ulterior de ambos fue favorable.
Respecto al tratamiento administrado tras la intervención quirúrgica, el 88,6% de los postoperados recibió tratamiento corticoideo con dexametasona para tratar el edema cerebral; el 95%, profilaxis antibiótica con cefazolina, y el 44,1%, tratamiento anticonvulsivo, la mayoría con fenitoína.
Se administró profilaxis anticonvulsiva en el 89,4% de las intervenciones de tumores de los hemisferios cerebrales, en el 57,7% de las de línea media, el 20% de las de tronco y el 14,4% de las de fosa posterior. Se presentaron 11 casos de convulsiones tras la intervención, 6 en niños afectos de tumores en los hemisferios cerebrales, 2 de la línea media y 3 de la fosa posterior. El 100% de los primeros estaban recibiendo profilaxis anticonvulsiva, ninguno del segundo grupo y sólo 1 caso del tercero.
De los 5 pacientes con convulsiones y que el tumor no estaba en los hemisferios cerebrales, en 4 fue en el contexto de hiponatremia. La cifra de natremia de estos pacientes estaba comprendida entre 116 y 125mEq/l.
En la tabla 1 se muestra el estado neurológico al alta de la UCIP y a los 6 meses de la intervención, donde se observa que en la mayoría de los casos el estado neurológico mejora con el tiempo. Para evitar sesgos se ha tenido en cuenta únicamente la primera intervención en el período de estudio (n=125). Se evidencia que los tumores con mejor pronóstico funcional son los de fosa posterior y hemisferios cerebrales.
Estado neurológico (escala de GOS) al alta y a los 6 meses según localización del tumor (n=125).
| Localización | Alta (UCIP) | 6 meses | |||||
| Secuelas graves | Secuelas leves | Normal | Muerte | Secuelas graves | Secuelas leves | Normal | |
| Fosa posterior | 9 | 40 | 11 | 0 | 8 | 24 | 28 |
| Tronco cerebral | 3 | 5 | 0 | 0 | 3 | 4 | 1 |
| Línea media | 4 | 6 | 7 | 1 | 2 | 7 | 7 |
| Hemisferios cerebrales | 4 | 7 | 25 | 2 | 2 | 4 | 28 |
| Otros | 0 | 3 | 1 | 0 | 0 | 3 | 1 |
Teniendo en cuenta todas la intervenciones realizadas (n=161), 3 pacientes fallecieron tras la intervención. Un varón de 13 años con recidiva, 11 años después, de un astrocitoma de bajo grado en el tronco del encéfalo, que al realizar la extirpación del tumor residual se obtuvo abundante líquido xantocrómico a tensión, desarrolló clínica de hipertensión endocraneana grave y falleció a los 2 días. El segundo caso se trata de una paciente con una recidiva en tronco del encéfalo de un ependimoma anaplásico localizado primariamente en la fosa posterior, que desarrolló clínica de disfunción del tronco progresiva e irrecuperable tras la intervención. El tercer paciente era una niña de 6 meses con diagnóstico prenatal de teratoma intracraneal que falleció tras la segunda intervención en la que, debido a la gran extensión en línea media de la tumoración, únicamente se realizó una resección parcial.
Un paciente quedó en estado vegetativo tras la tercera intervención; era un varón de 5 meses con un teratoma de línea media de muy mal pronóstico.
DiscusiónLa cirugía es el eje principal del tratamiento de los tumores cerebrales en la infancia. El postoperatorio de estos tumores requiere una monitorización neurológica, hemodinámica, respiratoria y analítica estrecha, por lo que es necesario que se realice en una UCIP adecuadamente preparada1,8.
La epidemiología de los tumores cerebrales intervenidos en nuestro centro traduce la epidemiología en la población infantil general: ligero predominio de los de localización infratentorial y astrocitoma de bajo grado como tumor más prevalente15,16.
EL 41% de los postoperatorios de la serie cursa con complicaciones. Las más frecuentes son los trastornos hidroelectrolíticos (diabetes insípida, síndrome de pérdida de sal y SIADH), de lo que se deriva la importancia de realizar un control estrecho del ionograma y del balance hídrico en estos pacientes.
Por su localización anatómica, los tumores cerebrales son de difícil extirpación5, este hecho ha podido constatarse en nuestra serie, en la que únicamente el 58,4% de los tumores ha podido resecarse completamente tras la primera intervención.
Respecto al tratamiento profiláctico tras la intervención, se han seguido las recomendaciones de realizar tratamiento corticoideo y antibiótico a todos los pacientes y tratamiento anticonvulsivo en todos los tumores supratentoriales8.
Las convulsiones en los tumores de fosa posterior y línea media suelen ser secundarias a hiponatremia, por lo que se debe insistir en la importancia de la detección y la corrección rápida de las alteraciones hidroelectrolíticas.
Los tumores cerebrales en la infancia entrañan una importante morbimortalidad, como puede extraerse del estado neurológico de los pacientes tras el alta de UCIP. La localización del tumor es una de las variables que más influyen en el pronóstico tras la intervención quirúrgica, ya que aquellos que presentan más dificultad en su resección (línea media y tronco) son también los que tienen un peor pronóstico.
El resultado de la intervención y la evaluación del estado neurológico deben demorarse unos meses, ya que en los primeros días todavía hay disfunciones y trastornos del acto quirúrgico que distorsionan el pronóstico, este hecho se ha podido constatar en nuestra serie, en la que se observa una mejora significativa del GOS a los 6 meses respecto al del alta de la UCIP.