Mycoplasma pneumoniae (MP) es una bacteria con características peculiares que produce un amplio espectro de manifestaciones clínicas, siendo la infección respiratoria la más frecuente de ellas. Se presenta en epidemias cíclicas, percibiendo los pediatras en España un incremento de casos desde enero del 2024 y poniéndose en marcha registros hospitalarios (no es una enfermedad de declaración obligatoria en nuestro medio). El diagnóstico de la infección por MP se realiza mediante la determinación de serologías y/o la detección de material genético mediante reacción en cadena de polimerasa (PCR). Ambas son incapaces de diferenciar la colonización de la infección activa, por lo cual el diagnóstico preciso no es posible y deben solicitarse solo en caso de alta sospecha clínica. El papel del tratamiento antibiótico en la infección por MP en sus diferentes variantes clínicas no está bien definido. La mayoría de las infecciones son autolimitadas y leves, sin evidencia suficiente en favor de la antibioterapia en estos casos. El tratamiento antibiótico estaría justificado en pacientes con factores de riesgo para desarrollo de formas graves (síndrome de Down, asplenia anatómica o funcional, inmunodepresión), en los pacientes hospitalizados con infección respiratoria y en pacientes con formas extrapulmonares moderadas o graves. Considerando aspectos referentes a la optimización del uso de antimicrobianos, el tratamiento de elección sería claritromicina, siendo alternativo el uso de azitromicina; y reservando el uso de doxiciclina y levofloxacino para los casos de resistencias antimicrobianas y/o infecciones del sistema nervioso central.
Mycoplasma pneumoniae (MP) is a bacterium with particular characteristics that give rise to a broad clinical spectrum, and respiratory infection is the most frequent presentation. Infection by MP occurs in cyclical epidemics, and paediatricians in Spain have noticed an increase in cases since January 2024, establishing hospital registers to collect surveillance data (as it is not a notifiable disease in Spain). The diagnosis of infection by MP is made through serological testing and/or the detection of genetic material by means of polymerase chain reaction (PCR). Neither methods can differentiate between colonization and active infection, so a precise diagnosis is not possible and testing should only be requested in the case of high clinical suspicion. The role of antibiotherapy in infection by MP in its different clinical variants is not well defined. Most infections are self-limiting and mild, and there is insufficient evidence to support the use of antibiotherapy in these cases. Antibiotic treatment is justified in patients with risk factors for the development of severe disease (Down syndrome, anatomical or functional asplenia, immunosuppression), in hospitalized patients with respiratory infection and in patients with moderate or severe extrapulmonary forms. Taking into account aspects concerning the rational use of antimicrobials, the treatment of choice would be clarithromycin, with azithromycin as an alternative, reserving the use of doxycycline and levofloxacin for cases of antimicrobial resistance and/or infections of the central nervous system.
El presente documento aborda el uso racional de pruebas diagnósticas y antimicrobianos en el manejo de la infección por Mycoplasma pneumoniae (MP) en niños, basado en la evidencia disponible.
¿Qué es Mycoplasma pneumoniae?Es una bacteria perteneciente a la clase Mollicutes, carente de pared celular1. Se transmite mediante contacto a través de gotas respiratorias, con un periodo de incubación de 2-4 semanas. La inmunidad tras la infección no es duradera, siendo frecuentes las reinfecciones1. El estado de portador asintomático puede perdurar durante meses, incluso en pacientes tratados con antibióticos1.
MP tiene mecanismos de virulencia que le confieren afinidad al epitelio respiratorio, capacidad de daño directo, supervivencia superficial e intracelular e interacciones diversas con el sistema inmunitario. Su patogenia se produce por: efectos directos de la bacteria, efectos indirectos inmunomediados y efectos mediados mediante vasculitis o trombosis.
¿Cuál es el escenario epidemiológico actual?MP sigue un patrón epidémico cíclico cada 3-5 años, presentándose habitualmente en verano o inicios del otoño2. Durante las medidas aplicadas para el control de la pandemia COVID-19 se objetivó una reducción significativa de las infecciones por MP3. A diferencia de lo ocurrido con otros patógenos respiratorios, MP no ha resurgido inmediatamente tras la retirada de estas medidas3, evidenciándose su incremento desde enero de 2023, con cifras ascendentes hacia el segundo semestre del 2023 en distintos países de América, Europa, Oceanía y Asia2.
China ha reportado un incremento relevante de los casos desde junio del 2023, alcanzando hasta un 61% de positividad en muestras de niños con afección respiratoria4. Esta epidemia actual en China muestra mayor porcentaje de resistencias a macrólidos (RM), mayor gravedad e incremento de la incidencia en menores de 3 años en comparación con años previos4.
En España no se cuenta con datos precisos al no tratarse de una enfermedad de declaración obligatoria. Sin embargo, desde enero del 2024 los pediatras hemos notado un incremento de los casos, de ingresos hospitalarios y de formas extrapulmonares, algunas graves. Está por determinar si ese incremento observado es proporcional al aumento de casos total o si estamos siendo testigos de circulación de cepas más patógenas. Se han puesto en marcha registros hospitalarios para la descripción y vigilancia epidemiológica de esta entidad.
Definición de caso clínico de infección por M. pneumoniae y factores de riesgoResumen ejecutivo en la tabla 1.
Definición de caso clínico de infección por M. pneumoniae y factores de riesgo
| A. ¿Cuál es la presentación clínica de la infección porM. pneumoniae? | |
|---|---|
| Infección/colonización asintomática | |
| • Frecuencia variable estimada entre ≤3% hasta un 50%4, pudiendo durar meses tras la infección. | |
| • La antibioterapia no estaría indicada dado que no reduce la excreción ni la transmisión. | |
| Infección sintomática | |
| • Infección de las vías respiratorias (tabla 2). | |
| Forma de presentación más frecuente. Producidas mayoritariamente por efectos directos de la bacteria. El curso es benigno en la mayor parte de los casos. | |
| • Manifestaciones extrapulmonares (tabla 2). | |
| Ocurren en aproximadamente en un 25% de los casos. Producidas mayoritariamente por efectos indirectos inmunomediados o efectos secundarios a vasculitis o trombosis. Aunque el beneficio del tratamiento antibiótico es discutible, la gravedad y la morbimortalidad asociada a cada manifestación justificará o no el inicio de la antibioterapia, siendo tan o más importante, si cabe, el tratamiento específico y adyuvante de cada manifestación (ver “Tratamiento”). | |
| B. ¿Cuál es la definición de caso confirmado de infección porM. pneumoniae? | |
| Clínica compatible+alguno de los siguientesa: | |
| • Detección directa de M. pneumoniae: | - PCR respiratoria/sangre/líquido cefalorraquídeo |
| - Test de antígenosb | |
| - Cultivob | |
| • Contacto con M. pneumoniae: | - Serología: Seroconversión por aparición de IgM específicac o aumento >4 veces del título de IgG en 2 muestras separadas al menos 2 semanas |
| - Respuesta de células secretoras de anticuerposb | |
| C. ¿Cuáles son los factores de riesgo para el desarrollo de formas graves? | |
| • Se consideran factores de riesgo para el desarrollo de neumonía grave por M. pneumoniae la asplenia anatómica o funcional, la anemia de células falciformes, el síndrome de Down y los estados de inmunosupresión. | |
| • La afectación del sistema inmune humoral incrementa el riesgo de enfermedad respiratoria grave y prolongada, así como el desarrollo de formas extrapulmonares. | |
La definición de caso confirmado se realiza por convención práctica con estos criterios, teniendo en consideración la dificultad para el diagnóstico microbiológico de la infección por M. pneumoniae (ver “Métodos diagnósticos”).
Técnicas diagnósticas no disponibles de forma rutinaria en la práctica clínica fuera del entorno de la investigación.
Una IgM aislada no permite un diagnóstico de seguridad, solo de alta probabilidad si el cuadro clínico es compatible y no hay otro diagnóstico alternativo. En la práctica, si no se tiene una IgM previa, habría que confirmar seroconversión IgG (si IgG negativa) o aumento de los títulos de IgG (en caso de IgM e IgG positivas) a las 2 semanas.
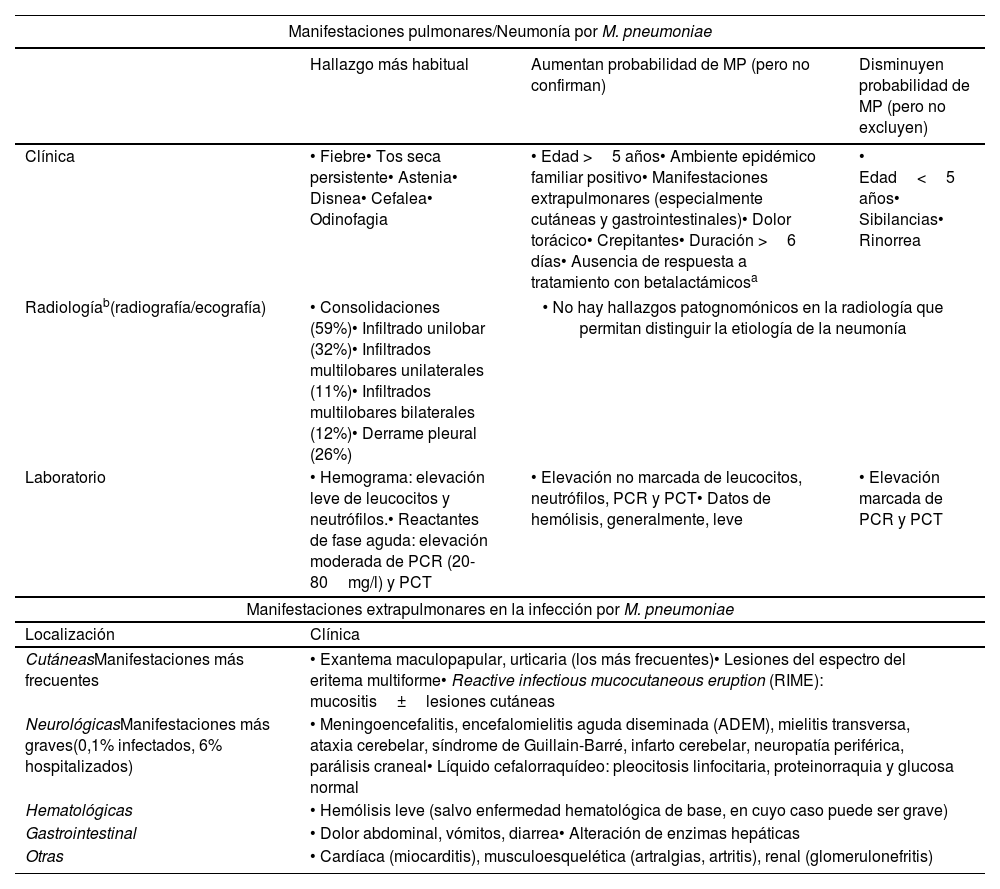
La presentación clínica más frecuente es la infección respiratoria que incluye: infección de vías altas, traqueobronquitis y neumonía. Las manifestaciones extrapulmonares se presentan en aproximadamente uno de cada 4 pacientes (tabla 2)5.
Manifestaciones pulmonares y extrapulmonares de la infección por M. pneumoniae
| Manifestaciones pulmonares/Neumonía por M. pneumoniae | |||
|---|---|---|---|
| Hallazgo más habitual | Aumentan probabilidad de MP (pero no confirman) | Disminuyen probabilidad de MP (pero no excluyen) | |
| Clínica | • Fiebre• Tos seca persistente• Astenia• Disnea• Cefalea• Odinofagia | • Edad >5 años• Ambiente epidémico familiar positivo• Manifestaciones extrapulmonares (especialmente cutáneas y gastrointestinales)• Dolor torácico• Crepitantes• Duración >6 días• Ausencia de respuesta a tratamiento con betalactámicosa | • Edad<5 años• Sibilancias• Rinorrea |
| Radiologíab(radiografía/ecografía) | • Consolidaciones (59%)• Infiltrado unilobar (32%)• Infiltrados multilobares unilaterales (11%)• Infiltrados multilobares bilaterales (12%)• Derrame pleural (26%) | • No hay hallazgos patognomónicos en la radiología que permitan distinguir la etiología de la neumonía | |
| Laboratorio | • Hemograma: elevación leve de leucocitos y neutrófilos.• Reactantes de fase aguda: elevación moderada de PCR (20-80mg/l) y PCT | • Elevación no marcada de leucocitos, neutrófilos, PCR y PCT• Datos de hemólisis, generalmente, leve | • Elevación marcada de PCR y PCT |
| Manifestaciones extrapulmonares en la infección por M. pneumoniae | |||
| Localización | Clínica | ||
| CutáneasManifestaciones más frecuentes | • Exantema maculopapular, urticaria (los más frecuentes)• Lesiones del espectro del eritema multiforme• Reactive infectious mucocutaneous eruption (RIME): mucositis±lesiones cutáneas | ||
| NeurológicasManifestaciones más graves(0,1% infectados, 6% hospitalizados) | • Meningoencefalitis, encefalomielitis aguda diseminada (ADEM), mielitis transversa, ataxia cerebelar, síndrome de Guillain-Barré, infarto cerebelar, neuropatía periférica, parálisis craneal• Líquido cefalorraquídeo: pleocitosis linfocitaria, proteinorraquia y glucosa normal | ||
| Hematológicas | • Hemólisis leve (salvo enfermedad hematológica de base, en cuyo caso puede ser grave) | ||
| Gastrointestinal | • Dolor abdominal, vómitos, diarrea• Alteración de enzimas hepáticas | ||
| Otras | • Cardíaca (miocarditis), musculoesquelética (artralgias, artritis), renal (glomerulonefritis) | ||
MP: Mycoplasma pneumoniae; PCR: proteína C reactiva; PCT: procalcitonina.
En la neumonía por MP los síntomas más frecuentes son: fiebre (86-96%), tos seca persistente (85-96%), astenia (78%), disnea (67%), cefalea (11-48%) y odinofagia (12-47%), siendo los crepitantes el signo más detectado en la auscultación5. Estos datos son inespecíficos y superponibles con otros patógenos. Los datos que aumentan o disminuyen la probabilidad de infección por MP se presentan en la tabla 2, aunque ninguno de ellos de forma aislada ni conjunta es suficiente para establecer un diagnóstico de certeza2,5,6.
¿Cuál es la definición de caso confirmado de infección por M. pneumoniae?Para considerar confirmado un caso sospechoso de infección por MP se precisa la detección de MP o demostrar una respuesta serológica compatible (tabla 1.B)2, ya que las manifestaciones clínicas, radiológicas y analíticas son insuficientes para establecer un diagnóstico. A su vez, los resultados microbiológicos y serológicos tienen sus limitaciones y han de interpretarse siempre en un marco clínico, puesto que no siempre es posible diferenciar entre infección y colonización asintomática o infección concomitante por otro patógeno7.
¿Cuáles son los factores de riesgo para el desarrollo de formas graves?Las infecciones por MP suelen ser leves y muchos pacientes no requieren hospitalización, pero también pueden causar neumonía o manifestaciones extrapulmonares graves.
Tienen más riesgo de tener una neumonía grave los niños con asplenia anatómica o funcional (como en la enfermedad de células falciformes), los niños con síndrome de Down y los afectados por ciertos estados de inmunodepresión (tabla 1C)8.
Por otra parte, aunque los determinantes de virulencia se conocen de forma muy parcial, la gravedad de la enfermedad pulmonar puede estar relacionada con la cepa infectante y la concentración de la toxina producida por algunas cepas8.
En líneas generales, podemos decir que, como en otros tipos de infecciones, las características y la magnitud de la respuesta inmune del huésped y su competencia pueden afectar mucho la expresión clínica de la enfermedad respiratoria por MP y de la multitud de complicaciones extrapulmonares que pueden ocurrir. Durante años se ha estudiado ampliamente la inmunidad del huésped que involucra a macrófagos, mastocitos, neutrófilos y células natural killer (NK), así como a linfocitos T y B y respuestas inmunes humorales. Aunque la respuesta humoral a la infección no proporciona inmunidad completa frente a infecciones futuras, la importancia de un sistema inmunológico humoral intacto en la contención de la enfermedad es evidente. Las personas con deficiencia de anticuerpos pueden desarrollar enfermedades respiratorias graves y prolongadas y el riesgo de complicaciones extrapulmonares como meningitis y artritis también aumenta9.
Métodos diagnósticosResumen ejecutivo en la tabla 3.
Métodos diagnósticos
| A. ¿Cuáles son los métodos de diagnóstico microbiológico paraM. pneumoniaeen nuestro medio? |
| • Las pruebas disponibles en nuestro medio para el diagnóstico microbiológico de infección por M. pneumoniae son la determinación de serologías (seroconversión por aparición de IgM específica o aumento >4 veces del título de IgG en dos muestras separadas al menos 2 semanas) y la detección de material genético mediante reacción en cadena de la polimerasa (PCR) en muestra respiratoria (habitualmente en aspirado nasofaríngeo). |
| • Tanto la serología como la detección mediante PCR son incapaces de diferenciar la colonización de la infección activa, por lo cual el diagnóstico preciso no es posible. |
| • La combinación de 2 técnicas diagnósticas como la detección mediante PCR junto a la determinación serológica (aparición de IgM o incremento de títulos de IgG) aumentan la precisión del diagnóstico, pero requieren un tiempo prolongado en la práctica clínica (3-4 semanas). |
| • La respuesta de células secretoras de anticuerpos diferenciaría infección de colonización, pero en el momento actual no está disponible fuera del ámbito de investigación. |
| • El uso de otras pruebas como el cultivo o el test de antígenos no se realizan de forma rutinaria. |
| B. ¿En qué casos se debe solicitar PCR en muestra respiratoria y/o serologías paraM. pneumoniae? |
| • Para maximizar la rentabilidad diagnóstica se recomienda solo solicitar las pruebas cuando exista una elevada sospecha diagnóstica (alta probabilidad pre-test) y el diagnóstico vaya a modificar su manejo (ver punto 4). |
| • No se recomienda la realización de pruebas diagnósticas en el manejo ambulatorio de las neumonías en niños sanos en los que el tratamiento empírico suele ser efectivo, incluso aunque no incluya antibióticos activos frente a M. pneumoniae. |
| • Estaría indicado un diagnóstico microbiológico en: |
| ∘ Sospecha de neumonía atípica con enfermedad moderada/grave que requiera hospitalización (PCR o serologías o ambas). |
| ∘ Pacientes con neumonía atípica que tengan factores de riesgo para el desarrollo de formas graves (ver tabla 1.C) (PCR, serologías o ambas). |
| ∘ Pacientes con neumonía grave que precise ingreso en cuidados intensivos (PCR, serologías o ambas). |
| ∘ Neumonía típica o indeterminada que presenten mala respuesta a betalactámicos tras 48-72h de tratamiento, tras descartar complicaciones (PCR, serologías o ambas). |
| ∘ Presencia de otros síndromes respiratorios (bronquitis, exacerbación asmática) que no responda a tratamiento habitual (PCR, serologías o ambas). |
| ∘ Presencia de manifestaciones extrapulmonares de M. pneumoniae, si presenta síntomas respiratorios acompañantes y en los pacientes con manifestaciones más graves (neurológicas, cutáneas, cardiacas) (PCR, serologías o ambas). |
| ∘ Muestras respiratorias profundas obtenidas por lavado bronquioalveolar (PCR) donde entre en el diagnóstico diferencial. |
| ∘ Cuando por cuestiones epidemiológicas se precisen aislamientos por cohortes (PCR). |
| ∘ Estudio de brotes (PCR y serología). |
| C. ¿En qué casos se debe solicitar PCR paraM. pneumoniaeen muestras no respiratorias? |
| • La realización de PCR en muestras no respiratorias no se realiza de forma sistemática y no está validada en la mayor parte de los casosa. |
| • En aquellas localizaciones con manifestaciones clínicas producidas por daño directo se puede intentar la identificación del patógeno mediante PCR, no siendo así en aquellas manifestaciones de mecanismo inmune (tabla 6). |
| • La detección mediante PCR de material genético de M. pneumoniae en muestra no respiratoria carece de valor pronóstico, no modificaría el plan de actuación y podría plantearse como complementaria al diagnóstico realizado en muestra respiratoria o mediante serología. |
| D. ¿En qué casos se debe solicitar pruebas de imagen y cuáles serían de elección? |
| • En nuestro medio, el patrón de oro para el diagnóstico de la neumonía adquirida en la comunidad, incluyendo la neumonía por M. pneumoniae, es la radiografía de tórax. |
| • Ningún patrón identificado en la radiografía de tórax permite distinguir la etiología de la neumonía, por lo cual su valor añadido con esta finalidad es limitado. |
| • La radiografía de tórax estará indicada también cuando se sospeche alguna complicación de la neumonía, cuando no se tenga el diagnóstico clínico de neumonía y se precise en el contexto del diagnóstico diferencial del paciente, para descartar otros posibles diagnósticos y en el caso de ingreso hospitalario. |
| • La ecografía pulmonar es una opción adecuada, que no irradia, para el diagnóstico de neumonía y la identificación de complicaciones como el derrame pareneumónico si se realiza por personas con formación específica. |
Actualmente no existe ninguna prueba de laboratorio que pueda servir de forma aislada para el diagnóstico de la infección pulmonar por MP. Aunque existen algunos signos clínicos y radiológicos asociados de forma característica en la infancia, es imposible diferenciar con seguridad una neumonía comunitaria por MP de las producidas por otros patógenos2,10.
Por otro lado, las distintas pruebas para el diagnóstico microbiológico disponibles actualmente ofrecen, en general, una información que resulta difícil de interpretar.
La muestra respiratoria ideal para el estudio etiológico de una infección pulmonar debería adquirirse mediante lavado broncoalveolar, líquido pleural, biopsia pulmonar o aspiración traqueal, técnicas no realizadas de forma rutinaria. En la práctica, las muestras obtenidas suelen ser a distancia del foco primario de la infección (vía aérea superior) o muestras indirectas de infección (serologías), induciendo un resultado subóptimo en términos de sensibilidad y valores predictivos11.
Numerosos trabajos indican que la positividad de alguna de estas pruebas no se asocia necesariamente a infección activa por MP, lo que compromete enormemente su valor predictivo positivo2,10,12. Por otra parte, y para que resulte aún más complicado, la negatividad de una sola prueba tampoco permite descartar con seguridad la participación etiológica de MP13.
Por todas estas dificultades en la interpretación de los resultados, es muy recomendable que el estudio etiológico se reserve para aquellos pacientes en los que exista una sospecha clínica elevada de infección de acuerdo con las características clínicas ya mencionadas. La combinación de pruebas para intentar mejorar la exactitud del diagnóstico etiológico (serología pareada+PCR) no es coste/efectiva en la práctica clínica habitual y no se recomienda fuera del ámbito de la investigación.
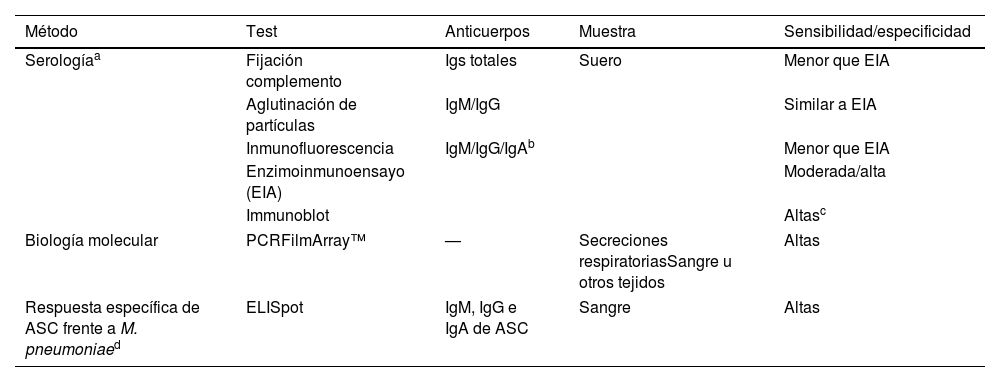
Las pruebas disponibles se resumen en la tabla 4.
Pruebas disponibles para el diagnóstico microbiológico de M. pneumoniae
| Método | Test | Anticuerpos | Muestra | Sensibilidad/especificidad |
|---|---|---|---|---|
| Serologíaa | Fijación complemento | Igs totales | Suero | Menor que EIA |
| Aglutinación de partículas | IgM/IgG | Similar a EIA | ||
| Inmunofluorescencia | IgM/IgG/IgAb | Menor que EIA | ||
| Enzimoinmunoensayo (EIA) | Moderada/alta | |||
| Immunoblot | Altasc | |||
| Biología molecular | PCRFilmArray™ | — | Secreciones respiratoriasSangre u otros tejidos | Altas |
| Respuesta específica de ASC frente a M. pneumoniaed | ELISpot | IgM, IgG e IgA de ASC | Sangre | Altas |
ASC: células secretoras de anticuerpos; EIA: enzimoinmunoensayo; PCR: reacción en cadena de la polimerasa.
Si se realizan serologías, se recomienda la utilización de pruebas de enzimoinmunoensayo para la determinación de estos anticuerpos dada su mayor sensibilidad y especificidad.
La IgA se eleva y desciende antes que la IgM, pero apenas se realiza en la práctica por su baja sensibilidad y especificidad.
La respuesta específica de células B secretoras de anticuerpos (ASC) al estímulo con antígenos de MP mediate técnicas de ELISpot, de forma similar a la empleada en otros procesos como la tuberculosis, se ha demostrado rápida y fiable a la hora de distinguir las infecciones activas por MP de los estados de colonización asintomática. Sin embargo, estas técnicas están aún en desarrollo y no están disponibles todavía fuera del ámbito de la investigación.
Fuente: Modificado de: Meyer Sauteur et al.10.
Tradicionalmente, se considera que la aparición de IgM específica o el aumento del título de IgG específica más de 4 veces en 2 muestras separadas al menos 2-4 semanas es diagnóstico de infección aguda por MP.
Este criterio solo permite un diagnóstico retrospectivo con poco impacto en la práctica clínica. La IgM puede mantenerse elevada durante meses tras la primera infección y puede también, por el contrario, elevarse muy poco ante futuras reinfecciones en niños mayores o adultos, que pueden responder únicamente con una elevación temporal de IgG.
Es improbable encontrar un valor positivo de IgM durante la primera semana de síntomas10. La seroprevalencia de IgM en población infantil sana puede llegar al 40% y algunos trabajos han demostrado la presencia de anticuerpos IgG, IgM e IgA en niños sanos colonizados por MP, por lo que su validez y sensibilidad serían debatibles10. Además, debe de tenerse en cuenta que las pruebas serológicas para la detección de IgM pueden generar en ocasiones resultados falsos positivos, que puede ocurrir debido a: 1) reacción cruzada con otros anticuerpos, 2) la presencia de sustancias que puedan interferir con la técnica o 3) las limitaciones inherentes a la prueba utilizada.
Reacción en cadena de la polimerasa (PCR)La positividad de las pruebas de diagnóstico molecular indica la presencia de material genético de la bacteria en la muestra, pero existe una fuerte evidencia de que no implica necesariamente relación causal con el proceso infeccioso activo2,10,12. En pacientes bien seleccionados y con una toma de muestras válida, su especificidad es superior al 90%, siendo progresivamente menor a partir de la primera semana de síntomas.
La identificación de PCR positiva en muestra nasofaríngea en la población general puede ascender al 45-56%10, ya sea por colonización asintomática o por la elevada persistencia del germen en la orofaringe tras una infección activa, pudiendo durar varios meses.
La relativa universalización de la disponibilidad de técnicas de PCR permiten la detección de múltiples patógenos respiratorios de forma rápida, pero precisan una correcta interpretación de los resultados para determinar su causalidad14.
¿En qué casos se debe solicitar PCR en muestra respiratoria y/o serologías para M. pneumoniae?La realización de pruebas para la identificación de MP debe individualizarse y solo se realizarán cuando la probabilidad pre-test sea alta y el resultado modifique el manejo (tabla 3.B)11.
De manera general no se recomienda la realización de pruebas diagnósticas en el manejo ambulatorio de las neumonías en niños sanos en los que el tratamiento empírico suele ser efectivo, incluso aunque no incluya antibióticos activos frente a MP11. Las tasas de detección de MP en secreciones respiratorias de niños con neumonía adquirida en la comunidad son muy variables en la literatura (4-39%) y no permite distinguir entre la infección activa y el portador asintomático12. La prevalencia de MP en la vía aérea superior varía muy considerablemente entre años y estaciones, siendo más elevada después de una estación epidémica (dado el comportamiento cíclico de MP). En los pacientes bien seleccionados por sospecha clínica, el valor predictivo positivo y sobre todo el negativo se eleva, habiendo demostrado aumentar de forma muy significativa el uso antibiótico correcto15.
Pese a las limitaciones descritas, la identificación por PCR en muestras respiratorias es hoy en día la técnica más rápida (1-2 h), sensible y específica en comparación a otras pruebas microbiológicas, no estando bien definidos sus valores16. En el último metaanálisis realizado en población pediátrica sobre la utilidad de las técnicas point-of-care en infecciones respiratorias infantiles, entre los 57 estudios incluidos, solo uno estaba dirigido exclusivamente al MP encontrándose un incremento muy significativo en la prescripción correcta de antibióticos16. La detección de RM no está disponible en nuestro país de forma generalizada.
Estaría indicado solicitar pruebas para un diagnóstico microbiológico en los supuestos reseñados en la tabla 3.B2,17,18. En función de la disponibilidad, el coste, el grupo poblacional y el supuesto clínico (considerando la precocidad con la que se necesite el diagnóstico) se priorizará una técnica sobre la otra.
¿En qué casos se debe solicitar PCR para M. pneumoniae en muestras no respiratorias?Además de la afectación respiratoria, se han descrito complicaciones neurológicas, dermatológicas, cardíacas, renales, hematológicas, inmunológicas, musculares, osteoarticulares y gastrointestinales18. Se realiza de forma sistemática y está más descrita la identificación de MP en líquido cefalorraquídeo. Aunque no realizadas de formas sistemática, en aquellas localizaciones con manifestaciones clínicas producidas por daño directo se puede intentar la identificación del patógeno, no siendo así en aquellas manifestaciones de mecanismo inmune (tabla 5).
Muestras de pruebas moleculares según manifestación y mecanismo fisiopatológico
| Complicaciones | Mecanismo directo (muestra) | Mecanismo inmunea |
|---|---|---|
| Neurológicas | Encefalomielitis aguda diseminadaNecrosis bilateral del núcleo estriadoEncefalopatía necrosanteMielitis transversa (líquido cefalorraquídeo) | Encefalitis y meningitis asépticasSíndrome de Guillain-BarréOtras neuropatías periféricas o radiculopatías varias (afectación de pares craneales, pérdida brusca de audición —VIII par craneal—, parálisis de abductores, neuritis óptica, neuropatía del plexo braquial y parálisis del frénico y recurrente) |
| Cardiológicas | Pericarditis (líquido o tejido pericárdico)Endocarditis (sangre) | Enfermedad de Kawasaki |
| Dermatológicas | Síndrome de Stevens-Johnson (líquido de vesículas bullosas) | Eritema multiformeUrticariaPúrpura anafilactoide |
| Hematológicas | Anemia sin significación clínicaCrioaglutininas (sangre) | Anemia hemolítica autoinmune |
| Musculoesqueléticas | Artritis (también exacerbaciones de artritis crónicas)Sinovitis (líquido o tejido sinovial) | |
| Renales | Glomerulonefritis agudaNefritis tubulointersticial | |
En pacientes graves, indicado también buscar en muestras respiratorias en caso de sospecha de mecanismo inmune.
Fuente: Modificado de: Acosta et al.19.
Hay que tener en consideración que en muchas ocasiones estas técnicas no están validadas para su uso fuera de las muestras respiratorias, por lo cual su valor diagnóstico debe interpretarse con cautela. Considerando esto, sería más fiable valorar si el mecanismo de acción es directo o indirecto según el tipo de patología, siendo la detección de PCR de material genético de MP en muestra no respiratoria complementaria al diagnóstico, no determinando ni modificando el plan de actuación19.
¿En qué casos se debe solicitar pruebas de imagen y cuáles serían de elección?Las recomendaciones e indicaciones de pruebas de imagen anta sospecha de infección por MP son las mismas que para cualquier neumonía adquirida en la comunidad. En nuestro medio el patrón de referencia para el diagnóstico es la radiografía de tórax. Además, estará también indicada cuando la evolución clínica no es la esperada, cuando se sospechan complicaciones o existan dudas diagnósticas. La radiografía no aporta mayor valor diagnóstico que en otras causas de neumonía ni está claro su papel en el diagnóstico diferencial2.
La ecografía clínica pulmonar, en aquellos pediatras con formación, puede ser una adecuada aproximación, ya que no irradia y su sensibilidad puede ser equiparable o incluso mejor que la de la radiografía en las primeras 48-72 h de fiebre, siendo además la técnica de elección para el diagnóstico de derrame pleural paraneumónico.
Algunos autores sugieren realizar prueba de imagen como apoyo diagnóstico en los casos de mucositis tipo reactive infectious mucocutaneous eruption (RIME) que sean precedidos de síntomas respiratorios6.
TratamientoResumen ejecutivo en la tabla 6.
Tratamiento
| A. ¿Es necesario tratar todos los casos? ¿En qué situaciones podemos dar tratamiento sintomático y esperar? |
| • La mayoría de las infecciones por M. pneumoniae son autolimitadas y leves. |
| • No está bien definido el papel de los antibióticos en el tratamiento de las infecciones por M. pneumoniae. No hay evidencia suficiente que demuestren que sea superior a placebo en formas leves ni que reduzcan la transmisión ni que prevengan la progresión a formas graves en todos los contextos epidemiológicos. |
| • En los lactantes la infección por M. pneumoniae es menos frecuente que las infecciones virales, por lo cual no está justificado dar tratamiento empírico frente a M. pneumoniae. En casos de alta sospecha por ambiente epidemiológico familiar se recomienda confirmar la infección antes de plantear tratamiento. |
| • En el manejo de pacientes ambulatorios con sospecha de infección respiratoria por M. pneumoniae sin factores de riesgo para desarrollo de formas graves (ver tabla 1.C) puede considerarse la observación sin tratamiento, siempre y cuando se pueda asegurar un seguimiento estrecho del paciente. |
| • En pacientes ambulatorios y hospitalizados en los que se haya iniciado tratamiento con un betalactámico por neumonía adquirida en la comunidad y que hayan respondido clínicamente al mismo, la detección de material genético de M. pneumoniae mediante técnicas moleculares, no supone una indicación de iniciar tratamiento específico en ausencia de factores de riesgo para el desarrollo de formas graves (ver tabla 1.C). |
| B. ¿En qué casos debemos iniciar tratamiento antibiótico? |
| Atención ambulatoria (atención primaria y urgencias) |
| • El tratamiento antibiótico estará razonablemente indicado en pacientes ambulatorios con sospecha clínica elevada de infección por M. pneumoniae que asocien factores de riesgo para el desarrollo de formas graves (ver tabla 1.C). |
| • Se puede valorar añadir cobertura antibiótica para M. pneumoniae para los pacientes con neumonía adquirida en la comunidad si no existe mejoría clínica tras 48-72h de tratamiento con un betalactámico, habiéndose descartado complicaciones asociadas (revisar los supuestos clínicos detallados en la tabla 7). |
| Atención hospitalaria |
| • En el ámbito hospitalario estaría justificado el tratamiento antibiótico para la infección confirmada por M. pneumoniae en los pacientes con factores de riesgo (tabla 1.C) o aquellos con infección respiratoria o formas extrapulmonares moderadas o graves (neumonías con hipoxemia que requieran oxigenoterapia suplementaria o que requieran soporte ventilatorio, encefalitis y afectaciones cutáneo mucosas graves). |
| C. ¿Qué tratamientos tenemos disponibles? |
| • Tratamiento de elección: |
| ∘ Claritromicina vía oral: 15mg/kg/día/repartida en 2 dosis/durante 5-7 días. |
| ■ Si evolución favorable en 48-72h/5 días es suficiente. |
| ■ Opción de primera elección recomendada como alternativa más ventajosa desde el punto de vista de política antibiótica («Programas de Optimización de Uso de los Antibióticos») dado que reduce considerablemente la exposición del huésped al antibiótico por su corta vida media. |
| ∘ Azitromicina vía oral: en pauta de 3 días (10mg/kg, máximo 500mg/durante 3 días). |
| ■ Su larga vida media conlleva un muy prolongado periodo de persistencia del antibiótico en el organismo que podría favorecer al desarrollo de resistencias. |
| • Fármacos de segunda elección: solo indicados en caso de sospecha de resistencias, afectación del sistema nervioso central o inmunodeprimidos. |
| ∘ Doxiciclina: 2mg/kg/12h el primer día (máximo 200 mg) y luego cada 24h vía oral o intravenosa (en pacientes con formas graves mantener 2 mg/kg/12 horas) (máximo 100mg/12h) 7 días. |
| ■ La doxiciclina tiene un espectro más reducido en comparación a levofloxacino, manteniendo un adecuado nivel de actividad tanto a nivel de sistema nervioso central, como a nivel pulmonar. Retirada la restricción de uso de tetraciclinas en menores de 8 años para tratamientos inferiores a 3 semanas tiene un perfil de seguridad más favorable con menor riesgo de reacciones adversas graves y menor impacto en el desarrollo de resistencias antimicrobianas. |
| ∘ Levofloxacino: (solo en caso de no poder usar macrólidos o doxiciclina) 6 meses-5 años: 10mg/kg/12h vía oral o intravenosa; >5 años: 10mg/kg/24h vía oral o intravenosa 7-10 días (máximo 750mg/día). |
| • Azitromicina, claritromicina y levofloxacino cuentan con presentación en vía intravenosa que deberán reservarse para los casos graves o con intolerancia oral. |
| • En ausencia de datos confiables de concentración y eficacia de los macrólidos a nivel del sistema nervioso central, doxiciclina sería el fármaco de elección en estas situaciones. |
| • Levofloxacino sería la alternativa en caso de sospecha de resistencia a macrólidos, o en caso de inmunosuprimidos que requieran cobertura empírica de amplio espectro para otros patógenos (p. ej., Pseudomonas aeruginosa) hasta el diagnóstico definitivo. |
Aún no está bien definido el papel de los antibióticos en el tratamiento de las infecciones por MP20–22. En nuestro medio la mayoría son autolimitadas y leves23,24.
Aunque algunos estudios, en contextos epidemiológicos distintos al nuestro, sugieren que podrían ocurrir complicaciones, manifestaciones extrapulmonares, cursos graves o prolongados si se retrasa el diagnóstico o se utiliza un antibiótico ineficaz23,25–27, existen diversos estudios, incluyendo una revisión sistemática de la Cochrane, que concluyen que existe insuficiente evidencia acerca de la eficacia de los antibióticos para las infecciones respiratorias por MP22–24.
Estudios observacionales recientes han evidenciado que el pronóstico y curso de la infección respiratoria por MP no fue diferente entre los que recibieron tratamiento empírico con betalactámicos para la neumonía comunitaria con y sin la inclusión de macrólidos, apoyando la idea de que el tratamiento de entrada no estaría indicado22,28.
Ante la falta de evidencias científicas a favor o en contra, parece razonable utilizar el criterio del beneficio de la duda y administrar antibióticos en pacientes graves cuyo cuadro clínico pudiera estar causado por MP. En general se puede considerar una pauta de observación sin tratamiento, incluso si el paciente presenta una neumonía adquirida en la comunidad leve sin signos de alerta, siempre y cuando se pueda asegurar un seguimiento ambulatorio estrecho del paciente2,29,30. En estos casos, se debe plantear el uso de pruebas microbiológicas atendiendo las consideraciones de indicación e interpretación reseñadas en la tabla 3.B.
Un aspecto fundamental es la edad del paciente. Los niños pequeños son menos susceptibles a la infección por MP que los escolares. Sin embargo, han aumentado considerablemente los casos sintomáticos en lactantes y preescolares en Asia y Europa, aunque se desconoce su repercusión sobre el curso clínico31. En los menores de 3-5 años es menos frecuente que se complique con neumonía sin la coexistencia de otros agentes microbiológicos25,26. En otras edades, se estima que entre un 10-40% pueden desarrollar neumonía25.
¿En qué casos debemos iniciar tratamiento antibiótico?Atendiendo las consideraciones previamente descritas, estaría justificado administrar tratamiento antibiótico dirigido a MP cuando la sospecha clínica de su implicación sea elevada o se demuestre su presencia mediante técnicas microbiológicas y el paciente tenga alguno de los factores de riesgo de enfermedad grave (tabla 1.C) o presente una forma clínica de enfermedad respiratoria o extrapulmonar grave. Las neumonías con hipoxemia que requieran oxigenoterapia suplementaria o que requieran soporte ventilatorio, las encefalitis y algunas afectaciones cutáneo-mucosas graves se consideran tributarias de tratamiento antibiótico2,32,33.
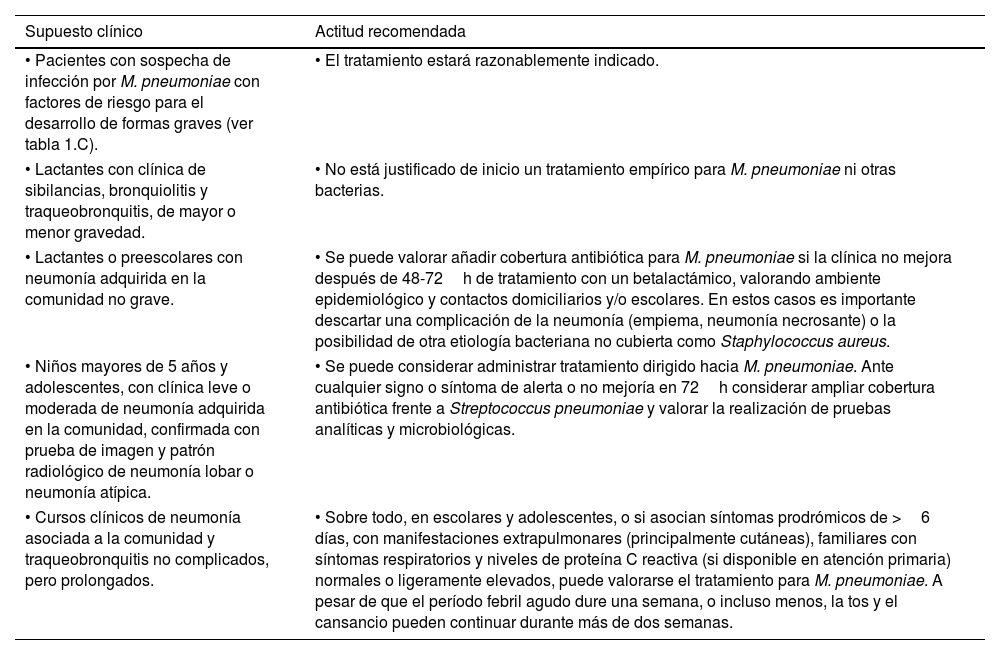
En la atención ambulatoria (atención primaria y urgencias), al no tener siempre la disponibilidad inmediata de las pruebas moleculares, se debe tener en cuenta el ambiente epidemiológico, la edad y la gravedad clínica para identificar a los pacientes con alta probabilidad de tener una infección por MP que precise tratamiento antibiótico empírico (tabla 7)2,26.
Supuestos clínicos en atención ambulatoria (atención primaria y urgencias) donde considerar iniciar o no el tratamiento
| Supuesto clínico | Actitud recomendada |
|---|---|
| • Pacientes con sospecha de infección por M. pneumoniae con factores de riesgo para el desarrollo de formas graves (ver tabla 1.C). | • El tratamiento estará razonablemente indicado. |
| • Lactantes con clínica de sibilancias, bronquiolitis y traqueobronquitis, de mayor o menor gravedad. | • No está justificado de inicio un tratamiento empírico para M. pneumoniae ni otras bacterias. |
| • Lactantes o preescolares con neumonía adquirida en la comunidad no grave. | • Se puede valorar añadir cobertura antibiótica para M. pneumoniae si la clínica no mejora después de 48-72h de tratamiento con un betalactámico, valorando ambiente epidemiológico y contactos domiciliarios y/o escolares. En estos casos es importante descartar una complicación de la neumonía (empiema, neumonía necrosante) o la posibilidad de otra etiología bacteriana no cubierta como Staphylococcus aureus. |
| • Niños mayores de 5 años y adolescentes, con clínica leve o moderada de neumonía adquirida en la comunidad, confirmada con prueba de imagen y patrón radiológico de neumonía lobar o neumonía atípica. | • Se puede considerar administrar tratamiento dirigido hacia M. pneumoniae. Ante cualquier signo o síntoma de alerta o no mejoría en 72h considerar ampliar cobertura antibiótica frente a Streptococcus pneumoniae y valorar la realización de pruebas analíticas y microbiológicas. |
| • Cursos clínicos de neumonía asociada a la comunidad y traqueobronquitis no complicados, pero prolongados. | • Sobre todo, en escolares y adolescentes, o si asocian síntomas prodrómicos de >6 días, con manifestaciones extrapulmonares (principalmente cutáneas), familiares con síntomas respiratorios y niveles de proteína C reactiva (si disponible en atención primaria) normales o ligeramente elevados, puede valorarse el tratamiento para M. pneumoniae. A pesar de que el período febril agudo dure una semana, o incluso menos, la tos y el cansancio pueden continuar durante más de dos semanas. |
Se resumen las dosis y duración de las distintas opciones en la tabla 6.C. Azitromicina y claritromicina no muestran diferencias respecto a eficacia, espectro microbiológico, perfil de seguridad (especialmente prolongación de QT) y mecanismos de resistencia. Ambos presentan interacciones con muchos fármacos (inhiben el citocromo P450).
Tradicionalmente el de elección ha sido azitromicina por su comodidad de uso y excelente tolerancia (se ha asociado intolerancia gastrointestinal más frecuentemente al uso de claritromicina). Sin embargo, cada vez hay más preocupación por la inducción de resistencias microbianas que ocasiona debido a su larga vida media, que conlleva un muy prolongado periodo de persistencia del antibiótico en el organismo2. Por ello, se propone como alternativa más ventajosa desde el punto de vista de política antibiótica el empleo de claritromicina, que reduce considerablemente la exposición al antibiótico.
En caso de afectación del sistema nervioso central, dado que no hay datos que permitan utilizar macrólidos con suficiente confianza34, el fármaco de elección sería la doxiciclina. En la práctica es frecuente el uso de macrólidos, intentando reducir la carga bacteriana en el organismo atendiendo a evitar el mecanismo inmune indirecto. Sin embargo, considerando la gravedad de estas presentaciones y la posibilidad de la existencia de algunas manifestaciones neurológicas mediadas por daño directo, las tetraciclinas son una elección más lógica, máxime cuando ya no hay restricción a la administración de doxiciclina en menores de 8 años durante un periodo inferior a 3 semanas35.
Las fluoroquinolonas se consideran de elección cuando se precise ampliar el espectro antimicrobiano para la cobertura de otros patógenos en el tratamiento empírico, pacientes inmunosuprimidos y en caso de sospecha de RM.
Existe un incremento significativo de la RM, particularmente en Asia36,37. En Europa se describen RM entre el 1-25%38, en España en torno al 8%39. Fuera del ámbito de investigación, no se realizan estudios de RM en nuestro medio. Pocos estudios hay disponibles sobre la repercusión clínica de la RM, pudiendo influir en la estancia hospitalaria y las complicaciones40. Ante la no disponibilidad clínica de pruebas que detecten RM, la elección debe orientarse por la tasa de resistencias conocidas a nivel local, la gravedad del paciente o su respuesta a macrólidos.
FinanciaciónNo se ha recibido financiación para el presente trabajo.
Conflicto de interesesLos autores del manuscrito declaran no tener ningún conflicto de intereses relacionado con el contenido.
Grupo de trabajo de infecciones respiratorias de la Sociedad Española de Infectología Pediátrica
Alfredo Tagarro García (Hospital Infanta Sofía, Madrid), Marta Cruz Cañete (Hospital de Montilla, Córdoba), Cristian Launes (Hospital Sant Joan de Déu, Barcelona), Cristina Calvo Rey (Hospital la Paz, Madrid, CIBERINFEC), José Antonio Couceiro Gianzo (Complejo Hospitalario de Pontevedra, Pontevedra), Enrique Otheo de Tejada (Hospital Universitario Ramón y Cajal, Madrid), Laura Francisco González (Centro de Salud, Madrid), Carlos Pérez (Hospital de Cabueñez, Gijón) y Marta Llorente (Hospital Universitario del Sureste, Madrid).
Grupo de trabajo de infecciones de manejo ambulatorio de la Sociedad Española de Infectología Pediátrica
David López Martín (Hospital Costa del Sol, Marbella), Roi Piñeiro Pérez (Hospital General de Villalba, Madrid), Alicia Berghezan Suárez (Centro de Salud De Xaló, Alicante), Marta Cruz Cañete (Hospital de Montilla, Córdoba), María Belén Hernández Rupérez (Centro de Salud Mirasierra, Madrid), Antonio Iofrío de Arce (Centro de Salud El Ranero, Murcia) y Nerea Cardelo Autero (Hospital Costa del Sol, Marbella, Málaga).