Introducción
La infección en niños por el virus de la inmunodeficiencia humana (VIH) tipo 1 es debido casi exclusivamente a la transmisión vertical (TV) de gestantes VIH positivas a sus hijos1. La epidemiología de la TV del VIH ha cambiado radicalmente en los últimos 10 años. Antes del desarrollo de intervenciones específicas para prevenir la TV, un 15-25 % de los niños en Europa y Estados Unidos y un 30-40 % de los niños nacidos en África subsahariana se infectaban2. Desde la implementación a partir de 1994 del régimen PACG076, que incluye la terapia con zidovudina (AZT) en la gestación, la administración de AZT en el parto y al niño durante 6 semanas y la lactancia artificial, la TV se redujo al 6,7 %. Al añadir la cesárea a este protocolo, la tasa disminuyó al 2 %, y con la administración de tratamiento antirretroviral de gran actividad (TARGA) durante la gestación, esta tasa se sitúa cercana al 1 %1-8. En los últimos años se han sucedido distintas guías de actuación clínica en la prevención de la TV, tanto en países en vías de desarrollo como en países desarrollados. La Guía Británica del año 2005 aconseja actualmente el cribado del virus en toda gestación y el TARGA de todas las gestantes VIH positivas6. Así mismo, permite el parto por vía vaginal si la carga viral (CV) es indetectable en el tercer trimestre; y en este caso, aconseja tratamiento al recién nacido con monoterapia con AZT durante 4-6 semanas. Entre las medidas de prevención de la TV, siempre según esta guía, también se incluye triple terapia (con AZT, nevirapina [NVP] y lamivudina [3TC]) en los recién nacidos de alto riesgo (cuando la madre no ha recibido tratamiento durante la gestación, la CV plasmática no es indetectable en el tercer trimestre o la infección materna se ha diagnosticado tras el parto6). Esta última medida preventiva (el tratamiento con 3 fármacos al recién nacido de alto riesgo) no se contempla, sin embargo, en el último informe sobre la prevención de la TV elaborado en el año 2004 por la American Academy of Pediatrics, donde se aconseja exclusivamente el uso de monoterapia o biterapia para este grupo de recién nacidos7. Así mismo, las recomendaciones del Public Health Service Task Force de Estados Unidos, en su última revisión de julio de 2006, tampoco contemplan la triple terapia en el recién nacido de riesgo y siguen proponiendo el uso exclusivo de AZT durante 6 semanas para los recién nacidos de gestantes que no han recibido tratamiento antirretroviral (TAR) durante la gestación, e incluso para recién nacidos de gestantes que no lo recibieron tampoco en el parto8. Esta guía propone a lo sumo un tratamiento corto (de una semana) con biterapia (AZT y 3TC) en recién nacidos de madres que no recibieron tratamiento en la gestación pero sí en el parto.
A pesar de la implementación de estas medidas, siguiendo unas u otras guías, en los servicios de salud españoles, aún hay casos de TV. El objetivo de este trabajo es analizar dichos casos en una cohorte de niños nacidos de madre VIH positiva, evaluar la carga que supone cada factor u "oportunidad perdida" en la prevención de la TV y describir las características clínicas iniciales de los recién nacidos infectados.
Métodos
Se seleccionaron los 9 casos de TV entre los 632 niños con exposición perinatal a VIH recogidos desde mayo de 2000 hasta diciembre de 2005 en la base de datos de las Cohorte FIPSE (Fundación para la Investigación y la Prevención del SIDA en España) del Proyecto 36299/02 (Seguridad del Tratamiento Antirretroviral en Madres Gestantes VIH y Transmisión Vertical) en el que colaboran diversos hospitales de la Comunidad Autónoma de Madrid (Hospital 12 de Octubre, Hospital La Paz, Hospital Gregorio Marañón, Hospital Universitario de Getafe, Hospital Severo Ochoa, Hospital de Móstoles, Hospital Príncipe de Asturias y Hospital Fundación Alcorcón. Las características de las gestantes seguidas en dicha cohorte han sido publicadas recientemente9, incluyéndose en ella a las gestantes VIH positivas identificadas antes de la gestación, durante la misma o en las 48 h posteriores al parto. Los pares de madres-niños son seguidos prospectivamente, aunque en esta serie se han analizado los casos de TV de manera retrospectiva. En el seguimiento de las madres se recogen datos sobre el control de la gestación, tratamiento antirretroviral recibido, las analíticas correspondientes a cada visita programada, los efectos adversos observados y las características del parto. En el seguimiento de los niños se anotan las características antropométricas, el tratamiento recibido desde el nacimiento, y los datos clínicos y analíticos correspondientes a cada visita, que se efectúa al nacimiento, a las 2-3 semanas, a las 6 semanas, a los 3, 6, 12, 18, 24 y 36 meses. La analítica incluye reacción en cadena de la polimerasa (PCR) para VIH en todas las visitas hasta la de los 3 meses, inclusive. Hasta el año 2004 se realizaba PCR del ADN proviral (del virus integrado en las células mononucleadas) casi exclusivamente, como método de cribado, cualitativo. En la actualidad, este método ya no está disponible y se utiliza como método de cribado la PCR del ARN viral, que cuantifica la CV plasmática. Desde el nacimiento, se suspende la lactancia materna; se descarta de manera definitiva la infección por VIH al producirse la serorreversión entre los 18 y los 24 meses.
Para el cálculo de los intervalos de confianza se usó el programa estadístico GraphPad, disponible online en www.graphpad.com/quickcalcs
Resultados
En el período estudiado (mayo 2000-diciembre 2005), en la Comunidad Autónoma de Madrid nacieron 17 niños infectados por VIH. De ellos, nueve pertenecen a la Cohorte FIPSE. El resto o bien pertenecen a otros hospitales o bien no cumplen los criterios de inclusión en la Cohorte (madres identificadas varios meses tras el parto, por fallo en la detección durante la gestación).
La tasa neta de Transmisión Vertical de VIH en la Cohorte y en el período de estudio fue de 1,42 % (IC 95 %: 0,7-2,68) (9 casos de TV entre un total de 632 pares madre-niño).
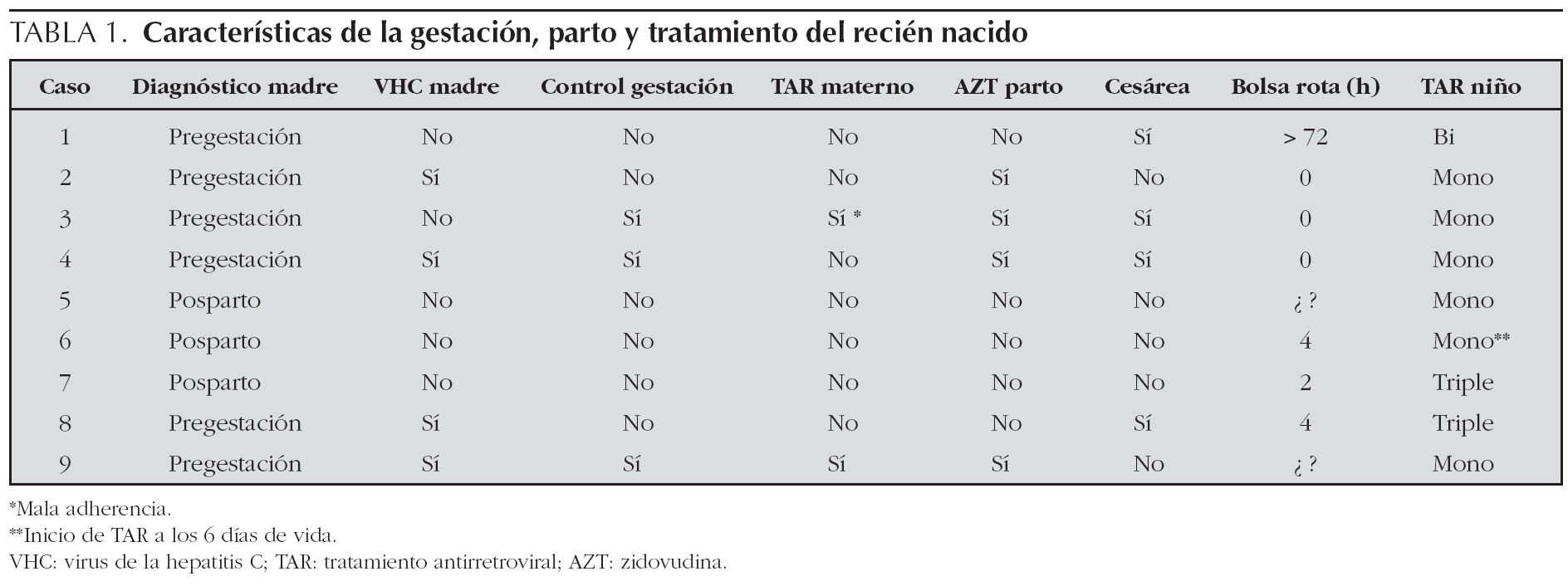
De las 9 gestaciones, únicamente tres fueron controladas. El resto de las gestantes, no acudió a los controles de la gestación previstos ni solicitó ayuda de los servicios sanitarios, debido a problemas de índole social como drogadicción (casos 1, 2, 6 y 8), marginalidad (caso 8), ocultamiento del embarazo (caso 7) e inmigración ilegal (caso 5). Entre las madres que sí controlaron su gestación, dos recibieron TAR (en ambas ocasiones consistió en triple terapia, incluyendo un inhibidor de la proteasa [IP]). Y sólo una de estas 2 madres tomó TARGA durante toda la gestación (tabla 1). Esta gestante (caso 9) tomaba inicialmente atazanavir, un IP que fue sustituido por nelfinavir al diagnosticarse el embarazo. Este último fue mal tolerado y se pautó de nuevo atazanavir, que tomó durante los últimos 4 meses de la gestación junto con otros 2 análogos de nucleósidos. Las CV de esta gestante fueron en todo momento negativas.
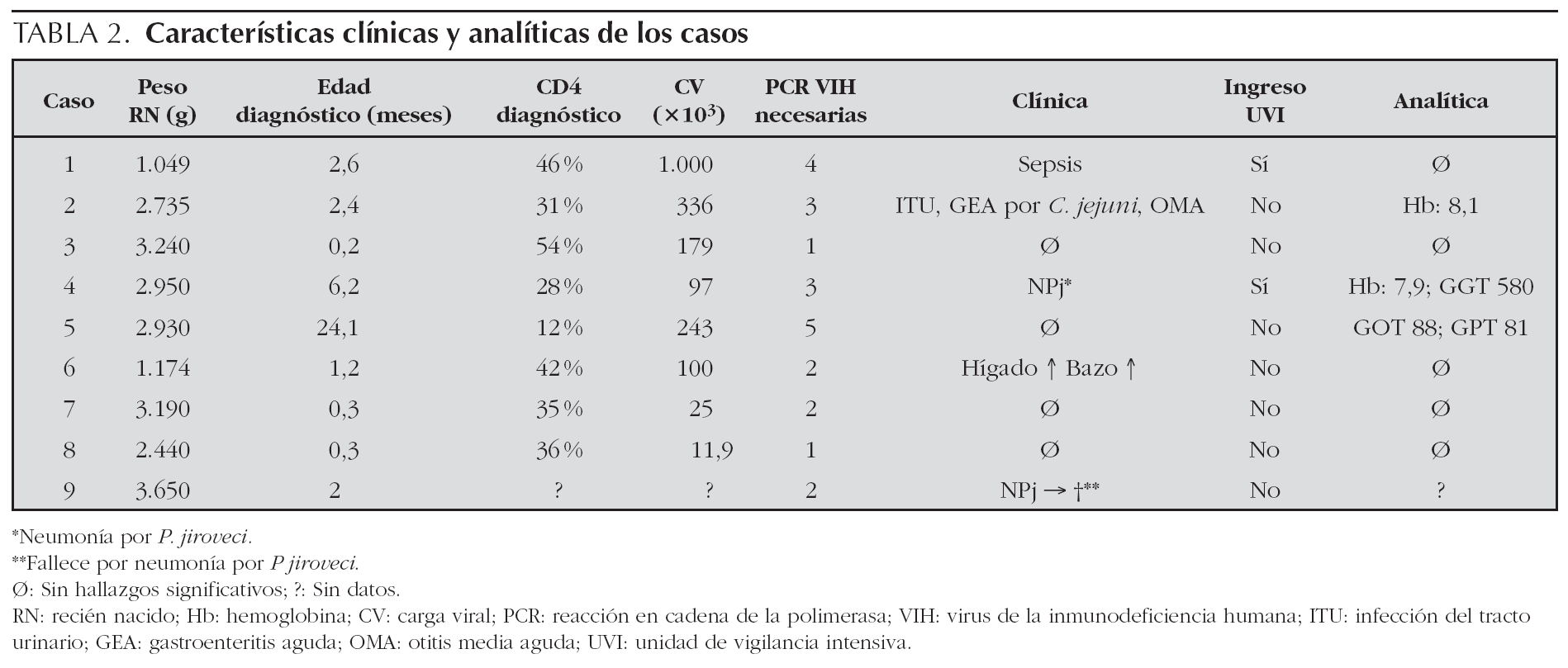
Sólo una de las 9 gestantes era inmigrante de raza negra (procedía de Camerún, caso 5). En el resto de los casos, se trataba de mujeres españolas. El diagnóstico materno de infección VIH se realizó tras el parto en 3 de los 9 casos (en las primeras 48 h de vida del recién nacido). El 44 % de las gestantes estaba coinfectado con virus de la hepatitis C (VHC). En 5 casos el parto fue por vía vaginal (en uno de ellos [caso 2] fue debido a la escasez de tiempo para realizar cesárea al ingresar la madre en expulsivo; en tres de ellos por desconocimiento de la seropositividad materna hasta el posparto y en uno de ellos por presentar CV indetectable). No se administró AZT intravenosa durante el parto a 5 de los casos (bien por falta de tiempo [caso 8], bien por desconocimiento de la infección materna [casos 5, 6, 7] o bien por ocultación de la seropositividad [caso 1]) (tabla 1). Dos de los recién nacidos (casos 1 y 6) fueron prematuros, con edades gestacionales de 28 y 32 semanas y con un peso medio de 1.112 g (tabla 2).
Respecto al TAR en el recién nacido, 2 recién nacidos recibieron triple terapia con AZT, nevirapina y lamivudina por ser de alto riesgo (no habían recibido TAR durante la gestación ni durante el parto). Un niño recibió biterapia (con AZT y lamivudina) y el resto monoterapia con AZT (tabla 2).
La mediana de edad al diagnóstico fue de 2,4 meses (rango: 7 días-21 meses). Una niña fue diagnosticada a los 2 años de vida a pesar de tener 4 PCR-ADN de VIH negativas realizadas en los primeros 4 meses posparto. En este caso, la permanencia de los anticuerpos anti-VIH después de los 2 años llevó a la petición de ARN-PCR de VIH (cuantitativo, más sensible que el anterior) que fue positivo para VIH-1, subtipo A/G recombinante.
Respecto al momento de la transmisión, podemos suponer que en un tercio de los casos (3, 7, 8), la transmisión habría sido intraútero, ya que el virus es detectable en la primera semana de vida
Las muestras de PCR de VIH necesarias para llegar al diagnóstico fueron 2,5 como media (rango: 1-5) y la CV inicial osciló entre 11.900 y 1.000.000 copias/ml (media: 276.000) (tabla 2).
El porcentaje de linfocitos T CD4+ medio de los niños al diagnóstico fue de 38 % (rango: 12-54 %).
Cinco de los casos eran ya sintomáticos cuando se realizó el diagnóstico de infección VIH. Dos de ellos (casos 4 y 9), presentaron neumonía por Pneumocystis jiroveci. Uno presentó sepsis clínica, uno infecciones bacterianas de repetición y uno hepatoesplenomegalia. De ellos, 4 niños habían precisado ingreso hospitalario por causa infecciosa (síndromes febriles sin foco o infección respiratoria grave) antes del diagnóstico de infección por VIH. El caso 9, inicialmente asintomático, fue llevado a la urgencia hospitalaria con insuficiencia respiratoria grave y parada cardiorrespiratoria posterior, que no pudo revertirse, falleciendo instantes después, a la edad de 4 semanas. La necropsia identificaría neumonía por P. jiroveci. En la evolución posterior de los otros 8 niños, no ha habido ningún otro fallecimiento.
Respecto a los hallazgos analíticos, en 4 casos se apreciaron alteraciones hematológicas (anemia moderada en los casos 2 y 4, con cifras de hemoglobina de 8,1 y 7,9 mg/dl, respectivamente) o bioquímicas (hipertransaminasemia en los casos 4 y 5) (tabla 2).
Discusión
La tasa de TV en la cohorte FIPSE de Madrid es similar a la de otras cohortes europeas10-13 donde se recoge el seguimiento de gestantes VIH positivas y de sus recién nacidos. Esta tasa (1,42 %) no refleja la efectividad de las medidas de prevención de la TV, ya que los casos de TV son el resultado, en su gran mayoría (8 de 9) de "oportunidades perdidas" en la prevención: gestaciones mal controladas (o con mala adherencia al TAR).
A la vista de los datos y en el período estudiado, se debe destacar como factor causal más importante la falta de TAR durante la gestación. Sólo 1 de las 7 gestantes que no tomaron TAR era inmigrante. El resto eran mujeres españolas, potenciales usuarias del sistema de salud en nuestro país, y que por diversos motivos (ocultación del embarazo, drogadicción, marginalidad) no solicitaron ayuda en el seguimiento de su gestación.
Un alto porcentaje de las madres (44 %) estaba coinfectado por VHC.
Es de destacar también que en esta serie de casos de TV, ninguno corresponde a niños de gestantes diagnosticadas durante la gestación. El estudio colaborativo europeo, sin embargo, encuentra una tasa mayor de TV en las gestantes que iniciaron TARGA durante la gestación (1,92 %) que en aquellas que lo iniciaron previamente (0,25 %)12.
La CV indetectable es el objetivo del tratamiento en la mujer gestante VIH. Aunque la TV puede ocurrir incluso cuando la CV es indetectable5,6,14-16, la tasa de TV aumenta 2,4 veces por cada aumento de un logaritmo en la CV plasmática14. Según las recomendaciones de la British HIV Association6 y las del Public Health Service Task Force de Estados Unidos8, cuando una gestante VIH presenta una CV indetectable en el último trimestre, el parto por vía vaginal ha de ser la norma, salvo deseo contrario de la madre. Sin embargo, en el último informe del Grupo Colaborativo Europeo, la cesárea programada se asoció a una disminución del 90 % en las pacientes con CV indetectable12. Estos resultados aún tienen que contrastarse y es aún muy prematuro indicar cesárea sistemática en todas las gestantes VIH positivas independientemente de su CV, aunque podría ser la norma en el futuro.
Una de las gestantes de nuestra serie (caso 9) transmitió la infección a su recién nacida, a pesar de contar con una CV plasmática indetectable (< 50 copias/ml) tras recibir TARGA durante la gestación. Además, se administró AZT intravenosa intraparto y oral al recién nacido durante 6 semanas. La vía elegida para el parto fue la vaginal, siguiendo las recomendaciones actuales para dichas gestantes6. Sin embargo, en casos aislados, la CV plasmática podría no representar la actividad del virus en el tracto genital femenino (TGF) y eso podría justificar los raros casos de transmisión vertical en gestantes con CV plasmática indetectable (se ha establecido una tasa de TV en torno al 0,6 % en gestantes con CV < 1.000 que reciben TARGA)6,16,17. Aunque las cifras de CV plasmática y la existencia de virus (bien en la fracción celular como provirus o en la fracción libre de células) en las secreciones cervicovaginales están correlacionadas18-20, una CV plasmática indetectable no garantiza ausencia del virus en el TGF: hasta en el 30 % de las mujeres con CV indetectable se encontró secreción de virus en las secreciones cervicovaginales20. Por lo tanto, el TAR y la administración de AZT intraparto no garantizaría la ausencia de VIH en el TGF.
En 5 casos de nuestra serie, no se llevó a cabo la administración de AZT intravenosa intraparto. Como se describe en el estudio descriptivo de las madres de la cohorte FIPSE9 un 6 % de las madres no recibieron tratamiento en el parto, bien por falta de tiempo al presentarse la gestante ya en período expulsivo o por ser la seropositividad para VIH desconocida. Se desconoce cuál es el grado de prevención de esta medida, aunque pudiera ser el factor menos influyente en la prevención de la TV: en las guías que se han mencionado previamente, y basándose en datos de la Cohorte Perinatal Francesa21 la administración de AZT intravenosa intraparto se considera "no esencial" en el grupo de mujeres con TARGA y CV < 50 copas/ml6.
No se ha definido aún el papel del TAR preventivo en el recién nacido en la reducción de la TV. Como se ha descrito en la introducción, existen discrepancias respecto al TAR profiláctico en recién nacidos de alto riesgo entre las recomendaciones americanas8 y las europeas6. En las primeras, se baraja la biterapia (con AZT más 3TC o NVP) e incluso la monoterapia con AZT exclusivamente, en aquellos recién nacidos con alto riesgo de TV5,7,8. En los casos 1 al 6 (que recibieron exclusivamente monoterapia con AZT) se siguieron posiblemente estas recomendaciones americanas, más conservadoras. Los recién nacidos 7 y 8, fueron tratados con triple terapia, según las recomendaciones británicas.
En nuestra pequeña serie, la proporción de TV intraútero (un tercio de los casos) resulta algo mayor de lo esperado, ya que ésta supone habitualmente un 15-20 % de los casos de TV2. Estas diferencias entre nuestros resultados y lo publicado en la literatura especializada se deben probablemente al escaso número de pacientes de nuestra serie. Podemos asumir en el resto de los casos que la infección ha sido intraparto, ya que se evitó la lactancia materna en todos los recién nacidos.
El diagnóstico de infección por VIH en el caso 5 demoró 21 meses: se trataba de una niña de raza negra infectada por un subtipo viral poco común, el VIH-1 A/G. Este subtipo de virus VIH-1 grupo M "no B", pertenece a las llamadas "formas recombinantes circulantes", que recientemente han sido descritas como el subtipo de VIH-1 más predominante en países de África subsahariana como Camerún y Senegal22. En el estudio europeo pediátrico PENTA-5, la morbimortalidad de esta forma recombinante no fue distinta al resto de los subtipos, pero sí se observaron fallos en la detección tanto del genoma viral al diagnóstico como de resistencias frente a antirretrovirales23. De igual modo, se han descrito frecuentes resultados falsamente negativos en las pruebas diagnósticas de cribado en los pacientes, en su mayoría subsaharianos, infectados por subtipos de VIH-1 grupo M "no B", ya que los métodos de detección están basados en secuencias de subtipos B24,25. La niña, hija de madre camerunesa, presentó PCR de ADN proviral (Versant HIV-1 RNA 3.0 Assay Bayer®) negativo a los 2 y 4 meses. En este caso, el diagnóstico de infección por VIH sólo se sospechó cuando la niña mostró IgG anti VIH persistentemente elevados a la edad de 21 meses. Se realizó entonces un ARN-PCR (Amplicor HIV-1 Monitor Test 1.5 Roche®, cuantitativo, y más sensible) que mostró entonces una CV de 5,3 log copias/ml.
Las CV iniciales de todos los casos eran elevadas, como suele ser la norma26-30. Sorprende sin embargo que sólo 2 o 4 semanas después de obtener una primera o segunda PCR negativa, un recién nacido infectado presente CV tan elevadas: la terapia antirretroviral en el recién nacido podría negativizar la CV, retrasando el diagnóstico de infección como sugieren las conclusiones de la Cohorte Perinatal Francesa6,31.
Es de destacar que el diagnóstico de infección por VIH se realizó durante un ingreso hospitalario por causa infecciosa en 4 de los casos (1, 2, 4, 9). Estos 4 recién nacidos empezaron en estadio clínico C antes de los 6 meses de vida. Según los resultados de las distintas cohortes de lactantes infectados por TV (en los años anteriores a la instauración del TARGA y las terapias de prevención de la TV), entre un 18 y un 25 % de ellos cumplen criterios diagnósticos de sida antes de cumplir el año de edad26-29. Aunque estos datos no son directamente comparables por tratarse en nuestro caso de lactantes a los que se aplicaron diversas medidas de prevención de la TV, cabe decir que en nuestra serie, esta proporción resultó algo mayor (44 %).
Respecto a las analíticas realizadas a estos niños, bien durante algún ingreso o en el seguimiento rutinario, sólo 3 casos (2, 4, 5) mostraban alteraciones como anemia o hipertransaminasemia, que, junto con la trombocitopenia y la leucopenia, son características habituales, pero no específicas, al inicio de la infección por VIH26-31.
Este estudio está limitado por consistir exclusivamente en el análisis de una serie de 9 casos. Las conclusiones de este corte transversal pudieran no ser aplicables en otras poblaciones donde se consideraran exclusivamente objeto de estudio gestantes con TAR, o en las que se hubieran excluido a las gestantes diagnosticadas tras el parto.
En conclusión, en nuestra serie hemos identificado fallos en la prevención de la TV en el 89 % de los niños infectados. El factor causal más determinante de la TV en este estudio ha sido la ausencia de TAR en las madres gestantes. Por otro lado se observa cómo el tratamiento con AZT intravenosa en el parto no alcanza a todas las gestantes seropositivas. Queremos destacar también la puesta en práctica de TAR preventivos en los recién nacidos de alto riesgo con 3 fármacos desde 2004, aunque la eficacia de esta medida no está claramente definida. También queremos llamar la atención sobre el número de PCR que fueron necesarias para llegar al diagnóstico (media: 2,5). En la práctica clínica a menudo se afirma que una segunda PCR negativa a las 6-8 semanas permite prácticamente descartar el diagnóstico. En esta serie vemos que no ha sido así. Respecto al diagnóstico, hemos observado que el ingreso por causa infecciosa de un lactante menor de 3 meses en riesgo de TV pudiera ser un factor de sospecha (datos propios no publicados).
Nuestro análisis refleja las deficiencias de la profilaxis, u "oportunidades perdidas" en una sociedad occidental con acceso libre y gratuito a todas las medidas de prevención de la TV conocidas actualmente. Son necesarias medidas que mejoren el acceso al sistema de salud y al TAR de gestantes con mal control de su embarazo, ya que son sus recién nacidos los de mayor riesgo de infección en nuestro país.
Correspondencia: Dra. M. Fernández Ibieta.
Servicio de Pediatría. Hospital Universitario de Getafe.
Ctra. de Toledo, km 12,5. 28430 Madrid. España.
Correo electrónico: mfndezibieta@hotmail.com
Recibido en septiembre de 2006.
Aceptado para su publicación en enero de 2007.