La pielonefritis xantogranulomatosa es una enfermedad inflamatoria muy poco frecuente, que se caracteriza por la sustitución del parénquima renal por tejido granulomatoso. Su presentación se caracteriza por dolor abdominal y síntomas constitucionales asociados a infecciones de orina de repetición. Los gérmenes más frecuentemente implicados son Escherichia coli y Proteus mirabilis. El diagnóstico definitivo es anatomopatológico y el único tratamiento curativo es la nefrectomía total o parcial. Presentamos una actualización de los conocimientos de esta enfermedad a raíz de un caso recientemente diagnosticado en nuestro servicio.
Xanthogranulomatous pyelonephritis is a rare inflammatory disease, characterized by replacement of renal parenchyma with granulomatous tissue. Initial clinical presentation includes abdominal pain and constitutional symptoms related to recurrent urinary infections. The microorganisms most commonly involved are Escherichia coli and Proteus mirabilis. Final diagnosis is made by histopathology, and the only curative treatment is total or partial nephrectomy. A recently diagnosed case in our unit is presented, as well as an update on the knowledge of this disease.
La pielonefritis xantogranulomatosa (PNX) es una enfermedad debida a un proceso inflamatorio-infeccioso crónico que cursa con brotes agudos de origen infeccioso. La enfermedad fue descrita en 1916 por Slagenhaufer1 y Obering acuñó el término de PNX en 1935. Es poco frecuente, suponiendo menos del 1% del total de las pielonefritis crónicas2,3. Es excepcional en la infancia y se presenta predominantemente en mujeres de edad media, siendo la máxima incidencia entre la 5.ª-6.ª década de la vida4. El primer caso en descrito en niños fue en 19635 y desde entonces se han recogido en la literatura menos de 300 casos6.
El objetivo de nuestro trabajo es analizar los aspectos clínicos de esta variante tan poco frecuente de pielonefritis para obtener un diagnóstico lo más precoz posible que mejore su pronóstico.
Caso clínicoNiña argelina de 3 años, con astenia, anorexia y pérdida de peso de 5 meses de evolución, tiempo en el que recibe varios ciclos de antibioterapia por vía oral en su país de origen por episodios febriles, algunos de ellos diagnosticados de infección urinaria.
Somatometría al ingreso: peso: 9kg (P<3), talla: 86,5cm (P<3), IMC 12 kg/m2 (P<3). Presenta afectación del estado general y una masa palpable en el hemiabdomen izquierdo, dolorosa a la palpación. Se objetiva leucocitosis (22.700 leucocitos/μl) con fórmula normal, incremento de reactantes de fase aguda (proteína C reactiva 12,17mg/dl y velocidad de sedimentación globular 78mm/h), anemia importante (hemoglobina 6,2g/dl, hematocrito 22,2%), plaquetas normales (402.000/mμ), ferropenia y leucocituria (1.670 leucocitos/μl).
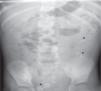
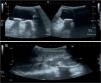
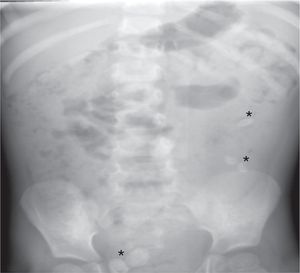
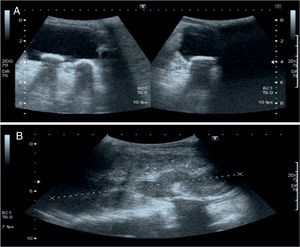
Se realizan una radiografía simple de abdomen y una ecografía abdominal, donde se aprecian litiasis renovesicales, nefromegalia izquierda e imágenes sugestivas de pionefrosis (figs. 1 y 2).
A) Focos cálcicos con sombra acústica posterior indicativos de litiasis vesicales. B) Nefromegalia izquierda y dilatación pielocalicial con contenido espeso ecogénico indicativo de pionefrosis. Pobre diferenciación corticomedular y focos cálcicos con sombra posterior en pelvis renal izquierda.
Ante los hallazgos analíticos y radiológicos, se inicia antibioterapia empírica intravenosa con amikacina y ceftriaxona, y se realiza una doble nefrostomía izquierda bajo control ecográfico obteniendo material purulento en el que se aísla Proteus mirabilis (P. mirabilis), Bacteroides fragilis y Prevotella bivia. La pielografía realizada a través de los catéteres de drenaje de la nefrostomía muestra un doble sistema uretero-pielocalicial y la gammagrafía DMSA, renal una nula función del riñón izquierdo, con un riñón derecho compensador normofuncionante.
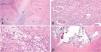
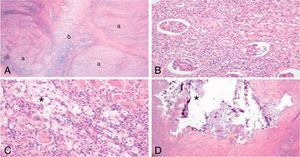
Tras 15 días de antibioterapia por vía intravenosa se realiza una nefrectomía total con ureterectomía izquierda por cirugía abierta, obteniendo una pieza de 10×6,5×4cm y un peso de 113,6 g. El parénquima renal es multilobulado y totalmente desestructurado, con mala separación córtico-medular y múltiples granulomas amarillentos que ocupan todo el tejido. Se observan cavidades quísticas encapsuladas que se corresponden con abscesos renales. Las imágenes microscópicas permitieron el diagnóstico anatomopatológico de PNX (fig. 3).
A) Grandes granulomas (a) comprimen el poco parénquima renal de la pieza (b). B) Nefritis intersticial por la presencia de células inflamatorias en el parénquima renal. C) Detalle de los granulomas con tejido inflamatorio crónico reagudizado (linfocitos, células plasmáticas, células multinucleadas y PMN) e histiocitos espumosos (*) (células de citoplasma claro por el acúmulo de lípidos en sus vacuolas), patognomónicos de la xantogranulomatosis y que confieren un aspecto amarillento característico al riñón. D) Focos cálcicos (*) compatibles con litiasis renales.
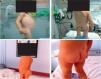
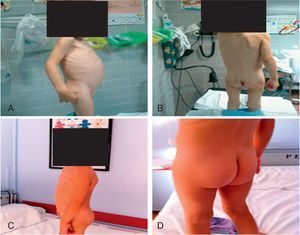
El examen químico de los cálculos reveló una composición de oxalato cálcico, carbonato cálcico y fosfato amónico magnésico. El estudio metabólico fue normal salvo una hipocitraturia, por lo que se inició tratamiento con citrato potásico, que se mantuvo 3 meses. Seis meses después de la intervención quirúrgica, la paciente se encuentra asintomática, con gran mejoría del estado nutricional (fig. 4), controles analíticos normales y una función renal normal. Somatometría actual: peso: 11,5 kg (P3), talla: 90cm (P3) e IMC: 14 kg/m2 (P10).
DiscusiónLa xantogranulomatosis es un tipo particular de inflamación crónica, caracterizada por la formación de tejido fibrogranulomatoso y nódulos amarillentos compuestos de macrófagos cargados de lípidos (foamy cells), que comprimen el tejido sano donde se forman (riñón, hígado, vesícula biliar, pulmón, etc.), provocando destrucción y disfunción del órgano afectado7.
Su etiología es diversa y aún controvertida: factores ambientales como la obstrucción del tracto urinario (litiasis, estenosis congénitas, etc.), infecciones recurrentes, malnutrición, isquemia renal crónica, obstrucción linfática o alteraciones del metabolismo de los lípidos, que se presentan en un sujeto con susceptibilidad genética, pueden desencadenar esta reacción inflamatoria tan característica3,8. Sin embargo, la causa última de la acumulación de lípidos en las vacuolas de los macrófagos es aún desconocida3.
La PNX puede ser focal (15%) o difusa (85%), según la afectación del parénquima renal9. Generalmente, es unilateral (no se ha descrito un lado predominante), aunque existen casos de afectación bilateral de peor pronóstico3. La clasificación de Malek y Elder10 diferencia 3 estadios según su extensión:
- –
Estadio I: afectación exclusiva del parénquima renal.
- –
Estadio II: afectación renal y de la grasa perirrenal.
- –
Estadio III: afectación renal, perirrenal y pararrenal, pudiendo afectar a retroperitoneo, diafragma y músculo psoas.
La sintomatología es inespecífica pero la aparición de dolor abdominal, lumbar o de flanco, asociado a episodios febriles recurrentes y antecedentes de infección de tracto urinario, puede ser el punto de partida en el diagnóstico. También puede presentarse como una masa abdominal, hepato-esplenomegalia, vómitos, disuria, hematuria, anorexia, pérdida de peso o desnutrición11. Suelen presentar alteraciones analíticas como anemia, leucocitosis e incremento de reactantes de fase aguda, así como piuria y microhematuria3,4,11.
Los urocultivos obtenidos por micción son positivos únicamente en un 50% de los casos debido a la presencia de abscesos encapsulados que no comunican con la vía urinaria o por la presencia de litiasis caliciales que impiden la salida de la orina infectada. Los cultivos de las muestras obtenidas por drenaje son positivos hasta en un 90%. Los patógenos más frecuentes son Escherichia coli y P. mirabilis, aunque también pueden aparecer Streptotococcus, Enterococcus faecalis, Candida albicans y Enterobacter3,9.
La ecografía es la prueba de imagen que más información aporta inicialmente, por lo que será la de elección. Los hallazgos más frecuentes son la nefromegalia unilateral con áreas multifocales de diferente densidad, litiasis, hidronefrosis, quistes renales y mala diferenciación córtico-medular9. La radiografía simple de abdomen, en la mayoría de las ocasiones, no aporta nuevos datos. La TC se suele utilizar indiscriminadamente en adultos con sospecha de PNX, pero su uso en niños está más limitado. Se solicitará para conocer la extensión peri y pararrenal, y para el diagnóstico diferencial con tumoraciones renales, sobre todo el tumor de Wilms9. La RMN aporta una información similar a la TC, presentando ambas técnicas un rendimiento cercano al 100% en la evaluación del parénquima renal y de la vía excretora, aunque en ocasiones la RMN no detecta litiasis caliciales, por lo que la TC superaría a la RMN en la detección de litiasis y en la de anormalidades renales, de uréter o vesicales. La gammagrafía renal es útil para la valoración de la función del riñón afectado.
El diagnóstico definitivo es anatomopatológico, de una muestra obtenida por biopsia, o de la pieza anatómica de una nefrectomía parcial/total. No existen, o al menos nosotros no hemos encontrado, indicaciones precisas de biopsia en casos de sospecha de PNX. Por lo tanto, la decisión de realizar de inicio una biopsia o bien directamente una nefrectomía parcial o total es un tema complejo que debe individualizarse a cada paciente. En nuestro caso, dado el proceso infeccioso activo y la anulación del riñón objetivada en la gammagrafía DMSA, se decidió directamente realizar una nefrectomía total. Macroscópicamente, son riñones grandes con múltiples granulomas amarillentos que ocupan gran parte del parénquima. En la microscopia óptica son característicos los xantogranulomas que comprimen el tejido renal. Este tejido de granulación crónico se caracteriza por la presencia de histiocitos espumosos o foamy cells, que son macrófagos repletos de lípidos en el interior de sus vacuolas y que son los que le confieren el peculiar aspecto macroscópico amarillento3.
Es crucial el inicio precoz de la antibioterapia parenteral empírica, modificable tras la llegada de los cultivos. Este no es un tratamiento curativo pero sirve para controlar la extensión del proceso inflamatorio-infeccioso y evita complicaciones sépticas3. Se recomienda la realización de una nefrostomía percutánea evacuadora previa a la intervención, ya que mejora el abordaje quirúrgico y permite el diagnóstico microbiológico3.
El tratamiento definitivo es la nefrectomía total o parcial (según la afectación parenquimatosa), siendo la cirugía abierta el abordaje habitual. La laparoscopia no disminuye la aparición de complicaciones posquirúrgicas, pero sí reduce la estancia hospitalaria y el dolor posquirúrgico, mejorando los resultados estéticos12.
ConclusionesEl caso presentado es peculiar, no solo por el diagnóstico, infrecuente en la infancia, sino porque reúne la mayoría de los condicionantes ambientales asociados a la aparición de PNX: malformaciones renoureterales (doble sistema pielocalicial), infecciones de orina de repetición (probablemente tratadas de forma incorrecta o incompleta), litiasis renales (que condicionan un cuadro obstructivo) y una malnutrición que es difícil establecer si es causa o consecuencia de la PNX.
Estamos ante una enfermedad infrecuente, poco conocida y que cursa con sintomatología inespecífica y sin signos radiológicos ni analíticos patognomónicos, lo que condiciona un diagnóstico tardío. Es imprescindible un alto índice de sospecha clínica para un diagnóstico y tratamiento precoz que condicione un buen pronóstico. Por tanto, la PNX debe entrar en el diagnóstico diferencial de niños con pielonefritis recurrentes y/o resistentes al tratamiento antibiótico empírico, abscesos renales y/o pararrenales y casos de nefromegalia unilateral no atribuible a otras causas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al Dr. Miguel Trigueros Mateos, del Servicio de Anatomía Patológica del Hospital General Universitario de Alicante, por el diagnóstico del caso, así como por facilitarnos las imágenes correspondientes a la anatomía patológica de la pieza de nefrectomía de nuestra paciente, y al Servicio de Cirugía infantil del Hospital General Universitario de Alicante, por su indispensable colaboración en la resolución del caso.