Aunque las enfermedades alérgicas son frecuentes en la infancia, pocos estudios han caracterizado el perfil de sensibilización inmunoglobulina (Ig) E en niños pequeños con síntomas de posible origen alérgico.
ObjetivoEstablecer la prevalencia y el tipo de sensibilización alérgica, y los factores demográficos y ambientales relacionados con ambas características, en niños de 0 a 5 años de edad con sibilancias o dermatitis atópica.
Población y métodosEstudio transversal colaborativo en el que participaron 20 centros de atención primaria de diversas áreas geográficas de España. En conjunto, 468 niños con sibilancias o dermatitis atópica realizaron una evaluación alergológica que incluyó la determinación en sangre de anticuerpos IgE específicos frente a neumoalérgenos y trofoalérgenos prevalentes.
ResultadosSe detectó sensibilización alérgica en el 32,4% de los niños con sibilancias (intervalo de confianza [IC] del 95%: 26,3–38,6%), el 54,8% de los niños con dermatitis atópica (IC del 95%: 42,1–67,6%) y el 39,2% de los que tuvieron ambos procesos (IC del 95%: 32,0–46,4%). El riesgo de sensibilización se vio influido por el sexo (odds ratio ajustado [ORA] masculino versus femenino: 1,91; IC del 95%: 1,24–2,95), la edad (ORA 3–5 versus 0–2 años: 1,96; IC del 95%: 1,27–3,0), el tipo de lactancia (ORA materna versus artificial: 0,51; IC del 95%: 0,31–0,84) y el área geoclimática (ORA continental versus atlántica: 2,26; IC del 95%: 1,30–3,93). Con respecto al área atlántica, la sensibilización en el área continental fue menor a ácaros (ORA: 0,16; IC del 95%: 0,07–0,36) y mayor a gramíneas (ORA: 4,65; IC del 95%: 1,99–10,86), leche de vaca (ORA: 5,17; IC del 95%: 1,71–15,62) y huevo (ORA: 5,26; IC del 95%: 2,04–13,62), mientras que en el área mediterránea fue menor a ácaros (ORA: 0,29; IC del 95%: 0,13–0,64) y mayor a leche de vaca (ORA: 3,81; IC del 95%: 1,20–12,14) y huevo (ORA: 5,24; IC del 95%: 1,94–14,20).
ConclusionesUna proporción relevante de los niños pequeños asistidos en atención primaria por sibilancias o dermatitis atópica presentan sensibilización alérgica. En España parecen existir variaciones según el área geoclimática en la prevalencia de sensibilización a inhalantes y alimentos en lactantes y niños preescolares con síntomas de posible origen alérgico.
Although allergic diseases are frequent in childhood, few studies have characterised the IgE sensitization profile among young children with allergic-like symptoms.
ObjectiveTo determine the prevalence and the type of allergic sensitization, as well as the demographic and environmental factors related to both characteristics, among 0–5 year old children presenting with wheezing and/or atopic dermatitis.
MethodsCollaborative cross-over study developed in the paediatric setting of 20 Spanish Primary Health Care Centres. An allergology evaluation including blood determination of specific IgE antibodies to common inhalant and food allergens was performed on 468 children who presented with wheezing and/or atopic dermatitis.
ResultsAllergic sensitization was detected in 32.4% of the children with wheezing (95% confidence interval, 95%CI, 26.3–38.6%), in 54.8% of the children who had atopic dermatitis (95%CI, 42.1–67.6%) and in 39.2% of the children with both processes (95%CI, 32.0–46.4%). The risk of allergic sensitization was sex related (male versus female adjusted odds ratio, ORA, 1.91, 95%CI, 1.24–2.95), and also related to the age (3–5 versus 0–2 year old ORA 1.96, 95%CI, 1.27–3.0), type of early feeding (maternal milk versus infant formula ORA 0.51, 95%CI, 0.31–0.84) and geoclimatic area (ORA Continental versus Atlantic 2.26, 95%CI, 1.30–3.93). Compared to the Atlantic area, the Continental area the sensitization was lower to mites (ORA 0.16, 95%CI, 0.07–0.36) and higher to grass (ORA 4.65, 95%CI 1.99–10.86), cow milk (ORA 5.17, 95%CI, 1.71–15.62) and egg (ORA 5.26, 95%CI, 2.04–13.62), whereas in the Mediterranean area the sensitization was lower to mites (ORA 0.29, 95%CI, 0.13–0.64) and higher to cow milk (ORA 3.81, 95%CI, 1.20–12.14) and egg (ORA 5.24, 95%CI, 1.94–14.20).
ConclusionA significant proportion of small children treated at the paediatric primary health care centres due to wheezing and/or atopic dermatitis had allergic sensitization. There appears to be a geoclimatic variation in the prevalence of sensitization to inhalant and food allergens among young children with allergic like symptoms who live in Spain.
En muchas áreas geográficas del mundo, incluyendo España, la investigación epidemiológica ha constatado una elevada prevalencia de síntomas relacionados con el asma y las enfermedades alérgicas en los niños al inicio de su período escolar1,2. También anteriormente, durante las etapas de lactante y preescolar, las manifestaciones clínicas respiratorias y cutáneas de posible naturaleza alérgica son muy frecuentes y, desde el punto de vista de la asistencia sanitaria, motivo de un buen número de consultas en atención primaria3,4. En los niños pequeños, los síntomas asmatiformes y las alteraciones cutáneas englobadas bajo el término dermatitis, aun cuando generalmente de carácter leve o moderado, constituyen un desafío para los clínicos del primer nivel asistencial, debido a la coexistencia de fenotipos de significado y pronóstico diferentes. Así, por ejemplo, las sibilancias de aparición precoz pueden ser transitorias en el corto plazo, tender a la desaparición al finalizar la edad escolar o acabar por configurarse como asma que persiste más allá de la adolescencia5–7. También la dermatitis atópica parece reconocer variantes, y aunque con frecuencia acaba por remitir, puede seguir un curso variable y recidivar en la edad adulta8,9. Los 2 procesos, además, participan de la secuencia clínica conocida como marcha alérgica, y recientemente se ha considerado que su coexistencia puede constituir un fenotipo de mal pronóstico en lo que respecta a la función pulmonar10,11. De cualquier forma, y sea cual fuere la relación íntima entre el asma y la dermatitis atópica, resulta evidente el papel que en la génesis y persistencia de ambos procesos desempeña la sensibilización alérgica, definida por la síntesis de inmunoglobulina E alergenoespecífica (IgEAE) frente a substancias comunes adquiridas por vía inhalatoria (neumoalérgenos) o digestiva (trofoalérgenos)7,10–13.
Si bien la historia natural de las enfermedades alérgicas se ha investigado ampliamente mediante estudios de cohortes poblacionales seguidos desde el nacimiento, existe menos información acerca de las características de la sensibilización dependiente de IgE en niños pequeños que presentan manifestaciones clínicas supuestamente relacionadas con la alergia10,14. En relación con esta cuestión, el estudio Aplicaciones de Phadiatop infant® en la Alergia Infantil (APiA), desarrollado en España con el objetivo primario de evaluar la exactitud de este test diagnóstico y su utilidad para la identificación precoz de la atopia, se ha ocupado del perfil de sensibilización alérgica en lactantes y preescolares que recibieron asistencia en el primer nivel asistencial por episodios de sibilancias o dermatitis atópica. Con un diseño multicéntrico basado en atención primaria, el estudio APiA programó la determinación sistemática de IgEAE circulantes frente a neumoalérgenos y trofoalérgenos comunes, circunstancia que ofreció la oportunidad de caracterizar la sensibilización IgEAE en la población infantil de distintas áreas geográficas españolas. Así, pues, el presente artículo plantea la descripción de la prevalencia y el tipo de sensibilización alérgica en niños de entre 0 y 5 años de edad con sibilancias o dermatitis atópica, y el análisis de la influencia que sobre el riesgo para presentar tal afección tienen distintos factores de carácter demográfico y ambiental; se hace especial énfasis en las variaciones observadas al respecto entre las regiones atlántica, continental y mediterránea que conforman la diversidad geoclimática de la península ibérica.
Población y métodosDiseñoEstudio observacional, multicéntrico, de base en atención primaria, llevado a cabo en 20 centros de salud de 8 regiones de España (Andalucía, Aragón, Asturias, Cataluña, Extremadura, Galicia, Madrid y País Vasco) durante 24 meses (junio de 2002 a mayo de 2004). Previo al inicio del trabajo de campo, el Comité Ético de Investigación Clínica competente en la comunidad autónoma acreditó el estudio para cada centro participante.
SujetosEn orden consecutivo de asistencia a la consulta, el pediatra investigador invitó a tomar parte en el estudio a los niños de edad de entre 0 y 5 años en cuya historia clínica se encontrasen recogidos los diagnósticos médicos de sibilancias, sin considerar el número de episodios, o dermatitis atópica de cualquier gravedad. El protocolo, común para todos los centros, incluyó la realización de una historia alergológica y un cuestionario ambiental, según un modelo estructurado, el examen de la piel dirigido a la búsqueda de lesiones de dermatitis, y la obtención de una muestra de sangre para la determinación de IgE total, Phadiatop infant® (test cualitativo que detecta IgEAE frente a una mezcla balanceada de antígenos de inhalantes y alimentos comunes) y un amplio panel de IgEAE frente a neumoalérgenos y trofoalérgenos prevalentes. En total, se propuso la investigación a 486 niños, y 8 de éstos (1,6%) no se incluyeron porque la familia declinó la participación; adicionalmente, se excluyó del análisis a 10 niños más (2,1%) debido a la ausencia de resultados de los test diagnósticos de alergia por dificultades en la extracción o el procesamiento de la muestra de sangre.
Evaluación clínicaSe consideró episodio de sibilancias a un proceso respiratorio agudo que motivó una visita médica, bien al centro de salud o bien al hospital, en cuyo registro clínico constaba de forma explícita la detección de sibilancias en la auscultación pulmonar, ya asociadas o no a otros síntomas y signos clínicos de obstrucción de las vías aéreas intrapulmonares, y que podían acompañarse de fiebre15. Respecto a la dermatitis atópica, se juzgó criterio suficiente la codificación de este proceso en la historia clínica, si bien en caso de encontrarse en fase activa en la visita de estudio, el diagnóstico se corroboró conforme a los criterios comúnmente establecidos, y su gravedad actual precisada con el índice SCORAD (Scoring Atopic Dermatitis)16,17. En relación con la circunstancia de haber presentado uno o ambos procesos, los niños se clasificaron en los fenotipos “sibilancias sólo”, si habían presentado episodios de sibilancias pero no tenían historia de dermatitis atópica; “dermatitis sólo”, si se habían diagnosticado de dermatitis atópica pero nunca habían presentado episodios de sibilancias, y finalmente, “sibilancias y dermatitis”, si habían tenido con anterioridad ambos procesos, bien de manera concomitante o secuencial. Adicionalmente, se recogieron de la historia clínica los registros diagnósticos previos de laringitis aguda, rinitis alérgica e intolerancia/alergia a alimentos (anexo II, cuestionario alergológico).
Cuestionario ambientalEn la visita de estudio la familia respondió a un cuestionario acerca de las características del hábitat residencial, número de hermanos y orden en la fratría, tipo de lactancia y, en su caso, duración de la lactancia natural, edad a la que el niño inició la asistencia a guardería, tabaquismo de la madre en la gestación y de los convivientes en la actualidad y presencia de mascotas en el hogar (anexo II, cuestionario ambiental). Se consideró lactancia materna la alimentación exclusiva con leche humana de al menos un mes de duración.
Áreas geoclimáticasAtendiendo a las condiciones atmosféricas propias de la zona geográfica en que se desarrolló la investigación, y a su influencia sobre la distribución y fenología de los neumoalérgenos testados (en especial ácaros y pólenes), se delimitaron las áreas geoclimáticas atlántica, en la que se incluyeron los niños habitantes en Asturias, Guipúzcoa y Pontevedra, continental, en la que se incluyeron los niños habitantes en Badajoz, Madrid, Huesca y Zaragoza, y mediterránea, en la que se incluyeron los niños habitantes de Barcelona, Sevilla y Málaga.
Inmunoglobulinas E alergenoespecíficasLas determinaciones de los test in vitro para la detección de la sensibilización alergenoespecífica se realizaron con el método Immuno CAP™ (Phadia AB, Uppsala, Sweden). Una vez obtenidas, las muestras de sangre se transportaron en un medio refrigerado para su procesamiento inmediato en el servicio de análisis clínicos de referencia en el área sanitaria de cada centro de salud participante en el estudio. En cada niño se testó un panel predeterminado de IgEAE que incluyó ácaros (Dermatophagoides pteronyssinus y Dermatophagoides farinae), epitelios de gato y perro, polen de gramíneas (Dactylis glomerata, Festuca elatior, Lolium perenne, Phleum pratense, Poa pratensis y Secale cereale), polen de árboles (Acer negundo, Betula verrucosa, Corylus avellana, Quercus alba y Platanus acerifolia, con la adición de Cupressus arizonica en el área geoclimática continental y Olea europea en las áreas geoclimáticas continental y mediterránea), polen de malezas (Ambrosia elatior, Artemisia vulgaris, Plantago lanceolata, Chenopodium album, Salsola kali y Parietaria judaica), hongos (Penicillium chrysogenum, Cladosporium herbarum, Aspergillus fumigatus y Alternaria alternata), leche de vaca, huevo, cacahuete, pescado (bacalao, atún y salmón) y gamba, ampliado según indicación de la historia alérgica personal (mínimo 10 y máximo 25 pruebas). En conjunto, los porcentajes de niños estudiados por clase de alérgenos fueron para ácaros del 100,0%, para gato del 99,8%, para perro del 99,8%, para gramíneas del 99,6%, para árboles del 83,8%, para malezas del 95,5%, para hongos del 99,4%, para huevo del 99,8%, para leche de vaca del 98,9%, para pescados/gamba del 98,8% y para cacahuete del 99,6%. Se consideró sensibilización alérgica cualquier resultado de IgEAE igual o superior a 0,35 kU/l.
Análisis estadísticoLa prevalencia de sensibilización alérgica se expresó como proporción con un intervalo de confianza (IC) del 95%. La relación entre la sensibilización alérgica y las características demográficas, ambientales y clínicas se analizó mediante la prueba de χ2, y en el caso de las 2 primeras, el cálculo de odds ratio ajustadas (ORA) con un IC del 95% a partir del ajuste de un modelo de regresión logística en el que, además de todas las variables estudiadas, se incluyeron la estación en que se realizó el estudio y el fenotipo clínico. Por último, la variación geoclimática en la prevalencia de sensibilización a las clases de alérgenos se analizó mediante el cálculo de ORA con un IC del 95% para las áreas continental y mediterránea respecto a la atlántica, mediante la utilización del modelo de regresión logística anteriormente descrito. Todos los datos, excepto los de carácter personal, se procesaron con la aplicación Microsoft Office 2003® (Microsoft Corporation) para generar una base en la que se definieron valores posibles y reglas de coherencia entre variables. Todos los cálculos estadísticos se realizaron con el programa SPSS® versión 11.0.1 (SPSS Inc.).
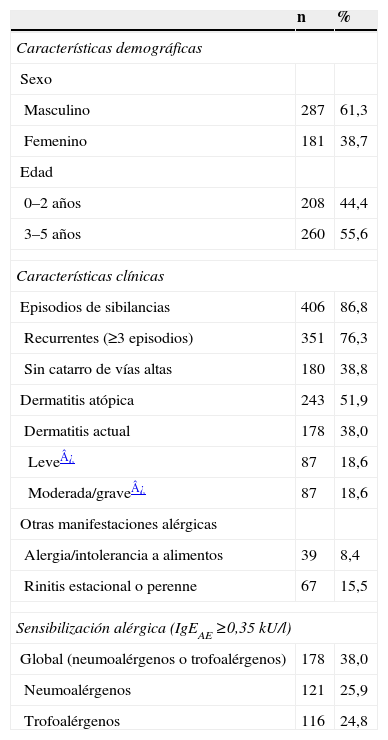
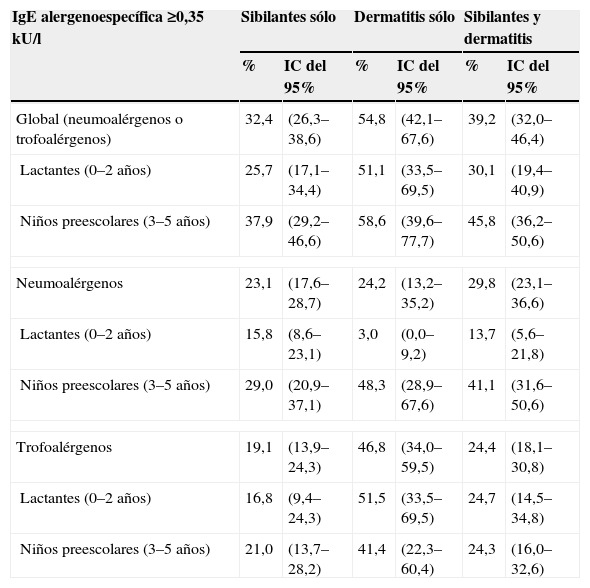
ResultadosSe estudiaron 468 niños, con predomino de varones, de entre 0 y 5 años de edad, de los que tres cuartas partes habían tenido 3 o más episodios de sibilancias y a la mitad se los había diagnosticado de dermatitis atópica. Con respecto a la sensibilización alérgica, más de un tercio de los niños tuvo al menos una prueba de IgEAE≥0,35 kU/l, de forma que una cuarta parte del conjunto presentó sensibilización a inhalantes y, asimismo, una cuarta parte presentó sensibilización a alimentos (tabla 1). Por fenotipos clínicos, la prevalencia de sensibilización dependiente de IgE casi alcanzó un tercio de los niños con “sibilancias sólo”, superó la mitad de los niños con “dermatitis sólo” y ocupó un lugar intermedio entre ambas proporciones en los niños con “sibilancias y dermatitis”. En relación con la edad, la prevalencia de sensibilización alérgica fue más alta en los niños de 3 a 5 años que en los de 0 a 2 años, circunstancia debida en buena medida al incremento de la sensibilización a neumoalérgenos ocurrida entre los primeros en los 3 fenotipos considerados (tabla 2).
Características demográficas, clínicas y de sensibilización alérgica en los niños participantes en el estudio Aplicaciones de Phadiatop infant® en la Alergia Infantil (n=468)
| n | % | |
| Características demográficas | ||
| Sexo | ||
| Masculino | 287 | 61,3 |
| Femenino | 181 | 38,7 |
| Edad | ||
| 0–2 años | 208 | 44,4 |
| 3–5 años | 260 | 55,6 |
| Características clínicas | ||
| Episodios de sibilancias | 406 | 86,8 |
| Recurrentes (≥3 episodios) | 351 | 76,3 |
| Sin catarro de vías altas | 180 | 38,8 |
| Dermatitis atópica | 243 | 51,9 |
| Dermatitis actual | 178 | 38,0 |
| Leve¿ | 87 | 18,6 |
| Moderada/grave¿ | 87 | 18,6 |
| Otras manifestaciones alérgicas | ||
| Alergia/intolerancia a alimentos | 39 | 8,4 |
| Rinitis estacional o perenne | 67 | 15,5 |
| Sensibilización alérgica (IgEAE ≥0,35kU/l) | ||
| Global (neumoalérgenos o trofoalérgenos) | 178 | 38,0 |
| Neumoalérgenos | 121 | 25,9 |
| Trofoalérgenos | 116 | 24,8 |
IgE: inmunoglobulina E.
Sensibilización inmunoglobulina E alergenoespecífica global y para neumoalérgenos y trofoalérgenos, por edad y fenotipo clínico en los niños participantes en el estudio Aplicaciones de Phadiatop infant® en la Alergia Infantil
| IgE alergenoespecífica ≥0,35kU/l | Sibilantes sólo | Dermatitis sólo | Sibilantes y dermatitis | |||
| % | IC del 95% | % | IC del 95% | % | IC del 95% | |
| Global (neumoalérgenos o trofoalérgenos) | 32,4 | (26,3–38,6) | 54,8 | (42,1–67,6) | 39,2 | (32,0–46,4) |
| Lactantes (0–2 años) | 25,7 | (17,1–34,4) | 51,1 | (33,5–69,5) | 30,1 | (19,4–40,9) |
| Niños preescolares (3–5 años) | 37,9 | (29,2–46,6) | 58,6 | (39,6–77,7) | 45,8 | (36,2–50,6) |
| Neumoalérgenos | 23,1 | (17,6–28,7) | 24,2 | (13,2–35,2) | 29,8 | (23,1–36,6) |
| Lactantes (0–2 años) | 15,8 | (8,6–23,1) | 3,0 | (0,0–9,2) | 13,7 | (5,6–21,8) |
| Niños preescolares (3–5 años) | 29,0 | (20,9–37,1) | 48,3 | (28,9–67,6) | 41,1 | (31,6–50,6) |
| Trofoalérgenos | 19,1 | (13,9–24,3) | 46,8 | (34,0–59,5) | 24,4 | (18,1–30,8) |
| Lactantes (0–2 años) | 16,8 | (9,4–24,3) | 51,5 | (33,5–69,5) | 24,7 | (14,5–34,8) |
| Niños preescolares (3–5 años) | 21,0 | (13,7–28,2) | 41,4 | (22,3–60,4) | 24,3 | (16,0–32,6) |
IC: intervalo de confianza; IgE: inmunoglobulina E.
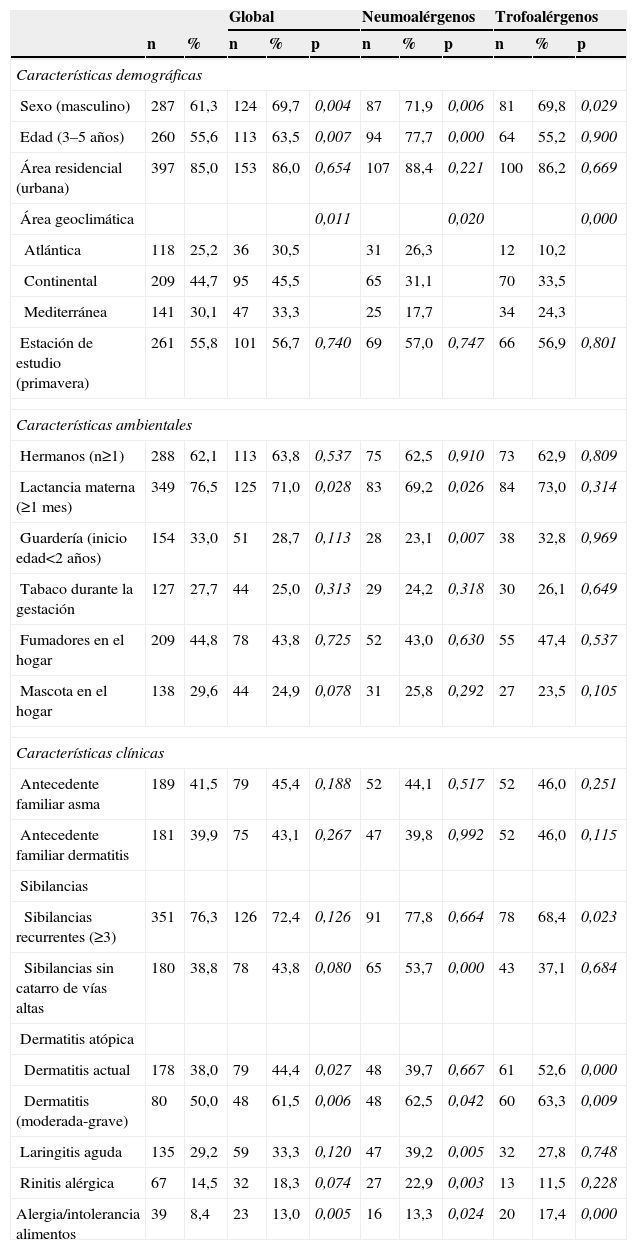
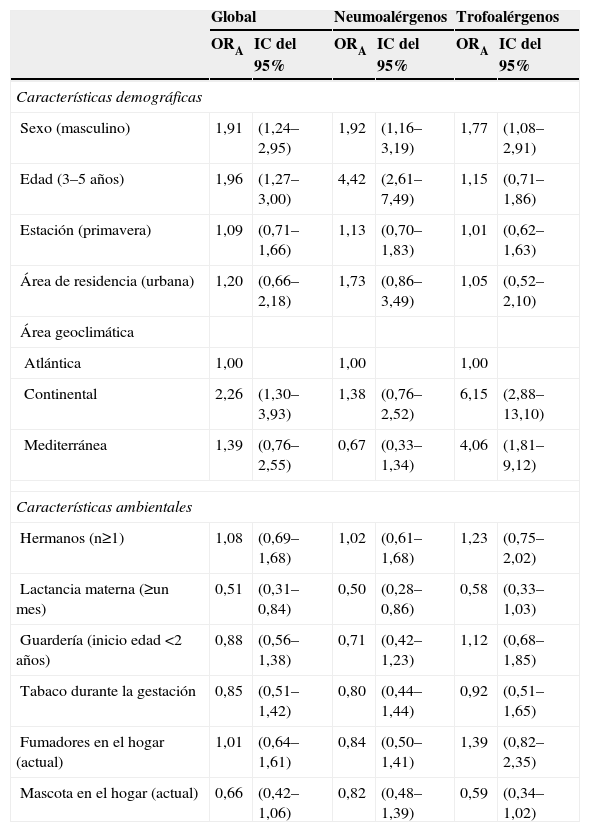
En el conjunto de niños estudiado, el análisis bivariante encontró una asociación de la sensibilización alérgica global con el sexo, la edad, el área geoclimática, el tipo de lactancia, la dermatitis atópica actual y moderada-grave y el diagnóstico de alergia/intolerancia a alimentos; una asociación de la sensibilización a neumoalérgenos con el sexo, la edad, el área geoclimática, el tipo de lactancia, ir a guardería antes de cumplir 2 años, tener sibilancias sin infección respiratoria aguda concomitante, la dermatitis atópica moderada-grave y los diagnósticos de laringitis aguda, rinitis alérgica y alergia/intolerancia a alimentos, y una asociación de la sensibilización a trofoalérgenos con el sexo, el área geoclimática, tener más de 3 episodios de sibilancias, la dermatitis atópica actual y moderada-grave y el diagnóstico de alergia/intolerancia a alimentos (tabla 3). Sin embargo, muchas de las asociaciones referidas perdieron su significación en el análisis multivariante, de forma que sólo se mantuvo un incremento del riesgo en el sexo masculino para la sensibilización tanto global como a neumoalérgenos y trofoalérgenos, la edad para la sensibilización global y a neumoalérgenos, el área geoclimática continental respecto a la atlántica para la sensibilización global y a trofoalérgenos, y el área mediterránea respecto a la atlántica para la sensibilización a trofoalérgenos, así como una disminución del riesgo con la lactancia materna para la sensibilización global y a neumoalérgenos (tabla 4).
Sensibilización a inmunoglobulina E alergenoespecífica global y a neumoalérgenos y trofoalérgenos, según las características demográficas, epidemiológicas y clínicas de los niños participantes en el estudio Aplicaciones de Phadiatop infant® en la Alergia Infantil
| Global | Neumoalérgenos | Trofoalérgenos | |||||||||
| n | % | n | % | p | n | % | p | n | % | p | |
| Características demográficas | |||||||||||
| Sexo (masculino) | 287 | 61,3 | 124 | 69,7 | 0,004 | 87 | 71,9 | 0,006 | 81 | 69,8 | 0,029 |
| Edad (3–5 años) | 260 | 55,6 | 113 | 63,5 | 0,007 | 94 | 77,7 | 0,000 | 64 | 55,2 | 0,900 |
| Área residencial (urbana) | 397 | 85,0 | 153 | 86,0 | 0,654 | 107 | 88,4 | 0,221 | 100 | 86,2 | 0,669 |
| Área geoclimática | 0,011 | 0,020 | 0,000 | ||||||||
| Atlántica | 118 | 25,2 | 36 | 30,5 | 31 | 26,3 | 12 | 10,2 | |||
| Continental | 209 | 44,7 | 95 | 45,5 | 65 | 31,1 | 70 | 33,5 | |||
| Mediterránea | 141 | 30,1 | 47 | 33,3 | 25 | 17,7 | 34 | 24,3 | |||
| Estación de estudio (primavera) | 261 | 55,8 | 101 | 56,7 | 0,740 | 69 | 57,0 | 0,747 | 66 | 56,9 | 0,801 |
| Características ambientales | |||||||||||
| Hermanos (n≥1) | 288 | 62,1 | 113 | 63,8 | 0,537 | 75 | 62,5 | 0,910 | 73 | 62,9 | 0,809 |
| Lactancia materna (≥1 mes) | 349 | 76,5 | 125 | 71,0 | 0,028 | 83 | 69,2 | 0,026 | 84 | 73,0 | 0,314 |
| Guardería (inicio edad<2 años) | 154 | 33,0 | 51 | 28,7 | 0,113 | 28 | 23,1 | 0,007 | 38 | 32,8 | 0,969 |
| Tabaco durante la gestación | 127 | 27,7 | 44 | 25,0 | 0,313 | 29 | 24,2 | 0,318 | 30 | 26,1 | 0,649 |
| Fumadores en el hogar | 209 | 44,8 | 78 | 43,8 | 0,725 | 52 | 43,0 | 0,630 | 55 | 47,4 | 0,537 |
| Mascota en el hogar | 138 | 29,6 | 44 | 24,9 | 0,078 | 31 | 25,8 | 0,292 | 27 | 23,5 | 0,105 |
| Características clínicas | |||||||||||
| Antecedente familiar asma | 189 | 41,5 | 79 | 45,4 | 0,188 | 52 | 44,1 | 0,517 | 52 | 46,0 | 0,251 |
| Antecedente familiar dermatitis | 181 | 39,9 | 75 | 43,1 | 0,267 | 47 | 39,8 | 0,992 | 52 | 46,0 | 0,115 |
| Sibilancias | |||||||||||
| Sibilancias recurrentes (≥3) | 351 | 76,3 | 126 | 72,4 | 0,126 | 91 | 77,8 | 0,664 | 78 | 68,4 | 0,023 |
| Sibilancias sin catarro de vías altas | 180 | 38,8 | 78 | 43,8 | 0,080 | 65 | 53,7 | 0,000 | 43 | 37,1 | 0,684 |
| Dermatitis atópica | |||||||||||
| Dermatitis actual | 178 | 38,0 | 79 | 44,4 | 0,027 | 48 | 39,7 | 0,667 | 61 | 52,6 | 0,000 |
| Dermatitis (moderada-grave) | 80 | 50,0 | 48 | 61,5 | 0,006 | 48 | 62,5 | 0,042 | 60 | 63,3 | 0,009 |
| Laringitis aguda | 135 | 29,2 | 59 | 33,3 | 0,120 | 47 | 39,2 | 0,005 | 32 | 27,8 | 0,748 |
| Rinitis alérgica | 67 | 14,5 | 32 | 18,3 | 0,074 | 27 | 22,9 | 0,003 | 13 | 11,5 | 0,228 |
| Alergia/intolerancia alimentos | 39 | 8,4 | 23 | 13,0 | 0,005 | 16 | 13,3 | 0,024 | 20 | 17,4 | 0,000 |
Estimación de odds ratio ajustadas para la sensibilización inmunoglobulina E alergenoespecífica global y a neumoalérgenos y trofoalérgenos, según las características demográficas y epidemiológicas en los niños participantes en el estudio Aplicaciones de Phadiatop infant® en la Alergia Infantil
| Global | Neumoalérgenos | Trofoalérgenos | ||||
| ORA | IC del 95% | ORA | IC del 95% | ORA | IC del 95% | |
| Características demográficas | ||||||
| Sexo (masculino) | 1,91 | (1,24–2,95) | 1,92 | (1,16–3,19) | 1,77 | (1,08–2,91) |
| Edad (3–5 años) | 1,96 | (1,27–3,00) | 4,42 | (2,61–7,49) | 1,15 | (0,71–1,86) |
| Estación (primavera) | 1,09 | (0,71–1,66) | 1,13 | (0,70–1,83) | 1,01 | (0,62–1,63) |
| Área de residencia (urbana) | 1,20 | (0,66–2,18) | 1,73 | (0,86–3,49) | 1,05 | (0,52–2,10) |
| Área geoclimática | ||||||
| Atlántica | 1,00 | 1,00 | 1,00 | |||
| Continental | 2,26 | (1,30–3,93) | 1,38 | (0,76–2,52) | 6,15 | (2,88–13,10) |
| Mediterránea | 1,39 | (0,76–2,55) | 0,67 | (0,33–1,34) | 4,06 | (1,81–9,12) |
| Características ambientales | ||||||
| Hermanos (n≥1) | 1,08 | (0,69–1,68) | 1,02 | (0,61–1,68) | 1,23 | (0,75–2,02) |
| Lactancia materna (≥un mes) | 0,51 | (0,31–0,84) | 0,50 | (0,28–0,86) | 0,58 | (0,33–1,03) |
| Guardería (inicio edad <2 años) | 0,88 | (0,56–1,38) | 0,71 | (0,42–1,23) | 1,12 | (0,68–1,85) |
| Tabaco durante la gestación | 0,85 | (0,51–1,42) | 0,80 | (0,44–1,44) | 0,92 | (0,51–1,65) |
| Fumadores en el hogar (actual) | 1,01 | (0,64–1,61) | 0,84 | (0,50–1,41) | 1,39 | (0,82–2,35) |
| Mascota en el hogar (actual) | 0,66 | (0,42–1,06) | 0,82 | (0,48–1,39) | 0,59 | (0,34–1,02) |
IC: intervalo de confianza; ORA: odds ratio ajustada.
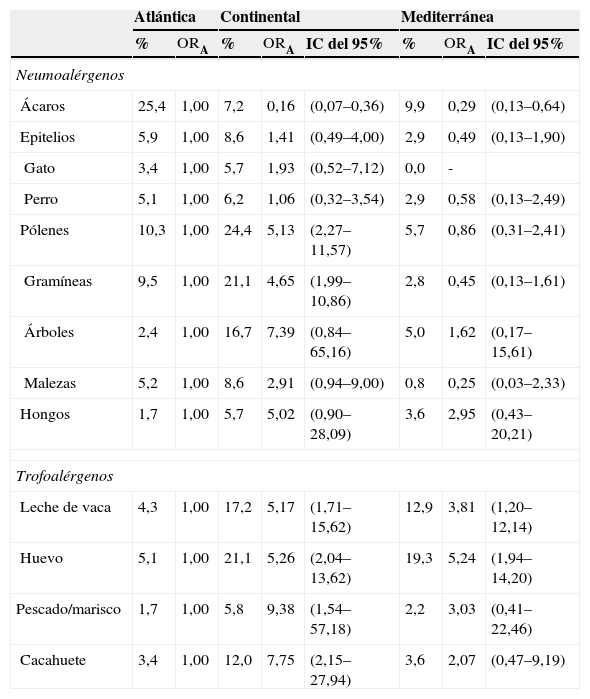
Finalmente, el análisis del patrón geoclimático de la sensibilización a las distintas clases de alérgenos mostró para el área continental respecto a la atlántica un riesgo menor de sensibilización a ácaros y un riesgo mayor a pólenes de gramíneas, leche de vaca, huevo, pescado/marisco y cacahuete, mientras que para el área mediterránea respecto a la atlántica mostró un riesgo menor de sensibilización a ácaros y un riesgo mayor a leche de vaca y huevo (tabla 5).
Estimación de odds ratio ajustadas para la sensibilización de inmunoglobulina E alergenoespecífica a clases de inhalantes y alimentos, según el área geoclimática de los niños participantes en el estudio Aplicaciones de Phadiatop infant® en la Alergia Infantil
| Atlántica | Continental | Mediterránea | ||||||
| % | ORA | % | ORA | IC del 95% | % | ORA | IC del 95% | |
| Neumoalérgenos | ||||||||
| Ácaros | 25,4 | 1,00 | 7,2 | 0,16 | (0,07–0,36) | 9,9 | 0,29 | (0,13–0,64) |
| Epitelios | 5,9 | 1,00 | 8,6 | 1,41 | (0,49–4,00) | 2,9 | 0,49 | (0,13–1,90) |
| Gato | 3,4 | 1,00 | 5,7 | 1,93 | (0,52–7,12) | 0,0 | - | |
| Perro | 5,1 | 1,00 | 6,2 | 1,06 | (0,32–3,54) | 2,9 | 0,58 | (0,13–2,49) |
| Pólenes | 10,3 | 1,00 | 24,4 | 5,13 | (2,27–11,57) | 5,7 | 0,86 | (0,31–2,41) |
| Gramíneas | 9,5 | 1,00 | 21,1 | 4,65 | (1,99–10,86) | 2,8 | 0,45 | (0,13–1,61) |
| Árboles | 2,4 | 1,00 | 16,7 | 7,39 | (0,84–65,16) | 5,0 | 1,62 | (0,17–15,61) |
| Malezas | 5,2 | 1,00 | 8,6 | 2,91 | (0,94–9,00) | 0,8 | 0,25 | (0,03–2,33) |
| Hongos | 1,7 | 1,00 | 5,7 | 5,02 | (0,90–28,09) | 3,6 | 2,95 | (0,43–20,21) |
| Trofoalérgenos | ||||||||
| Leche de vaca | 4,3 | 1,00 | 17,2 | 5,17 | (1,71–15,62) | 12,9 | 3,81 | (1,20–12,14) |
| Huevo | 5,1 | 1,00 | 21,1 | 5,26 | (2,04–13,62) | 19,3 | 5,24 | (1,94–14,20) |
| Pescado/marisco | 1,7 | 1,00 | 5,8 | 9,38 | (1,54–57,18) | 2,2 | 3,03 | (0,41–22,46) |
| Cacahuete | 3,4 | 1,00 | 12,0 | 7,75 | (2,15–27,94) | 3,6 | 2,07 | (0,47–9,19) |
IC: intervalo de confianza; ORA: odds ratio ajustada.
El estudio APiA investigó la frecuencia y el tipo de sensibilización alérgica, así como los factores relacionados con ambas características, en niños de 0 a 5 años de edad que consultaron en el primer nivel asistencial por episodios de sibilancias o dermatitis atópica. En una muestra poblacional con representación de distintas áreas geoclimáticas españolas, el estudio APiA detectó sensibilización a neumoalérgenos o trofoalérgenos en una proporción relevante (38%) de los niños pequeños tratados en atención primaria por tales procesos, cualesquiera que fuesen su recurrencia o gravedad. En lo que se refiere al tipo de sensibilización, se observó un porcentaje similar para inhalantes (26%) y alimentos (25%), circunstancia que refleja la importancia de la vía digestiva en el inicio del fenómeno alérgico y, por otro lado, indica la pertinencia de considerar ambas categorías de alérgenos en la evaluación de las manifestaciones clínicas de posible causa alérgica acontecidas en la infancia temprana. Por otro lado, habida cuenta de que la muestra se generó en condiciones asistenciales reales, el estudio APiA ilustra la rentabilidad potencial de la determinación de anticuerpos IgEAE en el examen alergológico de lactantes y preescolares con síntomas respiratorios o cutáneos tratados en el primer nivel. Así, el presente estudio complementa trabajos previos que proponen el uso de pruebas objetivas para mejorar la precisión del diagnóstico de la alergia en atención primaria, en este caso en niños de corta edad con síntomas comunes cuya intensidad leve o moderada no precisan su derivación al nivel especializado, pero pueden beneficiarse de alguna intervención terapéutica específicamente dirigida a esta afección18.
Con respecto a las manifestaciones clínicas, el estudio APiA describió 3 fenotipos fácilmente diferenciables: “sibilancias sólo” (sin historia de eccema), “dermatitis sólo” (sin historia de sibilancias) y, de manera distintiva, “sibilancias y dermatitis” (presentes simultánea o secuencialmente), ya que la coexistencia de ambos procesos revela un trasfondo atópico e implica una probabilidad mayor de sensibilización alérgica11,19. Adicionalmente, la clasificación de las sibilancias según su asociación a manifestaciones cutáneas puede tener un interés clínico, pues la dermatitis atópica diagnosticada por el médico es un criterio de positividad de un índice de predicción de asma muy utilizado en el tratamiento de las sibilancias recurrentes en menores de 3 años20,21. No obstante, en el estudio APiA la proporción de sensibilización alérgica del fenotipo “sibilancias y dermatitis” ocupó una posición intermedia (39%) entre las correspondientes a los fenotipos “dermatitis sólo” (55%) y “sibilancias sólo” (32%). Así, pues, en los niños con sibilancias incluidos en el presente estudio, el antecedente diagnóstico de dermatitis atópica, sin otra precisión acerca de su presencia actual o gravedad, implicó tan sólo un discreto incremento de la probabilidad de sensibilización dependiente de IgE, situación que apoya la idoneidad de la evaluación del estatus alérgico en ambos fenotipos respiratorios. Acerca de esta cuestión, es preciso tener en cuenta que algunos trabajos han demostrado que la detección de sensibilización temprana, en especial a neumoalérgenos, puede sustituir con ventaja a otros criterios en la predicción del riesgo de tener asma en edades posteriores de la vida14.
Tal y como era de prever, la frecuencia y el tipo de sensibilización predominante, ya a inhalantes o alimentos, observados en el estudio APiA guardaron una relación estrecha con la edad. En primer lugar, la sensibilización tanto global como a neumoalérgenos o trofoalérgenos ocurrió en mayor proporción en los niños de 3 a 5 años que en los de 0 a 2 años, con la sola excepción de la correspondiente a alimentos, en los que presentaron dermatitis atópica sin historia de sibilancias. Por otro lado, en los niños de menor edad la proporción de sensibilización a inhalantes fue siempre menor que la sensibilización a alimentos, sobre todo en el fenotipo antes aludido, mientras que en los mayores se produjo exactamente la situación inversa. Además, el análisis multivariante abundó en la misma conclusión, pues el riesgo de sensibilización a neumoalérgenos se incrementó de manera significativa con la edad (ORA: 4,4; IC del 95%: 2,6–7,5) mientras que el riesgo de sensibilización a trofoalérgenos no varió según ésta (ORA: 1,2; IC del 95%: 0,7–1,9). Puestos en conjunto, los resultados observados en el estudio APiA se ajustan fielmente a la secuencia denominada marcha alérgica; según ésta, las primeras respuestas IgEAE ocurren frente a proteínas contenidas en alimentos, como leche y huevo, para más tarde desarrollarse frente a inhalantes tanto domésticos como del exterior, a la vez que, en paralelo, se desarrollan las manifestaciones clínicas, inicialmente digestivas y cutáneas (alergia a alimentos y dermatitis atópica) y posteriormente respiratorias (asma y rinitis alérgica)10.
Aunque la variabilidad en la metodología impone límites a la interpretación de los hallazgos, resulta interesante comparar las prevalencias de sensibilización alérgica observadas en el estudio APiA con las de cohortes de base poblacional originarias de otras áreas geográficas. Así, por ejemplo, una investigación realizada en Inglaterra encontró porcentajes de sensibilización a los 4 años muy parecidos a los del presente estudio en niños con diagnóstico médico de asma (44%) y de eccema (43%)22. También otro trabajo llevado a cabo en Dinamarca observó proporciones de sensibilización a los 18 meses y 5 años superponibles a las del estudio APiA en niños con asma actual (el 25 y el 39%, respectivamente), si bien difirieron bastante en los niños que tuvieron dermatitis actual (el 9 y el 78% en ese orden de edad)23. Además, un análisis longitudinal desarrollado en Australia detectó un porcentaje de sensibilización similar al del presente estudio en preescolares con asma reciente (37%), mientras que otro estudio transversal realizado en Italia observó una proporción sólo algo menor en niños de esa edad con dermatitis atópica definida mediante cuestionario (32%)24,25. Por otro lado, las prevalencias de sensibilización alérgica reportadas en la literatura médica suelen ser claramente superiores cuando se seleccionan sujetos con antecedentes familiares de atopia o procesos alérgicos de mayor intensidad. Así, por ejemplo, un trabajo llevado a cabo en Estados Unidos de América detectó una proporción de sensibilización a los 2–3 años bastante superior a la del estudio APiA en niños con más de 3 episodios de sibilancias que cumplieron criterios adicionales de riesgo de asma (en total 61%, a inhalantes el 54%, y a alimentos el 33%)14. En el mismo sentido, una investigación de base hospitalaria desarrollada en Suecia observó una prevalencia acumulada de sensibilización entre 0–7 años también muy superior en niños con dermatitis atópica moderada/grave (inhalantes, el 80% y alimentos, el 62%)26. Así, pues, si bien las diferencias pueden atribuirse parcialmente a cuestiones metodológicas, como el uso de diferentes técnicas (in vivo o in vitro) para la evaluación de la alergia y, sin duda, los factores ambientales desempeñan un papel importante, se puede concluir que las prevalencias de sensibilización alérgica observadas en el estudio APiA se encuentran más próximas a las de cohortes no seleccionadas y podrían considerarse representativas del conjunto de la población infantil con síntomas de posible origen alérgico.
El estudio APiA constató un fuerte incremento del riesgo de sensibilización alérgica en el sexo masculino (ORA: 1,9), con predominio durante la infancia que, asimismo, otros trabajos han mostrado ya presente a una edad muy temprana27. En cuanto a las características ambientales, resulta interesante destacar el menor riesgo de sensibilización observado en los niños que fueron amamantados (ORA: 0,5; IC del 95%: 0,3–0,8), en especial en la situación actual, en que el paradigma que atribuye a la lactancia materna un papel protector frente a las enfermedades alérgicas se está poniendo en entredicho28. A este respecto, estudios de cohortes y de intervención dirigidos específicamente a explorar esta cuestión han verificado la asociación entre la lactancia materna exclusiva mantenida y el estatus alérgico, sobre todo en hijos de madres con trasfondo atópico29,30. Así, pues, el hallazgo realizado en el presente estudio precisa una explicación alternativa, que puede venir dada por el efecto protector que ejerce la lactancia materna sobre las infecciones respiratorias agudas de origen viral causantes de las sibilancias precoces no atópicas21. Por otro lado, el estudio APiA no detectó ningún influjo de las infecciones en la infancia temprana, evaluado a través de marcadores epidemiológicos como el número de hermanos y la asistencia a guardería, sobre la probabilidad de sensibilización, hecho que, cuando menos, no opera en contra de un hipotético papel protector de la lactancia natural frente a las enfermedades alérgicas. En cuanto al tabaco, el presente estudio no advirtió ningún efecto de este hábito en la madre durante la gestación ni de la convivencia con fumadores en el hogar sobre el riesgo de sensibilización dependiente de IgE, hallazgo que se encuentra en consonancia con buena parte de los estudios epidemiológicos que han abordado esta compleja cuestión sobre la que hay informes contradictorios, si bien un exhaustivo metaanálisis ha establecido que resulta poco probable que la exposición prenatal o durante los primeros años de vida al tabaco incremente el riesgo de sensibilización alérgica en niños de manera significativa31,32. Por último, el estudio APiA no pudo demostrar de forma fehaciente un efecto de la exposición a alérgenos de origen animal sobre la probabilidad de sensibilización alérgica, aunque en este caso no se puede descartar un error estadístico tipo β, ya que se apreció una tendencia a la protección del riesgo de sensibilización a alimentos en caso de presencia de mascotas en el hogar (ORA: 0,6; IC del 95%: 0,3–1,0), circunstancia que también se ha puesto de manifiesto en otros estudios33.
Tal vez las observaciones más interesantes del estudio APiA derivan de su carácter multicéntrico y se refieren, precisamente, a la distribución geoclimática de la sensibilización alérgica en la primera infancia en un territorio cuya población teóricamente comparte muchos factores ambientales, incluyendo los relacionados con el estilo de vida, implicados en la génesis de las enfermedades alérgicas. Como preámbulo a esta cuestión, sirva señalar que el International Study of Asthma and Allergies in Childhood (ISAAC) ha mostrado la influencia de variables atmosféricas, como la humedad relativa y la temperatura medias, en la prevalencia de los síntomas de asma y dermatitis atópica durante la infancia34. Por otro lado, la península ibérica constituye un ámbito geográfico apropiado para el estudio de las variaciones climáticas, ya que en un espacio relativamente pequeño coexisten 3 subtipos de clima templado, atlántico (oceánico) y mediterráneo en los litorales respectivos, y continental (mediterráneo continentalizado) en la meseta interior. Así, el ISAAC España ha observado una prevalencia de síntomas de asma y dermatitis a los 6–7 años en el área atlántica norte (costa gallega y cornisa cantábrica) más elevada que en la continental y, en menor proporción, la mediterránea, circunstancia que se ha atribuido principalmente al efecto del clima sobre la distribución geográfica de diversos neumoalérgenos (ácaros y pólenes)35,36. No obstante, la realidad parece ser algo más compleja, ya que el mismo ISAAC ha detectado una proporción de sensibilización alérgica a los 10–11 años claramente superior en una ciudad de clima continental (Madrid) que en otra ciudad de clima mediterráneo (Cartagena), si bien la fracción poblacional de asma atribuible a la atopia fue mayor en esta última localidad37.
El estudio APiA observó una proporción de sensibilización alérgica en el área geoclimática continental (46%) superior a la existente en las áreas mediterránea (33%) y atlántica (31%), de forma que, respecto a esta última, el riesgo estimado se incrementó ampliamente en la primera (ORA: 2,3; IC del 95%: 1,3–3,9). Así, pues, al dar por sentadas la uniformidad en la metodología del estudio y las características de la población analizada, se puede considerar la influencia del clima, si se atiende a la probabilidad de sensibilización de los distintos alérgenos implicados. En el presente estudio no hubo diferencias apreciables entre áreas geoclimáticas en la proporción de sensibilización a inhalantes, si bien lógicamente su clase vino dada por la distribución geográfica de los alérgenos considerados. Como era de esperar, los principales causantes de la sensibilización en el área atlántica fueron los ácaros (25,4%), en el área continental los pólenes (24,4%) y en el área mediterránea nuevamente los ácaros (9,9%), si bien en menor proporción que en la primera. Por contra, se advirtió un marcado incremento del riesgo de sensibilización a alimentos tanto en el área continental (ORA: 6,1; IC del 95%: 2,9–13,1) como en la mediterránea (ORA: 4,1; IC del 95%: 1,8–9,1) respecto a la atlántica, y los principales implicados en las 3 áreas consideradas fueron el huevo y la leche. Así, pues, el estudio APiA puso de manifiesto la posible influencia de factores geoclimáticos en la sensibilización alérgica a alimentos en niños pequeños con sibilancias o dermatitis atópica, hallazgo no reportado para el país, que precisa confirmarse o descartarse mediante un estudio de diseño multicéntrico específicamente dirigido a dirimir esta cuestión. Mientras tanto, resulta difícil atribuir un origen a semejante discrepancia, pues si bien el diseño transversal del presente estudio no permite excluir un sesgo de selección de la muestra, resulta improbable esta eventualidad dado el protocolo común de inclusión, el ajuste de posibles factores de confusión, y la congruencia de los resultados obtenidos para la sensibilización a inhalantes. Tampoco parece probable que las variaciones en la distribución geoclimática de la sensibilización a alimentos observada se deban a diferencias geográficas en los hábitos alimentarios de la población infantil, dadas la generalidad y homogeneidad del consejo nutricional, incluyendo el calendario de introducción de la alimentación complementaria, realizado desde la edad de lactante en la atención primaria pediátrica. A este respecto, un estudio ha demostrado diferencias entre Suecia y Estonia en la prevalencia de sensibilización a alimentos en niños de 10–11 años con síntomas de asma en el año previo, que se atribuyeron al estilo de vida, mucho más occidentalizado en el país escandinavo, al que correspondió la sensibilización más elevada, así como a la distinta composición de la flora intestinal derivada de los hábitos dietéticos existentes en los 2 países38.
En síntesis, el estudio APiA constató que una proporción relevante de los niños de 0 a 5 años de edad que reciben asistencia sanitaria en atención primaria por episodios de sibilancias o dermatitis atópica presentan sensibilización a neumoalérgenos o trofoalérgenos comunes. Asimismo, el estudio APiA observó variaciones en la prevalencia de sensibilización alérgica, y en las clases de alérgenos causantes de ésta, entre las distintas áreas geoclimáticas de la península ibérica, diferencias sólo parcialmente explicadas por la distribución geográfica de los alérgenos implicados y que, en todo caso, deberán confirmarse mediante estudios específicamente diseñados para esa finalidad.
Conflicto de interesesLos autores han recibido aportaciones económicas de Phadia España para la puesta en marcha de actividades de docencia e investigación relacionadas con el asma y las enfermedades alérgicas. El estudio APiA ha recibido soporte económico, material y logístico de Phadia España.
FinanciaciónEl estudio APiA ha recibido soporte económico, material y logístico de Phadia España.
A las enfermeras que se ocuparon de la obtención de la muestra de sangre y a los facultativos de análisis clínicos que realizaron las determinaciones de los test de alergia.
Díaz Vázquez C. (coordinador), Jiménez Cortés A., Lora Espinosa A., Praena Crespo M. (Andalucía), Pardos Martínez C., Castillo Laíta J. A. (Aragón), Carvajal Urueña I., Díaz Vázquez C., Domínguez Aurrecoechea B., García Merino A. (Asturias), Delgado Ayza M., García Gallego A., De Muga Doria M. E., Pérez Porcuna X. M., Ridao Redondo M. L., Torregrosa Bertet M. J. (Cataluña), Aguilar Peral M., Morell Bernabé J. J. (Extremadura), Bamonde Rodríguez L., Garnelo Suárez L. (Galicia), Blanco González J. E., Cortés Rico O., Montón Álvarez J. L., Pascual Pérez J. M., Sánchez Gómez J. (Comunidad de Madrid), Callén Blecua M. (País Vasco).