Introducción
La meningitis bacteriana era una enfermedad infecciosa uniformemente letal antes del advenimiento de los agentes antimicrobianos. Debido a la introducción de potentes antibióticos y a la sofisticación de la atención médica especializada, las tasas asociadas de mortalidad han disminuido de forma apreciable en los últimos 15 años1. El reconocimiento del importante papel desempeñado por la síntesis de mediadores inmunológicos, más que del propio microorganismo invasor, en la génesis y perpetuación de la cascada inflamatoria meníngea ha promovido la utilización de fármacos antiinflamatorios para potencialmente aminorar la lesión cerebral y mejorar el pronóstico de los pacientes afectados2,3.
La comprensión de la fisiopatología de la meningitis bacteriana, de las características particulares de cada patógeno meníngeo, de la constitución y dinámica del líquido cefalorraquídeo (LCR) en el espacio subaracnoideo y de las propiedades farmacológicas de los agentes antimicrobianos facilita la selección de la terapia antibiótica óptima para el adecuado tratamiento de la enfermedad4.
Patogénesis
Hoy día se sabe que para que un paciente desarrolle meningitis deben tener lugar, al menos, 5 pasos patogénicos de progresión secuencial (fig. 1):
Figura 1. Cascada fisiopatológica de la meningitis bacteriana.
1. Presencia del patógeno bacteriano en la mucosa nasofaríngea (se estima que entre el 5 y el 25 % de niños sanos están colonizados por los principales agentes causales de meningitis: Haemophilus influenzae tipo b, Streptococcus pneumoniae y Neisseria meningitidis).
2. Infección viral del tracto respiratorio superior que facilita la penetración de la bacteria colonizante a través del epitelio nasofaríngeo.
3. Invasión del torrente circulatorio por el patógeno meníngeo (bacteriemia).
4. Siembra bacteriana de las meninges debido a la entrada del agente causal a través de los plexos coroideos o de la microvasculatura cerebral.
5. Inflamación meníngea inducida por la entrada de componentes plasmáticos (leucocitos, proteínas, etc.) a través de una barrera hematoencefálica permeable.
Una vez que el microorganismo logra su entrada al espacio subaracnoideo, éste se multiplica rápidamente, debido principalmente a la ausencia de anticuerpos opsónicos neutralizantes en el LCR. Debido a la muerte bacteriana espontánea o aquella provocada por la terapia antimicrobiana, grandes cantidades de componentes de la pared celular (endotoxinas o complejos lipoteicoicos) son liberados al espacio subaracnoideo, marcando el inicio de la cascada inflamatoria meníngea. Esta inflamación de las meninges está mediada por la producción de numerosas citocinas o sustancias proinflamatorias por parte del huésped5.
Aunque las citocinas inicialmente sintetizadas son el factor de necrosis tumoral (TNF) y la interleucina-1 (IL-1), otro gran número de mediadores inflamatorios se produce y, de manera escalonada y sinergista, amplifican la cascada inflamatoria. La interrelación de todos estos complejos eventos se traduce en aumento de la permeabilidad de la barrera hematoencefálica, lo cual favorece la génesis de edema cerebral (vasogénico, intersticial y citotóxico) y de hipertensión intracraneal. Estos procesos patológicos, si no son detenidos o modulados tempranamente, pueden conducir eventualmente a procesos isquémicos, apoptosis neuronal, lesión cerebral difusa o regional o a la muerte del paciente afectado6.
Terapia antiinflamatoria
Hasta la fecha actual, la dexametasona representa el único agente antiinflamatorio que ha superado con éxito el riguroso análisis clínico llevado a cabo en sujetos, especialmente niños, con meningitis bacteriana. La evidencia que respalda la utilidad de la dexametasona se sustenta en investigaciones realizadas en el modelo animal, en estudios in vitro y en ensayos clínicos controlados7.
En estudios que han comparado animales o seres humanos tratados con esteroides frente a otros sometidos a terapia con placebo se han documentado modulación de los procesos fisiopatológicos, disminución del edema cerebral y la hipertensión intracraneal, atenuación de los índices inflamatorios en el LCR, reducción de la síntesis y expresión de citocinas inflamatorias, mejoría en manifestaciones clínicas y prevención de secuelas auditivas y neurológicas. Se detectaron óptimos resultados cuando la dexametasona se administraba antes o simultáneamente con el tratamiento antimicrobiano mientras que su inicio tardío estuvo asociado con beneficio marginal o nulo8.
En animales de experimentación, el beneficio de la terapia con esteroides se ha demostrado en la meningitis inducida por diferentes bacterias grampositivas y gramnegativas o por la inoculación intracisternal de los componentes proinflamatorios correspondientes de sus paredes microbianas. En pacientes, la mayor parte de la información disponible se ha obtenido en las meningitis causadas por H. influenzae. No obstante, la evaluación colectiva de una serie de estudios clínicos prospectivos, mediante la aplicación del método metaanalítico, sugiere también la efectividad de la dexametasona en la neuroinfección neumocócica, en particular si se administra de forma temprana9. La dosis preferida actualmente en muchos países es 0,4 mg/kg por vía intravenosa cada 12 h durante 2 días.
La penetración de los antibióticos a través de la barrera hematoencefálica se compromete con el uso concomitante de cualquier fármaco antiinflamatorio10, lo cual ha generado una reciente preocupación por el potencial retraso en la erradicación microbiana del espacio subaracnoideo durante la terapia combinada de dexametasona con agentes antimicrobianos. Aunque no existe evidencia clínica contundente sobre la ocurrencia de este efecto adverso, el creciente aumento de la resistencia de S. pneumoniae a los betalactámicos (penicilinas, cefalosporinas de amplio espectro, meropenem) obliga a ser cauteloso en el manejo y evaluación de los pacientes infectados por estas cepas. La reciente identificación de aislamientos de S. pneumoniae que muestran tolerancia a la vancomicina merece que se esté en máxima alerta para asegurar la rápida desaparición del germen del LCR11.
Se han evaluado diversos compuestos antiinflamatorios en el modelo experimental de meningitis pero, hasta la fecha, no se ha iniciado investigación clínica sobre ninguno de estos fármacos. Como ejemplos de sustancias estudiadas puede señalarse indometacina, pentoxifilina, anticuerpos anticitocinas, inhibidores de la adhesión leucocitaria al endotelio, IL-10, etc. El entusiasmo por seguir investigando en el campo de la meningitis bacteriana experimental ha descendido significativamente después de los notables avances conseguidos en el desarrollo de vacunas efectivas para la prevención de infecciones sistémicas causadas por H. influenzae, S. pneumoniae y algunos serogrupos de meningococos.
Terapia antimicrobiana
La meningitis bacteriana representa una infección que acontece en un espacio desprovisto de propiedades inmunológicas de defensa (ausencia de complemento y anticuerpos específicos), requeridas para lograr la eficiente fagocitosis del microorganismo invasor. Por lo tanto, tan pronto como una bacteria penetra en el compartimiento subaracnoideo, la multiplicación microbiana se produce muy rápidamente, lo que apoya el empleo de antibióticos con alto poder bactericida para asegurar la pronta erradicación del patógeno. En el modelo experimental de meningitis, la máxima eficacia antibacteriana se logra cuando la concentración del antibiótico en el LCR supera por 10 veces la concentración bactericida mínima (CBM) frente al microorganismo aislado12.
La actividad de los fármacos antimicrobianos en el tratamiento de pacientes con meningitis depende de la ecuación: concentración alcanzada en el LCR sobre la concentración bactericida mínima (CBM) para el patógeno causal (tabla 1). El numerador es un reflejo de la concentración plasmática del fármaco administrado y su grado de penetración al LCR. Además, deben tenerse en consideración las propiedades farmacodinámicas del antibiótico para maximizar su efectividad. Por ejemplo, los aminoglucósidos y las quinolonas poseen un mecanismo de acción dependiente de la concentración y del efecto postantibiótico; los índices que determinan su efectividad son: área bajo la curva sobre CBM y concentración máxima en LCR sobre CBM13. Por el contrario, los antibióticos betalactámicos (penicilinas, cefalosporinas y carbapenemes) y la vancomicina basan su efectividad en el porcentaje de tiempo que su concentración en el LCR supera la CBM, lo que obliga a utilizar intervalos de administración más frecuentes14.
La penetración de un antibiótico al LCR depende de sus características físicas y químicas (tamaño molecular, porcentaje de unión a proteínas, grado de ionización en pH fisiológico y liposolubilidad) y de la permeabilidad de la barrera hematoencefálica. El paso del fármaco al espacio subaracnoideo es mínimo a través de meninges intactas pero apreciable durante cualquier proceso inflamatorio que lesione la integridad del tejido cerebral. El porcentaje de penetración de los antibióticos betalactámicos oscila entre 5 y 20 % de su concentración sérica, mientras que para agentes liposolubles (cloranfenicol, rifampicina, quinolonas) los valores pueden alcanzar hasta el 30-50 %.
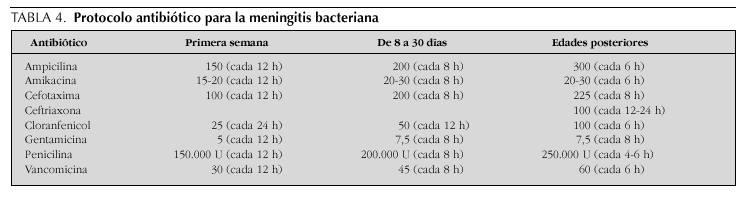
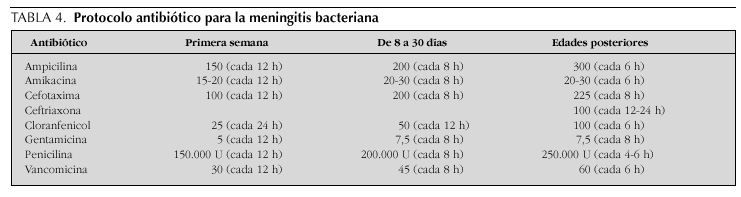
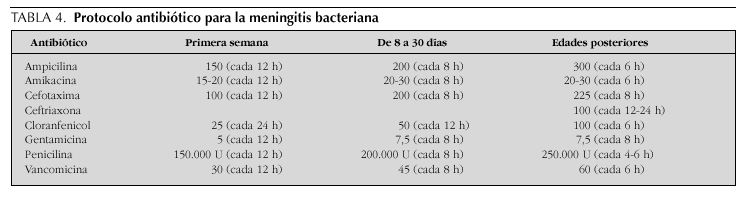
Tradicionalmente, la elección de la terapia antimicrobiana para niños con meningitis ha dependido del espectro etiológico encontrado más frecuentemente en revisiones nacionales e internacionales, ajustadas a la edad del paciente afectado (tabla 2). De esta manera, los antibióticos históricamente utilizados han incluido el uso de ampicilina más un aminoglucósido para la meningitis neonatal, ampicilina más cloranfenicol para la infección en lactantes y penicilina para la enfermedad en niños mayores y adolescentes.
En los últimos 15 años, sin embargo, se han suscitado cambios importantes en la epidemiología y el patrón de resistencia de los patógenos meníngeos comunes, lo que ha favorecido la implementación de modificaciones a los regímenes terapéuticos convencionales15. La virtual desaparición de las infecciones causadas por H. influenzae gracias a la vacunación sistemática y el aumento vertiginoso de la resistencia en los bacilos gramnegativos (período neonatal) y en serotipos de S. pneumoniae han promovido cambios en los esquemas empíricos de terapia antibiótica. Así pues, la combinación de ampicilina con cefalosporinas de espectro ampliado en el lactante menor de 3 meses de edad, la monoterapia con cefotaxima o ceftriaxona en el niño mayor y la adición de vancomicina en áreas prevalentes de neumococos resistentes constituyen las recomendaciones actuales para el tratamiento antimicrobiano de la meningitis bacteriana pediátrica.
Una vez que se ha identificado el microorganismo causal de la meningitis, se procede a mantener o cambiar el antibiótico inicial de acuerdo con el patrón esperado de sensibilidad antimicrobiana. El tratamiento de la infección por S. agalactiae, Listeria monocytogenes y enterococos apoya el empleo de ampicilina o penicilina más un aminoglucósido; los bacilos gramnegativos se manejan con cefalosporinas de tercera generación o, en el caso de resistencia, con meropenem o cefepima (la ciprofloxacina es utilizada en cepas multirresistentes). La cefotaxima o ceftriaxona se recomiendan en la meningitis por H. influenzae, S. pneumoniae y N. meningitidis. Conviene destacar que la vancomicina usualmente se adiciona en áreas prevalentes de neumococos resistentes y que la penicilina todavía representa un fármaco de primera elección en el tratamiento la meningitis meningocócica. La duración usual de la terapia antimicrobiana es de 14-21 días en el período neonatal, 7-10 días en la meningitis por H. influenzae y S. pneumoniae y 5-7 días en la infección meningocócica.