La ototoxicidad se presenta en diversos porcentajes según estudios tras el tratamiento con quimioterapia basada en platino y/o radioterapia craneal. El objetivo es mostrar nuestra experiencia en la monitorización de la ototoxicidad.
Material y métodosSe realizó una revisión del 1999 al 2019 en el registro de pacientes oncológicos pediátricos de nuestro hospital y remitidos a la Unidad de Hipoacusia Infantil.
Resultados46 pacientes fueron remitidos a nuestra unidad. 41 pacientes recibieron platinos como parte de su tratamiento, 17 pacientes fueron sometidos a una intervención neuroquirúrgica y 18 pacientes recibieron radioterapia craneal. A todos se les realizó una anamnesis y otoscopia, y la monitorización se llevó a cabo con una audiometría tono-verbal y/o productos de distorsión. Se objetivó una hipoacusia como secuela del tratamiento en ocho pacientes (21,05% de los pacientes remitidos para seguimiento audiológico). Fue imposible determinar la situación audiológica al finalizar el tratamiento en ocho pacientes. La adaptación audioprotésica fue necesaria en dos pacientes. En la coordinación con Oncología Pediátrica, se consideró oportuno el cambio de cisplatino por carboplatino por ototoxicidad importante durante el tratamiento en un único paciente.
ConclusiónEs imprescindible una adecuada coordinación con Oncología Pediátrica para realizar una vigilancia activa de la ototoxicidad y modificar, si es posible, la dosificación o el tipo de quimioterápico en caso de verse afectada la audición. En nuestra experiencia, y siguiendo las recomendaciones actuales, realizamos una valoración pretratamiento, una monitorización durante el tratamiento, al finalizarlo y después de forma anual por el riesgo de desarrollo diferido de una hipoacusia.
Ototoxicity occurs in different percentages in patients after treatment with platinum-based chemotherapy or cranial radiation therapy. The aim of this study was to present experience in ototoxicity monitoring.
Material and methodsA review was made of the registry of paediatric cancer patients referred to the Children's Hearing Loss Unit from 1999 to 2019.
ResultsOf the 46 patients referred to this unit, 41 had received platinum as part of their treatment, 17 patients underwent neurosurgery, and 18 patients received cranial radiation therapy. An anamnesis and otoscopy were performed on all of them, and the monitoring was carried out with tone-verbal audiometry and/or distortion products. Hearing loss was observed in eight patients (21.05% of patients referred for audiological follow-up) as a consequence of the treatment. It was impossible to determine the audiological situation in eight patients at the end of treatment. Hearing aid adaption was necessary in two patients. In coordination with Paediatric Oncology, a change from cisplatin to carboplatin due to bilateral grade two ototoxicity was considered appropriate during treatment in one patient.
ConclusionAdequate coordination with Paediatric Oncology is essential to carry out active surveillance for ototoxicity and to modify, if possible, the dosage or type of chemotherapy in case hearing is affected. In our experience, and following current recommendations, a pre-treatment assessment is usually performed, as well as monitoring during treatment, at the end of treatment, and annually thereafter due to the risk of a later development of hearing loss.
Los medicamentos ototóxicos producen una alteración funcional y/o una degeneración celular de los tejidos del oído interno. La cocleotoxicidad se define como el daño que afecta al sistema auditivo dando como resultado una hipoacusia neurosensorial y/o acúfenos1. En la actualidad más de 150 medicamentos son considerados como ototóxicos. Se incluyen antibióticos aminoglucósidos, glicopéptidos y macrólidos, quimioterápicos derivados del platino, diuréticos del asa, quinina y salicilatos entre otros2. La ototoxicidad es, por norma, permanente. Sin embargo, existe un mecanismo de reversibilidad que se ha observado en estudios en animales y en algunos casos en humanos que explica que una lesión inicial en las células marginales de la stria vascularis (por ejemplo, en el caso del cisplatino) pueda revertir si se permite la actuación de los procesos reparativos. Si no es el caso, el acúmulo adicional del agente ototóxico frustra las posibilidades de recuperación dando paso a la destrucción definitiva de las células ciliadas externas y a una hipoacusia permanente3.
Los avances en el tratamiento del cáncer infantil han permitido mejorar el pronóstico de estos pacientes, con una supervivencia media a 5 años mayor del 80% en los países desarrollados. Sin embargo, estas mejoras en el pronóstico se ven empañadas por la presencia de efectos adversos a largo plazo derivados del tratamiento4-6. Uno de ellos es la ototoxicidad, que se presenta en aproximadamente un 50% de los pacientes tras el tratamiento con quimioterapia basada en platino, radioterapia craneal, o ambas4,7. Se manifiesta como una disminución de la audición en frecuencias agudas, normalmente acompañado por acúfenos4,8. La ototoxicidad puede ocurrir tanto en niños como en adultos, pero los niños son más vulnerables a sus efectos (sobre todo los de más corta edad), ya que las vías auditivas y del lenguaje están aún en desarrollo9.
A pesar de las recomendaciones la vigilancia de la ototoxicidad infantil es insuficiente. Un 72% de los pacientes considerados de riesgo han sido sometidos a test audiológicos durante el seguimiento y solamente un 43% han sido seguidos con una monitorización audiológica completa antes y después del tratamiento10. El hecho de que los niños que presentan una hipoacusia neurosensorial moderada o severa debida a ototoxicidad muestren un deterioro significativo en las funciones intelectuales globales, lectura y análisis matemático a los 5 años11, y que estas secuelas puedan ser evitadas con el oportuno tratamiento audiológico, hace cobrar relevancia a la atención audiológica desde el inicio del tratamiento oncológico4.
El objetivo de este trabajo es mostrar nuestra experiencia de 20 años en la vigilancia de la ototoxicidad en una población oncológica pediátrica en un hospital terciario y explicar el protocolo de monitorización y seguimiento de la función auditiva a largo plazo que deriva de ella, incorporando los avances tecnológicos y organizativos de la última década.
Material y métodosSe realizó una revisión, desde 1999 al 2019, en el registro de pacientes oncológicos con tumores sólidos tratados por el Servicio de Pediatría de nuestro hospital y que fueron remitidos a la Unidad de Hipoacusia Infantil para la vigilancia de la ototoxicidad. El estudio fue aprobado por el Comité de Ética de la Investigación del Principado de Asturias (Proyecto N° 2020.287; fecha: 8 de junio de 2020).
Se llevó a cabo un análisis retrospectivo y descriptivo de las características clínicas de los pacientes, y se correlacionó con el desarrollo de ototoxicidad durante el tratamiento o el seguimiento clínico. Las características clínicas y demográficas de los pacientes se resumieron usando estadísticos descriptivos estándar. La correlación entre ototoxicidad y las variables clínicas fue analizada mediante la versión 21 del software para Mac de IBM SPSS Statistics usando Chi-cuadrado de Pearson. Los valores de p < 0,05 fueron considerados estadísticamente significativos.
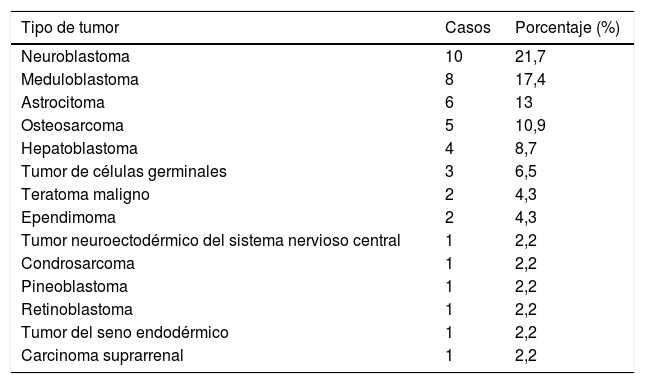
ResultadosUn total de 46 pacientes fueron remitidos a la Unidad de Hipoacusia Infantil. La media de edad al diagnóstico fue de seis años, siendo 24 pacientes varones (52%) y 22 mujeres (48%). De todos ellos, 41 pacientes no tenían antecedentes personales de interés, uno presentaba una hipoacusia congénita, tres pacientes presentaban síndromes congénitos (Síndrome de Li Fraumeni, Síndrome de Poland y Síndrome de Wiedeman-Beckwik) y un paciente presentaba coartación de aorta. En la tabla 1 se recogen los tipos de tumor que se presentaron al diagnóstico.
Tipos de tumor que se presentaron al diagnóstico
| Tipo de tumor | Casos | Porcentaje (%) |
|---|---|---|
| Neuroblastoma | 10 | 21,7 |
| Meduloblastoma | 8 | 17,4 |
| Astrocitoma | 6 | 13 |
| Osteosarcoma | 5 | 10,9 |
| Hepatoblastoma | 4 | 8,7 |
| Tumor de células germinales | 3 | 6,5 |
| Teratoma maligno | 2 | 4,3 |
| Ependimoma | 2 | 4,3 |
| Tumor neuroectodérmico del sistema nervioso central | 1 | 2,2 |
| Condrosarcoma | 1 | 2,2 |
| Pineoblastoma | 1 | 2,2 |
| Retinoblastoma | 1 | 2,2 |
| Tumor del seno endodérmico | 1 | 2,2 |
| Carcinoma suprarrenal | 1 | 2,2 |
Un total de 41 pacientes recibieron platinos como parte de su tratamiento, a 17 pacientes se les sometió a una intervención neuroquirúrgica y 18 pacientes recibieron radioterapia craneal. En la tabla 2 se recogen las combinaciones de tratamiento administradas. En la tabla 3 se recogen las dosis medias de platinos administradas. Los pacientes que recibieron cisplatino y/o dosis superiores de 1.500 mg/m2 de carboplatino fueron 36 (17 pacientes cisplatino, cuatro pacientes carboplatino a dosis superiores a 1.500 mg/m2 y 15 pacientes cisplatino y carboplatino). En cuanto a la radioterapia, la dosis media recibida fue de 57,1 Gy, todos los pacientes recibieron irradiación craneal por encima de 30 Gy.
Combinaciones de tratamiento administradas
| Combinaciones de tratamiento | N° de pacientes |
|---|---|
| Platinos + otros quimioterápicos no ototóxicos | 25 |
| Intervención neuroquirúrgica + radioterapia + platinos | 13 |
| Intervención neuroquirúrgica + platinos | 2 |
| Radioterapia | 2 |
| Intervención neuroquirúrgica + radioterapia | 1 |
| Platinos + radioterapia | 1 |
| Intervención neuroquirúrgica | 1 |
A todos los casos remitidos a la Unidad de Hipoacusia Infantil se les realizó una anamnesis y una otoscopia. La monitorización se llevó a cabo con una audiometría tono-verbal, productos de distorsión o ambas. En los menores de dos años se realizó una audiometría conductual adaptada a la edad. 28 pacientes fueron remitidos para su valoración audiológica antes de recibir los tratamientos ototóxicos, de ellos solo un paciente tenía hipoacusia previa. Sin embargo, de los otros 18 se desconoce su situación audiológica previa. Durante el tratamiento y el seguimiento se objetivó una hipoacusia como manifestación de ototoxicidad asociada a la administración de ototóxicos en ocho pacientes (dos pacientes menores de dos años, tres pacientes de dos a seis años y tres pacientes mayores de seis años). No fue posible determinar la situación audiológica al finalizar el tratamiento en ocho pacientes (por exitus tres pacientes y por no acudir a las revisiones programadas en cinco pacientes). De esta forma, un 21,05% de los pacientes a los que se les realizó un adecuado seguimiento audiológico presentaron hipoacusia. Se cuantificó la ototoxicidad en cada oído siguiendo la escala de ototoxicidad SIOP Boston (tabla 4). Solamente un paciente refirió acúfenos bilaterales como secuela del tratamiento. Aunque no se objetivó hipoacusia en la audiometría, el paciente sí refirió acúfenos bilaterales al finalizar el tratamiento. Se recomendó terapia sonora antiacúfenos y siguió revisiones periódicas con buena tolerancia subjetiva a los mismos. A una paciente se le detectó una pseudohipoacusia con umbrales audiométricos alterados no concordantes con la conversación y pruebas objetivas normales. Fue necesario indicar la adaptación audioprotésica en dos pacientes por ototoxicidad grado IV en la escala de Boston. Ningún paciente requirió tratamiento rehabilitador con logopedia ni se indicó implante coclear. En la coordinación con Oncología Pediátrica, se consideró oportuno el cambio de cisplatino por carboplatino por ototoxicidad grado II bilateral durante el tratamiento en un único paciente.
Escala de ototoxicidad SIOP Boston
| Escala ototoxicidad de Boston | Oído derecho | Oído izquierdo |
|---|---|---|
| Grado 0: ≤ 20 dB en todas las frecuencias | 32 (84,2%) | 30 (78,9%) |
| Grado 1: > 20 dB HNS por encima de 4 KHz | 3 (7,9%) | 4 (10,5%) |
| Grado 2: > 20 dB HNS a 4 KHz o más | 1 (2,6%) | 1 (2,6%) |
| Grado 3: > 20 dB HNS a 2 KHz o más | 0 (0%) | 1 (2,6%) |
| Grado 4: > 40 dB HNS a 2 KHz o más | 2 (5,3%) | 2 (5,3%) |
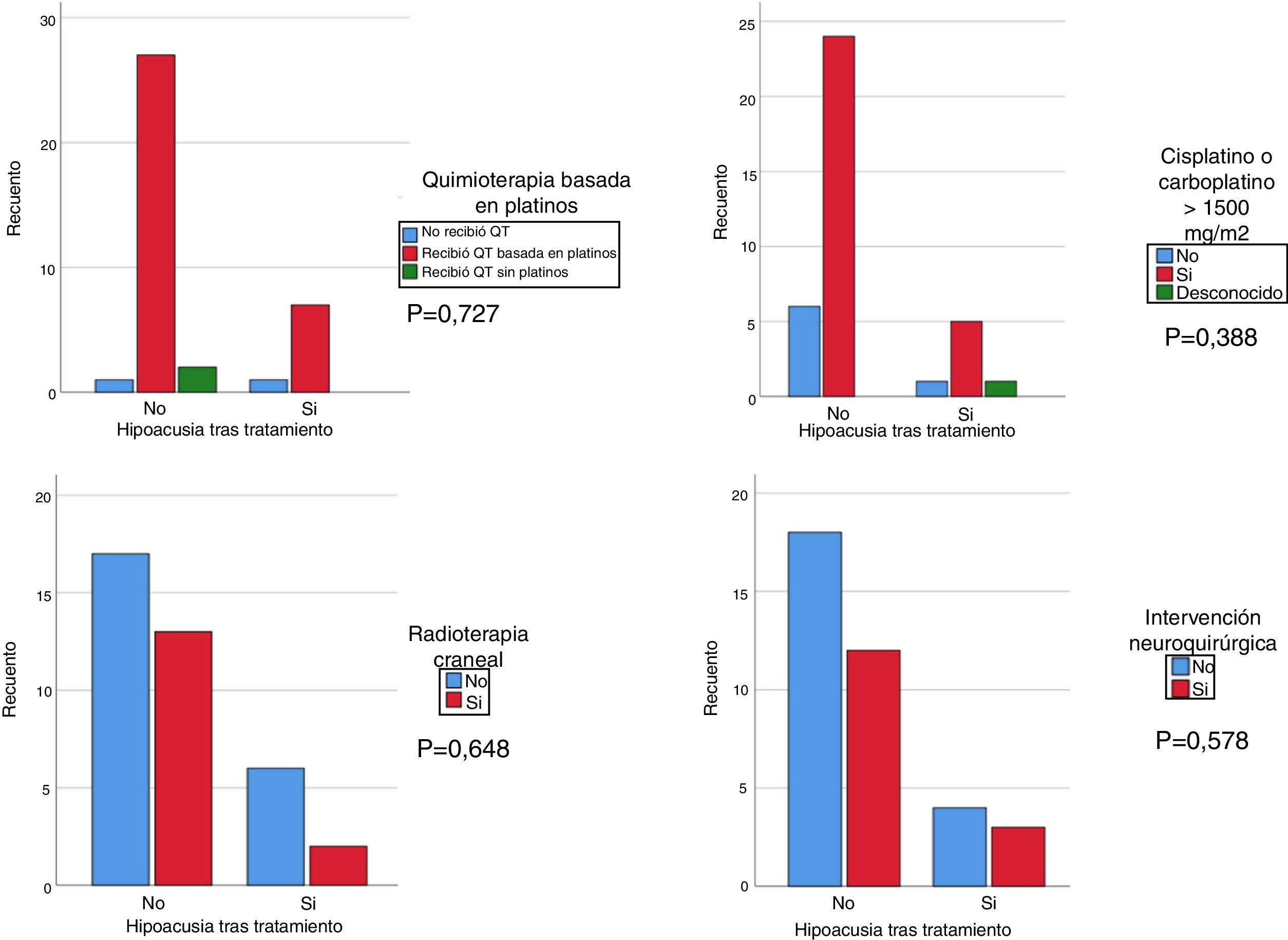
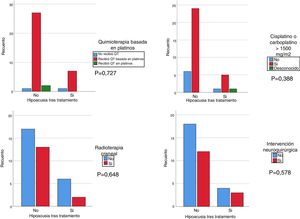
Se realizó un análisis mediante Chi-cuadrado para correlacionar la hipoacusia tras el tratamiento con el grupo de pacientes que recibieron cisplatino (cualquier dosis) y/o >1.500 mg/m2 de carboplatino, recibieron irradiación craneal con más de 30 Gy y/o se realizó una intervención neuroquirúrgica. Si bien no se obtuvo significación estadística, el grupo de pacientes que recibieron tratamiento con platinos, irradiación craneal y cisplatino y/o dosis mayores de 1.500 mg/m2 de carboplatino presentaron una hipoacusia de mayor gravedad, respecto a los pacientes que no recibieron tratamiento con cisplatino y/o dosis menores de 1.500 mg/m2 y/o no irradiación craneal (fig. 1). Se correlacionó el desarrollo de hipoacusia con los grupos de edad (
Desde que se ha generalizado la puesta en marcha de los programas de detección precoz de la hipoacusia infantil la atención a la hipoacusia en la infancia ha progresado por los importantes avances en la tecnología (diagnóstica y terapéutica) y el desarrollo de unidades de audiología infantil, donde se realiza la confirmación de la hipoacusia descubierta en el cribado, el diagnóstico etiológico de las pérdidas de audición detectadas y su atención temprana. Paralelamente, la hipoacusia sobrevenida o de desarrollo tardío se ha beneficiado de estos progresos alertando a los pediatras y otorrinolaringólogos de la importancia de la pronta detección y tratamiento de este problema y dentro de él, la ototoxicidad, principalmente la relacionada con procesos oncológicos.
Para ofrecer unos adecuados cuidados audiológicos y minimizar las secuelas del deterioro de la función auditiva, como son los trastornos del habla, lenguaje, desarrollo socioemocional y dificultad en el aprendizaje, es esencial llevar a cabo una monitorización audiológica en aquellos pacientes que van a recibir un tratamiento ototóxico.
La hipoacusia provocada por el cisplatino se origina por un daño localizado en el órgano de Corti, concretamente por una degeneración de los estereocilios de las células ciliadas externas, stria vascularis y ganglio espiral12. El daño de las células ciliadas externas precede al de las internas y es más pronunciado en la espira basal de la cóclea, lo que explica la presentación audiométrica bilateral con mayor caída en las frecuencias agudas que luego se extiende a las frecuencias graves con la exposición prolongada13. Los niños menores de cinco años (por probable inmadurez coclear y vascular), y aquellos que reciben dosis acumuladas superiores a 400 mg/m2 de cisplatino presentan mayor riesgo. La pérdida de audición suele ser permanente, bilateral y simétrica -aunque se han observado presentaciones asimétricas- y se manifiesta durante, o poco después de terminar el tratamiento, pero también puede progresar lentamente en el futuro, incluso hasta 20 años después14. El carboplatino es un agente derivado del platino de segunda generación, y aunque se le considera un análogo menos tóxico del cisplatino, presenta un potencial de efecto tóxico sobre la cóclea, particularmente si se administra en altas dosis (mieloablativas)15. Los rangos de incidencia de ototoxicidad van desde ningún caso al 16,7%, y como dato a resaltar es la tendencia de la hipoacusia a presentarse de forma diferida (una media de 14 meses tras la última dosis)16. La radioterapia craneal se asocia frecuentemente con el cisplatino para el tratamiento de algunas formas de cáncer, produciendo esta asociación un mayor riesgo. La hipoacusia que produce la irradiación tiene un diagnóstico más complicado ya que puede presentarse como una hipoacusia de transmisión (al dañar el oído externo y/o medio), como una hipoacusia mixta, como una hipoacusia neurosensorial o como una hipoacusia retrococlear. En estas dos últimas, el daño se produce por la degeneración de las células ciliadas, células de soporte del órgano de Corti y/o fibras nerviosas del VIII par craneal17.
El audiograma presenta de forma típica una mayor afectación en las frecuencias agudas y puede aparecer de forma gradual incluso años después de la exposición. La gravedad de la hipoacusia está relacionada con la menor edad, con la asociación con cisplatino y con la dosis, considerándose que en el niño ha de limitarse a 35 Gy para minimizarla18,19.
En la serie de pacientes que presentamos se encontró que un 21,05% de los niños desarrollaron una hipoacusia como secuela del tratamiento con platinos, radioterapia craneal y/o intervención neuroquirúrgica. En estudios previos se reportan porcentajes mayores, en torno al 50%7,9,20,21 pero con gran variabilidad (entre el 1,7 y 90,1%). Estas cifras son reflejo de que los estudios son heterogéneos en relación con la definición de hipoacusia, test diagnósticos realizados, características de los pacientes, tipos de tratamientos oncológicos, otros fármacos ototóxicos administrados y la duración del seguimiento22.
Es esencial la remisión de estos pacientes a una valoración audiológica dada la importancia que tiene la detección y tratamiento temprano de la hipoacusia en la infancia, en especial en un contexto donde se espera una alta incidencia. Se recomienda extremar la vigilancia del desarrollo de una hipoacusia a los niños tratados con cisplatino, con o sin carboplatino a dosis altas (>1.500 mg/m2), o radioterapia craneal superior o igual a 30 Gy.
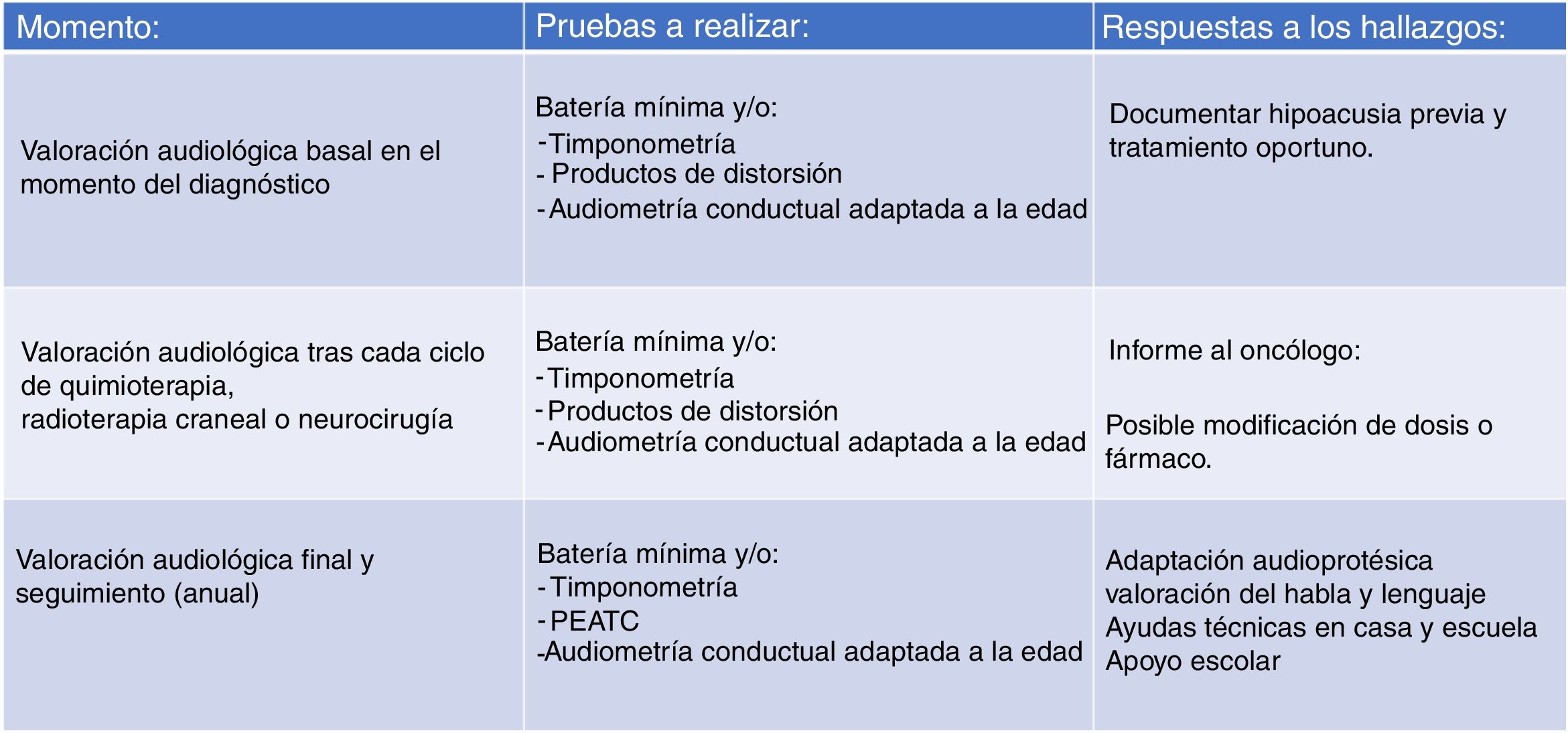
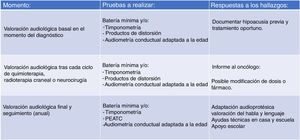
El importante número de pacientes en nuestra serie que no cuentan con una valoración audiológica basal -antes de iniciar el tratamiento- y los pacientes que se perdieron en el seguimiento, hizo necesaria una revisión de nuestro protocolo, proponiendo el que manejamos actualmente (fig. 2). Se intenta facilitar el acceso a las valoraciones audiológicas flexibilizando la agenda de la Unidad de Hipoacusia Infantil todo lo posible (valoración a demanda si el niño acude a otras consultas o pruebas en el hospital) para que todo paciente que vaya a ser sometido a un tratamiento potencialmente ototóxico cuente con una valoración audiológica basal. También es importante tener en cuenta que los niños pueden presentar un estado de afectación general que les impida su participación en pruebas audiométricas conductuales, por lo que el sistema de gradación de la ototoxicidad ha de ser flexible para aceptar dicha posibilidad.
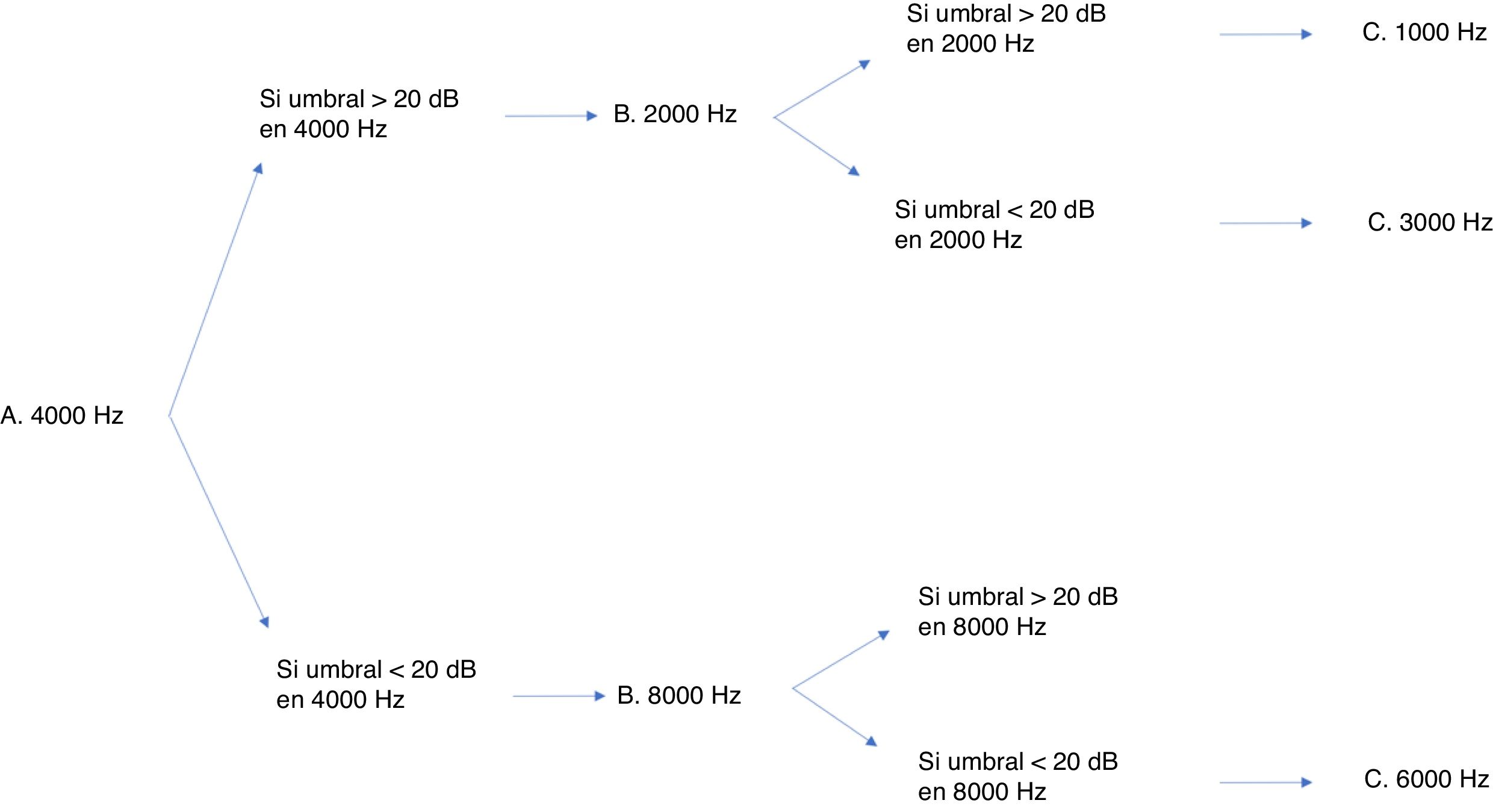
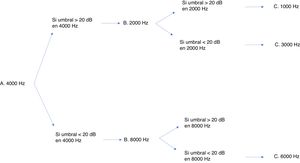
Existen numerosos protocolos de monitorización de la ototoxicidad, pero como se ha de contar con una uniformidad, se optó por la escala internacional de gradación SIOP Boston23. Aunque contar con una audiometría basal es lo ideal, para este protocolo no es imprescindible, por lo que da margen para los casos en los que no lo permite el estado del paciente. Además, esta escala es sensible a pequeños cambios en los niveles auditivos de las altas frecuencias y necesita conocer, para asignar con éxito un grado de afectación, los umbrales de muy pocas frecuencias24. Aunque el sistema de gradación requiera examinar pocas frecuencias no impide que se recomiende, en todos los casos que el estado general lo permita, una valoración audiológica completa. La batería mínima imprescindible se recoge en la figura 3. Las pruebas audiológicas adicionales, como las otoemisiones acústicas y potenciales evocados, no pueden sustituir a la audiometría conductual25. Quizá la posible excepción son los potenciales evocados auditivos, aunque sus resultados no han sido validados aún para su uso en los protocolos de quimioterapia. Los productos de distorsión de las otoemisiones acústicas tienen la capacidad de detectar cambios en el funcionamiento coclear antes de que se observe una caída en el audiograma26, por lo que se han mostrado eficaces para la detección de daño coclear. Sin embargo, como lo que sucede con los potenciales, no están aún validados. En nuestra experiencia, los productos de distorsión se han usado con eficacia y los consideramos imprescindibles para documentar la hipoacusia. En el caso de una niña mayor que presentaba una hipoacusia significativa ayudaron a demostrar que se trataba de una pseudohipoacusia al obtener unos productos de distorsión normales y evitar una innecesaria adaptación audioprotésica.
El protocolo que seguimos en la actualidad, basado en el sistema de gradación SIOP Boston, tiene tres niveles (fig. 2). El primero se ocupa de la valoración audiológica basal, que debe llevarse a cabo, si es posible, antes del tratamiento oncológico. El segundo nivel es el que se ocupa de la monitorización auditiva tras cada ciclo de quimioterapia o tras cualquier otro tratamiento que pudiera comprometer la audición (radioterapia o intervención neuroquirúrgica) con el fin de documentar la pérdida de audición por ototoxicidad e informar al oncólogo. Por último, el tercer nivel se ocupa de que, una vez terminado el tratamiento oncológico, se programe un seguimiento de la función auditiva que incluya la evaluación del habla y del lenguaje. La vigilancia se efectuará no más tarde de finalizar el tratamiento y luego anualmente en niños menores de seis años y entre los seis y 12 años y cada cinco años para los adolescentes mayores de 12 años o antes si surgen cambios clínicos.
En los casos en los que se documente un deterioro de los umbrales auditivos se debe tener establecido un circuito ágil de valoración audioprotésica para proveer de forma precoz y efectiva una adaptación de audífonos, rehabilitación logopédica y apoyo en el ámbito escolar.
Si un sistema de gradación que sea fácil de aplicar en la clínica es importante, también lo es en el ámbito de la investigación, como es el caso de la búsqueda de agentes otoprotectores. Se precisa contar con sistemas de documentación de los resultados que sean sensibles y uniformes y compararlos a través de los múltiples estudios que se publican al respecto. Otros estudios buscan determinar los factores que influyen en el riesgo individual de desarrollar una hipoacusia por ototóxicos. El 50% de los niños tratados con platinos desarrollarán una hipoacusia, pero cuáles son los factores que permiten al resto no presentarla es muy difícil de averiguar sin realizar estudios multicéntricos con el suficiente número de casos y sin contar con un sistema uniforme de registro de resultados24. Debido a la heterogeneidad de los resultados obtenidos en estudios sobre la asociación genética con la mayor susceptibilidad, parece que aún no se tienen las suficientes evidencias para recomendar un cribado de marcadores genéticos específicos27.
En cuanto a la aparición de tinnitus durante o tras el tratamiento, por lo general, se le presta poca atención, aunque se estima que hasta un 40% de los casos puede presentarlo. Este síntoma, que puede afectar sensiblemente a la calidad de vida es difícil de estudiar y de evidenciar. La escala NCI CTCAE v5.0 incluye al tinnitus entre los eventos adversos asociados a la ototoxicidad por quimioterapia28. El cuestionario para valorar el tinnitus más reciente y extendido es el tinnitus functional index (TFI), aunque se pueda usar solo en niños mayores y adolescentes, está diseñado para categorizar la gravedad del síntoma y para documentar las respuestas al tratamiento29. La atención al déficit auditivo infantil secundario a la grave situación que supone un proceso oncológico pone de manifiesto que existen espacios donde la colaboración entre especialidades puede mejorar y paliar las graves secuelas que sin tratamiento adecuado produce la hipoacusia. Además de asegurar el normal desarrollo del niño en el futuro puede aliviar de forma significativa el estado de fragilidad de las familias al ser tratado el problema en un sólido entorno que ha propiciado el desarrollo generalizado de los programas de cribado neonatal de la hipoacusia, de unidades de hipoacusia infantil, de la atención temprana especializada y de la integración en el ámbito escolar.
Como conclusión consideramos que es imprescindible una adecuada coordinación interservicios (Pediatría, Oncología Radioterápica, Farmacia, Neurocirugía) a fin de realizar una vigilancia activa de la ototoxicidad en esta población de pacientes y modificar, si es posible, la dosificación del quimioterápico en caso de verse afectada la audición. En nuestra experiencia, y siguiendo las recomendaciones más recientes, realizamos una valoración pretratamiento, una monitorización durante el tratamiento con ototóxicos, al finalizarlo y después de forma anual por el riesgo de desarrollo diferido de una hipoacusia.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.