Desde que Norwood et al. efectuaron la primera paliación exitosa en 1983, ha habido cambios sustanciales en el diagnóstico, el manejo y el pronóstico del síndrome de corazón izquierdo hipoplásico. La supervivencia en el estadio i de la paliación quirúrgica ha aumentado hasta el 90% en muchas instituciones, con la posibilidad de sobrevivir hasta la vida adulta. No obstante, la morbimortalidad asociada continúa siendo sustancial.
Aunque la premisa de la paliación quirúrgica por etapas del síndrome de corazón izquierdo hipoplásico está bien establecida, hay variaciones significativas en la técnica quirúrgica y el manejo entre distintos centros, y varios aspectos controvertidos siguen sin resolverse. En esta revisión resumimos las opciones quirúrgicas y de manejo disponibles actualmente para neonatos con síndrome de corazón hipoplásico, así como sus resultados.
Since the first successful palliation was performed by Norwood et al. in 1983, there have been substantial changes in diagnosis, management, and outcomes of hypoplastic left heart syndrome, Survival for stage 1 palliation has increased to 90% in many centres, with patients potentially surviving into adulthood. However, the associated morbidity and mortality remain substantial.
Although the principles of staged surgical palliation of hypoplastic left heart syndrome are well established, there is significant variability in surgical procedure and management between centres, and several controversial aspects remain unresolved. In this review, we summarize the current surgical and management options for newborns with hypoplastic left heart syndrome and their outcomes.
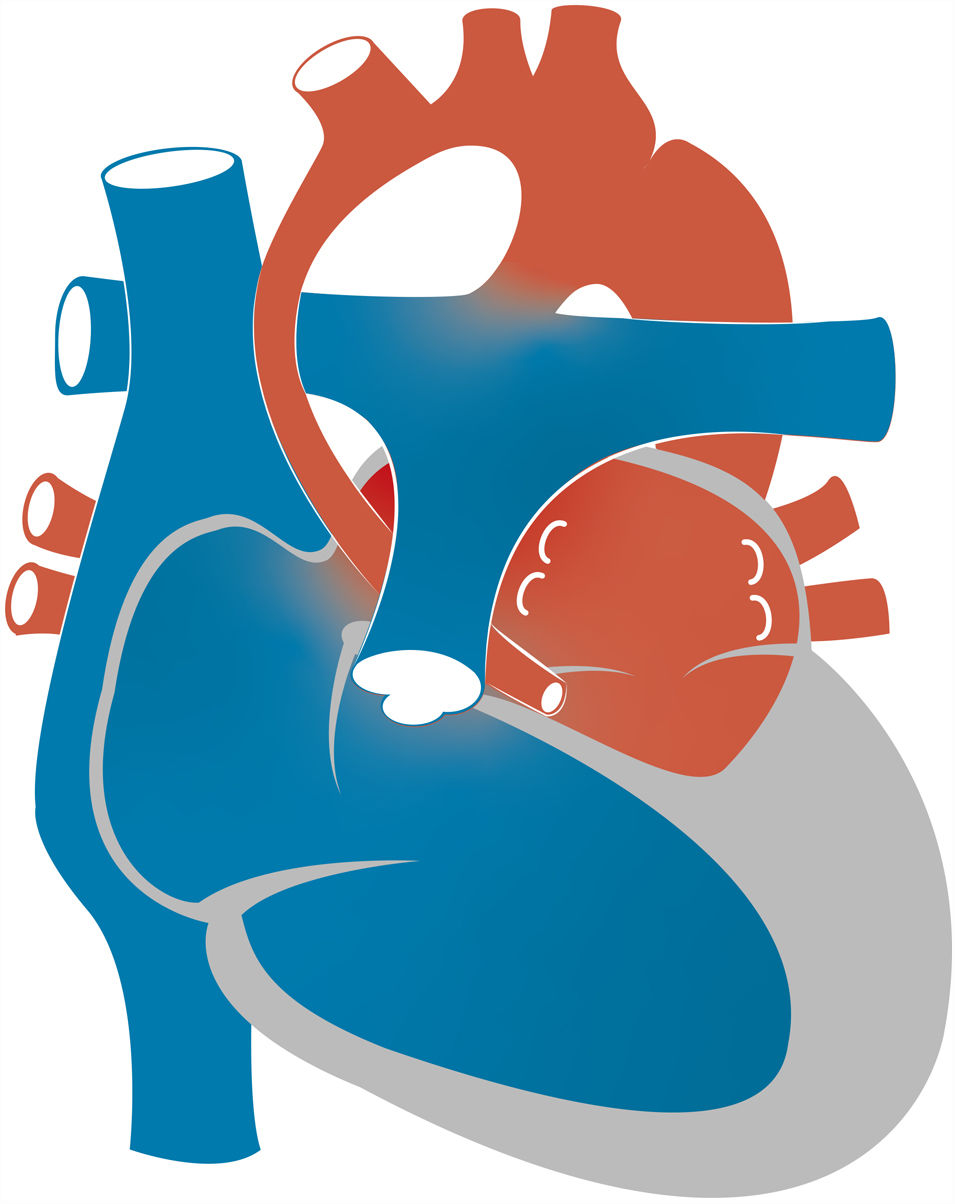
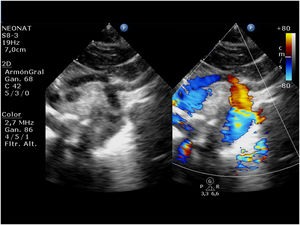
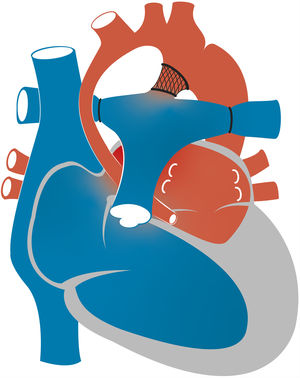
El síndrome de corazón izquierdo hipoplásico (SCIH) ocurre en 0,16-0,36 de cada 1.000 nacidos vivos y representa del 1,4 al 3,8% de las cardiopatías congénitas. Es responsable del 23% del total de muertes cardíacas en la primera semana de vida1. El término SCIH comprende un amplio abanico de lesiones caracterizadas por el infradesarrollo de las estructuras del lado izquierdo del corazón, que en casos extremos se manifiesta con atresia aórtica o mitral o estenosis grave e hipoplasia o la ausencia virtual del ventrículo izquierdo (VI) (fig. 1).
En los años 70 una multitud de artículos en la literatura quirúrgica describieron varios procedimientos ingeniosos que posibilitaron la supervivencia de neonatos con infradesarrollo del lado izquierdo del corazón. No obstante, no se documentó ningún procedimiento paliativo inicial (estadío I [E1]) que culminara en la paliación definitiva de Fontan hasta que William I. Norwood y colegas describieron la realización de una anastomosis en la que conectaron la arteria pulmonar (AP) y la aorta en el Boston Children's Hospital en 19832. Esta cirugía revolucionaria que resulta en el uso del ventrículo derecho (VD) como principal cavidad impulsora de la circulación sistémica se conoce como la cirugía de Norwood. En operaciones posteriores, la circulación sistémica y la pulmonar se separan mediante la conexión directa de la vena cava a la vasculatura pulmonar, lo que se conoce como fisiología de Fontan.
A lo largo del tiempo, se han introducido varias modificaciones técnicas y de manejo que han desembocado en un aumento de la supervivencia tras el E1 al 90% en muchos centros3, aunque continúa habiendo aspectos controvertidos y una morbimortalidad considerable durante el E1 y en el tiempo que transcurre entre las distintas etapas4. En esta revisión se describen las opciones quirúrgicas disponibles actualmente para los neonatos con SCIH, así como su pronóstico.
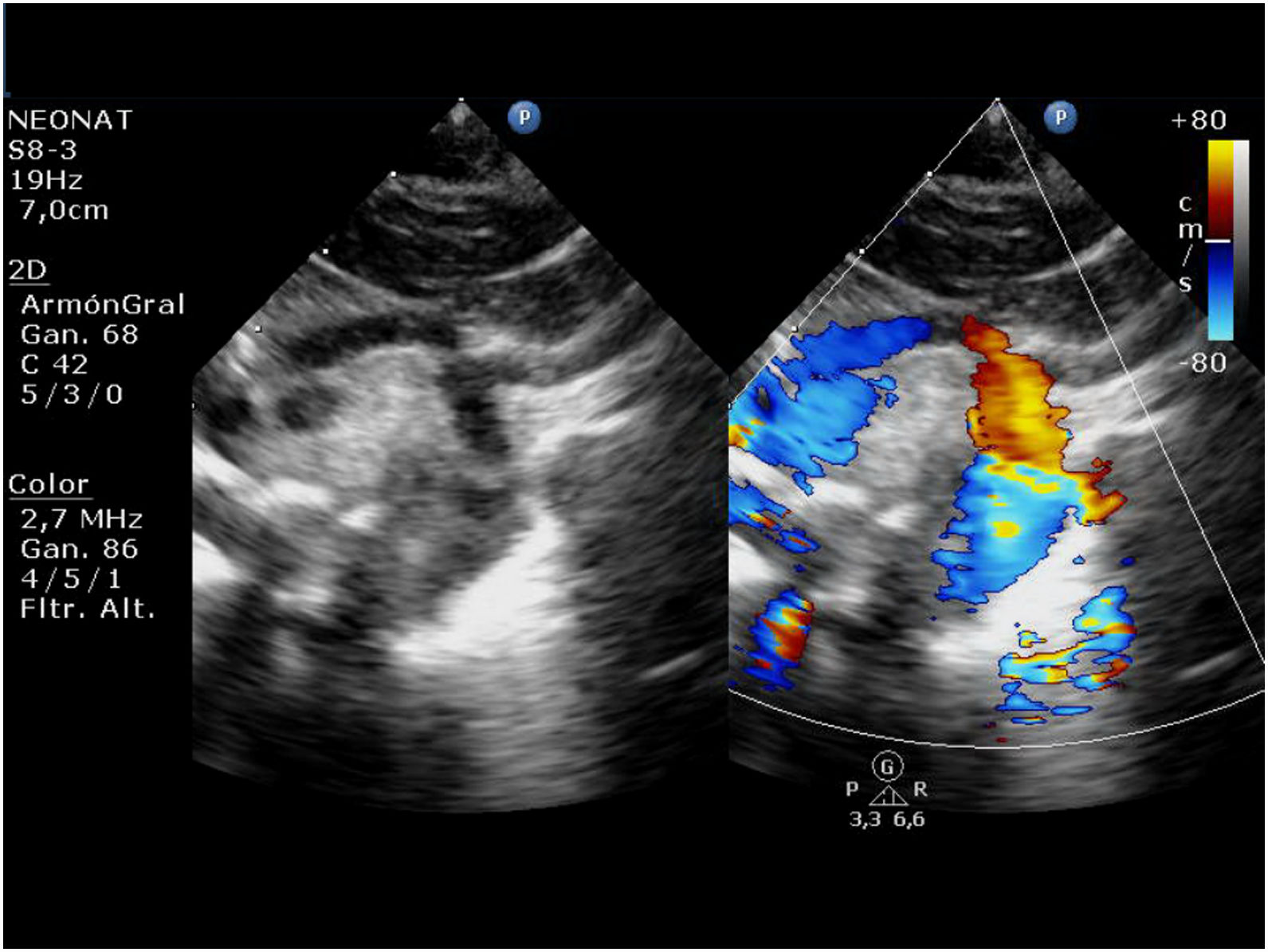
Fisiopatología, presentación clínica y manejo preoperatorioDurante la vida fetal, en la que las resistencias vasculares pulmonares (RVP) son elevadas y las resistencias vasculares sistémicas (RVS) reducidas, el VD funciona como ventrículo sistémico y el SCIH se tolera bien. Los neonatos afectados suelen ser recién nacidos a término con peso adecuado al nacer. Además, en las primeras horas de vida hay un período de «luna de miel» durante la cual las manifestaciones de inestabilidad hemodinámica son mínimas o nulas. En este estado de transición, el retorno venoso pulmonar llega a la aurícula izquierda y, aunque una pequeña parte puede llegar al VI hipoplásico a través de la válvula mitral, la mayor parte avanza a la aurícula derecha a través de un defecto en el septo interauricular. Por lo tanto, la sangre oxigenada de las venas pulmonares se mezcla con sangre no oxigenada del retorno venoso sistémico en la aurícula derecha, que a continuación es bombeada al VD y la AP. Una vez en el tronco pulmonar, el flujo sanguíneo dispone de 3«salidas»: las arterias pulmonares y el ductus arterioso (DA). En ausencia de obstrucción anatómica, la distribución de la sangre depende de la relación entre la RVP y la RVS. A través del DA, la sangre llega a la circulación sistémica y la aorta descendente, con flujo retrógrado hacia las ramas supraaórticas y las arterias coronarias (fig. 2). Puede haber una contribución marginal anterógrada del VI hipoplásico a la circulación sistémica.
El cierre del DA y el descenso de la RVP produce hipoperfusión sistémica e hiperaflujo pulmonar que progresan rápidamente a shock hemodinámico. Por lo tanto, el manejo inicial de neonatos con SCIH ha de incluir el mantenimiento de la permeabilidad del conducto arterioso mediante la administración de prostaglandinas y del equilibrio entre los flujos sistémico y pulmonar, principalmente mediante la manipulación de la RVP, asegurándose también una mezcla adecuada de flujos a nivel auricular. La situación preoperatoria ideal consiste en una distribución homogénea del flujo proveniente del VD entre las circulaciones pulmonar y sistémica, maximizándose el aporte de oxígeno a los tejidos y minimizándose el trabajo cardíaco. También se ha descrito la estabilización preoperatoria de neonatos críticos con SCIH mediante ECMO5. No obstante, la necesidad de soporte circulatorio mecánico antes o después de la cirugía de Norwood continúa siendo uno de los principales factores de riesgo que afectan a la supervivencia6.
El manejo perioperatorio específico de estos pacientes excede el alcance de este manuscrito. En España, estos pacientes complejos son derivados a 6 centros específicos distribuidos por todo el país, acreditados por el Ministerio de Salud y denominados Centros, Servicios y Unidades de Referencia, incluyendo el nuestro.
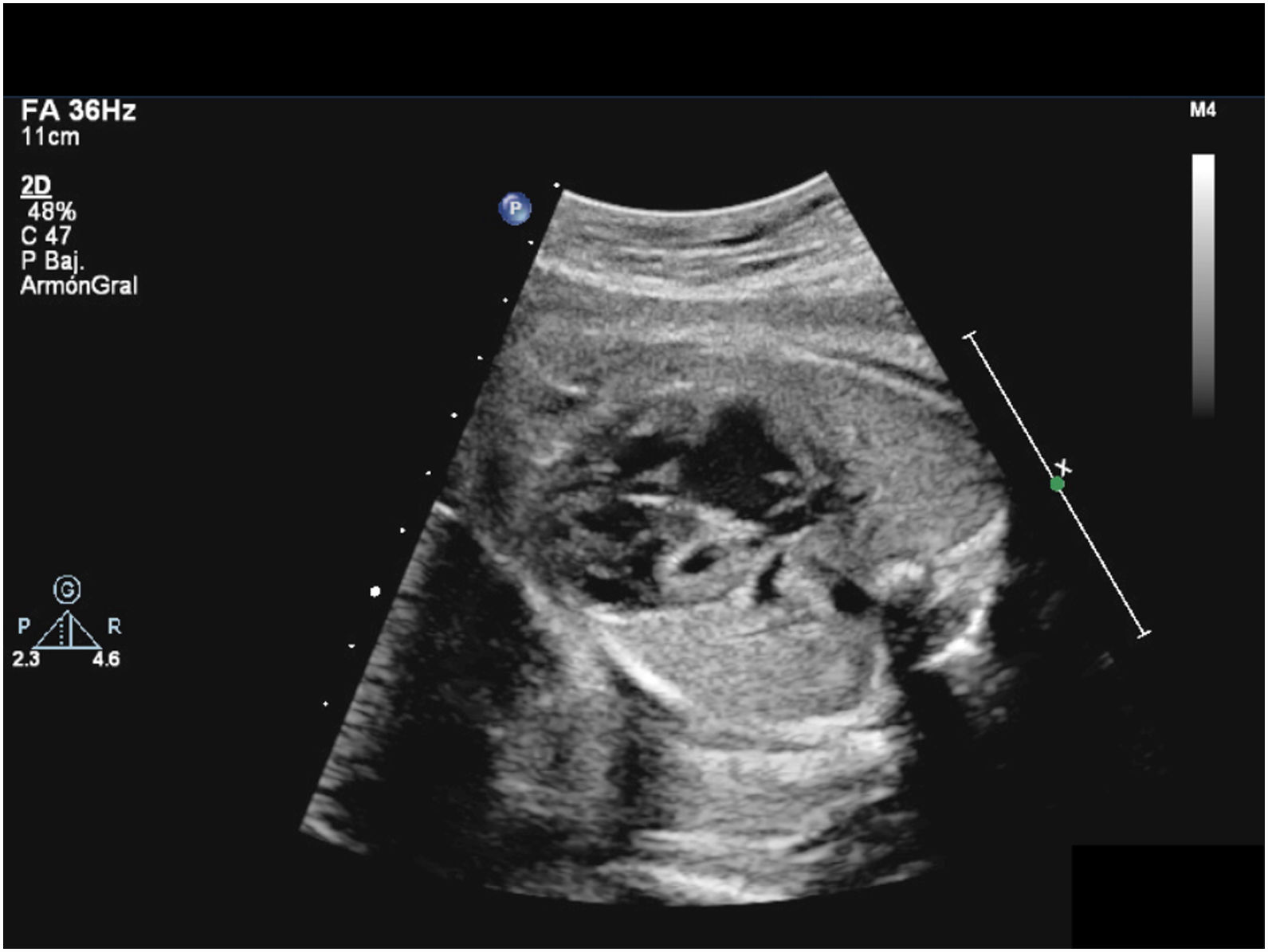
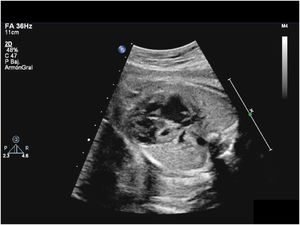
Diagnóstico e intervención prenatalesActualmente, muchos neonatos con SCIH se diagnostican antes de nacer, lo que permite la planificación del nacimiento y el tratamiento (fig. 3). El impacto del diagnóstico prenatal en los resultados a largo plazo del tratamiento quirúrgico es objeto de controversia. La mayoría de los datos no muestran una reducción en la mortalidad cuando el diagnóstico se establece prenatalmente7,8. No obstante, hay datos consistentes sobre la reducción de la morbilidad tras el diagnóstico prenatal de SCIH, incluyendo niveles más bajos de lactato y una mejor función renal preoperatorio, así como una reducción en las convulsiones tras el E17,9. La capacidad de detectar el VI hipoplásico en desarrollo (estenosis aórtica crítica) a mitad del embarazo permite la realización de valvuloplastia aórtica en fetos seleccionados. En 1991, Maxwell et al. publicaron su experiencia con la dilatación intrauterina de la válvula aórtica en 2 pacientes con estenosis aórtica10. Desde esta publicación, un número creciente de centros están ensayando técnicas de intervencionismo cardíaco fetal en todo el mundo y en 2010 se estableció un registro internacional de dichas intervenciones (el International Fetal Cardiac Interventions Registry)11. En 2014, el equipo de intervencionismo fetal en el Boston Children's Hospital publicó los resultados posnatales iniciales y la supervivencia en 100 fetos tratados mediante valvuloplastia aórtica, de los que 88 sobrevivieron hasta el nacimiento, con establecimiento de circulación biventricular en 3812.
La presencia de foramen oval restrictivo o tabique interauricular intacto se asocia a una mortalidad alta. La mortalidad perioperatoria inicial en el E1 de los pacientes con SCIH con antecedente prenatal de foramen oval restrictivo se sitúa en aproximadamente el 50%13. Los intentos de apertura quirúrgica del foramen oval en la vida fetal no se han asociado con cambios en el pronóstico. Esto se debe en parte a que puede que no se consiga mantener la permeabilidad de la comunicación interauricular a pesar de haberse realizado septostomía auricular14.
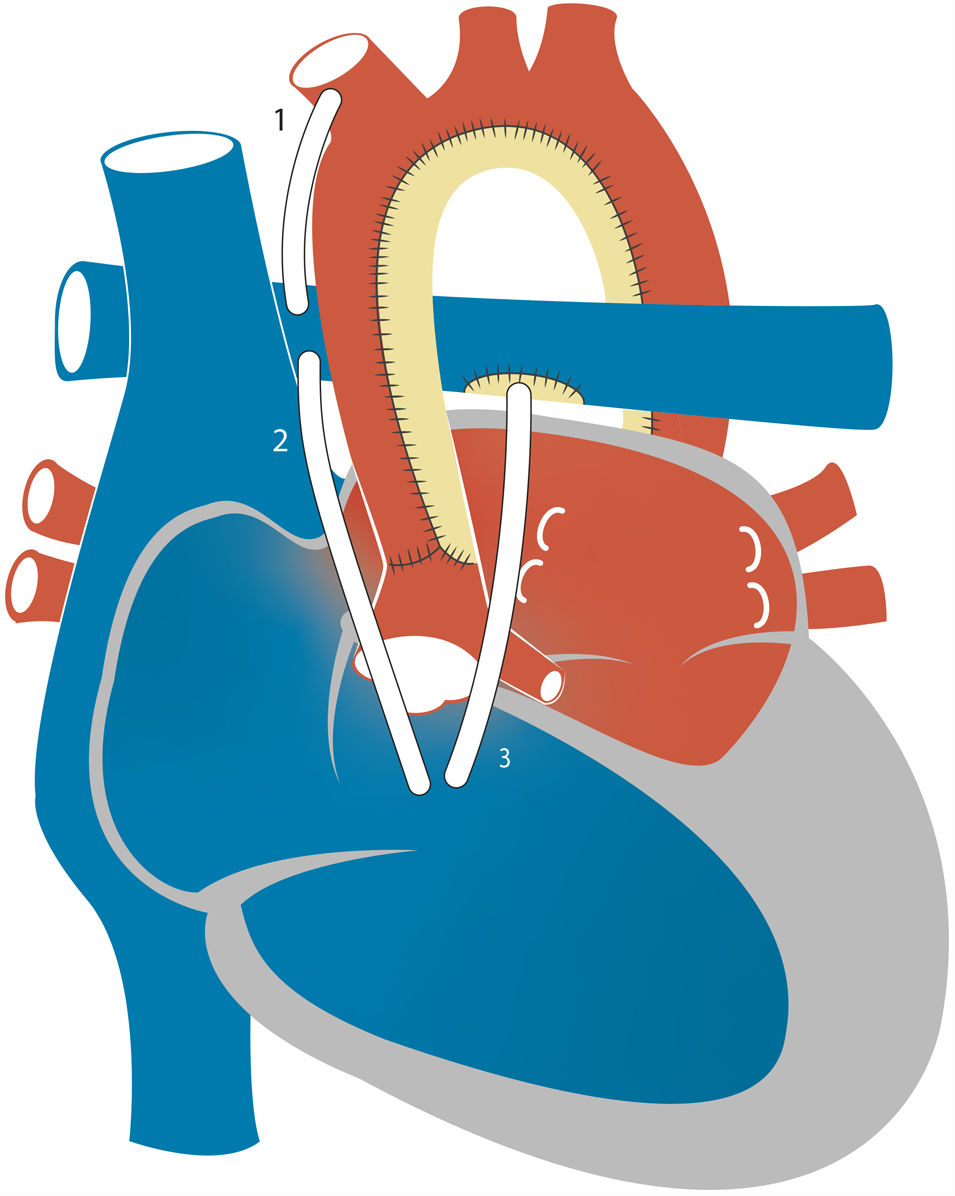
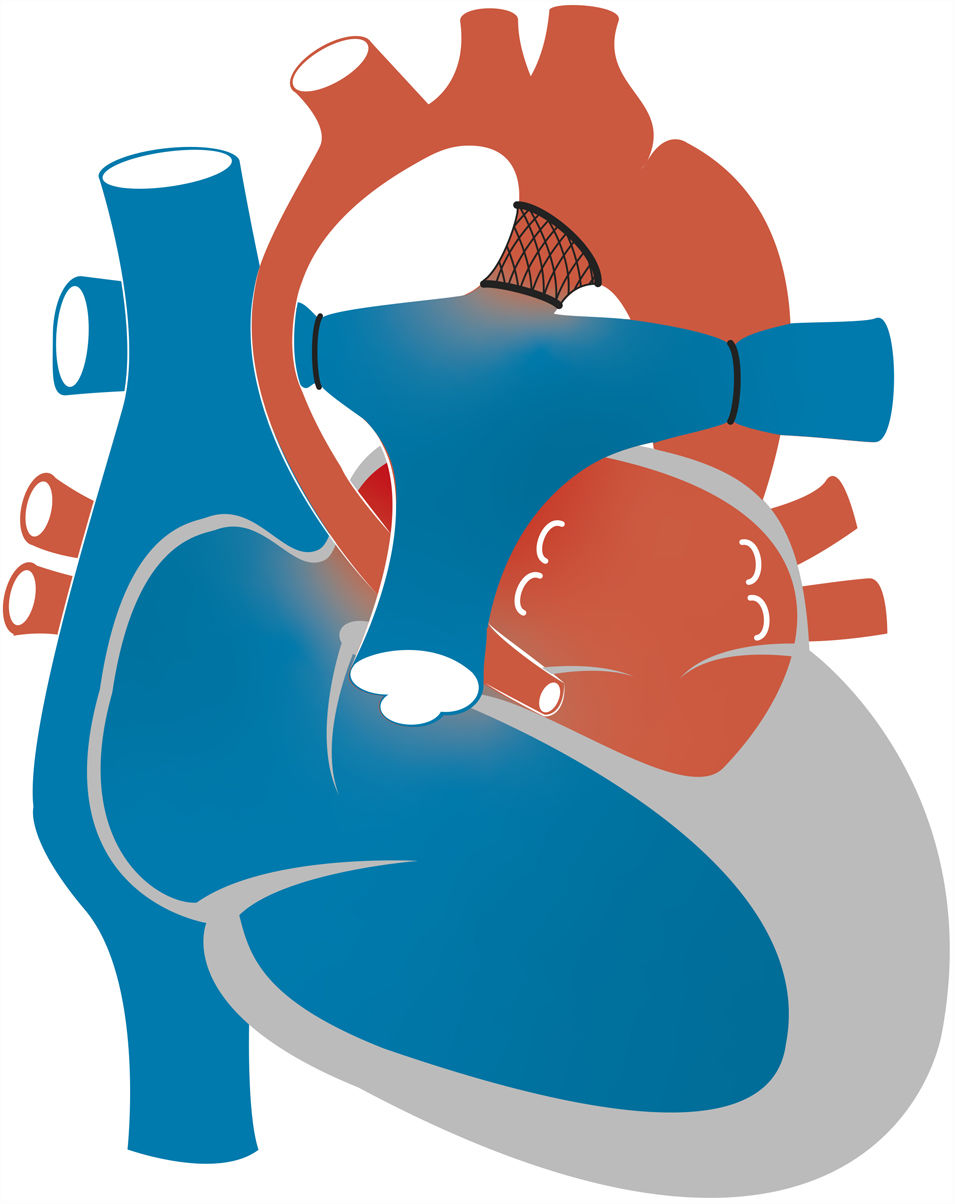
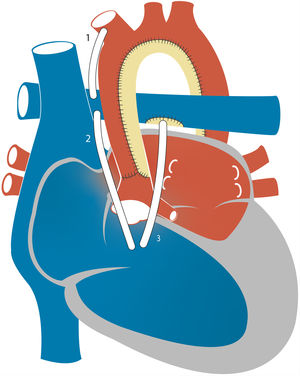
Estadio I de paliación quirúrgica: cirugía de NorwoodCon fístula de Blalock-Taussig modificadaEn la operación de Norwood clásica la circulación pulmonar se establece mediante la creación de una fístula que deriva el flujo sistémico de la arteria subclavia o innominada a la AP (fig. 4). Debido a la baja RVP en relación con la RVS, se establece un flujo continuo a través del conducto que resulta en una reducción de la presión sanguínea sistémica diastólica. Esta situación puede dar lugar al llamado «robo coronario», definido como la reducción de la perfusión coronaria resultante del desvío de parte del flujo diastólico a la circulación pulmonar, que puede ocasionar disfunción miocárdica, arritmias malignas o muerte súbita cardíaca. El otro problema importante que puede surgir con la fístula de Blalock-Taussig modificada (FBTM) es estenosis de la fístula con trombosis, aunque la incidencia de trombosis puede reducirse mediante diversas estrategias anticoagulantes y cambios en el diseño del material empleado y la geometría de la FBTM. Una revisión de varios estudios de la cirugía de Norwood, la mayoría de los cuales emplearon la FBTM, encontró que la incidencia de trombosis oscilaba entre el 0 y el 40%, mientras que los eventos tromboembólicos (derrame cerebral o embolia pulmonar) se reportaron con poca frecuencia. Aunque la mayoría de los estudios reportaron el uso a largo plazo de ácido acetilsalicílico, hubo variabilidad entre las distintas instituciones en la estrategia de tromboprofilaxis15.
Con conducto del ventrículo derecho a la arteria pulmonarEn la época en que se comenzó a desarrollar la técnica de Norwood, se emplearon conductos valvulados y no valvulados del VD a la AP para establecer el flujo pulmonar, pero los pacientes murieron a las pocas horas de realizarse la cirugía debido a un flujo pulmonar excesivo o por fallo del VD16. Esto llevó al abandono de la técnica con conducto del ventrículo derecho a la arteria pulmonar (VDAP) a favor de la FBTM. No obstante, a finales de los años 90 Dr. Shunji Sano volvió a popularizar el abordaje con conducto VDAP para prevenir la pérdida de flujo diastólico y el robo coronario observados con la FBTM (fig. 4). En 2004, Sano et al. reportaron el manejo consecutivo de 33 pacientes con SCIH mediante la colocación de conductos no valvulados de politetrafluoroetileno (PTFE) conectando el VD y la AP en el E1. La supervivencia inicial alcanzó el 89%. No obstante, se observó un aumento en la incidencia de disfunción sistólica del VD, arritmias y sobrecarga de volumen ventricular17. Estas complicaciones se atribuyeron a la necesidad de practicar una ventriculotomía derecha para establecer el conducto VDAP, que conlleva un riesgo de disfunción miocárdica y arritmia, y al uso de conductos no valvulados, asociado a la regurgitación y la sobrecarga de volumen en el VD.
Comparación de la fístula de Blalock-Taussig modificada y el conducto del ventrículo derecho a la arteria pulmonarEn 2011, el Boston Children's Hospital comparó los resultados a medio plazo de la FBTM con los del conducto VDAP en 118 pacientes con SCIH en los que se había realizado la operación de Fontan18. Dentro de esta muestra, el abordaje en el E1 consistió en conducto VDAP en 36 y la FBTM en 82. Todos los pacientes, salvo uno, sobrevivieron a la operación de Fontan. En la evaluación de seguimiento a medio plazo, la evolución clínica y los parámetros hemodinámicos fueron similares en ambos grupos. Con todo, se observó una frecuencia mayor de insuficiencia tricúspide en el grupo de FBTM y una incidencia mayor de cateterización de la AP en el grupo de conducto VDAP. No se observaron diferencias significativas entre los grupos en la función ventricular derecha.
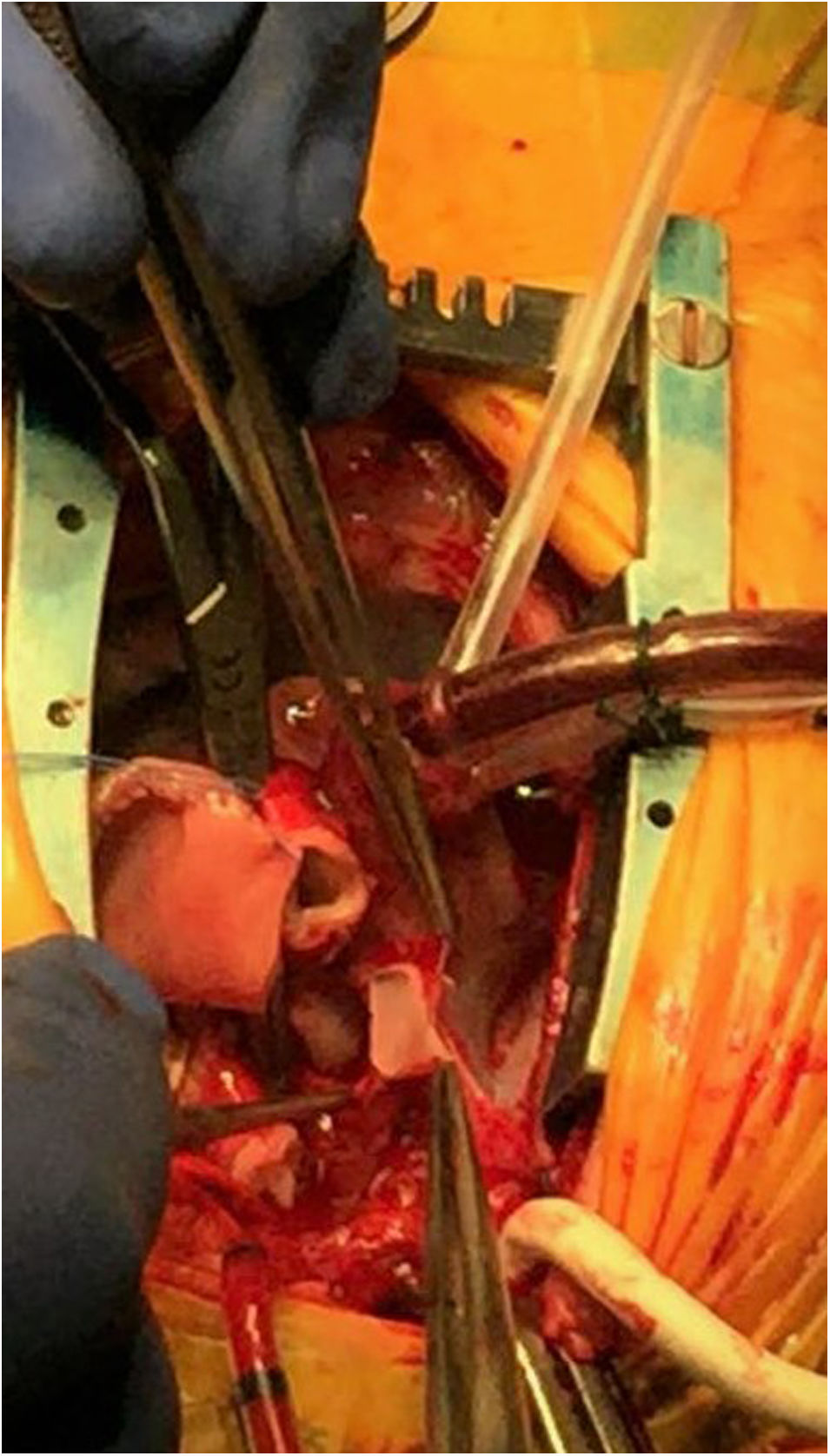
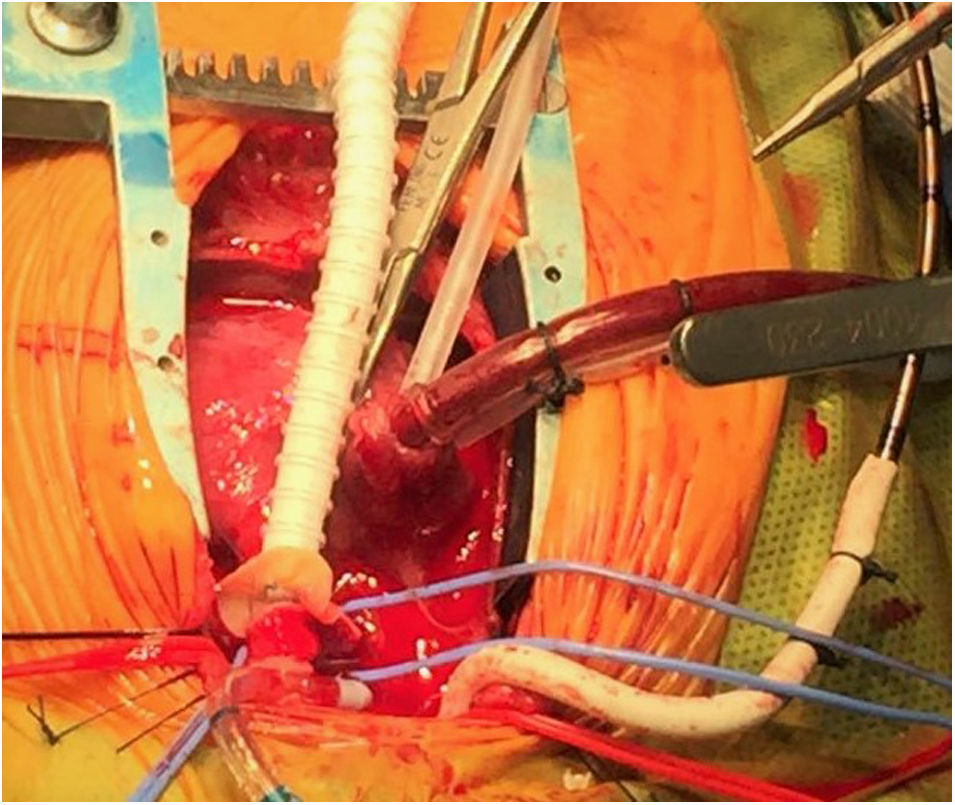
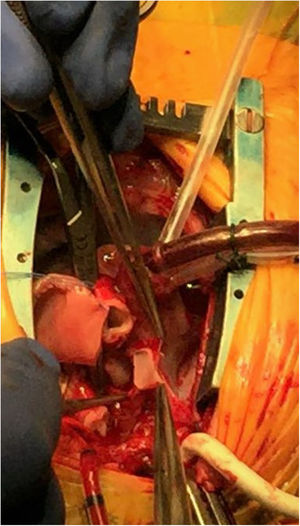
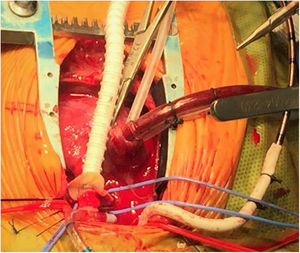
Con intención de mejorar las limitaciones de la técnica con conducto VDAP, se han probado distintas modificaciones técnicas en la cirugía del E1: 1) una posible modificación implica el uso de un conducto valvulado; sin embargo, un estudio comparativo con pacientes en los que se practicó la FBTM no encontró mejoría en la supervivencia, y además se observó una frecuencia mayor de necesidad de intervención en el conducto19; 2) técnicas más recientes han empleado un injerto tubular de PTFE reforzado para prevenir deformaciones y minimizar el daño al miocardio; en esta técnica «invaginante» se practica una pequeña incisión en el miocardio que luego se dilata para introducir el injerto, evitando así la resección de tejido muscular. Este anillo reforzado se extiende hacia el interior del VD; esta nueva modificación se ha descrito en 39 pacientes en comparación con 48 pacientes en los que se practicó la técnica convencional con conducto VDAP; los pacientes con un anillo reforzado tuvieron una tasa de reintervención menor, así como una presión del pulso aórtica más alta y mejor crecimiento de la AP a 1 año de seguimiento20 (véanse las imágenes intraoperatorias en las figuras 5 y 6), y 3) el posicionamiento del conducto VDAP a la izquierda o la derecha de la aorta se ha asociado a una evolución más favorable en esta población; un estudio del grupo de Birmingham evaluó a 153 pacientes tratados mediante el E1 de paliación quirúrgica con conductos colocados o bien a la derecha (n=125) o bien a la izquierda (n=28); en el grupo con conducto a la derecha se observaron duraciones menores de bypass, ramas más grandes de la AP y una ventaja significativa en la supervivencia21. Un estudio que analizó el conjunto de datos del Ensayo de reconstrucción de ventrículo único (Single Ventricle Reconstruction Trial [SVRT] del Pediatric Heart Network) obtuvo resultados similares22.
Imagen intraoperatoria de cirugía de Norwood en estadio i de la paliación en paciente con síndrome de corazón izquierdo hipoplásico. Hasta este punto, se ha extirpado el tejido ductal, reparado la coartación y dilatado la arteria pulmonar bajo perfusión cerebral y miocárdica selectiva. En la imagen, se aprecia como la aorta ascendiente diminuta se abre hasta la unión sinotubular, quedando lista para la anastomosis con la arteria pulmonar. Esta parte del procedimiento se realiza bajo perfusión cerebral selectiva.
Imagen intraoperatoria de cirugía de Norwood en estadio i de la paliación en paciente con síndrome de corazón izquierdo hipoplásico. Momento en el que se realiza una anastomosis entre una derivación consistente en un tubo reforzado de 5mm aumentado con pericardio heterólogo y la bifurcación de la arteria pulmonar. Colocación de cintas de color azul en las arterias pulmonares nativas. Nótese que el flujo arterial entra a través de una derivación de 3,5mm anastomosada a la arteria innominada, mientras que una cánula venosa única se inserta en la aurícula derecha a través de su apéndice. En este momento, el paciente está siendo enfriado y bajo asistencia ventricular de flujo continuo.
La amplia controversia con respecto a los posibles riesgos y ventajas de la FBTM o el conducto VDAP motivó el desarrollo del SVRT, que representó un esfuerzo notable en el campo de la cirugía cardíaca congénita. Quince centros reclutaron a 555 pacientes que fueron asignados aleatoriamente a cirugía con FBTM o conducto VDAP en el E1. La medida de resultado primaria fue la muerte o la supervivencia libre de trasplante de corazón (TC) a los 12 meses. Las medidas de resultado secundarias incluyeron las intervenciones cardiovasculares no planificadas, la función ventricular derecha, la evolución hospitalaria y otros eventos adversos serios23. El análisis encontró que el conducto VDAP era preferible en comparación con la FBTM en cuanto a la medida de resultado primaria a los 12 meses (supervivencia libre de TC del 73% en pacientes con conducto VDAP vs. el 63,3% en pacientes con FBTM). Una proporción mayor de pacientes intervenidos de FBTM requirieron reanimación cardiopulmonar durante la hospitalización correspondiente a la cirugía de Norwood (20% vs. 13%). Por otro lado, las intervenciones no planeadas y las complicaciones fueron más frecuentes en el grupo de pacientes con conducto VDAP. Además, el crecimiento de la AP, el volumen telediastólico ventricular derecho y la fracción de eyección ventricular derecha fueron más favorables durante el seguimiento en pacientes con FBTM. La ventaja del conducto VDAP sobre la FBTM en la supervivencia decreció con el tiempo, sin haber diferencias entre los grupos durante un período de seguimiento con duración media de 32 meses. Estos resultados fueron corroborados a los 3 y 6 años de seguimiento. Hubo una frecuencia mayor de cateterismo intervencionista en pacientes con conducto VDAP, mientras que pacientes en ambos grupos sufrieron complicaciones serias con el paso del tiempo24,25.
Reconstrucción del arco aórticoLa obstrucción del arco aórtico reconstruido es una de las complicaciones principales implicadas en la morbimortalidad tras el E1, con una incidencia reportada actual del 20% de los pacientes. Esta complicación puede producir una reducción del gasto cardíaco, disfunción ventricular derecha e insuficiencia tricuspídea3. La reconstrucción del arco aórtico puede afectar al flujo de la neoaorta y, por lo tanto, también el coronario.
La primera cirugía paliativa de Norwood reconstruyó el arco aórtico mediante la anastomosis directa entre el tronco de la AP y la aorta diminuta2. Aunque algunos grupos abogan por este abordaje26, este procedimiento fue abandonado por Norwood y otros porque la anatomía quirúrgica no suele considerarse adecuada para su realización. En 2007, el Boston Children's Hospital publicó datos de 210 pacientes con SCIH tratados mediante la cirugía del E1: en 12 (6%) se estableció una conexión directa, en 115 (55%) se implantó un homoinjerto de aorta, en 53 (25%) un homoinjerto pulmonar, y en 30 (14%) se practicó interposición de un tubo de pericardio autógeno3. La proporción de pacientes que requirió reintervención por obstrucción de la neoaorta fue menor en aquellos en los que se agrandó el arco aórtico con tejido autógeno en comparación con los pacientes en los que la reconstrucción se realizó con homoinjerto. Por añadidura, la escisión de todo el tejido ductal por medio de coartectomía se asoció a una reducción del riesgo de obstrucción recurrente. Otros estudios más recientes han confirmado las ventajas de la reconstrucción del arco aórtico con tejido autógeno, asociada a incidencias menores de recoartación, compresión bronquial o compresión de ramas de la AP27. Los datos del SVRT mostraron que 97 de un total de 549 pacientes (18%) requirieron cirugía a corazón abierto o cateterismo cardíaco por recoartación, que generalmente se practicó antes del cateterismo o la cirugía del estadio ii28.
Insuficiencia tricuspídea y disfunción ventricular derechaLa presencia de disfunción ventricular derecha significativa o insuficiencia tricuspídea se ha asociado consistentemente a la incapacidad de progresar en el proceso de paliación por etapas y evolución desfavorable. Aunque la reparación de la válvula tricúspide consigue reducir el grado de regurgitación en la mayoría de los pacientes, el pronóstico se ve mermado por la duración limitada de la corrección, con recurrencia de regurgitación significativa en un tercio de los pacientes29. La disfunción ventricular derecha es progresiva y es uno de los principales determinantes de la supervivencia libre de TC. Además, la mortalidad entre las distintas etapas de la paliación quirúrgica en pacientes con SCIH continúa siendo elevada (12%) y parece estar asociada a la fracción de eyección del VD y la insuficiencia tricuspídea, así como a otros factores tales como parto pretérmino, el subtipo con atresia de las válvulas mitral y aórtica, y el nivel socioeconómico4,30.
Manejo híbridoEn 1992, Gibbs et al. propusieron la implantación de un stent en el DA como medida paliativa, que se practicó en 2 neonatos con atresia pulmonar31. Un año después, Ruiz et al. implantaron stents ductales en 6 pacientes con SCIH como puente al TC32. El mismo año, Gibbs et al. reportaron los casos de 4 neonatos con SCIH en los que se implantó stent ductal con cerclaje bilateral de las ramas pulmonares33. Este abordaje híbrido consigue los mismos objetivos que la cirugía de Norwood: la colocación del stent ductal establece el flujo sistémico mientras que el cerclaje bilateral restringe el flujo pulmonar, con lo que se reduce el posible robo coronario. La perfusión cerebral y coronaria se asegura mediante el flujo retrógrado del arco aórtico, en contraste con el abordaje clásico del E1 (fig. 7). La estenosis u obstrucción de la conexión entre la aorta descendiente y el arco aórtico (obstrucción retrógrada del arco aórtico) es una complicación importante que se ha descrito en hasta el 25% de los pacientes34. Se ha propuesto el uso de una «fístula de Blalock-Taussig inversa» del tronco de la pulmonar a la arteria innominada para evitar problemas de obstrucción retrógrada del arco aórtico en la paliación híbrida35. Por añadidura, la evitación del bypass cardiopulmonar puede ofrecer ventajas importantes en los neonatos. Una comparación reciente de 49 pacientes tratados con la cirugía clásica de Norwood y 13 pacientes con el procedimiento híbrido tras realizarse la cirugía de Fontan encontró que los pacientes con manejo híbrido exhibieron una ganancia de peso menor antes de la derivación cavopulmonar que se había recuperado en el momento de la cirugía de Fontan, lo que podría suponer un factor de riesgo para un incremento de la morbilidad y de alteraciones del desarrollo neurológico36.
En la última década, el manejo híbrido se ha empleado en muchos pacientes con SCIH. Galantowicz et al. y, más recientemente, Yerebakan et al. han reportado tasas de supervivencia del 90 y el 97,5% en 40 y 182 pacientes con SCIH, respectivamente, tratados mediante el procedimiento híbrido37,38. No obstante, se ha descrito una frecuencia mayor de intervenciones en las ramas de la AP y una proporción significativa de interrupción de la paliación por etapas antes y después del estadio ii en asociación con el cerclaje bilateral38.
Un estudio de la Congenital Heart Surgeons Society (Sociedad de Cirujanos de Cardiopatías Congénitas) evaluó el abordaje híbrido como alternativa a la cirugía de Norwood en 564 neonatos, en quienes el E1 de la paliación consistió en la cirugía de Norwood con FBTM o conducto VDAP, o en el procedimiento híbrido. La supervivencia a 4 años ajustada al riesgo fue mejor tras la cirugía con conducto VDAP en comparación con la cirugía con FBTM y el manejo híbrido (76% vs. 60% vs. 61%, respectivamente)39. Un metaanálisis reciente describió una supervivencia precoz menor con el manejo híbrido en comparación con el E1 clásico40. En consecuencia, la mayoría de los centros actualmente se decantan por la cirugía de Norwood y reservan el manejo híbrido para los pacientes más vulnerables (bajo peso al nacer o foramen oval restrictivo) o en estado de shock.
TrasplanteA pesar de los considerables avances en el pronóstico de los pacientes con SCIH, continúa habiendo una morbimortalidad significativa hasta completarse la paliación quirúrgica por etapas30 y los datos de series recientes sugieren que la supervivencia tras la cirugía de Norwood se ha estancado41. Un metaanálisis reciente que comparó la evolución de la paliación quirúrgica de SCIH con FBTM o con conducto VDAP encontró que la supervivencia sin TC a 1, 4 y 6 años fue del 67, el 64 y el 63%, respectivamente, para la FBTM, mientras que para el conducto VDAP fue del 75, el 67 y el 61%, respectivamente. Por lo tanto, las diferencias observadas en la supervivencia entre ambas derivaciones fueron significativas a un año pero no a partir de ese momento42.
El uso del trasplante cardíaco ortotópico como estrategia paliativa inicial en neonatos con SCIH fue descrito por primera vez por Bailey et al.43. Su grupo reportó los resultados del TC en 28 neonatos con SCIH entre 1985 y 1989. La tasa de mortalidad precoz fue del 18%. No obstante, se alcanzó una tasa de supervivencia al trasplante del 89% en los últimos 19 pacientes de la serie. Una actualización de los datos de la experiencia pionera del grupo de la Loma Linda University reportó una supervivencia a 5 años del 81% en los 111 pacientes con SCIH tratados mediante el protocolo de trasplante, lo que refleja mejoras recientes en las estrategias de prevención del rechazo44. Debido a los largos tiempos de espera para el TC neonatal y la mejora progresiva de las estrategias de paliación en etapas, actualmente el TC se ofrece raramente como tratamiento de primera línea. También se han realizado esfuerzos para aumentar el número de posibles donantes mediante la realización de trasplantes ABO incompatibles.
El trasplante también es una opción ofrecida a pacientes con SCIH que no pueden progresar en la paliación por etapas o que desarrollan complicaciones asociadas a la circulación de Fontan. Se han publicado datos sobre los factores de riesgo para la inclusión en la lista y la evolución del TC tras la cirugía de Norwood del SVRT, en el que 33 pacientes fueron puestos en la lista de espera y 18 tratados mediante TC. La mortalidad fue del 39% en los pacientes en lista de espera y del 33% tras el TC. Aun así, el TC como tratamiento de rescate tras la cirugía de Norwood en el primer año de vida se asocia a una mortalidad considerable. En otro estudio en 253 niños previamente tratados mediante la cirugía de Norwood, la supervivencia tras el TC no se asoció al estadio alcanzado en la paliación quirúrgica o la sensibilización45.
ConclusionesAntes del decisivo avance descrito por William I. Norwood y colegas en 1983, los niños nacidos con SCIH no operados tenían una probabilidad prácticamente nula de sobrevivir. Desde esta descripción inicial del éxito de la cirugía paliativa ha habido mejoras significativas en el manejo de estos pacientes y muchos centros reportan una supervivencia del 90% en el E1 de la paliación. Además, en la actualidad, ya son posibles la finalización de la paliación quirúrgica por etapas y la supervivencia hasta la edad adulta. No obstante, la morbimortalidad en pacientes con SCIH continúa siendo alarmantemente alta. Se están consiguiendo mejoras en los resultados del TC en pacientes tanto intervenidos como sin intervenir. En cualquier caso, tenemos la convicción de igual que en el pasado los grandes avances en medicina y cirugía han conseguido mejorar la evolución del SCIH, avances futuros continuarán mejorando el pronóstico a largo plazo de pacientes nacidos con esta difícil enfermedad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a Doña Ana L. Teruel Martínez (anateruel.louise@gmail.com) su trabajo artístico en las figuras de este manuscrito.