Se estima que unos 70 millones de personas padecen epilepsia a nivel mundial de los cuales más de la mitad son niños, en los que la prevalencia estimada se sitúa en torno al 0,5-0,8%. Aunque existen diversas terapias, el tratamiento de la epilepsia se basa mayoritariamente en fármacos, que en función de su año de comercialización se clasifican como de primera, segunda o tercera generación. En el presente artículo se revisan las principales características de los fármacos antiepilépticos de última generación (lacosamida, acetato de eslicarbazepina, brivaracetam, perampanel, retigabina, everolimus y cannabidiol) que, con excepción de la retigabina (ya no está comercializada), se consideran seguros y efectivos en población pediátrica. El everolimus y el cannabidiol tienen indicaciones muy concretas (esclerosis tuberosa, síndrome de Dravet y síndrome de Lennox Gastaut) mientras que el resto están indicados en el manejo de crisis de origen focal en niños a partir de 4 años. Estas nuevas moléculas han sido desarrolladas para aportar un perfil farmacocinético y de tolerancia superior a los fármacos previamente disponibles y es previsible que a medida que aumente su uso, se vaya perfilando y ampliando su verdadero potencial. Además, por primera vez en epileptología pediátrica, se ha utilizado la extrapolación de datos de efectividad en adultos (junto con estudios de seguridad y farmacocinética específicos en población pediátrica), para acelerar la aprobación de uso en población infantil.
It is estimated that about 70 million people all over the world suffer from epilepsy, half of which are children, in whom the prevalence is around 0.5 to 0.8%. Although there are several therapies, the treatment of epilepsy is based mainly on drugs, which, depending on the year of coming onto the market are classified as first, second, or third generation. In this article, a description is presented on the main characteristics of the latest generation of anti-epileptic drugs (lacosamide, eslicarbazepine acetate, brivaracetam, perampanel, retigabine, everolimus and cannabidiol). These, with the exception of retigabine (is not yet on the market), are considered safe and effective in the paediatric population. Everolimus and cannabidiol have very specific indications (tuberous sclerosis, Dravet syndrome, and Lennox Gastaut syndrome), while the rest are indicated in the management of seizures of focal origin in children from 4 years-old. These new molecules have been developed in order to provide a pharmaceutical profile and tolerance superior to the previously available drugs, and it is forecast that as their use increases, their true potential and profile will widen. Furthermore, for the first time in Paediatric Epileptology, the extrapolation of the efficacy data in adults have been used (together with specific safety and pharmacokinetic studies in the paediatric population), in order to speed up their approval for use in the child population.
Se estima que a nivel mundial, unos 70 millones de personas padecen epilepsia, de las cuales más de la mitad se hallan en la edad pediátrica1–3. Se trata pues de una patología neurológica relativamente frecuente en el niño, que afecta a la calidad de vida de los pacientes y sus familias y que genera un impacto significativo tanto a nivel social como económico en los sistemas de salud1.
El término epilepsia engloba a una multitud de trastornos y síndromes muy heterogéneos, con etiologías, grados de afectación y evolución natural altamente variables. Todo ello tiene importantes implicaciones en cuanto al diagnóstico y el manejo, que dependiendo del área geográfica, de la complejidad del caso y la disponibilidad de profesionales, se lleva a cabo en distintos niveles de especialización (médicos generalistas, pediatras generalistas, neurólogos, neuropediatras o epileptólogos pediátricos).
La epilepsia es una enfermedad que está claramente influenciada por el nivel de desarrollo de una sociedad, ya que tanto la incidencia como la prevalencia en los países en vías de desarrollo son más elevadas (se estima que el 75-80% de los nuevos casos de epilepsia se producen en estas zonas geográficas)3,4. La incidencia de crisis cerebrales es más elevada en el primer año de vida (100 casos/100.000) y va decayendo con la edad hasta una tasa aproximada de 20 casos/100.000 en la adolescencia. La prevalencia estimada en población pediátrica (< 16 años) a nivel global es del 0,5-0,8%5,6, siendo mayoritariamente de origen focal (59-63%) y menos frecuentemente generalizada (12-29%), si bien en un 20% de los casos esta clasificación puede variar en un mismo paciente durante la evolución de la enfermedad5,7.
Tanto en el niño como en el adulto, el tratamiento de la epilepsia se basa mayoritariamente en el uso de fármacos (bien en monoterapia o de forma combinada), siendo el resto de las terapias (cirugía de la epilepsia, neuromodulación, dieta cetogénica) mucho menos frecuentes. Además, la mayoría de los pacientes tratados con terapias no farmacológicas precisan igualmente del uso de fármacos de forma coadyuvante para conseguir un control óptimo de las crisis.
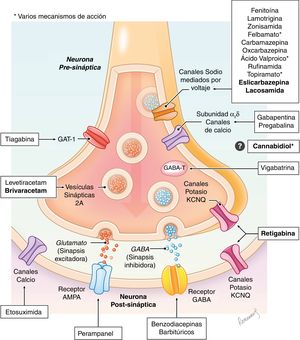
Los fármacos antiepilépticos son moléculas que actúan a diferentes niveles de la sinapsis neuronal con el fin de modificar la respuesta excitatoria y/o inhibitoria a través de diferentes mecanismos (canales de sodio o de calcio, receptores GABA, glutamato etc…). Los mecanismos de acción son diversos e incluso en algunos fármacos aún no totalmente elucidados (fig. 1), existiendo excelentes revisiones sobre el tema8–10. En el momento actual existen más de 25 fármacos que se clasifican según el año de introducción en el mercado, como fármacos de primera, segunda o tercera generación (tabla 111,12).
Esquema simplificado del mecanismo de acción de los principales fármacos antiepilépticos en la sinapsis neuronal.
GABA-T: GABA transaminasa (enzima que produce la degradación del GABA); GAT-1: trasportador de GABA tipo 1 (realiza la recaptación de GABA de la sinapsis neuronal). En negrita, los nombres de los fármacos que se comentan en el artículo.
Principales fármacos antiepilépticos y su año de introducción en Europa (autorización de la Agencia Europea del Medicamento), en orden cronológico
| Fármaco | Abreviatura internacional | Fecha inicial comercialización |
|---|---|---|
| Primera generación | ||
| Bromuro | - | 1857 |
| Fenobarbital | PB | 1912 |
| Fenitoína | PHT | 1960 |
| Primidona | PRM | 1960 |
| Sulthiame | STM | 1960 |
| Carbamazepina | CBZ | 1965 |
| Valproato | VPA | 1970 |
| Segunda generación | ||
| Clobazam | CLB | 1979 |
| Vigabatrina | VGB | 1989 |
| Oxcarbazepina | OXC | 1990 |
| Lamotrigina | LTG | 1991 |
| Gabapentina | GBP | 1994 |
| Felbamato | FBM | 1994 |
| Topiramato | TPM | 1995 |
| Tiagabina | TGB | 1996 |
| Levetiracetam | LEV | 2000 |
| Pregabalina | PGB | 2005 |
| Zonisamida | ZNS | 2007 |
| Stiripentol | STP | 2007 |
| Rufinamida | RUF | 2007 |
| Tercera generación | ||
| Eslicarbacepina (acetato de) | ESL | 2010 |
| Lacosamida | LCM | 2010 |
| Retigabina/ezogabina | RTG/EZG | 2011 |
| Perampanel | PER | 2012 |
| Everolimus | EVR | 2017 |
| Brivaracetam | BRV | 2018 |
| Cannabidiol | CBD | 2019 |
El manejo de la epilepsia en la edad pediátrica tiene unas peculiaridades específicas, ya que muchos de los tipos de epilepsia son diferentes a los del adulto (incluyendo a la mayoría de los síndromes epilépticos) y el manejo de los fármacos, así como de los posibles efectos secundarios y/o secuelas derivados del uso de los mismos son distintas11. Por otra parte, algunos aspectos sí son similares a lo que ocurre en el adulto; concretamente, la evolución y la respuesta a fármacos de las crisis de origen focal en niños a partir de 2 años se considera similar a lo que ocurre en el paciente adulto, lo que ha permitido usar la extrapolación para agilizar la autorización para el uso de nuevos fármacos en niños13.
Conseguir la autorización para su uso en población pediátrica de la mayoría de los nuevos fármacos antiepilépticos cuesta muchos años, lo que favorece el empleo fuera de indicación en esta franja de edad. Esto genera por una parte inseguridad en el paciente (ausencia de información validada en cuanto a dosis, seguridad y tolerabilidad) y por otra problemas ético-legales en el prescriptor13. Con el fin de acortar el tiempo entre la autorización de medicamentos para uso en el adulto y en el niño se usa la extrapolación, término que fue inicialmente establecido por la FDA en el año 1994 y que actualmente está implantado y validado a nivel internacional13,14. En pediatría, tiene el fin de garantizar el uso eficiente de los datos obtenidos en población adulta para el desarrollo de fármacos destinados a población pediátrica. La extrapolación se define como el acto de ampliar la información y las conclusiones obtenidas en estudios en uno o más subgrupos de una población de pacientes (población de origen) o en trastornos asociados o en productos médicos relacionados, con el fin de realizar inferencias en otros subgrupos de pacientes (población diana), o trastorno o producto medicinal, reduciendo así la necesidad o la cantidad de información adicional (tipos de estudios, diseño de los mismos o número de pacientes precisos) necesaria para alcanzar conclusiones13,15. Para poder extrapolar información de fármacos se han de asumir varias premisas, siendo las más importantes: a) que la progresión de la enfermedad sea similar en el adulto y en el niño, b) que la respuesta al tratamiento sea similar entre niños y adultos y c) que la respuesta a la exposición al fármaco de ambas poblaciones sea similar13,15.
En epilepsia, la extrapolación no se puede realizar de forma global, ya que existen diferencias significativas en niños y adultos en cuanto a etiología, tipos de síndromes e historia natural, pero sí es posible establecer similitud en las crisis de origen focal en niños ≥ 4 años13. Aunque es importante señalar que si bien es posible asumir datos en cuanto a eficacia, no se pueden extrapolar otros aspectos como dosis, farmacocinética o seguridad, por lo que es preceptivo realizar estudios específicos en el niño.
En el presente trabajo nos limitaremos a revisar las principales novedades en cuanto al tratamiento farmacológico de la epilepsia en la edad pediátrica. Esta última generación de fármacos es la primera que incluye moléculas (ESL, BRV, LCM, PER) cuya efectividad en el niño no ha sido demostrada en base a estudios específicos randomizados y a doble ciego, sino en base a la extrapolación de datos del adulto.
Acetato de eslicarbazepinaLa ESL es un fármaco de nueva generación perteneciente a la familia de las carboxamidas (CBZ, OXC) que actúa bloqueando los canales de sodio mediados por voltaje, lo que genera una inactivación lenta de la excitabilidad neuronal. Fue inicialmente autorizada para uso en adultos en Europa por la Agencia Europea del Medicamento (EMA) en el año 2010 y posteriormente en EE. UU. por la Food and Drug Administration (FDA) en 2013 con indicación para el tratamiento coadyuvante en crisis de origen focal con o sin generalización secundaria. Esta indicación fue posteriormente ampliada para uso en monoterapia. Desde el año 2017 tiene autorización para uso en población pediátrica como terapia coadyuvante en crisis de origen focal con o sin generalización secundaria en niños a partir de 4 años (FDA)/6 años (EMA), tratándose del primer fármaco antiepiléptico aprobado para uso pediátrico en base a criterios de extrapolación. Como principales ventajas, la ESL se administra en una única toma diaria, lo que facilita una mejor adherencia al tratamiento, no genera importantes interacciones con otros fármacos y tiene un perfil de seguridad bueno, ya que no se han descrito alteraciones hematológicas o iónicas significativas. En este sentido, la hiponatremia suele ser menos frecuente que con OXC11,16. Los efectos adversos parecen ser dosis-dependientes, y vienen recogidos en la tabla 2. En los niños no parece generar problemas a nivel cognitivo o conductual17.
Principales características de los FAE de tercera generación en población pediátrica
| Nombre | Laboratorio desarrollador | Diana terapéutica | Indicación en niños (año de inicio) | Dosificación recomendada | Vía de administración | Efectos adversos más frecuentes |
|---|---|---|---|---|---|---|
| Acetato de Eslicarbacepina (ESL) | Sunovion Pharmaceuticals/BIAL-Portela EE. UU. | Inhibición de canales de sodio mediados por voltaje | Terapia coadyuvante en crisis de origen focal (con o sin generalización secundaria) en niños ≥ 4 años (FDA 2017) o ≥ 6 años (EMA 2016) | Dosis de inicio: 10-20 mg/kg/día en una única toma al día.Ascensos de 200-400mg cada 1-2 semanas.Dosis de mantenimiento: 20-60 mg/kg/díaDosis máxima: 1.200 mg/día.Niños > 60 kg dosificación igual que en adultos | oral | Ocurren en 80% de los pacientes; mareo, somnolencia, náusea, diplopía, cefalea, vómitos, alteraciones en la coordinación, visión borrosa, vértigo y fatiga |
| Lacosamida (LCM) | UCB Inc. | Modulación lenta de canales de sodio | Uso en monoterapia o como terapia coadyuvante en crsis de origen focal (con o generalización secundaria) en niños ≥ 4 años (EMA, FDA 2017) | Dosis de inicio: 2mg/kg/día (dividido en 2 tomas diarias). Aumentos semanales de 2 mg/kg/día.Dosis de mantenimiento:Niños 11-30 kg: 6-12 mg/kg/díaNiños 30-50 kg: 4-8 mg/kg/díaNiños > 50 kg:Dosis de inicio: 100 mg/día (divido en 2 tomas diarias). Ascensos semanales de 100 mg/día.Dosis de mantenimiento:Monoterapia: 300-400 mg/díaCoadyuvante: 200-400 mg/día | oral, iv | Ocurren en 30-59% de los pacientes; náuseas, vómitos, inestabilidad, mareo, nistagmo, debilidad, cefalea |
| Retigabina (RTG)/ezogabine (EZG) | GlaxoSmithKline | Modulación canales de potasio y receptores GABA | No | - | oral | Autorizaciones de la FDA y EMA retiradas por efectos adversos relacionados con la pigmentación de la piel y la retina |
| Perampanel (PER) | Eisai Inc. | Antagonista receptores AMPA- glutamato no competitivo | En niños >12 años uso en monoterapia (FDA 2017) o como terapia coadyuvante (FDA, EMA 2012) en crisis de origen focal con o sin generalización secundariaEn niños > 4 años uso en monoterapia o como terapia coadyuvante crisis de origen focal con o sin generalización secundaria (FDA 2018) | Dosis de inicio:2 mg/día en una única toma diariaAumentos semanales (o más lentamente) de 2mg en 2mg en función de respuesta.Dosis de mantenimiento:8 mg/día.Dosis máxima: 12 mg/día | oral | Ocurren hasta en el 70% de los pacientes; mareo, somnolencia, agresividad, irritabiliad, pérdida de apetito, rinitis |
| Everolimus (EVR) | Novartis | Inhibidor vía mTOR | Tratamiento coadyuvante en niños > 2 años con crisis farmacorresistentes de origen focalasociadas a TSC (EMA 2017) (FDA 2018) | Dosis de inicio: 5 mg/m2 en una única toma diariaAjustes progresivos hasta alcanzar unos niveles plasmáticos de 5-15 ng/mL | oral | Ocurren en el 95%; Estomatitis, infecciones respiratorias vías altas, nasofaringitis, sinusitis, tos, neumonía, ITU, HTA, hipercolesterolemia, amenorrea, cefalea, diarrea o vómitos, rash, fiebre, anorexia |
| Brivaracetam (BRV) | UCB | Vesículas sinápticas de la proteína 2A (SV2A) | Tratamiento en niños > 4 años con crisis de origen focal, en monoterapia (FDA) o como terapia coadyuvante (FDA, EMA) | Dosis de inicio: 1-2 mg/kg/día (dividido en dos tomas diarias)Ajustes progresivos hasta alcanzar efecto deseadoDosis de mantenimiento: 1-5 mg/kg/díaPacientes > 50 kg:Dosis de inicio: 20-100 mg/día. Dosis máxima: 200 mg/día | oral, iv | Ocurren en el 32%; somnolencia, cefalea, mareo, cansancio, náuseas, nasofaringitis, irritabilidad, insomnio, ansiedad, depresión |
| Cannabidiol (CBD) | GW Pharmaceuticals Inc. | Probable modulador del receptor GABA-A | Tratamiento de crisis en pacientes > de 2 años con síndrome de Dravet ysíndrome de Lennox-Gastaut (FDA 2018)Tratamiento coadyuvante (asociado a CLB) de crisis en pacientes > de 2 años con síndrome de Dravet ysíndrome de Lennox-Gastaut (EMA 2019) | Dosis de inicio: 5 mg/kg/día (dividido en 2 tomas diarias).Incrementos semanales de 5 mg/kg/día hasta alcanzar efecto deseadoDosis de mantenimiento: 20 mg/kg/día | oral | Ocurren en el 79%; sedación, cansancio, anorexia, diarrea, alteración enzimas hepáticas (especialmente en uso conjunto con VPA y CLB) |
La LCM es un aminoácido «funcionalizado» que actúa a nivel neuronal favoreciendo la inactivación lenta de los canales de sodio mediados por voltaje de forma selectiva. La LCM no afecta la inactivación rápida, por lo que se considera que modula la hiperexcitabilidad neuronal patológica sin alterar la función fisiológica de la célula18. Su uso fue aprobado inicialmente en adultos mayores de 17 años por la FDA (2008) para uso como terapia coadyuvante en crisis de origen focal con o sin generalización secundaria. Desde el año 2017 tiene autorización por la EMA y la FDA para uso en monoterapia o como coadyuvante en niños a partir de 4 años. La LCM tiene la ventaja de ser un fármaco efectivo, seguro y bien tolerado en población pediátrica, con escasa interacción con otros fármacos y que puede usarse tanto por vía enteral como parenteral. Además, en base a series de casos publicadas en los últimos 5 años, en un futuro podría posicionarse como un tratamiento efectivo y seguro para el estado de mal y el estado de mal refractario en la edad pediátrica19. Los efectos adversos más frecuentes vienen reflejados en la tabla 2, siendo su perfil de neurotoxicidad favorable: depresión 9,5%, alteración en la memoria 7,4% y otros trastornos cognitivos 4,3%11,20.
Retigabina/ezogabinaLa RTG (nombre usado a nivel internacional)/EZG (nombre usado en EE. UU.) tiene un mecanismo de acción único entre los fármacos antiepilépticos, ya que actúa activando los canales de potasio KCNQ2-5, aunque también actúa modulando los receptores GABA4,10. El uso de la RTG/EZG fue autorizado por la FDA y la EMA en 2011 para adultos con crisis de origen focal, con o generalización secundaria. Posteriormente dicha autorización fue retirada por ambas agencias (FSA 2017, EMA 2018) a petición de la farmacéutica propietaria, debido a efectos adversos relacionados con la pigmentación de la piel y la retina, por lo que su uso no está disponible en este momento. Nunca recibió autorización para uso en población pediátrica y existe una única publicación en niños, en la que se relata el tratamiento exitoso de una paciente de 8 años con cromosoma 20 en anillo. La región donde más frecuentemente ocurre esta fusión es en la región q13.3 de dicho cromosoma, donde se sitúa el gen codificante de KCNQ221.
PerampanelEl PER es uno de los últimos fármacos que ha recibido aprobación para el tratamiento de la epilepsia en niños (FDA 2018) aunque tiene autorización para uso en adultos y niños ≥ 12 años desde el año 2012. Actúa como un antagonista no competitivo de forma altamente selectiva sobre el receptor AMPA del glutamato (localizado a nivel postsináptico en las sinapsis excitatorias), lo que hace que su mecanismo de acción sea único entre los antiepilépticos. Esta inhibición actúa modulando la respuesta excitatoria rápida en la neurotransmisión22,23. En el adulto y en niños > 12 años tiene indicación para el tratamiento de crisis de origen focal con o sin generalización secundaria (FDA, EMA 2012), así como para crisis tónico-clónicas generalizadas (EMA, FDA 2015). En el año 2018 la FDA amplió la indicación a niños ≥ 4 años con crisis de origen focal con o sin generalización secundaria en base a criterios de extrapolación, una vez realizados estudios de seguridad y farmacocinética. Está pendiente su aprobación en esta franja de edad por la EMA13. Además, existen diversos estudios en población pediátrica y adolescentes que han demostrado igualmente su efectividad en epilepsia focal22. El PER tiene como principales ventajas la baja incidencia de toxicidad cognitiva, su forma de administración, una única toma diaria facilitando la adherencia al tratamiento y con un ratio riesgo/beneficio favorable. Los efectos secundarios son más frecuentes en niños > 12 años que en los más pequeños, y se han descrito hasta en el 70% de los pacientes. De los más frecuentes (tabla 2), son de especial importancia las alteraciones psiquiátricas, como agresividad e irritabilidad, que parecen ser dosis-dependientes y se han descrito en el 8,2-14% de los niños. Son más frecuentes en las primeras 6 semanas de tratamiento y en pacientes con antecedentes psiquiátricos, como TDAH o trastornos de la personalidad10,22.
EverolimusEl EVR es un fármaco cuyo uso en Neuropediatría se centra en el manejo de patologías secundarias al complejo esclerosis tuberosa (TSC), un trastorno neurocutáneo de baja prevalencia (1/6.000 recién nacidos) pero asociado a una elevada morbilidad a nivel multisistémico y específicamente a nivel del sistema nervioso central. Se trata de un inhibidor del complejo 1 del mTOR (mammalian target of rapamicyn) que tiene indicación en TSC para el manejo del astrocitoma subependimario de células gigantes (SEGA), los angiomiolipomas renales y la epilepsia. La epilepsia es el trastorno más frecuente en pacientes con TSC (85% de los pacientes), y suele debutar en el primer año de vida en 2 de cada 3 casos, bien en forma de crisis focales o espasmos epilépticos. En más del 60% las crisis son farmacorresistentes24. Su utilidad como antiepiléptico se observó inicialmente durante los ensayos clínicos para el tratamiento del SEGA25,26. Posteriormente, en base a los hallazgos del estudio EXIST-3 (estudio multicéntrico prospectivo internacional, randomizado a doble ciego, n=366)27, la EMA (2017) y la FDA (2018) otorgaron la indicación para su uso como antiepiléptico coadyuvante en adultos y en niños a partir de 2 años con crisis focales farmacorresistentes asociadas a TSC. El tratamiento se ha de ajustar mediante monitorización de niveles plasmáticos y los efectos adversos son frecuentes (tabla 2), siendo la estomatitis la complicación que genera mayor tasa de reducciones o retiradas del fármaco11,27.
BrivaracetamEl BRV es un análogo modificado del LEV, por lo que tiene un mecanismo de acción similar a este, modulando las vesículas sinápticas 2A (SV2A) pero de forma mucho más selectiva y con una afinidad 15-30 veces mayor10,28. Este mecanismo actúa antagonizando parcialmente los canales de sodio voltaje-dependientes. El BRV obtuvo la indicación para el tratamiento coadyuvante de crisis focales en pacientes ≥ 16 años en 2016 (FDA, EMA), ampliándose posteriormente para uso en monoterapia (2017) y finalmente (2018) para uso en población pediátrica a partir de 4 años en base a criterios de extrapolación.
Como principales ventajas el BRV es un fármaco seguro y efectivo, que se puede administrar por vía enteral o parenteral, y cuyo potencial es alto dada la efectividad frente a diversos tipos de crisis que ha mostrado en estudios en animales13. Los efectos adversos son poco frecuentes y vienen recogidos en la tabla 2. Es importante reseñar que parece tener menores efectos adversos a nivel conductual que el LEV29. Como desventajas presenta más interacciones con otros fármacos que el LEV, pudiendo alterar y verse alterado por otros inductores hepáticos10.
CannabidiolEl CBD es una molécula obtenida de la planta del cannabis, aunque a diferencia del tetrahidrocanabinol, no interacciona con el receptor B1, por lo que no tiene propiedades psicotrópicas pero si antiepilépticas30. Su mecanismo de acción no es totalmente conocido, aunque se piensa que podría incrementar la actividad GABA neuronal a través de la modulación del receptor GABA-A, que podría modular la entrada de calcio intracelular a través de diversos receptores (TRPV, VDAC, GPR55) y que tendría cierto efecto antiinflamatorio a través de la adenosina10,31. Recientemente ha obtenido la indicación por la FDA (2018) y por la EMA (2019) para el manejo de crisis en pacientes ≥ 2 años con síndrome de Dravet y con síndrome de Lennox-Gastaut. La efectividad del CBD fue demostrada en 3 estudios randomizados a doble ciego, realizados en población pediátrica y adulta30,32,33, aunque existen estudios que parecen indicar que podría ser efectivo en otros tipos de epilepsia y síndromes epilépticos34,35). Su principal ventaja es que ha demostrado ser efectivo en dos de los síndromes epilépticos más complejos de controlar. Como principales desventajas, que es un fármaco que presenta una tasa elevada de efectos adversos (tabla 2) y que interacciona con diversos fármacos antiepilépticos y puede provocar alteraciones hepáticas especialmente cuando se usa en conjunción con VPA o con VPA y CLB, precisando una monitorización analítica estrecha (tabla 3).
Principales ventajas y desventajas en población pediátrica de los fármacos antiepilépticos de tercera generación
| Principales ventajas | Fármaco | Principales desventajas |
|---|---|---|
| Cinética lineal y previsibleVida media prolongada (20-24 horas)Una única toma diariaEfectos adversos predeciblesMejor tolerada que CBZSin efecto inductor de CBZDosis bien definida en niños | Eslicarbazepina(ESL) | Inhibidor citocromo CYP2C19 (interacción con PHT)Efectos adversos neurológicos clase I (somnolencia)HiponatremiaMayor tasa de efectos adversos si se usa en combinación con otros fármacos que actúan en los canales de sodioEscasa experiencia en niños |
| Inicio de acción rápidoCinética lineal y previsibleEscasa unión a proteínas plasmáticasNo es un inductor enzimáticoMetabolismo hepático distinto a CYP450Eliminación renalNo interacciones farmacológicas significativasPotencial empleo por vía parenteralAmplia gama de presentacionesSinergias con otros fármacos antiepilépticos (LEV,VPA...) | Lacosamida(LCM) | Espectro de acción limitado actualmente a epilepsias focalesEfectos adversos neurológicos clase I, dosis-dependientes, que empeoran al asociarlo con otros fármacos bloqueantes del canal de sodio voltaje-dependiente |
| Retirado del mercado | Retigabina(RTG) | Efectos adversos incluyendo alteración de la pigmentación a nivel dermatológico y cutáneo (degeneración retiniana). |
| Cinética lineal previsibleVida media prolongada (105 horas)Metabolismo hepático por vía distinta a CYP450Potencial amplio espectro (otros tipos de epilepsia)Administración en una única toma diaria (nocturna)Efectos adversos bien definidos y previsiblesAmplia gama de presentacionesEscasa afectación cognitivaNo produce alteraciones del sueño | Perampanel (PER) | Elevada tasa de unión a proteínas plasmáticasSe ve influenciado por otros fármacos inductoresInteracciona con otros fármacos antiepilépticos (OXC, TPM)Efectos adversos neurológicos clase IPotencial desarrollo de alteraciones comportamentales gravesNo existe suspensión oral ni presentación intravenosaNo existe dosis pediátrica por kg de peso y día. |
| Opción terapéutica en pacientes epilépticos de muy difícil control (epilepsia farmacorresistente asociada a esclerosis tuberosa)Efectivo frente a otras patologías asociadas a esclerosis tuberosa (SEGA, angiomiolipoma renal) | Everolimus (EVR) | Indicación en este momento limitada a la epilepsia farmacorresistente en pacientes con esclerosis tuberosaFrecuentes efectos adversos (estomatitis, infecciones etc.)Dosificación precisa monitorización de niveles terapéuticos (analíticas frecuentes) |
| Amplio espectroInicio de acción rápidoPosible titulación rápidaCinética lineal y predecibleEscasa unión a proteínas plasmáticasNo interacciones con otros fármacosBalance adecuado entre eficacia y tolerabilidad. Mejor tolerado que LEVAmplia gama de presentaciones, incluyendo suspensión oral. Se puede administrar por vía enteral o parenteral. | Brivaracetam (BRV) | Efectos adversos neurológicos tipo I (somnolencia, irritabilidad)Escasa experiencia global en epilepsias de origen no focalEscasa experiencia en niños |
| Opción terapéutica en pacientes epilépticos de muy difícil control (epilepsia farmacorresistente asociada a síndrome de Dravet y síndrome de Lennox-Gastaut), con efecto positivo mantenido en el tiempoPotencial amplio espectro (otras formas de epilepsia farmacorresistente), con efecto positivo mantenido en el tiempoAusencia de efectos psicotrópicos | Cannabidiol (CBD) | Efectos adversos neurológicos tipo I, dosis-dependientes (somnolencia, sedación, ataxia, alteración de la conducta)Incrementa los niveles plasmáticos de CLB (>166%) por lo que suele ser precisa una reducción de dosis de CLBPosible hepatopatía si se usa en combinación con VPA |
En el presente artículo hemos intentado resumir las principales características de los nuevos FAE en pediatría. La mayoría de estos fármacos de tercera generación son fármacos efectivos, seguros y generalmente bien tolerados en el niño. Si nos centramos en aquellos destinados para un uso más amplio (BRV, ESL, LCM, PER), si bien su efectividad ha sido demostrada en base a extrapolación de datos de estudios realizados en adultos, será la experiencia real en el día a día lo que nos mostrará el verdadero potencial de estos fármacos, probablemente ampliando su espectro y definiendo nuevas indicaciones o sinergias con otros tratamientos (tal y como ha pasado con la mayoría de los fármacos antiepilépticos en el pasado). En un amplio metaanálisis reciente (se analizaron y compararon 19 estudios randomizados y controlados a doble ciego, con una n=7245) sobre uso de fármacos de tercera generación (ESL, LCM, PER, BRV) en adultos con epilepsia de origen focal, no se hallaron diferencias significativas en cuanto a efectividad, aunque los datos parecían indicar que la tolerabilidad del BRV era mejor que el resto, independientemente de las dosis empleadas36. Así pues y teniendo en cuenta que todos los fármacos parecen ser igualmente efectivos y seguros, el manejo de la epilepsia se está volviendo cada vez más personalizado, optando por uno u otro fármaco en función de la tolerancia, sinergias, antagonismos o contraindicaciones aunque el fin sigue siendo el mismo, el de mejorar la calidad de vida de los niños con epilepsia y sus familias.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Maria Romanova, MScBMC, ilustradora médica y animadora (www.mariaromanova.com. Correo electrónico: biomedical.art@gmail.com).