La supervivencia después del trasplante de progenitores hematopoyéticos ha mejorado de forma importante en los últimos años. Desafortunadamente, se ha descrito un mayor riesgo de neoplasias malignas secundarias (NMS) en esta población representando una causa importante de mortalidad tardía.
Pacientes y métodosEn este estudio, analizamos la incidencia de NMS y los factores de riesgo asociados en los pacientes sometidos en edad pediátrica a un trasplante de progenitores hematopoyéticos (alogénico o autólogo) en nuestro centro.
ResultadosObservamos 19 casos de NMS en una cohorte de 371 pacientes, siendo la incidencia acumulada del 6, 12 y 36% a los 15, 20 y 30 años de seguimiento, respectivamente. Los tumores sólidos fueron los más prevalentes. El riesgo fue significativamente mayor de lo esperado en la población general para cada tipo de tumor y en los diferentes rangos de edad (p <0,0001). La radioterapia y la EICH crónica fueron los principales factores de riesgo para el desarrollo de NMS en nuestra serie.
ConclusionesHemos observado una alta incidencia de neoplasias malignas secundarias en los supervivientes de un trasplante de progenitores hematopoyéticos evidenciando la necesidad de un seguimiento a largo plazo de esta población de pacientes.
Survival after hematopoietic stem cell transplantation has improved dramatically in recent years. Unfortunately, there is an increased risk of subsequent malignant neoplasms (SMN) in this population and this represents a significant cause of late mortality.
Patients and methodsIn this study, we analyzed the incidence of SMN and the associated risk factors in patients referred at a pediatric age for hematopoietic stem cell transplantation (allogeneic or autologous) in our center.
ResultsWe observed 19 cases of SMN in a cohort of 371 patients, with a cumulative incidence of 6, 12, and 36% at 15, 20, and 30 years of follow-up, respectively. The solid tumors were the most prevalent malignancies. The risk was significantly higher than expected in the general population for each tumor type and in the different age ranges (p<.0001). Radiotherapy and chronic GvHD were the main risk factors for the development of SMN in our series.
ConclusionsWe observed a high incidence of SMN among hematopoietic stem cell transplantation survivors highlighting the need for life-long surveillance.
El trasplante de progenitores hematopoyéticos (TPH) permite la curación de varias enfermedades malignas y no malignas, tanto congénitas como adquiridas, en la infancia y en la edad adulta. En años recientes, avances en el TPH y en los tratamientos de soporte han mejorado la supervivencia a largo plazo de los pacientes sometidos a este procedimiento. Desafortunadamente, se ha descrito un mayor riesgo de neoplasias malignas secundarias (NMS) en esta población. Hay pocos estudios restringidos a la población pediátrica. Los estudios de Curtis et al.1 en 1997 y de Socie et al.2 en 2000 reportaron un riesgo de NMS 36 y 45 veces mayor, respectivamente, en niños sometidos a TPH. Ambos estudios encontraron una correlación inversa entre el riesgo de desarrollo tardío de neoplasias y la edad al trasplante.
En el presente estudio, analizamos la incidencia de NMS y los riesgos asociados a su desarrollo en pacientes sometidos a TPH en nuestra unidad pediátrica. El estudio de los factores de riesgo para el desarrollo de estas neoplasias malignas es crucial para poder mejorar los regímenes de acondicionamiento y los tratamientos de soporte asociados al TPH.
Pacientes y métodosLa cohorte de estudio incluyó 371 pacientes sometidos a TPH (autólogo o alogénico) entre 1984 y 2013 en la Unidad Pediátrica de TPH de nuestro hospital. Se analizaron un total de 434 trasplantes, correspondientes a todos los realizados en nuestra unidad entre 1984 y 2013. No hubo pérdidas de seguimiento. De los 371 pacientes, 63 fueron sometidos a más de un trasplante: 2 TPH (n=58) o 3 TPH (n=5). Se obtuvo el consentimiento informado de los tutores legales para la realización del TPH y estudios posteriores. Se recogieron prospectivamente las características de los pacientes, el tipo de TPH y la evolución clínica en una base de datos. La recogida de datos evolutivos se completó el 30 de septiembre de 2016. La duración del seguimiento fue de 30 años. Nos pusimos en contacto con todos los pacientes adultos dados de alta del seguimiento en nuestro centro para obtener información sobre su estado clínico y complicaciones tales como neoplasias malignas. Todas las neoplasias malignas secundarias se diagnosticaron en nuestro centro, por lo que nos fue posible proceder a la revisión de las pruebas diagnósticas y las historias clínicas. La edad mediana de los pacientes en el momento del trasplante fue de 8,4 años (0,1-20 años) y 9 pacientes recibieron el trasplante con más de 18 años; 226 pacientes eran varones (60,9%) y 145 mujeres (39,1%).
La indicación para TPH fue enfermedad maligna en 317 pacientes (85,4%) y enfermedad no maligna en 54 pacientes (14,6%). Las enfermedades malignas incluyeron tumores hematológicos (n=209) y tumores sólidos (n=108). Las enfermedades no malignas fueron inmunodeficiencias primarias (n=20), anemias aplásicas (n=11), fallas medulares congénitas (n=8), hemoglobinopatías (n=8) y enfermedades metabólicas (n=7). En pacientes con enfermedades malignas, el estado clínico en el momento del trasplante fue primera remisión completa en 146 pacientes, segunda remisión completa en 101 pacientes y enfermedad avanzada o refractaria en 7 pacientes. El TPH fue autólogo en 234 casos (53,9%) y alogénico en 200 casos (46,1%). Los TPH fueron de donante emparentado en 141 casos (32,5%) y de donante no emparentado en 59 casos (13,6%). En cuanto a la identidad HLA, los TPH alogénicos fueron de hermano compatible (n=106), donante haploidéntico (n=35), donante no emparentado compatible (n=23) o donante no emparentado no idéntico (n=36).
La fuente de progenitores hematopoyéticos fue la médula ósea en la mayoría de los casos (68,7%; n=298) seguida de sangre periférica movilizada (23,7%; n=103) y sangre de cordón umbilical (5,8%; n=25). En 8 trasplantes se utilizó una combinación de distintas fuentes (sangre de cordón umbilical combinada con médula ósea o sangre periférica). El tratamiento de acondicionamiento se basó en la irradiación corporal total (ICT) en el 48,2% de los TPH (n=209). La dosis fraccionada osciló generalmente entre 10 y 13,5Gy (n=190). Pocos pacientes recibieron dosis menores de 10Gy (n=12) o mayores de 13,5Gy (n=7). Los regímenes de acondicionamiento basados en quimioterapia incluyeron busulfán+ciclofosfamida±otros (n=84), ciclofosfamida+otros fármacos (n=62), fludarabina+otros (n=46), etopósido+otros (n=26).
Siete pacientes no recibieron tratamiento de acondicionamiento. Cincuenta y ocho pacientes habían recibido radioterapia (RT) antes del trasplante para tratar su enfermedad maligna. La dosis de RT generalmente osciló entre los 12,5Gy y los 20Gy (n=47), superando los 20Gy en 11 pacientes.
La profilaxis de injerto contra el huésped se realizó mayoritariamente con ciclosporina, como único inmunosupresor (n=88) o asociada a otros inmunosupresores como metotrexato± micofenolato (n=70), prednisona (n=18) o micofenolato (n=18). Se realizó depleción in vivo de linfocitos T en 56 trasplantes mediante la administración de timoglobulina antitimocítica (ATG) o alemtuzumab (Campath).
DefinicionesSe ha considerado evento a los acontecimientos desfavorables ocurridos en el período postrasplante: recaída de enfermedad de base, aparición de neoplasia secundaria o éxitus.
Se ha definido supervivencia global como el tiempo transcurrido desde la realización del TPH. Se ha definido como supervivencia libre de evento el tiempo transcurrido entre la realización del TPH y la presentación de cualquier evento. Se ha definido mortalidad relacionada con el trasplante como muerte por cualquier causa relacionada con el trasplante exceptuando la enfermedad de base.
Análisis estadísticoSe utilizó el test log-rank para evaluar posibles factores de riesgo. La descripción univariante se ha llevado a cabo mediante tablas de contingencia y el test inferencial empleado ha sido el chi cuadrado. La aproximación multivariante se realizó mediante un modelo de regresión logística, obteniéndose el odds ratio para cada factor. El nivel de significación estadística se fijó en el 5% habitual (α=0,05). El análisis estadístico se llevó a cabo con el paquete estadístico IBM-SPSS (Statistical Package for Social Sciences) versión 22.0 para Windows.
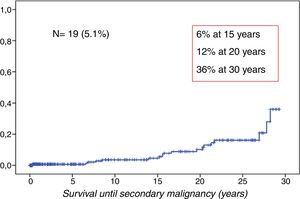
ResultadosSe observaron 19 casos de NMS (5,1%). La incidencia acumulada fue 6% a 15 años, 12% a 20 años, y 36% a 30 años de seguimiento (fig. 1).
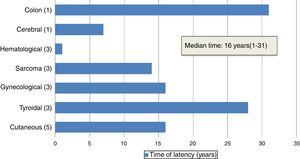
La edad mediana de los pacientes al diagnóstico de NMS fue 25 años (11-42 años). La mediana del tiempo de latencia entre el TPH y el diagnóstico de NMS fue 16 años (1-31 años) (fig. 2).
En nuestra serie, las neoplasias más prevalentes fueron los tumores sólidos, correspondiendo al 84% de los casos (n=16). La mediana del tiempo de latencia entre el TPH y el diagnóstico de tumores sólidos fue 18,5 años (7-28 años). El tumor sólido secundario fue la causa de muerte en 5 pacientes. Las neoplasias cutáneas fueron el tipo más frecuente (n=5), seguidas de los carcinomas de tiroides (n=3), neoplasias ginecológicas (n=3), y sarcomas (n=3). Se registraron un tumor cerebral y un carcinoma de colon. Las neoplasias hematológicas constituyeron el 16% de los casos en nuestra serie (n=3): 2 de leucemia mieloblástica aguda (LMA) y uno de síndrome linfoproliferativo postrasplante (SLPT). Estos tres pacientes murieron a causa de la neoplasia secundaria. La latencia fue más corta en el desarrollo de tumores hematológicos en comparación con los sólidos: menos de un año en dos pacientes (tabla 1).
Tipos de neoplasia postrasplante
| Tipo de neoplasia maligna | N (=19) | Estado actual |
|---|---|---|
| Cutánea | 5 | Vivo (4) |
| Carcinoma basocelular (3) | Muerto (1) | |
| Carcinoma escamoso (1) | ||
| Melanoma (1) | ||
| Carcinoma tiroides | 3 | Vivo (3) |
| Papilar (2) | ||
| Folicular (1) | ||
| Ginecológica | 3 | Muerto (3) |
| Carcinoma mama (2) | ||
| TNEP útero (1) | ||
| Sarcoma | 3 | Vivo (3) |
| Osteosarcoma (2) | ||
| Angiosarcoma (1) | ||
| Hematológica | 3 | Muerto (3) |
| LMA (2) | ||
| SLPT (1) | ||
| Glioma cerebral | 1 | Muerto |
| (Glioblastoma multiforme) | ||
| Carcinoma colon | 1 | Muerto |
LMA: leucemia mieloblástica aguda; SLPT: síndrome linfoproliferativo postrasplante; TNEP: tumor neuroectodérmico primitivo.
El motivo del trasplante en casi todos los pacientes que desarrollaron una NMS (17 de 19 pacientes) fue una enfermedad maligna: leucemia aguda en 12 pacientes y tumor sólido en 5 pacientes. Las enfermedades benignas que llevaron al trasplante fueron anemia de Fanconi y aplasia medular adquirida.
Once pacientes recibieron un trasplante autólogo y 8 un trasplante alogénico.
Las características de los pacientes, los TPH y las NMS se detallan en la tabla 2.
Características de los pacientes y los trasplante de progenitores hematopoyéticos
| Pac. | Sexo/edad TPH (años) | Enfermedad | Tipo TPH / | Acondicionamiento/ | Radioterapia previa | EICH | Neoplasia secundaria | Edad 2.ª neoplasia | Estado actual | Causa éxitus |
|---|---|---|---|---|---|---|---|---|---|---|
| Fuente | Profilaxis EICH | (dosis) | (tipo) | (años) | ||||||
| 1 | M/4 | Tumor sólido(Wilms) | Auto/MO | CARBO-VP16-MEL | Sí (holocraneal) | Osteosarcoma calota cráneo | 12 | Muerto | NMS | |
| (12,5-20 Gy) | ||||||||||
| 2 | F/6 | LLA-B | Alo-SD/MO | CFM-ICT (12,5 Gy)/CsA+MTX | Sí (holocraneal) | No | Glioma cerebral | 13 | Muerto | NMS |
| (12,5-20 Gy) | ||||||||||
| 3 | M/13 | LLA-T | Auto/MO | CFM-ICT (12,5 Gy) | No | LMA | 13 | Muerto | NMS | |
| 4 | M/11 | LLA-T | Auto/MO | CFM-ICT (12,5 Gy) | No | LMA | 20 | Muerto | NMS | |
| 5 | F/4 | LLA-B | Alo-SD/MO | CFM-ICT (12,5 Gy)/CsA | No | Sí (aguda II; | Útero (PNET) | 21 | Vivo | |
| crónica: piel/ extensa) | ||||||||||
| 6 | F/10 | LMA | Alo-SD/MO | CFM-ICT (12,5 Gy)/CsA+MTX | No | Sí (aguda I; | Carcinoma mama | 26 | Vivo | |
| crónica: piel/ extensa) | ||||||||||
| 7 | M/15 | LLA-B | Alo-SD/MO | CFM-ICT (12,5 Gy)/CsA+MTX | No | No | Carcinoma basocelular | 34 | Vivo | |
| 8 | M/7 | LMA | Auto/MO | CFM-ICT (12,5 Gy) | No | Carcinoma basocelular | 23 | Vivo | ||
| 9 | F/4 | Tumor sólido (neuroblastoma) | Auto/MO | CFM+otros QT | Sí (abdomen) | Osteosarcoma | 25 | Muerto | NMS | |
| (12,5-20Gy) | ||||||||||
| 10 | M/17 | LMA | Alo-DNE/SP | BU-CFM/CsA+MMF | No | No | PTLD x VEB | 17 | Muerto | NMS |
| Alo-DNE/SCU | FLU+otros QT /CsA | |||||||||
| 11 | M/11 | LMA | Auto/MO | CFM-ICT (12,5Gy) | No | Adenocarcinoma colon | 31 | Muerto | NMS | |
| 12 | F/12 | LMA | Auto/MO | CFM-ICT (12,5 Gy) | No | Carcinoma basocelular | 27 | Vivo | ||
| 13 | F/5 | LLA-B | Alo-SD/MO | CFM-ICT (12,5 Gy)/CsA+MTX | No | No | Carcinoma mama | 27 | Vivo | |
| 14 | M/12 | A. Fanconi | Alo-SD/MO | CFM-ITA (<10Gy)/CsA | No | No | Carcinoma escamoso piel | 32 | Muerto | NMS |
| 15 | M/12 | Auto/MO | VP16+MEL+TT | Sí (tórax) | Carcinoma papilar tiroides | 34 | Vivo | |||
| Linfoma Hodgkin | (12,5-20Gy) | |||||||||
| 16 | M/14 | LLA-B | Auto/MO | CFM-VP16-ICT (12,5 Gy) | No | Melanoma | 21 | Vivo | ||
| 17 | M/8 | Anemia aplásica | Alo-DNE/MO | CFM-TAI (< 10Gy)-ATG/CsA+MTX | No | Sí (aguda I) | Angiosarcoma hepático | 22 | Muerto | NMS |
| 18 | M/13 | Linfoma no Hodgkin | Auto/MO | CFM-ICT (12,5 Gy) | Sí (tórax) | Carcinoma folicular tiroides | 42 | Vivo | ||
| (> 20Gy) | ||||||||||
| 19 | F/3 | Tumor sólido(Wilms) | Auto/MO | CFM+otro QT | No | Carcinoma papilar tiroides | 31 | Vivo |
CFM: ciclofosfamida; CsA: ciclosporina; F: female (mujer); ICT: irradiación corporal total; ITA: irradiación toracoabdominal; LLA: leucemia linfoblástica aguda; LMA: leucemia mieloblástica aguda; M: male (varón); MEL: melfalán; MMF: mofetil micofelonato; MTX: metotrexato; QT: quimioterapia; TPH: trasplante de progenitores hematopoyéticos; VP16: etoposido.
En nuestra cohorte, 17 de los 19 pacientes habían recibido radioterapia. Durante el acondicionamiento, 12 pacientes recibieron ICT (12,5Gy) y 2 radioterapia toracoabdominal (5Gy). Dos pacientes que recibieron ICT durante el acondicionamiento habían sido tratados previamente con radioterapia: un paciente con radioterapia holocraneal (19Gy) y uno con radioterapia toracoabdominal (>20Gy). Tres pacientes recibieron radioterapia únicamente durante el tratamiento de la enfermedad de base, pero no durante el acondicionamiento: un paciente radioterapia holocraneal (19Gy), un paciente radioterapia abdominal (20Gy), y un paciente radioterapia de tórax (20Gy). Los pacientes tratados con radioterapia holocraneal desarrollaron la neoplasia secundaria maligna a nivel craneal: un osteosarcoma de la calota craneal y un glioma cerebral de alto grado, respectivamente. La neoplasia secundaria fue la causa de muerte en ambos pacientes.
La mortalidad en pacientes que desarrollaron una NMS fue del 47,4% (n=9). La neoplasia secundaria fue la causa de éxitus en todos los casos.
En el análisis univariante, el acondicionamiento basado en la ICT se asoció a un aumento del riesgo, aunque sin alcanzar el nivel de significación estadística (OR=2,73; p=0,05). La RT previa se relacionó con un riesgo 3 veces mayor, asociación que sí fue estadísticamente significativa (OR=3,1; p=0,04). La enfermedad injerto contra huésped (EICH) crónica se asoció significativamente a un riesgo mayor de neoplasia maligna (OR=16; p=0,006) (tabla 3).
Factores de riesgo de neoplasias malignas secundarias (análisis univariante)
| Factor | OR | p-valor | IC 95% |
|---|---|---|---|
| ICT | 2,73 | 0,05 | 1,0-8,3 |
| RT | 3,1 | 0,04 | 1,0-9,2 |
| ICT+RT | 2,3 | 0,2 | 0,5-9,2 |
| Edad al TPH ≥ 10 a | 1,87 | 0,2 | 0,7-4,5 |
| Edad al TPH <10 a | 0,51 | 0,2 | 0,2-1,3 |
| EICH aguda | 0,5 | 0,4 | 0,1-1,8 |
| EICH crónica | 16,7 | 0,006 | 2,8-98,3 |
| Enfermedad maligna | 1,47 | 1 | 0,3-6,5 |
| Enfermedad benigna | 0,69 | 1 | 0,1-2,9 |
| Auto-TPH | 0,98 | 1 | 0,3-2,5 |
| Alo-TPH | 1 | 1 | 0,4-2,4 |
| Depleción in vivo | 0,86 | 1 | 0,1-4,4 |
EICH: enfermedad injerto contra huésped; ICT: irradiación corporal total; IC 95%: intervalo de confianza del odds ratio del 95%; OR: odds ratio; RT: radioterapia; TPH: trasplante de progenitores hematopoyéticos.
En el análisis multivariante, la ICT y la EICH crónica fueron los factores relacionados de forma estadísticamente significativa con un aumento en el riesgo de neoplasia maligna. La ICT se asoció a un riesgo 4 veces mayor (OR=4,3; p=0,03) y la EICH crónica a un riesgo más de 15 veces mayor (OR=15,4; p <0,0001). La RT previa no se relacionó con un aumento del riesgo en este análisis (tabla 4).
Factores de riesgo de neoplasias malignas secundarias (análisis multivariante)
| Factor | OR | p-valor |
|---|---|---|
| ICT | 4,3 | 0,03 |
| RT | 0,25 | 0,6 |
| Edad al TPH ≥ 10 a | 0,3 | 0,5 |
| EICH aguda | 0,65 | 0,4 |
| EICH crónica | 15,4 | <0,0001 |
EICH: enfermedad de injerto contra huésped; ICT: irradiación corporal total; OR: odds ratio; RT: radioterapia; TPH: trasplante de progenitores hematopoyéticos.
En nuestra serie, la EICH aguda no estaba relacionada con un aumento en el riesgo. También se estudiaron otros factores, como el tipo de TPH, el tipo de enfermedad de base, la edad al trasplante y la depleción linfocitaria in vivo, pero ninguna de ellas se asoció a un riesgo mayor.
Para corroborar que nuestra cohorte exhibía un riesgo mayor de neoplasias malignas en comparación con la población general, comparamos el número de casos observados en la cohorte con los casos esperados en la población general por grupos de edad. El número limitado de pacientes en nuestro estudio impidió la realización de un análisis estadístico que cumpliese estrictamente las condiciones necesarias para su aplicación. No obstante, verificamos que la incidencia en nuestra cohorte excedía con mucho la esperada para cada tipo de neoplasia tanto en varones como en mujeres, y que la diferencia era estadísticamente significativa (p <0,0001).
Para este análisis se emplearon datos proporcionados por la Red Española de Registros de Cáncer (Registre de Càncer de Tarragona, Fundació Lliga per a la Investigació i Prevenció del Càncer).
DiscusiónVarios estudios han descrito un riesgo mayor de neoplasias malignas secundarias en supervivientes al TPH que representan una causa importante de mortalidad tardía.
Las incidencias acumuladas encontradas en nuestro estudio (6, 12, y 36% a 15, 20, y 30 años, respectivamente) corroboran que el riesgo de NMS aumenta con el tiempo. Cabe mencionar que aunque nuestro informe se basa en una cohorte de un único centro, los porcentajes que observamos se encuentran entre los más altos de la literatura. La incidencia de tumores sólidos reportada en las series más grandes (más de 19.000 pacientes) es de 1-6% a 10 años y 2-15% a 15 años1. El estudio publicado por los investigadores del Center of International Blood and Marrow Transplant Research y el Fred Hutchinson Cancer Research Center reportó 189 casos de tumores sólidos secundarios en una cohorte de 28.874 receptores de alo-TPH (adultos y niños)3. La incidencia acumulada fue de 1% a 10 años, 2,2% a 15 años y 3,3% a 20 años del TPH. En un estudio europeo con una cohorte de 1.036 pacientes, la incidencia acumulada de tumores sólidos fue del 3,5% a 10 años y del 12,8% a 15 años4.
Entre los tumores sólidos registrados en nuestra serie, los más prevalentes fueron los de tiroides, cutáneos y de mama.
El carcinoma de tiroides es un tumor típicamente radioinducido que se observa con frecuencia en pacientes irradiados previamente5,6. No obstante, también se han descrito casos de tumores de tiroides desarrollados tras el TPH en pacientes que nunca han recibido radioterapia, lo que sugiere que puede haber otros mecanismos involucrados en el desarrollo de estos tumores7. De acuerdo con dichas descripciones, en nuestra serie también se registró un caso de carcinoma papilar tiroideo en una paciente que no recibió radioterapia en ningún momento.
La asociación entre la radioterapia y el aumento en el riesgo de carcinoma basocelular es bien conocida. De hecho, la membrana basal de la epidermis, donde se localizan el 70% de las células proliferantes, es la zona más radiosensible de la piel8. Un estudio japonés de sobrevivientes de la bomba atómica evidenció un aumento del riesgo de carcinoma basocelular en los sobrevivientes en comparación con individuos no expuestos a radiación ionizante, con un riesgo relativo del 1,8% (intervalo de confianza del 90%, 0,8-3,3) y aumento del riesgo con el paso del tiempo9. Las neoplasias cutáneas (tipo no melanoma) son típicas de la edad avanzada, con presentación a una edad mediana de 64 años10. Por otro lado, los supervivientes de TPH desarrollan neoplasias cutáneas a edades más tempranas en comparación con la población general, normalmente antes de los 30 años de edad, como demostraron Perkins et al.10. En nuestra cohorte, los 3 pacientes que desarrollaron carcinomas basocelulares lo hicieron a los 23, 27 y 34 años, lo que confirma la aparición temprana de estos tumores respecto a lo esperado.
Se observaron 2 casos de cáncer de mama con aparición antes de los 30 años de edad. Los factores de riesgo principales descritos en relación con estos tumores son edad temprana al trasplante y el acondicionamiento basado en la ICT. En 2008 se publicó un estudio colaborativo del Fred Hutchinson Cancer Research Center y el European Group for Blood and Marrow Transplantation que evaluaba la incidencia de las neoplasias secundarias de mama en supervivientes de TPH alogénicos11. La cohorte incluía a 3.337 mujeres (de las que 1.026 habían recibido el trasplante en edad pediátrica), entre las que se detectaron 52 casos de cáncer de mama. La mediana del tiempo de aparición fue de 12,5 años (5,7-24,8 años). La incidencia acumulada también aumentó con el paso del tiempo: 0,8% a 10 años, 4,6% a 20 años y 11% a 25 años tras el TPH.
En la literatura, la LMA se ha asociado a altas dosis de quimioterapia y el TPH autólogo; el desarrollo de leucemia de células del donante en un, TPH alogénico es muy infrecuente12. En un estudio con una duración de seguimiento mínima de 5 años, el riesgo de desarrollar LMA después de un TPH autólogo en pacientes con linfoma oscilaba entre el 3% y el 19,8%13. Consistentemente con estas observaciones, los 2 pacientes de nuestra cohorte que desarrollaron LMA habían sido sometidos a un TPH autólogo y habían recibido ICT durante el acondicionamiento.
En cuanto al SLPT, la incidencia reportada en series amplias es muy baja (1-1,6%) y se asocia a un pronóstico infausto en la mayoría de los casos14. Hay dos factores de riesgo importantes: la inmunosupresión intensa, y, en muchos casos, la reactivación de virus de Epstein-Barr15. En nuestro paciente, el SLPT se asoció a la reactivación de virus de Epstein-Barr.
Uno de los objetivos de nuestro estudio fue identificar los factores de riesgo asociados al desarrollo de neoplasias secundarias. Nuestros datos confirmaron que la radioterapia es uno de los factores de riesgo principales en relación con las NMS. Curiosamente, la EICH crónica también fue un factor de riesgo importante de desarrollo de NMS (RR=15,4). En la literatura, la EICH crónica se ha relacionado con un aumento del riesgo de tumores escamosos de piel y de la cavidad bucal. En algunas series, el factor de riesgo identificado en relación con el desarrollo de NMS ha sido el tratamiento inmunosupresor asociado a la EICH crónica (por ejemplo, la ciclosporina o la azatioprina)16. La inflamación crónica y la inmunosupresión administrada durante largos períodos podrían interferir en la reparación tisular, incrementando el riesgo de desarrollo tumoral.
Nuestros resultados corroboran el papel contribuyente de la irradiación al desarrollo de neoplasias secundarias. La ITC (asociada a ciclofosfamida) ha sido el gold standard entre los regímenes de acondicionamiento durante muchos años. El cambio producido en la última década hacia regímenes menos tóxicos sin irradiación podría contribuir a la reducción de las complicaciones a largo plazo tales como las NMS. Se requiere seguimiento adicional para estudiar la influencia de los nuevos regímenes de intensidad reducida sobre el desarrollo de nuevos tumores. Otro hallazgo importante de nuestro estudio es la verificación de que la EICH crónica es una complicación aparentemente asociada a un aumento del riesgo de NMS. La profilaxis de la EICH crónica parece ser el mejor método para prevenir las neoplasias malignas tardías. No obstante, esta estrategia ha de valorarse con cautela, sopesando el riesgo aumentado de recaída si el trasplante se realizó en un paciente con enfermedad maligna.
La alta incidencia de neoplasias subraya la necesidad del seguimiento de por vida de los supervivientes de un TPH.
Una de las principales fortalezas del estudio es su largo seguimiento, ya que la incidencia de neoplasias secundarias tiende a aumentar con el tiempo, de manera que pudimos detectar varios casos de NMS a pesar del pequeño tamaño de la cohorte. Además, no hubo pérdidas durante el seguimiento, lo que nos permitió reportar la incidencia real de NMS. Nuestro estudio también tiene limitaciones. A pesar del alto número de casos de neoplasia secundaria, el escaso número de pacientes en la cohorte no nos permite llegar a conclusiones generalizables. La considerable heterogenia de los regímenes de quimioterapia utilizados en el tratamiento de tumores sólidos y leucemia no nos ha permitido analizar la influencia del tratamiento recibido previamente al trasplante sobre el riesgo de neoplasias secundarias. Por último, no se estudió la influencia de otros factores exógenos (alcohol, tabaco, obesidad, tratamiento hormonal, etc.) o genéticos que podrían estar involucrados en la oncogénesis.
En conclusión, las neoplasias malignas secundarias representan una importante causa de morbimortalidad a largo plazo en supervivientes de un trasplante de progenitores hematopoyéticos. Se encontró una incidencia muy alta de NMS en pacientes sometidos a TPH durante la infancia. La radioterapia y la EICH crónica fueron los factores de riesgo más importantes relacionados con el desarrollo de NMS.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Jaume Galceran, director del Registre de Cancer de Tarragona, Fundació Lliga per a la Investigació i Prevenció del Cáncer, Reus (Tarragona, España).