Introducción
Los avances en el cuidado perinatal y neonatal de las últimas tres décadas han mejorado la supervivencia de los recién nacidos prematuros de muy bajo peso (RNMBP o < 1.500 g)1,2. Sin embargo, desde la segunda mitad de los años 1990 no se han encontrado mejorías adicionales evidentes en la morbilidad de estos pacientes3. Los programas de seguimiento específico para este grupo de niños permiten conocer no sólo las diferentes morbilidades en el curso del desarrollo derivadas de la prematuridad extrema, información esencial a la hora de planificar cuidados y distribuir recursos, sino también anticipar problemas para, en algunos casos, prevenirlos y/o adoptar estrategias que aminoren las diferentes morbilidades, optimizando así el potencial de desarrollo. Es por ello que conocer la morbilidad neurológica y neurosensorial posnatal de los RNMBP es un aspecto de gran relevancia para los pediatras y todos aquellos que trabajan o planifican cuidados en el campo sanitario. Debido a que para los 2 años de edad corregida la gran mayoría de las secuelas graves están claramente identificadas, el objetivo del presente estudio fue conocer la morbilidad a los 2 años de edad corregida de una cohorte de recién nacidos de 1.500 g durante los años 1999-2000 en un hospital terciario de la comunidad de Madrid.
Pacientes y métodos
Estudio observacional de una cohorte de 188 recién nacidos consecutivos con peso inferior a 1.500 g atendidos en el Hospital Universitario La Paz (Madrid) entre enero de 1999 y diciembre de 2.000, que sobrevivieron al período neonatal cuyas características perinatales se muestran en la tabla 1.
Durante el ingreso en neonatología se realizaron evaluaciones ecográficas seriadas a todos los pacientes, comenzando en los primeros 2 días y luego periódicamente según los hallazgos clínicos, al menos hasta la 40 semana de edad posconcepcional. Las hemorragias subependimarias-intraventriculares se agruparon según una clasificación modificada de Volpe4,5. La ventriculomegalia posthemorrágica se definió según el índice ventricular de Levene6. Cuando se diagnosticó infarto periventricular, éste fue clasificado como pequeño si se limitaba sólo a una región, o extenso cuando se extendía desde la región frontal a las regiones parietooccipitales. Para la definición y clasificación de leucomalacia periventricular se siguió una modificación de la clasificación de De Vries et al7, en la que se consideraron aquellos casos con hiperecogenicidad periventricular persistente (> 15 días) por el riesgo que estos niños tienen de evolucionar a una ventriculomegalia de bordes irregulares, que traduce una lesión isquémica periventricular.
Se definió enfermedad pulmonar crónica como la necesidad de oxígeno suplementario por encima de las 36 semanas de edad posconcepcional.
El seguimiento consistió en revisiones periódicas programadas desde los 15 días postalta con periodicidad trimestral durante el primer año y semestral durante el segundo. Todas las revisiones fueron realizadas por el mismo neonatólogo y en cada revisión, además de la somatometría y el examen global de la salud del niño, se realizó un examen neurológico siguiendo un esquema modificado del de Amiel-Tisson y Grenier8. La evaluación del crecimiento somatométrico (peso, talla y perímetro cefálico [PC]) se realizó con los mismos aparatos y se evaluó utilizando las tablas de crecimiento de Hernández et al9. También a intervalos regulares (a los 6 y 12 meses durante el primer año, y posteriormente según evolución) el estado neurológico funcional fue evaluado por un neurólogo infantil. Se evaluaron también las diferentes morbilidades por dominios: desarrollo motor, cociente de desarrollo, crecimiento somatométrico, discapacidades cognitivas y neurosensoriales. El diagnóstico de parálisis cerebral fue establecido sobre la base de la presencia de alteraciones motoras espásticas no progresivas10. La clasificación topográfica de la parálisis cerebral se realizó según los criterios de Hagberg et al11. Para aproximarnos a la clasificación funcional seguimos las directrices de Sala y Grant12 y Payás et al13 teniendo en cuenta la edad de adquisición de los principales hitos del control postural temprano. La evaluación del cociente de desarrollo (CD) la llevó a cabo un psicólogo al año y a los 2 años de edad corregida utilizando la escala de Brunet y Lezine14. Se consideró patológica una puntuación inferior a 85. Se realizaron potenciales auditivos evocados (PAE) a todos los niños entre los 3-6 meses de edad corregida, repitiéndose al año en caso de resultar dudosa o patológica la primera exploración. Se consideraron pérdidas auditivas leves (21-39 dB), moderadas (40-69 dB), graves (70-89 dB) y profundas (> 90 dB), de acuerdo con los criterios del American National Standards Institute. Se exploró el fondo ocular a todos los niños a las 4 semanas de vida, realizándose controles posteriores según la presencia o ausencia de retinopatía de la prematuridad (RDP) y su gravedad15, registrándose el grado máximo de RDP que hubiera presentado el niño durante su evolución. Así mismo, se registró la presencia de estrabismo, miopía, hipermetropía y astigmatismo. Se definió ceguera como una agudeza visual inferior a 1/10 en ambos ojos.
El grado de secuelas se consideró como:
A.Leve, si cumplían algunos de los siguientes criterios: CD 71-84 (que representa 1 desviación estándar [DE] por debajo de la media: 100-15) o en aquellos niños con parálisis cerebral que consiguieron la marcha a los 2 años o antes y los trastornos sensoriales leves (hipoacusia leve-pérdida auditiva de 21-40 dB o alteraciones de la refracción < 3 dioptrías).
B.Moderado, cuando el CD fue entre 55-70, o PC con sedestación en torno a los 2 años, ceguera unilateral o alteraciones de la refracción de más de 3 dioptrías e hipoacusia moderada-grave (41-90 dB).
C.Secuelas graves: CD < 55 (3 DE por debajo de la media), parálisis cerebral que no ha alcanzado sedestación y en algunos casos ni siquiera sostén cefálico; sordera bilateral o hipoacusia profunda (> 90 dB) y ceguera bilateral.
Dentro de los trastornos de conducta sólo se han analizado las alteraciones graves, ya que las moderadas o leves, sobre todo estas últimas, son de más difícil evaluación a los 2 años de edad, y pueden considerarse posteriormente algunas de ellas como variantes de la normalidad.
Los datos se analizaron con el programa estadístico SPSS 10.0 (SPSS Inc.). La descripción de los datos cualitativos se realizó en forma de frecuencias absolutas y porcentajes y los datos cuantitativos mediante media, mediana y desviación estándar (mínimo, máximo). Para cualquier otro tipo de análisis y de forma genérica la comparación entre datos cualitativos se realizó mediante el test de la ji alcuadrado (x2) o el test exacto de Fisher; la comparación de medias se realizó, según la distribución de los datos, mediante el test de la t de Student o el test de la U de Mann-Whitney. La correlación entre datos cuantitativos se realizó mediante la correlación de Pearson o Spearman según la distribución. La asociación entre variables numéricas u ordinales y variables categóricas con más de dos categorías se analizó según su distribución con análisis de la varianza (ANOVA) o test de Kruskall-Wallis. Todas las pruebas estadísticas se han considerado bilaterales y como valores significativos aquellos con p < 0,05.
Resultados
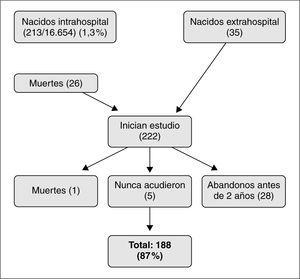
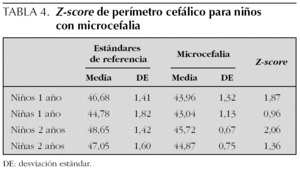
El diagrama de flujo de pacientes se muestra en la figura 1. De los 216 niños que inicialmente participaron en el estudio, 45 (20 %) abandonaron el seguimiento entre los 3 y los 18 meses. Algunos datos pudieron recuperarse por vía telefónica según cuestionario y/o entrevista personal en 17 casos. Los niños perdidos fueron de características similares a los seguidos, salvo que sus familias presentaron una mayor frecuencia de problema social. Los principales resultados del seguimiento se muestran en la tabla 2. Un total de 37 niños (17,1 %) presentaron morbilidad neurológica o sensorial mayor (ceguera, sordera, parálisis cerebral y CD < 85), nueve de los cuales mostraron dos o más dominios de discapacidad. Entre los datos somatométricos (tabla 3) destaca que el 20,4 % de los niños presentaron un PC inferior al percentil 3 (P3) al año de vida, pero sólo permaneció por debajo del P3 a los 2 años en el 7 %. En la tabla 4 queda reflejado el Z-score del perímetro cefálico de los niños con microcefalia al año y a los 2 años.
Figura 1. Diagrama de flujos de pacientes perdidos a lo largo del seguimiento.
Morbilidad sensorial
Alteraciones auditivas. Tuvieron sordera neurosensorial 4 pacientes (1,8 %); en tres fue leve (21-39 dB) y unilateral y en un caso profunda (> 90 dB) y bilateral, necesitando audífono. Este paciente tenía además asociada una notable microrretrognatia.
Alteraciones visuales: 44 niños (20,2 %) presentaron RDP; 12 fueron tratados con láser (6,3 % del total, 27 % de las RDP). Un paciente que no cumplió el protocolo oftalmológico desarrolló ceguera bilateral y otros dos presentaron una grave afectación unilateral, próxima a la ceguera. Se diagnosticaron 29 casos de enfermedad ocular menor (miopía, astigmatismo, hipermetropía y estrabismo) y necesitaron gafas correctoras para los 2 años de edad corregida 16 pacientes (7 %). Cinco pacientes (2,6 % del total) presentaron miopía magna (> 3 dioptrías) a los 2 años de edad. Como era de esperar se observó una correlación negativa entre el grado máximo de RDP alcanzado y la edad gestacional (R = 0,52; p < 0,05), así como con el peso al nacimiento (R = 0,46; p < 0,05).
Alteraciones motoras. Parálisis cerebral
Once niños (5,8 %) presentaron PC durante el seguimiento (tabla 5). Desde el punto de vista funcional (nuestra aproximación diagnóstica a los 2 años se ha visto ratificada por seguimiento posterior) cinco fueron graves, todas las tetraplejías y una diplejía. Tres pacientes mostraron parálisis cerebral moderada; los tres tenían diplejía. Otros 3 casos mostraron funcionalmente una parálisis cerebral leve (dos hemiplejía y uno diplejía).
Nueve de los 11 niños con parálisis cerebral presentaron algún tipo de alteración ecográfica, y destacó la leucomalacia periventricular como el hallazgo más relevante por su frecuencia (63,6 %). Existió un mayor porcentaje de lesión parenquimatosa (leucomalacia periventricular y/o infarto periventricular) entre los niños con PC que entre aquellos sin alteraciones motoras (54,5 % frente a 4,3 %; p < 0,001). Por el contrario, la incidencia de la hemorragia intraventricular (HIV) no difirió entre los niños con y sin parálisis cerebral. La relación entre las lesiones detectadas mediante ultrasonografía cerebral y morbilidad neurológica se muestra en la tabla 6. Cinco de los 11 pacientes con parálisis cerebral presentaron unos cocientes de desarrollo a los 2 años menores de 85. Debido al escaso número de pacientes es difícil llegar a establecer una relación estadística entre niños con parálisis cerebral y CD < 85, pero parece que la tendencia es que ambas morbilidades se asocien. En las tetraplejías el 100 % de los niños tuvieron un CD < 85. Un perímetro cefálico inferior al P3 a los 2 años de edad fue más frecuente entre los niños con parálisis cerebral que en aquellos con normalidad motora (45 % frente a 3,7 %; p < 0,001).
Coeficiente de desarrollo inferior a 85
El CD se determinó en 169 (89,9 %) pacientes, 28 (14,9 % del total) de los cuales presentaron un cociente inferior a 85 a los 2 años, asociándose en 8 casos (28,5 %) alguna otra discapacidad mayor. Existió un mayor porcentaje de lesiones parenquimatosas en estos niños que en aquellos con CD normal (21,5 % frente a 7 %; p < 0,01). La prevalencia de HIV no difirió entre niños con o sin CD < 85; el 17,8 % presentaron algún grado de HIV y 2 pacientes precisaron de una válvula de derivación ventriculoperitoneal (VDVP) como tratamiento de la hidrocefalia posthemorrágica. Seis casos tuvieron un PC < P3 a los 2 años, y prácticamente se alcanzó una significación estadística al comparar el PC entre el grupo con CD < 85 y aquellos con puntuaciones superiores (p = 0,053).
Trastornos de conducta
Cuatro pacientes presentaron trastornos graves de conducta: dos con un comportamiento no relacional tenían además tetraplejía espástica y de los otros dos, uno presentó un comportamiento agresivo con conducta repetitiva y el otro una conducta no relacional. Ambos pacientes presentaron además retraso psicomotor grave (CD < 55) y uno de ellos también una ceguera bilateral.
Discusión
Durante la década de 1990, la supervivencia de los RNMBP y RNEBP se incrementó gracias a la utilización de corticoides antenatales como inductores de la maduración pulmonar, el surfactante exógeno para profilaxis o el tratamiento de la enfermedad de membrana hialina, los avances en la asistencia ventilatoria y el cuidado intensivo neonatal4,16. Sin embargo, este descenso de mortalidad no se ha visto acompañado de un decremento paralelo de la morbilidad, e incluso algunos trabajos sugieren que las alteraciones neurosensoriales van en ascenso debido al mayor riesgo potencial de los RNEBP17,18.
En nuestro trabajo encontramos el 17,1 % de discapacidades en niños con un peso al nacimiento menor de 1.500 g lo que está acorde con lo publicado en otras series2-3,19-22. El 5,8 % de nuestros pacientes presentaron PC en particular diplejía espástica. La frecuencia de PC a los 2 años de edad corregida puede diferir de la observada en edades posteriores por la tendencia a sobrediagnosticarla23 o infradignosticarla24 y la dificultad de establecer el diagnóstico topográfico certero antes de los 3 años de edad24. La incidencia y prevalencia de parálisis cerebral en los RNMBP difiere entre las diversas series estudiadas, oscilando entre el 2-15 %20,25-27. También la topografía de la misma es heterogénea; la diplejía es la forma de presentación en el 21-69 % de los que desarrollan parálisis cerebral, la tetraplejía en el 27-41 % y la hemiplejía en el 0-33 %21,28-30.
El 63,6 % de los pacientes con parálisis cerebral presentaron leucomalacia periventricular, una frecuencia similar a la referida en otros trabajos31. Desde que Fawer y Calame32 relacionaran la leucomalacia periventricular con patología neurológica posterior en un pequeño grupo de niños prematuros y Levene33 afirmara que los hallazgos ecográficos realizados alrededor de la semana 40 de edad posconcepcional tenían un buen valor predictivo sobre el neurodesarrollo de estos pacientes, el diagnóstico ultrasonográfico de lesión parenquimatosa de la sustancia blanca, infarto periventricular y/o leucomalacia periventricular, predice morbilidad mayor a los 2 años de edad. De los 40 pacientes que presentaron HIV como única alteración ecográfica, sólo tres (7 %) padecieron alguna secuela mayor, pero cuando la HIV se asociaba con leucomalacia periventricular y/o infarto periventricular se observaron en el 75 % de los pacientes.
La incidencia de leucomalacia periventricular en nuestro estudio fue del 5,5 %, una prevalencia similar a la referida en otros estudios, en los que varía habitualmente entre el 2,8 y el 9,2 %34,35. La incidencia de leucomalacia periventricular varía de acuerdo con los criterios ultrasonográficos utilizados para definir su existencia, lo que determina que la verdadera incidencia y prevalencia de esta lesión sea difícil de estimar de la literatura previa, debido a que los estudios difieren en la terminología, las definiciones operativas, en los criterios diagnósticos y en el número de exámenes. En una cohorte de 4.279 RNMBP, correspondientes a 12 centros de Estados Unidos, la prevalencia media de leucomalacia periventricular fue del 8 %, con una variabilidad diagnóstica entre centros que osciló entre el 4 y el 22 %36. Para valorar correctamente nuestra incidencia es preciso señalar que el seguimiento ecográfico cerebral se realizó como mínimo hasta la semana 40 de edad posconcepcional, lo cual permite detectar lesiones que aparecen tardíamente34, y que a diferencia de otras series no sólo se consideró la leucomalacia periventricular quística, sino la forma no quística caracterizada por hiperecogenicidad periventricular persistente. De los 12 pacientes que presentaron leucomalacia periventricular, 10 (83 %) padecieron parálisis cerebral y/o bajo CD. Este hallazgo concuerda con otros estudios neuroevolutivos en RNMBP que han mostrado que el diagnóstico ultrasonográfico de la enfermedad muestra una sensibilidad y especificidad superior al 80 % para predecir mayor disfunción motora a los 2 años de edad37. De los pacientes con diplejía espástica, dos presentaron hiperecogenicidad periventricular persistente y ventriculomegalia de bordes irregulares, lo que apoya la observación de otros trabajos en los que se consideró este hallazgo ultrasonográfico como marcador de mal pronóstico neurológico34,38,39; de hecho, Pierrat et al34 encontraron que 29 de los 30 pacientes que presentaron este tipo de imagen desarrollaron parálisis cerebral. Los 2 casos con parálisis cerebral que no mostraron alteración cerebral en la evaluación ultrasonográfica, presentaron lesiones difusas en la sustancia blanca en la resonancia magnética realizada a los 15 meses de edad. En el presente se distinguen diferentes formas de leucomalacia periventricular o lesión de la sustancia blanca; una forma con daño focal, una forma con daño difuso y con más frecuencia una combinación de ambas. El daño difuso de la sustancia blanca es un daño tisular menos grave que el focal, pero muestra una distribución más amplia y con hallazgos histológicos distintos a los de la forma clásica; la lesión no afecta a todos los elementos celulares, sino que muestra cierta especificidad celular por las células precursoras oligodendrogliales37. Este daño difuso se observa preferentemente en los RNEBP al nacimiento (≤ 1.000 g) y experimenta con menos frecuencia cavitación pudiendo pasar inadvertido en las evaluaciones ultrasonográficas37,39.
Las alteraciones cognitivas constituyen una morbilidad de gran relevancia social y familiar. En nuestra serie de pacientes, el 14,9 % presentó un CD < 85 a los 2 años. Sin embargo, esta prevalencia debe ser considerada con gran cautela debido a que sólo pudimos determinar el CD en el 89,9 % de los pacientes por no disponer de un psicólogo intrahospitalario y depender esta valoración de la asistencia de los pacientes a un centro de atención temprana. La prevalencia de trastornos cognitivos señalada en esta población de niños en la literatura médica es muy variable, entre el 4,8 % de Aziz et al40 y el 37 % de Vohr et al41. La gran disparidad referida puede ser debida fundamentalmente a tres razones: a) a la heterogenicidad en el peso y edad gestacional de los pacientes participantes en los múltiples estudios; b) a diferencias metodológicas como pueden ser los diferentes pruebas utilizadas en la valoración cognitiva, y c) la edad de realización de las pruebas. El 28,5 % de estos niños con CD < 85 presentaron, además, alguna otra forma de morbilidad mayor, principalmente parálisis cerebral. Aunque los niños con una cifra de CD < 85 presentaron un mayor porcentaje de lesiones parenquimatosas en la USC que aquellos con una cifra de CD > 85 (21,5 % frente a 7 %), la diferencia no fue significativa.
Dada la dificultad de establecer un diagnóstico certero y definitivo de trastorno de conducta en un niño menor de 2 años, no se ha analizado de forma sistemática este aspecto, si bien en el seguimiento se han detectado 4 pacientes con alteraciones graves que, además, asociaban otras morbilidades graves (tetraplejía, CD < 55, ceguera). Coincidimos con el grupo de Arce42 en afirmar que las alteraciones del lenguaje son fundamentalmente del lenguaje expresivo. En nuestra casuística el 25 % de los niños no habían adquirido más de 10 palabras referenciales ni construían frases sencillas.
El crecimiento cefálico posnatal es uno de los indicadores más útiles y disponibles durante el seguimiento para predecir la evolución de los neonatos que fueron prematuros menores de 1.500 g43,44. En el estudio presentado, casi el 40 % de los niños que presentaron un perímetro cefálico inferior al P3 a los 2 años mostraron parálisis cerebral y el 46 % una cifra de CD < 85. Por otra parte, el 21,4 % de los niños con CD < 85 tuvieron un perímetro cefálico por debajo del P3 a los 2 años, y el 46 % de los niños con microcefalia a esta edad tenían un bajo CD. Estos datos apoyan estudios previos que encontraron que la recuperación del perímetro craneal a percentiles de crecimiento constitucional constituye un factor pronóstico favorable, mientras que por el contrario, la ausencia de recuperación determina per se un aumento de riesgo de trastornos del desarrollo ulterior43-46.
En nuestra serie la prevalencia de discapacidad neurosensorial grave, tanto auditiva como visual fue inferior a la señalada en otros estudios19,45. La sordera neurosensorial grave se observó en el 0,4 % de los pacientes y esta frecuencia es claramente inferior a la señalada en otros trabajos, que oscila entre el 2 y el 12 %19,45. Por otra parte, nosotros encontramos el 0,4 % de incidencia de ceguera bilateral en nuestra serie, mientras que en otros estudios la prevalencia varía entre el 1 y el 6 % dependiendo, sobre todo, del año del estudio, del peso y de la edad gestacional de los pacientes19,45. Aunque las razones acerca de estas diferencias en la morbilidad neurosensorial grave no son claras, pudieran ser debidas a cambios introducidos en los últimos años en el cuidado neonatal, como son, entre otros: el estrecho control de niveles de fármacos ototóxicos, la menor agresividad ventilatoria, la rigurosa monitorización de la saturación de oxígeno evitando así situaciones de hiperoxia mantenida, el seguimiento estandarizado del desarrollo vascular retiniano de estos pacientes y al tratamiento precoz con láser en aquellos casos de RDP umbral. El 27,2 % de los pacientes que presentaron RDP precisaron fotocoagulación con láser para prevenir la progresión de la RDP, lo que recalca la importancia de los exámenes seriados del fondo ocular en estos pacientes.
Debido a la rapidez con la que se introducen cambios en el tratamiento perinatal de los niños prematuros, la información que aporta un estudio de seguimiento de RNMBP supone sólo un reflejo de la realidad asistencial del momento en que permanecieron ingresados en la unidad de neonatología de un determinado hospital. Sin embargo, esta es la mejor aproximación que se puede hacer para conocer la evolución de nuestros pequeños pacientes, y poder mejorar nuestro estándar asistencial, evitar que el riesgo se convierta en daño y si éste se ha establecido, prevenir o minimizar sus secuelas o consecuencias funcionales.
En los niños que habían abandonado el seguimiento y pudimos rescatar entre los 2 y 3 años, no hemos encontrado mayor incidencia de parálisis cerebral.
Agradecimientos
Este trabajo no hubiera sido posible sin la colaboración de todo el personal médico y de enfermería de la Unidad Neonatal, que atendieron a estos pacientes durante su estancia en nuestro centro, así como oftalmólogos, neurofisiólogos, neurólogos, psicólogos del Centro de Atención Temprana del Centro Base n.º 1 de la Comunidad de Madrid que participaron en el cuidado y seguimiento de los pacientes incluidos en este estudio.