Describimos el caso de un paciente de 8 años de edad, con síndrome nefrótico por lesiones mínimas dependiente de corticoides, con recaídas frecuentes a pesar del tratamiento con ciclosporina. Tras la conversión a micofenolato de mofetilo, el paciente sufre nuevas recaídas, con una situación de difícil control de la enfermedad. La reincorporación de la ciclosporina asociada al tratamiento con micofenolato de mofetilo consiguió una remisión de la enfermedad, con un tiempo libre de recaída superior a los obtenidos hasta ese momento, siendo necesario un adecuado seguimiento de las concentraciones sanguíneas de ambos fármacos debido a su variabilidad en el comportamiento cinético.
We describe the case of an 8-year-old patient, with steroid-dependent minimal lesion nephrotic syndrome, with frequent relapses despite treatment with cyclosporine. After the switch to mycophenolate mofetil the patient had new relapses, and there was difficulty in controlling the disease. The reintroduction of cyclosporine combined with mycophenolate mofetil obtained an optimal response, with a longer relapse-free time. Due to their kinetic variability, the blood levels of both drugs were closely monitored during follow-up.
El síndrome nefrótico (SN) es una de las principales formas de manifestación de enfermedad renal en niños; el subtipo más frecuente es el SN de cambios mínimos o SN idiopático1. Éste se caracteriza por una proteinuria en rango nefrótico (> 50mg/kg/día), hipoalbuminemia (< 2,5g/dl) y edemas.
El tratamiento del SN persigue obtener la remisión de la proteinuria lo más precozmente posible, disminuir el número de recaídas, y evitar o disminuir en lo posible la toxicidad de los fármacos utilizados. Según las recomendaciones del Estudio Internacional de las Enfermedades Renales del Niño (International Study of Kidney Disease in Children [ISKDC]), publicadas en 1981, que siguen siendo válidas en la actualidad, los glucocorticoides son la base del tratamiento del SN2. En caso de resistencia o dependencia a los corticoides, debe valorarse la introducción de otros fármacos que permitan reducir las dosis de corticoides al mínimo necesario para controlar la enfermedad, disminuyendo de este modo el riesgo de reacciones adversas (osteoporosis, cataratas, retraso en el crecimiento). Entre estos fármacos se encuentran inmunosupresores como la ciclofosfamida, la ciclosporina A (CsA), el micofenolato de mofetilo (MMF) o el tacrólimo, además de coadyuvantes como los inhibidores de la enzima de conversión de la angiotensina (IECA)3.
CsA ha sido muy utilizada en el SN corticodependiente y corticorresistente4, con una efectividad para conseguir la remisión completa de la proteinuria entre el 20 y el 40 %. Sin embargo, muchos pacientes desarrollan dependencia a CsA y debido a su efrotoxicidad a largo plazo se recomienda realizar una conversión a MMF5, que ha demostrado tener una efectividad comparable en el tratamiento del SN idiopático6. Sólo en aquellos pocos pacientes con mala respuesta a estos tratamientos se puede valorar combinar varios inmunosupresores7, teniendo en cuenta que la experiencia actual en estos casos es escasa.
A continuación se presenta un caso clínico de un paciente con SN idiopático corticodependiente con múltiples recaídas al tratamiento inmunosupresor que inicia tratamiento combinado con MMF y CsA, con buena respuesta y que ha permitido disminuir la dosis de prednisona.
DESCRIPCIÓN DEL CASOVarón de 8 años, que en noviembre de 2002, a la edad de 3 años, fue diagnosticado de SN de cambios mínimos, con confirmación anatomopatológica tras una biopsia renal (abril de 2003).
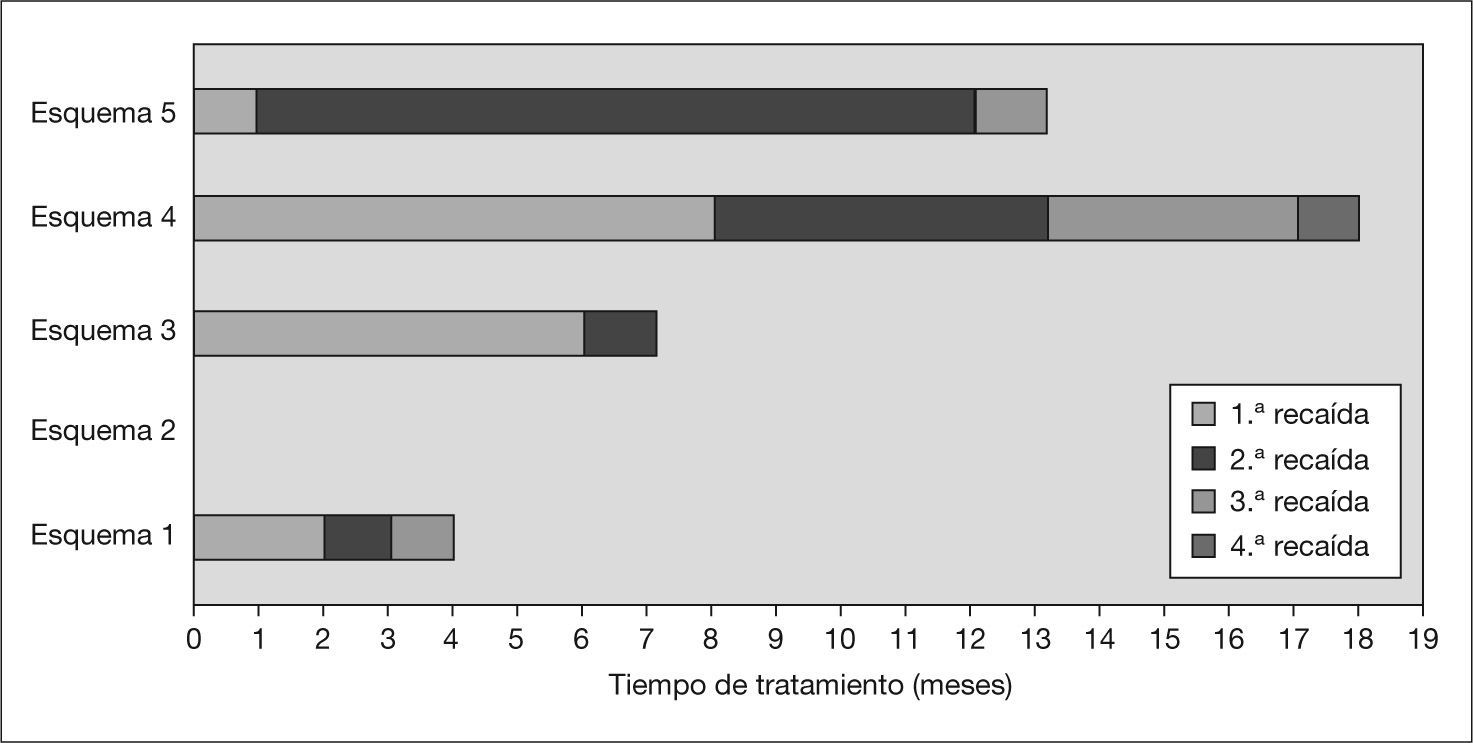
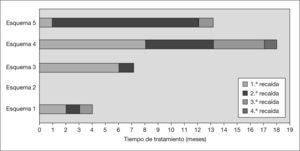
En la tabla 1 se muestran los esquemas de tratamiento que recibió el paciente desde su diagnóstico. El esquema de primera línea que recibió el paciente al inicio fue el recomendado por el ISKDC. El paciente sufrió dos recaídas tras reducir las dosis de prednisona oral, por lo que se clasificó como SN dependiente de corticoides, y se decidió iniciar tratamiento de segunda línea con ciclofosfamida (2mg/kg/día) por vía oral; a las 6 semanas no se consiguió la desaparición de la proteinuria. Debido a esto, se suspendió este tratamiento y se llevó a cabo la primera biopsia renal, así como un esquema terapéutico de tercera línea formado por CsA y prednisona. Las dosis iniciales de CsA fueron de 150mg/m2/día por vía oral, con una posterior individualización posológica de acuerdo con la monitorización de las concentraciones sanguíneas y de la respuesta clínica. El intervalo terapéutico de concentraciones sanguíneas objetivo se fijó entre 80 y 195ng/ml de sangre determinado con FPIA (inmunoanálisis de fluorescencia polarizada específico)8. Con este esquema de tratamiento se consiguió una negativización de la proteinuria a los 7–10 días de tratamiento, aumentando el tiempo libre de recaída (TLR) a los 6 meses (fig. 1).
Esquemas de tratamiento recibidos por el paciente desde el diagnóstico de la enfermedad
| Esquemas de tratamiento | Observaciones |
| 1.alínea: esquema ISKDC (noviembre de 2002) | Dos recaídas al reducir las dosis de prednisona a 25mg/48h → SN dependiente de corticoides` |
| Prednisona oral 60mg/m2/día, 4 semanas | |
| Prednisona 40mg/m2/día, 3 días consecutivos, 4 semanas | Duración: 4 meses |
| Reducción de la dosis durante 2 meses, hasta la total supresión | |
| 2.alínea (febrero de 2003) | No se consigue la remisión de la proteinuria |
| Prednisona oral (dosis inicial: 40mg/m2/día) | |
| Ciclofosfamida oral: 2mg/kg/día; 25mg/día/6 semanas | |
| 3.alínea (abril de 2003; primera biopsia) | Se reduce progresivamente la prednisona hasta llegar a 7,5mg/días alternos, presentando la primera recaída al mes de esta dosis |
| Prednisona oral (dosis inicial de 40mg/m2/día y reducción progresiva) | |
| Ciclosporina oral (dosis inicial de 150mg/m2/día e individualización posológica) | |
| 4.alínea (febrero de 2005) | Desde el inicio del tratamiento con CsA: Media de CsCSA: 109,3ng/ml (Máx.: 252,4ng/ml; Mín: 45,2ng/ml) |
| Prednisona y ciclosporina oral | |
| Enalapril oral (5mg/día) | |
| 5.alínea (septiembre de 2005) | |
| Prednisona oral | Esquema con mayor tiempo libre de recaída (de enero a diciembre de 2006) |
| Micofenolato de mofetilo oral (dosis inicial de 600mg/m2/2 veces al día e individualización posológica) | Cpmpa media: 3,6μg/ml (Máx.: 10,8μg/ml; Mín: 0,8μg/ml) |
| Enalapril oral (5mg/día) | Dosis media: 1.085mg/día (Máx.: 1.480mg; Mín: 1.000mg) |
| 6.alínea (febrero de 2007;segunda biopsia) | |
| Prednisona oral (dosis inicial de 40mg/m2/día y reducción progresiva) | Cscsa media: 105,0ng/ml (Máx.: 150,1ng/ml; Mín.: 51,7ng/ml) |
| Micofenolato de mofetilo (dosis inicial de 600mg/m2/2 veces al día e individualización posológica) | Dosis media de CsA: 150mg/día (Máx.: 140mg; Mín.: 80mg) |
| Ciclosporina oral (dosis inicial de 150mg/m2/día e individualización posológica) | Cpmpa media: 3,4μg/ml (Máx.: 7μg/ml; Mín.: 0,6μg/ml) |
| Enalapril oral (7,5mg/día) | Dosis media: 1.942mg/día (Máx.: 1.800mg; Mín.:1.200mg) |
SN: síndrome nefrótico.
Tiempo libre de recaída de los diferentes esquemas de tratamiento. Esquema 1: prednisona; esquema 2: prednisona + ciclofosfamida; esquema 3: prednisona + ciclosporina; esquema 4: prednisona + ciclosporina + enalapril; esquema 5: prednisona + micofenolato de mofetilo + enalapril (con el esquema 2 formado por prednisona y ciclofosfamida no se consigue una remisión de la proteinuria). En cada esquema se indica el número de recaídas que sufrió el paciente.
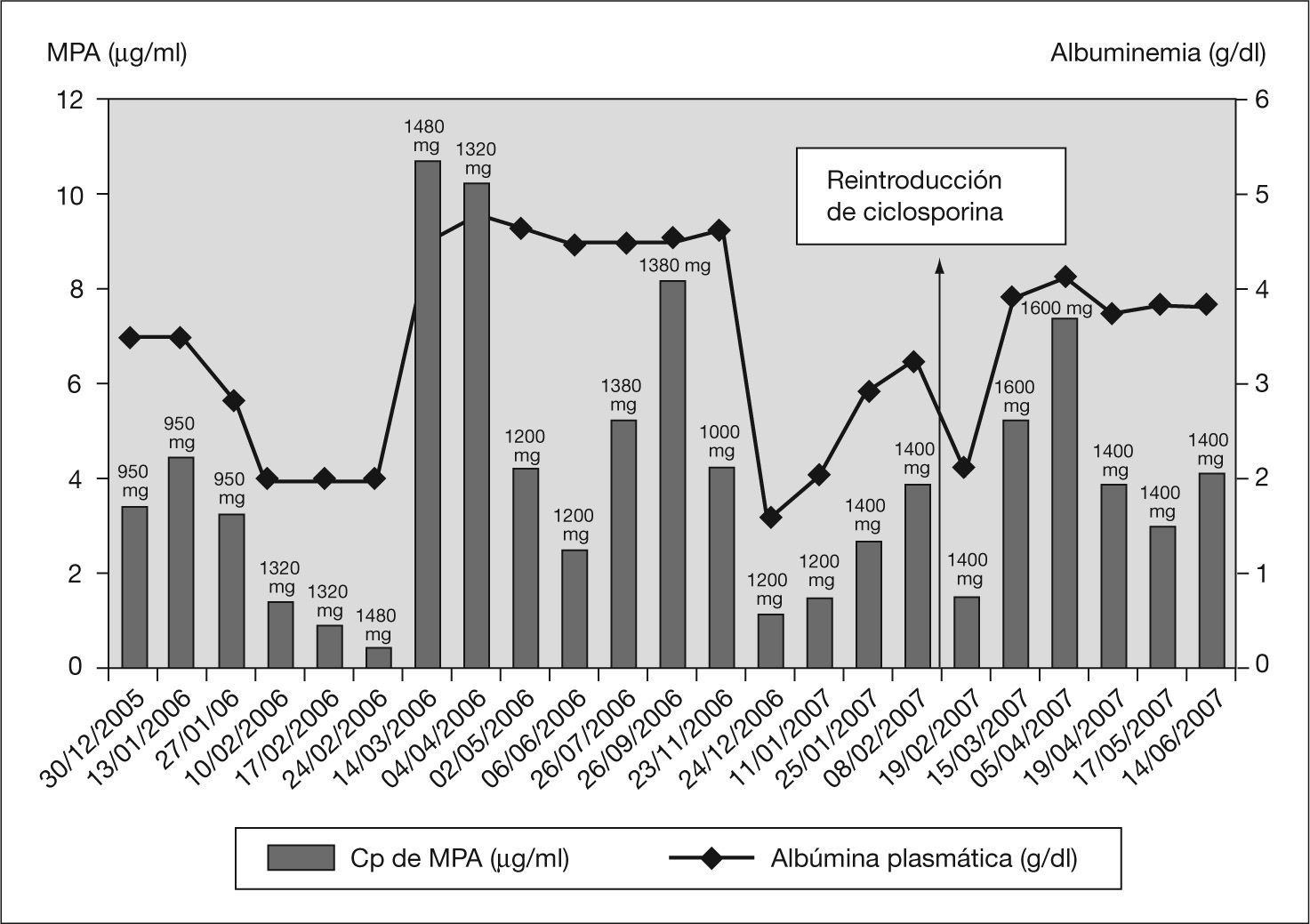
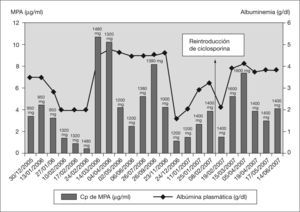
Como consecuencia de las alteraciones en los valores de presión arterial, se inició el tratamiento con enalapril, que además ha demostrado tener un efecto antiproteinúrico y renoprotector3,9. Tras varias recaídas en un corto período de tiempo, y después de 2 años de tratamiento con CsA, se realizó una conversión a MMF. La dosis inicial de MMF fue de 600mg/m2 cada 12h, con una posterior individualización posológica en función de la evolución de la respuesta clínica y de la monitorización de las concentraciones plasmáticas de su principal metabolito, el ácido micofenólico (MPA), aceptando el intervalo terapéutico establecido por Mendizábal et al (2,5-5μg/ml)10.
Con este esquema de tratamiento se consiguió un TLR de 11 meses, aunque el paciente sufrió una recaída al mes de tratamiento asociado a concentraciones infraterapéuticas del MPA, por lo que fue necesario un aumento de la dosis de MMF. Las posteriores recaídas sufridas coincidieron en el tiempo con concentraciones plasmáticas de MPA infraterapéuticas no justificadas por el cumplimiento de la pauta posológica establecida. Es en este momento (febrero de 2007) cuando se decidió reintroducir la CsA asociándola con MMF y realizar una segunda biopsia renal, la cual siguió evidenciando los mismos cambios mínimos que en la primera, sin aparición de lesiones de cronicidad ni afectación vascular; de esta manera se descartó una progresión de la enfermedad que pudiera explicar la falta de respuesta al tratamiento.
Actualmente, y tras 11 meses de tratamiento, el paciente continúa en tratamiento con MMF, CsA, prednisona y enalapril, sin haber sufrido ninguna recaída hasta el momento, lo que ha permitido reducir la dosis de prednisona, y en los últimos meses, la de CsA, con el objetivo de reducir potenciales efectos nefrotóxicos del fármaco.
DISCUSIÓNLas recaídas sufridas por el paciente a pesar del tratamiento con fármacos inmunosupresores ha hecho necesaria la asociación de CsA y MMF. La utilización conjunta de ambos inmunosupresores se ha estudiado ampliamente en el tratamiento inmunosupresor de pacientes con trasplante renal, en los que se ha observado una mayor supervivencia del injerto11,12. Sin embargo, la experiencia en la utilización de esta asociación en el tratamiento del SN es escasa, como se ha constatado al realizar una búsqueda bibliográfica en Pubmed® (palabras clave: ciclosporyne, micophenolate mofetil y nephrotic syndrome). Los estudios encontrados indican que la adición de MMF permite reducir o suspender el tratamiento con CsA para resolver situaciones de dependencia a CsA o prevenir la toxicidad renal del fármaco. Sólo en el trabajo realizado por El-Reshaid et al7 se estudia la efectividad y la seguridad de la asociación de inmunosupresores como opción de tratamiento en niños con SN.
Con respecto a los intervalos terapéuticos objetivo de CsA y MMF, en ninguno de los trabajos revisados se ha encontrado que sea necesario modificar los intervalos terapéuticos establecidos para el tratamiento en monoterapia, por lo que se han considerado los mismos. Tras el control de la proteinuria en el paciente, se ha reducido el intervalo terapéutico objetivo de CsA entorno a 50–60ng/ml en función de la experiencia en pacientes trasplantados, en el que una menor exposición al fármaco reduce el riesgo de nefrotoxicidad sin afectar a la efectividad del tratamiento inmunosupresor13.
Un aspecto muy importante que hay que considerar en la individualización del tratamiento inmunosupresor del SN con CsA y MMF son las alteraciones en la farmacocinética de ambos fármacos producida por la enfermedad y por las interacciones que se producen entre estos fármacos. De este modo, hay que destacar la interacción farmacocinética que se produce entre CsA y MMF, inhibiéndose la eliminación biliar del glucurónido del MPA al interrumpirse la reabsorción enterohepática que sufre este metabolito, favoreciendo su eliminación renal y disminuyendo las concentraciones plasmáticas de MPA11. Aunque la presencia de esta interacción y su importancia clínica se han puesto en duda, se sospecha que se produjo en nuestro paciente al observarse una reducción de las concentraciones plasmáticas del MPA al reintroducir la CsA (fig. 2), por lo que fue necesario un aumento de la dosis de MMF.
Además, hay que considerar las situaciones fisiopatológicas que se producen en las recaídas del SN. El MPA tiene una elevada unión a proteínas (cerca del 97 %), y en situaciones de hipoalbuminemia se produce un aumento de la fracción libre del MPA (habitualmente representa el 1-3 % del total), responsable de la acción terapéutica y de la toxicidad hematológica del fármaco14. La fracción libre del MPA se elimina por vía renal, por lo que un aumento de ésta aumentaría el aclaramiento corporal del fármaco, disminuyendo las concentraciones plasmáticas de MPA y aumentando el riesgo de recaídas por infradosificación. En estas situaciones es necesario un aumento de dosis de MMF, ya que se ha observado que no se modifica la exposición corporal al MPA libre (AUC0-12 no se modifica de forma significativa)15, e incluso puede disminuir la exposición al MPA total16. En nuestro paciente se observa este comportamiento, ya que en situaciones de hipoalbuminemia los valores de MPA disminuyen, por lo que es necesario aumentar las dosis de MMF (fig. 2), y cuando se pasa a un estado de normoalbuminemia, los valores de MPA aumentan sin realizarse ningún aumento de dosis. Durante el tratamiento con MMF no se ha observado toxicidad hematológica. Una recomendación práctica previa al aumento de dosis de MMF sería determinar las concentraciones plasmáticas de MPA totales para realizar un adecuado ajuste posológico, pudiendo determinar la fracción libre de MPA. Si esta fracción supone más del 3 % de MPA total, el riesgo de toxicidad hematológica podría ser mayor y se debería realizar un seguimiento más estrecho de los parámetros hematológicos del paciente.
En conclusión, en pacientes con SN dependiente de corticoides con múltiples recaídas en tratamiento con inmunosupresores, se puede plantear la posibilidad de utilizar esquemas de tratamiento que combinen CsA y MMF, teniendo en cuenta el comportamiento cinético descrito para la individualización de la pauta posológica. Así, es necesario monitorizar estrechamente las concentraciones de CsA y MMF, siendo susceptible determinar la fracción libre de MPA, en situaciones de hipoalbuminemia previo al aumento de dosis de MMF. No obstante, dado el bajo grado de evidencia del que se dispone en la utilización de esta combinación, es necesario realizar ensayos clínicos prospectivos y aleatorizados para evaluar su eficacia y su seguridad.