La meningitis recurrente es una patología infrecuente. Los factores predisponentes son alteraciones anatómicas o situaciones de inmunodeficiencia. Presentamos 4 casos en los que, excluida una inmunodeficiencia, el microorganismo responsable orientó al defecto anatómico causante de las recurrencias.
Pacientes y métodosRevisión retrospectiva de 4 casos clínicos con diagnóstico de meningitis bacteriana recurrente.
ResultadosCaso 1: niño de 30 meses con hipoacusia unilateral, diagnosticado por resonancia magnética (RM) de malformación de Mondini tras 2 episodios de meningitis por Haemophilus influenzae. Reparación quirúrgica tras tercera recurrencia. Caso 2: niña de 14 años diagnosticada por RM de defecto de lámina cribiforme posterior a 3 episodios de meningitis por Streptococcus pneumoniae. Se coloca válvula de derivación ventrículo-peritoneal. Caso 3: niña con meningitis por Staphylococcus aureus a los 2 y 7 meses. La RM muestra seno dérmico occipital que requiere exéresis. Complicación con abscesos cerebelosos por coexistencia de quiste dermoide. Caso 4: niño con meningitis por Streptococcus bovis a los 9 días y por Enterococcus faecium, Klebsiella pneumoniae y Escherichia coli a los 7 meses, con crecimiento de Citrobacter freundii y E. faecium posteriormente. RM compatible con síndrome de Currarino. Incluye fístula rectal de LCR, que se repara quirúrgicamente. A los 4 pacientes se les habían realizado pruebas de imagen durante los primeros episodios de meningitis, informadas como normales.
ConclusionesEn los pacientes con meningitis recurrentes se debe valorar la posibilidad de un defecto anatómico; el microorganismo aislado debe ayudar a localizarlo. Es imprescindible conocer la flora normal de los potenciales focos. El tratamiento definitivo es habitualmente quirúrgico.
Recurrent meningitis is a rare disease. Anatomical abnormalities and immunodeficiency states are predisposing factors. Four cases, in which immunodeficiency was excluded, are presented. The causal microorganism led to the detection of the anatomical defect responsible for the recurrences.
Patients and methodsRetrospective review of 4 cases with clinical diagnosis of recurrent bacterial meningitis.
ResultsCase 1: a thirty month-old boy with unilateral hearing loss, diagnosed with Mondini abnormality by magnetic resonance imaging (MRI) after 2 episodes of Haemophilus influenzae meningitis. Surgical repair after third recurrence. Case 2: fourteen year-old girl diagnosed by MRI with cribriform plate defect after 3 episodes of meningitis due to Streptococcus pneumoniae. Ventriculoperitoneal shunt was placed. Case 3: girl with meningitis due to Staphylococcus aureus at 2 and 7 months. MRI shows occipital dermal sinus requiring excision. Complication with cerebellar abscesses because of a coexisting dermoid cyst. Case 4: child with meningitis due to Streptococcus bovis at 9 days and Enterococcus faecium, Klebsiella pneumoniae and Escherichia coli at 7 months, with positive cultures to Citrobacter freundii and E. faecium later on. Spinal MRI led to the diagnosis of Currarino syndrome with CSF fistula, which was surgically repaired. The 4 patients had undergone image studies reported as normal during the first episodes.
ConclusionsIn patients with recurrent meningitis the possibility of an anatomical defect should be considered. The isolated microorganism should help to locate it. It is essential to know the normal flora of the different anatomical sites. The definitive treatment is usually surgical.
La meningitis bacteriana es una infección grave, potencialmente mortal. Se asocia a un elevado número de complicaciones y secuelas neurológicas a pesar de los avances en antibioterapia y cuidados intensivos. Aproximadamente, en el 1-4,8% de todos los casos de meningitis bacteriana aguda se producen recurrencias, definidas como la reaparición de signos y síntomas de meningitis transcurridas al menos 3 semanas después de la esterilización del líquido cefalorraquídeo (LCR) si se trata del mismo microorganismo, o bien como un nuevo episodio por un microorganismo distinto1.
Se han identificado diferentes factores predisponentes a la meningitis recurrente como los déficits de inmunidad humoral y celular y los defectos estructurales congénitos o adquiridos, que establecen una comunicación anatómica entre el espacio subaracnoideo y la piel o el oído medio y las cavidades paranasales2-4 (tabla 1).
Principales causas de meningitis bacteriana recurrente
| Defectos anatómicos congénitos | Inmunodeficiencias primarias o adquiridas | ||
|---|---|---|---|
| Meningocele (craneal o lumbosacro)/meningoencefalocele | Infección por VIH | ||
| Defectos de base de cráneo | Etmoides | Déficits del complemento | |
| Peñasco del temporal | Déficit de IRAK-4 | ||
| Esfenoides | Asplenia | ||
| Alteraciones en oído interno (Malformación de Mondini) | Déficits humorales | Déficits de subclases IgG | |
| Quiste neuroentérico | Inmunodeficiencia común variable | ||
| Seno dérmico y quiste dermoide/epidermoide (desde raíz nasal hasta cono medular) | |||
| Defectos anatómicos adquiridos | Agammaglobulinemia | ||
IgG: inmunoglobulina G; IRAK-4: cinasa relacionada con el receptor de interleucina 4; VIH: virus de la inmunodeficiencia humana.
El enfoque diagnóstico debe estar orientado por el conjunto de la historia clínica, los hallazgos de la exploración física y los datos microbiológicos5. En muchas ocasiones, la bacteria indica el origen de la meningitis.
Presentamos 4 casos de pacientes pediátricos con meningitis bacteriana recurrente por defectos anatómicos congénitos en que los microorganismos responsables ayudaron a orientar su diagnóstico (tabla 2).
Principales características de los 4 casos presentados
| Sexo | Número de episodio | Edad | Microorganismo | Defecto anatómico | Tratamiento definitivo | Evolución | |
|---|---|---|---|---|---|---|---|
| Caso 1 | Masculino | 1 | 20 meses | H. influenzae no serotipificable no productor de betalactamasas | Malformación de Mondini | Cierre de la fístula perilinfática mediante aislamiento del oído medio del interno y cierre de la cavidad mastoidea | No secuelas neurológicasNo nuevos episodios de meningitis |
| 2 | 30 meses | Haemophilus spp. no serotipo b productor de betalactamasas | |||||
| 3 | 34 meses | No se aísla microorganismo | |||||
| Caso 2 | Femenino | 1 | 11 años | S. pneumoniae serotipo 19A | Defecto óseo y dural a nivel de lámina cribiforme | Colocación de válvula de derivación ventrículo-peritoneal | No secuelas neurológicasNo nuevos episodios de meningitis |
| 2 | 13 años | S. pneumoniae serotipo 19A | |||||
| 3 | 14 años | S. pneumoniae serotipo 6A | |||||
| Caso 3 | Femenino | 1 | 2 meses | S. aureus | Seno dérmico occipital y quiste dermoide | Exéresis completa de seno dérmico y quiste dermoide | No secuelas neurológicasNo nuevos episodios de meningitis |
| 2 | 7 meses | S. aureus | |||||
| Caso 4 | Masculino | 1 | 9 días | S. bovis tipo i | Síndrome de Currarino | Reparación quirúrgica de fístula recto-espacio subaracnoideo | No secuelas neurológicasNo nuevos episodios de meningitis |
| 2 | 7 meses | E. faecium, K. pneumoniae y E. coli | |||||
| 3 | 7 meses | C. freundii | |||||
| 4 | 7 meses | E. faecium |
Niño de 22 meses, sin antecedentes de interés, excepto la falta de administración de vacunas desde los 12 meses por decisión de los padres, que ingresa en el hospital afectado de meningitis. En el LCR se aísla Haemophilus influenzae no serotipificable, no productor de betalactamasas. El paciente sigue buena evolución con cefotaxima por vía intravenosa. Presenta electroencefalograma y tomografía computarizada (TC) craneal que no muestran alteraciones, pero se detecta una hipoacusia moderada del oído derecho en los potenciales evocados auditivos del tronco cerebral, que se orienta como secuela del proceso infeccioso.
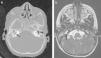
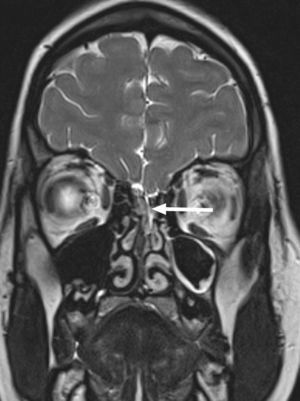
A los 30 meses, ingresa nuevamente por meningitis por H. influenzae no serotipificable. Los padres explican clínica previa indicativa de otitis de oído derecho. Al tratarse de un segundo episodio de meningitis bacteriana, se realiza un estudio inmunológico completo que resulta normal, incluyendo serología a virus de la inmunodeficiencia humana (VIH), inmunoglobulinas séricas, estudio de vías clásica y alternativa del complemento, presencia de bazo en ecografía y ausencia de cuerpos de Howell-Jolly en sangre periférica. Ante la recurrencia de una meningitis por gérmenes característicos de la flora ótica-orofaríngea se decide descartar un defecto anatómico a este nivel. Así, se amplía el estudio de imagen con la realización de una TC de peñasco de alta resolución y resonancia magnética (RM) craneal, donde se aprecia una malformación del laberinto membranoso que afecta a la cóclea y el vestíbulo en el lado derecho (partición incompleta tipo ii o deformidad de Mondini), considerándose el origen de la meningitis recidivante por fístula al espacio subaracnoideo (fig. 1).
TC y RM de peñasco. a) Imagen axial de TC de alta resolución. b) Imagen axial CISS (three-dimensional constructive interference in steady state) de RM. Malformación del laberinto membranoso que afecta a la cóclea y el vestíbulo en el lado derecho (partición incompleta tipo ii o deformidad de Mondini) (flechas negras).
Ante estos hallazgos, se inicia inmunización antineumocócica y se coloca un drenaje transtimpánico en el oído derecho con el objetivo de prevenir otitis que puedan resultar en un nuevo foco de infección, decidiéndose posponer la corrección definitiva.
A pesar de ello, a los 34 meses de edad, reingresa por nueva sospecha de meningitis bacteriana. En el estudio de LCR se objetiva proteinorraquia y leucorraquia marcada, con predominio de polimorfonucleares, pero en esta ocasión no se aísla el microorganismo responsable a pesar de la utilización de técnicas de biología molecular. En la otoscopia, destaca la caída del drenaje transtimpánico y presencia de otitis media derecha.
Tras la resolución clínica del tercer episodio de meningitis bacteriana, se decide el cierre de la fístula perilinfática mediante aislamiento del oído medio del interno y cierre de la cavidad mastoidea6, con buenos resultados clínicos. Hasta el momento (39 meses de edad), el paciente no ha presentado nuevos episodios de meningitis.
Caso 2Niña de 11 años, que ingresa en otro centro por fiebre, cefalea y vómitos de 12 h de evolución. Se diagnostica de meningitis y en el hemocultivo y en el cultivo de LCR se aísla Streptococcus pneumoniae y se inicia tratamiento antibiótico con cefotaxima con buena respuesta clínica. Se realiza RM cerebral, que se informa como normal y es dada de alta sin secuelas.
A los 13 años, presenta nuevo episodio de meningitis por S. pneumoniae. Al tratarse de una segunda meningitis, se realiza cribado de inmunodeficiencias (serologías frente al VIH negativas, inmunoglobulinas séricas, vías clásica y alternativa del complemento, con resultados normales, presencia de bazo en ecografía y ausencia de cuerpos de Howell-Jolly) y se inicia vacunación antineumocócica. Al referir como único antecedente otitis media de repetición, se realiza TC coclear y de peñasco, que son informadas como normales.
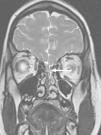
A los 14 años, ingresa en nuestro centro por un nuevo episodio de meningitis neumocócica con bacteriemia. En ese momento, se amplía el estudio inmunológico, descartando una alteración de la inmunidad innata y, ante la sospecha un defecto anatómico, se realiza una RM, hallándose un defecto óseo y dural a la altura de la lámina cribiforme (fig. 2). La paciente se sometió a cirugía para resolver el defecto anatómico, estando asintomática desde entonces (4 años).
Caso 3Niña de 2 meses, sin antecedentes de interés; consulta por fiebre de 39°C de pocas horas de evolución, sin otros síntomas asociados. En el estudio de fiebre sin foco se realiza una punción lumbar encontrando leucorraquia con predominio de polimorfonucleares, hipoglucorraquia y proteinorraquia. En el estudio microbiológico, se informa crecimiento de una única colonia de Staphylococcus aureus (S. aureus) sensible a cloxacilina en el LCR, que se confirma en un segundo cultivo. Se completan 3 semanas de tratamiento con cloxacilina por vía intravenosa y se descarta colonización por S. aureus en la paciente y sus familiares. Durante el ingreso, se realiza estudio de extensión con ecocardiograma, fondo de ojo, ecografía abdominal y RM cerebral, que se informan como normales.
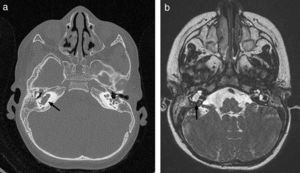
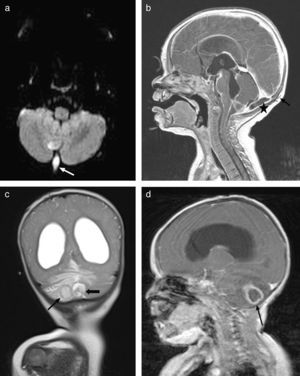
A los 7 meses, consulta por febrícula, fontanela abombada, vómitos e irritabilidad, por lo que se realiza una punción lumbar que muestra una citoquímica similar al episodio anterior y aislamiento de escasas colonias de S. aureus sensible a cloxacilina. Esta vez se observa estado de portador de S. aureus en la madre. Ante una segunda meningitis por el mismo germen, y sospechando un defecto anatómico, se repite la RM, donde se observa una imagen en la fosa posterior compatible con un seno dérmico complicado con un pequeño empiema subdural, además de una hidrocefalia arreabsortiva secundaria a la inflamación (fig. 3 a). En ese momento, se coloca un drenaje ventricular externo, se drenan los abscesos subdurales y cerebelosos, y se extirpa el seno dérmico. A pesar de ello, la paciente presenta deterioro clínico y se realiza nueva prueba de imagen, objetivando abscesos a nivel occipital y de cerebelo (fig. 3b) que obligan a su drenaje. Durante la cirugía, se identifica un quiste dermoide, realizándose exéresis completa del mismo. Se aísla nuevamente S. aureus y se completan 7 semanas de tratamiento con cloxacilina. Como terapia de la hidrocefalia, se coloca una derivación ventrículo-peritoneal. Hasta la fecha (11 meses de edad), no ha presentado nuevas infecciones
a) RM con imagen de difusión en plano axial que muestra seno dérmico infectado en fosa posterior (flecha blanca) con restricción. b) RM sagital T1 poscontraste, donde se muestra el trayecto del seno dérmico subcutáneo (flecha negra), complicado con pequeño empiema subdural en la fosa posterior (asterisco). c) Imagen coronal T2 que muestra hidrocefalia arreabsortiva secundaria a la leptomeningitis y 2 imágenes compatibles con abscesos cerebelosos, asociados con edema. d) Imagen sagital T1 poscontraste con presencia de hidrocefalia y realce en anillo de las imágenes de abscesos intraparenquimatosos cerebelosos (flecha negra).
Niño de 7 meses, con antecedente de meningitis y sepsis por Streptococcus bovis a los 9 días de vida; consulta por fiebre de 12 h de evolución y alteración del estado general. Ante la sospecha de meningitis, se realiza punción lumbar, obteniendo un LCR compatible con meningitis bacteriana. Se inicia tratamiento empírico con cefotaxima, vancomicina y dexametasona por vía intravenosas. En el cultivo de LCR se aísla Enterococcus faecium, Klebsiella pneumoniae y Escherichia coli sensibles al tratamiento administrado.
Al octavo día de ingreso, vuelve a presentar fiebre y alteración del estado general, y se realiza nueva punción lumbar, con un LCR compatible con nueva meningitis bacteriana. En el cultivo se aísla Citrobacter freundii, cambiándose el tratamiento a meropenem por vía intravenosa.
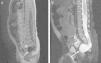
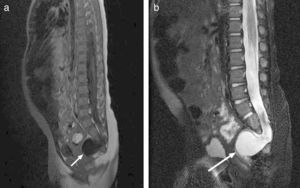
Tras 6 días de tratamiento con meropenem, se repite el cuadro clínico, aislándose de nuevo en el cultivo de LCR E. faecium. Debido a la evolución del paciente, se le realiza un estudio de inmunidad, que resulta normal (serologías para el VIH, poblaciones linfoides, inmunoglobulinas, vías del complemento, presencia de bazo en la ecografía). Una vez descartada patología inmunitaria, y ante la persistencia de meningitis por flora entérica, se realiza inicialmente ecografía abdominal y de partes blandas (trayecto de columna), informadas sin alteraciones, y posteriormente RM, que demuestra una agenesia parcial del segmento derecho del sacro desde S3, un meningocele presacro por debajo de S2, y tras la administración de gadolinio, una fístula de LCR con recto (fig. 4), por lo que establece el diagnóstico de síndrome de Currarino, llevándose a cabo una cirugía correctora del defecto anatómico. Actualmente, el paciente no ha presentado nuevas infecciones (41 meses de edad) y tiene un desarrollo psicomotor normal.
DiscusiónLa meningitis bacteriana recurrente es una patología poco frecuente en los niños, con pocos datos sobre su incidencia. En una revisión de 463 niños con meningitis bacteriana se identificaron 6 pacientes con episodios recurrentes, representando una incidencia del 1,3%. El microorganismo más frecuentemente identificado fue S. pneumoniae. En 2 de los casos se confirmó una alteración otorrinolaringológica, en otros 2 una inmunodeficiencia primaria y en el resto no se halló una causa predisponente2. En un estudio de meningitis en 696 adultos se identificaron 34 episodios de recurrencia (4,8%), estimando su incidencia anual en 0,12 casos por cada 100.000 adultos7.
Ante un paciente con meningitis recurrentes se deben descartar tanto defectos anatómicos como inmunodeficiencias primarias y secundarias como causa subyacente8. La bacteria identificada puede orientar sobre la localización de dicho defecto y del defecto inmunitario a descartar. En este sentido, una revisión de Trebuegge y Curtis sobre 132 casos de meningitis recurrentes en niños y adultos, a partir de descripciones de casos clínico entre 1988 y 2008, recomienda un abordaje diagnóstico que incluye las exploraciones realizadas en los casos de este artículo. Las alteraciones descritas en los pacientes incluidos en esta serie fueron principalmente el déficit de complemento, las anomalías de oído interno (malformación de Mondini), quistes dermoides, meningoceles y mielomeningoceles3.
En los casos expuestos en este trabajo, se describe a 4 pacientes con diferentes malformaciones anatómicas congénitas que generaron dificultades para ser identificadas precozmente.
La malformación de Mondini es un fallo en el desarrollo coclear durante el primer trimestre de gestación que resulta en una cóclea con menos giros de lo normal, con una región medial y apical indiferenciadas que forman un apéndice quístico que puede ser causa de sordera, alteraciones vestibulares y predisposición a infecciones del sistema nervioso central9. Para su diagnóstico radiológico se precisa una TC centrada en el hueso temporal10, pudiendo ser obviada en una TC craneal. En el caso 1, los antecedentes de otitis media previos a los episodios, la hipoacusia unilateral acompañante y la presencia reiterada de una bacteria habitual de la flora nasofaríngea obligan a descartar dicha malformación. La aproximación quirúrgica será más o menos agresiva dependiendo de la capacidad auditiva previa del paciente, con el objetivo de cerrar la fístula de LCR11. La necesidad de un implante coclear solo se planteará en casos de sordera bilateral, ya que hay riesgo de gusher (salida de líquido perilinfático) durante la intervención12,13.
En el caso del defecto en lámina cribiforme, un estudio clínico y anatómico sobre rinolicuorrea espontánea de Tóth et al. describe a 29 pacientes, de los cuales 4 presentan defectos en esta localización. Relacionan aumentos de la presión intracraneal (intermitente o persistente) con la formación de fístulas de LCR en las áreas frontonasales predispuestas por alteración en la fusión de los distintos componentes óseos14. En nuestro caso, se descartan malformaciones anatómicas de oído interno e inmunodeficiencias primarias y adquiridas. Con la presencia de un microorganismo propio del área nasofaríngea en el LCR, se confirma mediante estudio radiológico específico un defecto anatómico a nivel frontonasal. La paciente presentaba alteración en la dinámica de LCR, por lo que el tratamiento consistió en colocación de válvula de derivación ventrículo-peritoneal para disminuir la presión intracraneal, facilitando el cierre de la fístula y la resolución de la recurrencia de los episodios de meningitis.
Respecto al tercer caso, el seno dérmico es un defecto congénito del cierre del tubo neural que determina una comunicación variable entre piel y sistema nervioso central. Se puede localizar desde la raíz nasal hasta el cono medular, siendo la localización más frecuente la lumbosacra, seguida de la occipital15. En este caso, la comunicación suele ser intradural, facilitando el paso directo de bacterias de la flora cutánea con la consecuente meningitis, siendo S. aureus la bacteria más frecuentemente implicada16. El hallazgo precoz de una lesión dérmica occipital se dificulta por la presencia de pelo. En caso de hallarla, se recomienda la realización de una RM, que determinará el diagnóstico y la extensión del seno dérmico y su posible asociación a tumores quísticos y anomalías venosas17, permitiendo un abordaje quirúrgico precoz y así evitar aparición de complicaciones. Frecuentemente, se asocia a quistes dermoides o epidermoides, siendo más rara la asociación a teratomas. Los pacientes con quiste dermoide occipital asociado a seno dérmico pueden desarrollar meningitis y/o formación de abscesos como primera manifestación clínica, debido a la abscesificación del quiste dermoide en sí mismo o bien a la formación de abscesos secundarios18,19.
En la literatura hay descritos 25 casos de meningitis asociadas a quistes dermoides y epidermoides. Todos los casos se acompañan de un seno dérmico que conecta con el sistema nervioso central20. Además, se describen meningitis recurrentes asépticas asociadas a estos quistes. Su alto contenido en queratina produce una reacción inflamatoria que puede desencadenar desde una leptomeningitis leve hasta una meningitis granulomatosa, ependimitis y radiculitis posterior21. Naderi et al., en una revisión de 18 pacientes con meningitis asociadas a seno dérmico occipital, recomiendan la exéresis quirúrgica profiláctica de todos los senos dérmicos craneales y la exéresis precoz en caso de presentar sintomatología16.
En nuestro caso, la recurrencia de meningitis por S. aureus indica la presencia de un disrafismo craneoespinal. Con el hallazgo del seno dérmico, se rehistorió de nuevo a la familia y la madre refiere la presencia de un bultoma occipital desde el nacimiento, que no se había estudiado. No se logra la resolución del cuadro clínico hasta la resección completa del quiste dermoide y del seno dérmico, y el drenaje de los abscesos junto a la antibioterapia. Resulta inadecuado realizar drenaje y antibioterapia exclusivamente pues no se elimina el foco infeccioso22.
Ante el último caso presentado, en que se objetiva meningitis polimicrobiana por bacterias propias de la flora intestinal, algunas anaerobias, urge encontrar la causa de la meningitis para evitar secuelas neurológicas graves23.
El síndrome de Currarino se define por la tríada clínica: malformación anorrectal, en un 30% de los casos se trata de una estenosis rectal (diagnosticada en el paciente a posteriori); defecto óseo a nivel sacro, siendo patognomónico el sacro en cimitarra, y masa presacra, tratándose en un 60% de los casos de un meningocele anterior24. Aunque el estreñimiento es el síntoma más común, pueden asociarse meningitis recurrentes por la presencia de fístula enteromeníngea, con una elevada mortalidad (56%)25. El 50% de los casos se deben a una mutación autosómica dominante ligada al gen HLXB9 (7q36). Este se encuentra implicado en el desarrollo caudal y su alteración produce un defecto en la separación del neuroectodermo y neuroendodermo antes del desarrollo de la notocorda. Es recomendable el estudio de la mutación en otros miembros de la familia26. El diagnóstico se realiza en el 80% de los casos en la primera década de la vida mediante pruebas de imagen. El tratamiento de los niños asintomáticos es conservador, con un seguimiento analítico de la alfa-fetoproteína, por la posible malignización de la masa presacra. En los niños que presentan síntomas, se fundamenta en la corrección quirúrgica del defecto anatómico24.
Como conclusión, queremos destacar que, en situaciones como los 4 casos expuestos, resulta imprescindible el trabajo conjunto del clínico y el radiólogo. La bacteria ayuda a indicar el origen del foco infeccioso, pero es necesario conocer la existencia de los diversos defectos anatómicos que facilitan la meningitis para poder aplicar la prueba de imagen más adecuada en cada situación, así como la flora normal de las diferentes localizaciones para indicar un tratamiento antibiótico empírico. En un paciente con meningitis recurrentes con estudio inmunológico normal, el haber obtenido inicialmente una prueba de imagen informada como normal no debe frenar un estudio más exhaustivo si la sospecha clínica de defecto anatómico subyacente es elevada.
Siguiendo la experiencia de nuestros casos y los descritos en la bibliografía, se concluye que, ante un defecto anatómico que causa meningitis recurrentes, el tratamiento definitivo debe ser quirúrgico. En el caso de la imposibilidad de resolución quirúrgica, no existen aún estudios que demuestren la eficacia de la profilaxis antibiótica en estos pacientes con defectos anatómicos congénitos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.