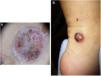
El melanoma es raro en niños, constituyendo menos del 3% de los cánceres pediátricos, y especialmente inusual en menores de 5 años1. Dado el bajo índice de sospecha y su similitud clínica con otras entidades, el diagnóstico suele ser tardío. A pesar de un comportamiento distinto al del adulto, no existen guías terapéuticas específicas pediátricas1.
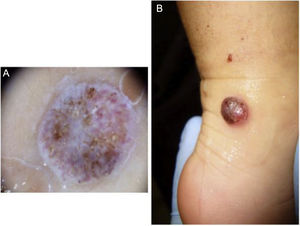
Presentamos el caso de una paciente de 12 meses sin enfermedad previa relevante. Manifiesta inicialmente una lesión en maléolo derecho de 0,5cm de diámetro (fig. 1A), evolucionando posteriormente a lesión nodular cupuliforme eritematosa irregular (fig. 1B). Durante 13 meses se diagnostica como una lesión traumática, verruga viral vulgar y granuloma telangiectásico recibiendo distintos tratamientos tópicos, crioterapia hasta finalmente escisión y biopsia. El patrón histológico muestra una proliferación melanocítica fusiforme atípica con alto índice mitótico (>20%). El estudio inmunohistoquímico (kit Vysis Melanoma FISH Probe) demuestra una sobreexpresión de RREB1 y CNND1 en el 80 y el 40% de células, presencia de 2 copias/núcleo de Cep6, sin amplificación de MYB. Bcl-2 resulta positivo en el 80%. No se detecta mutación de BRAFv600E ni ganancia de 11p. Se amplían márgenes ante Breslow 2,25mm, negativos, a 4 y 7mm de los bordes y se biopsia el ganglio centinela (GC), que se encuentra infiltrado subcapsularmente. Se realiza PET/TC corporal, negativo. Se decide la linfadenectomía completa inguinal derecha (clínicamente negativa), con ganglios histológicamente no infiltrados. Recibe tratamiento adyuvante con interferón alfa-2b pegilado; 6μg/kg/sem intravenoso 2 meses y 3μg/kg/sem subcutáneo 11,5meses, bien tolerado. Diez años después, la paciente continua en remisión.
El melanoma pediátrico es excepcional, constituyendo menos del 1% de todos los diagnósticos de melanoma, todavía más insólito en prepúberes2. El diagnóstico diferencial es particularmente difícil por su similitud clínica e histológica con otras entidades como el espectro de las lesiones spitzoides y otras lesiones no melánicas, haciendo imprescindibles la intervención de un/a dermatólogo/a y patólogo/a experto/as y estudios moleculares. Alejado de los signos cardinales del adulto, existe un «ABCDE» pediátrico, presente en menos del 40% de los casos2: lesión amelanocítica, hemorrágica, ulcerativa, de color uniforme, de novo, de cualquier diámetro y progresiva. Típicamente, se localiza en cabeza, cuello y extremidades. Se manifiesta generalmente en pacientes sin factores de riesgo previos2. Existen 3 entidades diferenciadas: los melanomas originados sobre nevus melanocíticos congénitos, con gran capacidad de metástasis a distancia; el melanoma convencional, clínica y molecularmente similar al del adulto; y, como nuestra paciente, el melanoma spitzoide, con un patrón agresivo locorregional, pero rara capacidad de diseminación a distancia2,3. El pronóstico del melanoma a esta edad es generalmente excelente. En la tabla 1 se resumen las series de melanoma pediátrico más relevantes.
Revisión de las series pediátricas de melanoma más significativas en la literatura
| Estudio | Periodo deestudio | n | Edad (años) | Breslow | Subtipo histológico | Biopsia ganglio centinela | Estadio | Tratamiento | Supervivencia | Conclusiones |
|---|---|---|---|---|---|---|---|---|---|---|
| Brecht et al. (2018) | 2002-2012 | 219 | 1-14: 51,6%15-18: 46,6% | <1mm: 27,8%1,01-2mm: 21,46%2,01-4mm: 19,63%>4mm: 21,46%No definido: 9,6% | SSM: 31,9%Nodular: 20,5%Spitzoide: 18,7%Otros: 19,2%No definido: 9,65% | 77% global76% en >0,75mm(37,5%+) | I: 42,47%II: 26,94%III: 20,09% IV: 4,6%No referido 5,9% | Cirugía: 100%QT (7)IFN-alfa (19)Inmunoterapia (4)QT+IFN alfa (2)QT+vemurafenib (1)RT (3) | SLE 1 año: 93,6%SLE 3 años: 84%OS 1 año: 98%OS 3 años: 91,4% | Misma supervivencia en E III para pacientes que recibieron o no terapia sistémica |
| Parikh et al. (2017) | 1973-2010 | 917 | <10: 12%10-19: 88% | <1mm: 59%1-2mm: 17,5%2-4mm: 15%>4mm: 8% | SSM: 33%Nodular: 7%Maligno, NOS: 52%Desmoplásico: 0,2%Otros: 7,5% | 15,9% (34%+) | I: 69%II: 6,7%III: 15%IV: 0,7% | LRC | SG 10 años: no BGC (99%) vs. BGC (100%) vs. BGC+LRC (80%) p<0,0001Supervivencia BGC sí/no:Localizado 96 vs. 98% (p0,65)Regional 100 vs. 86% (p?)Metastásico 50 vs. 50% (p0,99) | La biopsia del ganglio centinela no modifica la supervivencia |
| Richards et al. (2016) | 1998-2012 | 84.744 | <18: 657 (0,8%)>18a 98,2% | <18 vs. >18a1,52mm vs. >0,15mmUlceración: 14,7 vs. −8,4% | <18 vs. >18aNOS: 56,5 vs. 58,7%SSM: 24 vs. 19,9%Nodular: 9 vs. 9,8%Otros: 9,4 vs. 1,5% | <18 vs. >18a70% (38,5%+) vs. 45% (18,5%) | <18 vs. >18aI: 47,7 vs. 60,1%II: 22,9 vs. 25,2%III: 28,3 vs. 11,8%IV: <1 vs. 2,9% | Inmunoterapia: 17,1 vs. 3,8%RT: 3,7 vs. 4,8% | OS 5 a HR 0,92 vs. 0,68 adultosOS 10 a HR 0,88 vs. 0,49 adultos | Los pacientes pediátricos presentan mayor estadio al diagnóstico a pesar de lo cual presentan mejor pronóstico |
| Mitkov et al. (2016) | 2000-2015 | 86 | <17: 50%17-21: 49% | 1,2mm medianaClark*I: 4,8%II: 33,7%III: 18,1%IV: 38,6%V: 4,8% | SSM: 47,8%Nodular: 8,7%Spitzoide: 16,3%No especificado: 27,2% | No consta | I: 51,1%II: 19,1%III: 17,1%IV: 12,8% | No consta | No evaluada | Lesiones de apariencia benigna con una evolución tórpida, sangrado o ulceración deberían hacer sospechar melanoma |
| Lorimer et al. (2016) | 1998-2011 | 4.968 | <10: 6,2%>10: 73,6% | <10: >2mm 37%>10: >2mm 14% | No consta | <10: 63%(42%+)11-20: 51,35% (18,3%+)>20: 44,7% (10,8%+) | <10I: 49,6%II: 13,4%III: 37,5%IV: 17,65%>10I: 60%II: 13,8%III: 9,3%IV: 4,51% | <10IFN: 5,14%QT: 1,61%RT: 1,41%>10IFN: 10,20%RT: 0,91%QT: 2,53% | SG 5 años:<10GC−: 94,1%GC+: 96%>10GC+vs. - HR 4,82 (CI 3,38-6,67)Regresión de cox RRIFN: 0,77 (0,74-0,80)RT: 2,60 (2,28-2,96QT 1,33 (1,25-1,41) | No diferencias supervivencia con IFN, biopsia GC, LA. Positividad GC no implicación pronóstico en <10 años.Mejor supervivencia en niños vs adolescentes |
| Kim et al. (2016) | 2004-2011 | 310 | <20: 100% | Mediana: 1,5mm | No consta | 84%(28%+) | III: 23%Resto no consta | IFN>SLENo estudiado como variable de SG | GC+: SG 7 años 88 vs. 66% adultos | Ganglio centinela sirve para estratificar en grupos de riesgo, pero su positividad no se asocia a peor supervivencia global en niños.Pacientes pediátricos mejor supervivencia que adultos para mismo estadio evolutivo. |
| Brecht et al. (2015) | 1983-2011 | 443 | <18: 80,7%<10: 9,3% | <1mm: 60%>2mm: 16,5% | Superficial: 4%Nodular: 1%Desconocido: 5% | 16%(24%+) | I-II: 93%III: 5,7%IV: 0,7% | Cir. lesión+márgenesLRC | SG a 5 años: 94,8%Ulceración: 65,6 vs. 99,2%Superficial (100%) vs. nodular (77,9%) vs. otro (96,9%)Nivel de Clark (I, II, III) 99,1 vs. (IV, V) 87,1%Breslow <1mm (99,1%) vs. 1-2mm (91,4%) vs. >2mm (84,9%)Estadio I (98,5%), II (91,1%), III/IV (53%). | Peor supervivencia en melanomas profundos y nodulares y con estadios avanzados |
| Cordoro et al. (2013) | 1984-2009 | 70 | <10: 27%10-20: 72% | <10: 3,9mm>10: 2,4mm (mediana) | Inclasificado | 15%(17%+) | I-II: 0%III: 65,4%IV: 34,6% | Cir. lesión+márgenesLRCIFN | SG 85%Breslow >1mm 20%Clark <III 90%Clark >III 40%Metástasis: 0%LRC: 50%IFN: 50%Estadio Ib 90%Estadio Iib 80%Estadio IV 60% | Características melanoma <10 años:Mayor grosor, amelanocíticos, ulcerativos, agresivos |
| Averbook et al. (2012) | 1973-2001 | 365 | <10: 6,8%>10: 93,2% | <10: 2,66mm>10: 1,59mm | No estudiado | 36,6% (25,4%+) | <10I: 25%II: 29,2%III: 41,7%IV: 4,2%>10:I: 56,6%II: 20,7%III: 22,1%IV: 2,5% | No consta | SG 10 años <10: 100%SG 10 años >10: 74,6%SG 10 años:Estadio I 94,1%Estadio II 79,6%Estadio III: 77,1%Estadio IV: no aplicableSG a 10 años GP: 65,5%SG a 10 años ulceración sí/no: 74,1 vs. 91,6% | La profundidad, ulceración, afectación ganglionar y estadio comprometen el pronóstico del melanoma pediátrico de manera similar al del adulto.La supervivencia es mejor en pacientes <10 años. |
| Moore-Olufemi et al.(2011) | 1992-2006 | 109 | <10: 23%10-18: 77% | <10: >2mm: 57%>10: >2mm: 23% | Spitzoide:<10 12% >10 5%No spitzoide:<10 56% >10 84%Mixto:<10 20% >10 6%Atípico:<10 12% >10 años 6% | <10: 76% (53%+)>10: 52% (34%+) | <10:I: 35%II: 9%III-IV: 57%>10:I: 56%II: 21%III-IV: 23% | Cir. lesión+márgenes | SG: 89%, sin diferencias entre prepuberales y adolescentesSLE: 73%. 88% para pacientes con GCP<10 años y 54% en >10 años | Pacientes prepuberales mayor Breslow y positividad GC.Mayor incidencia de melanoma pediátrico en pacientes de origen hispano/latino.Positividad de GC y mayor Breslow inversamente relacionados con SG y SLE |
| Austin et al. (2013) | 1998-2007 | 1.447 | <10: 11%>10-18a: 89% | <10:≤1mm: 21%1,01-2,0mm: 4%2,01-4,0mm: 7%4,0mm: 6%10-18:≤1mm: 39%1,01-2,0mm: 6%2,01-4,0mm: 5%4,0mm: 3% | Superficial: 46%Nodular: 5%Desmoplásico: 3%No especificado: 46% | <10: 8,7%(12,6%+) | I-II: 73,2%III-IV: 26,8%III: 21%IV: 5,8% | No consta | No consta | Pacientes pediátricos mayor Breslow y afectación de GC |
BGC: biopsia del ganglio centinela; Cir: cirugía; GC: ganglio centinela; IFN: interferón; LRC: linfadenectomía regional completa; QT: quimioterapia; RT: radioterapia; SG: supervivencia global; SLE: supervivencia libre de enfermedad; SSM: melanoma de extensión superficial.
Brecht IB, De Paoli A, Bisogno G, Orbach D, Schneider DT, Leiter U, et al. Pediatric patients with cutaneous melanoma: A European study. Pediatr Blood Cancer. 2018;65:1-8.
Parikh PP, Tashiro J, Rubio GA, Sola JE, Neville HL, Hogan AR, et al. Incidence and outcomes of pediatric extremity melanoma: A propensity score matched SEER study. J Pediatr Surg [Internet]. 2018;53:1753-60.
Richards MK, Czechowicz J, Goldin AB, Gow KW, Doski J, Goldfarb M, et al. Survival and surgical outcomes for pediatric head and neck melanoma. JAMA Otolaryngol - Head Neck Surg. 2017;143:34-40.
Mitkov M, Chrest M, Diehl NN, Heckman MG, Tollefson M, Jambusaria-Pahlajani A. Pediatric melanomas often mimic benign skin lesions: A retrospective study. J Am Acad Dermatol [Internet]. 2016;75:706-11.e4.
Lorimer PD, White RL, Walsh K, Han Y, Kirks RC, Symanowski J, et al. Pediatric and Adolescent Melanoma: A National Cancer Data Base Update. Ann Surg Oncol. 2016;23:4058-66.
Kim J, Sun Z, Gulack BC, Adam MA, Mosca PJ, Rice HE, et al. Sentinel lymph node biopsy is a prognostic measure in pediatric melanoma. J Pediatr Surg [Internet]. 2016;51:986-90.
Brecht IB, Garbe C, Gefeller O, Pfahlberg A, Bauer J, Eigentler TK, et al. 443 paediatric cases of malignant melanoma registered with the German Central Malignant Melanoma Registry between 1983 and 2011. Eur J Cancer. 2015;51:861–8.
Cordoro KM, Gupta D, Frieden IJ, McCalmont T, Kashani-Sabet M. Pediatric melanoma: Results of a large cohort study and proposal for modified ABCD detection criteria for children. J Am Acad Dermatol [Internet]. 2013;68:913–25.
Averbook BJ, Lee SJ, Delman KA, Gow KW, Zager JS, Sondak VK, et al. Pediatric melanoma: Analysis of an international registry. Cancer. 2013;119:4012–9.
Moore-Olufemi S, Herzog C, Warneke C, Gershenwald JE, Mansfield P, Ross M, et al. Outcomes in pediatric melanoma: Comparing prepubertal to adolescent pediatric patients. Ann Surg. 2011;253:1211–5.
Austin MT, Xing Y, Hayes-Jordan AA, Lally KP, Cormier JN. Melanoma incidence rises for children and adolescents: An epidemiologic review of pediatric melanoma in the United States. J Pediatr Surg [Internet]. 2013;48:2207-13.
Los test inmunohistoquímicos como el utilizado, han demostrado una sensibilidad y especificidad del 85-100 y 95% para diferenciar malignidad y benignidad en las lesiones spitzoides. Las ganancias en 6p25 (RREB1) en más del 63% de las células y en 11q13 (CCND1) en más del 38% como en el caso, se asocian a melanoma y no a lesiones benignas2,4. Los reordenamientos cromosómicos que inducen fusión de quinasas (ROS1, NTRK1, ALK, BRAF y RET) están presentes en más del 50% de melanomas, pudiendo encontrarse en otras lesiones spitzoides, así como mutaciones en HRAS3,5. Excluyen el diagnóstico la mutación de BRAFv600E y NRAS, típicas del melanoma convencional. La sobreexpresión de Bcl-2 no se ha demostrado de utilidad diagnóstica6. Se desconocen los marcadores de mal pronóstico, habiéndose detectado TERT-p y la delección homocigótica de 9p21 en melanomas spitzoides con diseminación hematógena3.
A pesar de su diferente comportamiento, no existen guías específicas para el melanoma pediátrico. El tratamiento de primera línea reside en la extirpación local con márgenes. La indicación de biopsia de ganglio centinela es discutida, pudiendo realizarse un seguimiento ecográfico2. En caso de afectación regional, la linfadenectomía regional ha perdido su indicación debido a una importante morbilidad asociada sin beneficio pronóstico2. También es discutida la indicación de interferón-alfa, muy tóxico en adultos, seguro y bien tolerado en niños1,2. La presencia de mutaciones específicas permite tratamientos dirigidos, ejemplo es BRAF. Los inhibidores de quinasas podrían tener relevancia en el tratamiento de melanomas spitzoides con fusión de quinasas5.
El melanoma en pediatría es excepcional, especialmente en prepuberales, afectos más frecuentemente por el melanoma spitzoide. Su diagnóstico diferencial es amplio, confundiéndose con otras lesiones no melánicas y spitzoides, que hacen necesario un alto índice de sospecha. Presenta un agresivo patrón locorregional, a pesar de lo cual tiene buen pronóstico. El tratamiento local se basa en la extirpación de la lesión y ampliación de márgenes. Todavía queda por precisar el perfil molecular oncogénico, marcadores de potencial diseminación hematógena y el rol de la terapia adyuvante en esta entidad.