El retraso de crecimiento postnatal es frecuente en los recién nacidos pretérmino (RNPT) de bajo peso. La administración precoz de proteínas en su nutrición parece mejorar el crecimiento extrauterino y las comorbilidades asociadas. Evaluamos el impacto sobre el crecimiento posnatal de un nuevo protocolo de nutrición parenteral con aporte precoz de aminoácidos en recién nacidos < 1.500g.
Material y métodosEstudio observacional de casos-controles sobre una muestra de 58 RNPT < 1.500g. El grupo de casos lo formaron 29 RNPT que recibieron al menos 1,5g/kg/día de aminoácidos vía parenteral en las primeras 24h de vida, con aumentos diarios hasta alcanzar al menos 3,5g/kg/día al 3.°-4.° día, comparándose con un grupo control de 29 RNPT en los que el aporte de aminoácidos se inició el 2.°-3.° día de vida a 1g/kg/día, con incrementos menores diariamente. Valoramos la evolución somatométrica de ambos en el primer mes de vida.
ResultadosNo había diferencias en las características basales (sexo, edad gestacional, parámetros somatométricos) entre ambos grupos. Los RNPT que recibieron proteínas a dosis mayores y más precozmente tuvieron una ganancia de peso significativamente mayor que el grupo control (423±138g vs. 315±142g; p=0,005), presentando también una mayor velocidad de ganancia ponderal diaria (19,4±3,3 vs. 16,5±4,8; p=0,010) y una recuperación más precoz del peso al nacimiento (11,5±3,3 días vs. 14,5±4,5 días; p=0,045). No se observó mayor incidencia de complicaciones.
ConclusionesEl aporte precoz de aminoácidos a dosis más altas mejora la ganancia ponderal en RNPT sin observarse un riesgo añadido para el paciente.
Extrauterine growth restriction affects most premature newborns. Early and higher parenteral protein intake seems to improve postnatal growth and associated comorbidities. We evaluate the impact of a new parenteral nutrition protocol based on early amino acid administration on postnatal growth in premature infants with a birth weight < 1,500 grams.
Material and methodsA case-control study in 58 premature newborns with a birth weight < 1,500 grams. In the case group we included 29 preterm neonates who received at least 1.5g/kg/day parenteral amino acid during the first 24hours after birth, reaching a maximum dose of 3.5g/kg/day on the 3rd-4th day after birth. The control group was formed by 29 preterm neonates for whom protein support began on the 2nd-3rd day after birth with a dose of 1g/kg/day with lower daily increases than the case group. Growth rates and complications were followed until 28 days of life or discharge from NICU.
ResultsThere were no differences between groups in baseline characteristics. Premature newborns who received higher and earlier doses of proteins had a greater weight gain than the control group, and this difference was statistically significant (423±138g vs. 315±142g; P=.005). In addition, they had a higher daily weight gain rate (19.4±3.3 vs. 16.5±4.8; P=.010) and they regained birth weight earlier (11.5±3.3 days vs. 14.5±4.5 days; P=.045). A higher incidence of complications was not observed.
ConclusionsEarly and higher amino acid administration improves growth rate in premature neonates with no apparent increase in risks for the patient.
El retraso de crecimiento postnatal es una situación que afecta a la gran mayoría de recién nacidos pretérmino (RNPT) y que puede tener importantes consecuencias a largo plazo, como son el retraso del neurodesarrollo, menor rendimiento escolar, talla baja, diabetes mellitus tipo 1 y, ya en la edad adulta, enfermedades cardiovasculares1. Es por ello que uno de los principales objetivos de las unidades de cuidados intensivos neonatales es optimizar el soporte nutricional de estos pacientes. Se ha visto que los principales condicionantes de la aparición del retraso de crecimiento extrauterino son el bajo peso al nacimiento (reservas energéticas limitadas) y la inmadurez (capacidad anabólica reducida). Por otra parte, aspectos relacionados con problemas médicos, como la enterocolitis necrotizante o con el tratamiento (soporte respiratorio o exposición a corticoides postnatales entre otros), son también factores limitantes a la hora de establecer e incrementar el aporte nutricional a lo largo de la estancia hospitalaria, en situaciones que además suponen requerimientos metabólicos mayores1–4.
Frecuentemente, en RNPT de bajo peso al nacimiento, el soporte nutricional inicial se realiza por vía parenteral. Las recomendaciones clásicas de nutrición parenteral (NP) establecían el inicio del aporte proteico en el 2.° día de vida a 1g/kg/día con aumentos de 0,5g/kg/día hasta un máximo de 3,5g/kg/día; en cuanto al aporte de lípidos no se solía iniciar hasta el tercer día de vida, partiendo de 0,5-1g/kg/día y con aumentos de 0,5g/kg/día hasta un máximo de 3g/kg/día. Se ha visto que estas cantidades recomendadas de nutrientes son insuficientes para lograr los objetivos de crecimiento1,5,6, puesto que están orientadas a mantener el ritmo de crecimiento normal pero no tienen en cuenta el déficit nutricional que presentan los RNPT. La tendencia actual, aunque no existe un consenso global, es iniciar el aporte proteico en las primeras 24h de vida, con al menos 1,5g/kg/día y hasta un máximo de 3,5-4g/kg/día, y en cuanto al aporte de lípidos se recomienda empezar en el 2.° día de vida a 1g/kg/día, hasta alcanzar 3-3,5g/kg/día.
El objetivo de nuestro estudio es evaluar el impacto sobre el crecimiento extrauterino inmediato de la aplicación rutinaria de un protocolo de NP basado en aporte parenteral precoz de cantidades moderadas de aminoácidos en una muestra de RNPT de bajo peso.
Material y métodosEstudio observacional de casos y controles para evaluar un nuevo protocolo de NP basado en el aporte precoz de aminoácidos en RNPT de < 1.500g de peso al nacimiento.
Se consideraron criterios de inclusión: edad gestacional (EG) < 37 semanas, peso al nacimiento < 1.500g y alimentación parenteral inicial. Se excluyeron los recién nacidos (RN) que recibieron alimentación enteral no trófica (> 24ml/kg/día de fórmula y/o leche materna) dentro de las primeras 24h de vida, los que presentaban cromosomopatías o síndromes genéticos y/o dismórficos que condicionan retraso de crecimiento extrauterino, patologías gastrointestinales severas y cardiopatías congénitas hemodinámicamente significativas, con la excepción del ductus arterioso persistente.
Se estudiaron los RNPT nacidos vivos entre junio de 2008 y julio de 2009, que fueron alimentados según el nuevo protocolo de NP precoz. Dicho protocolo incluye la administración de al menos 1,5g/kg/día de aminoácidos parenterales en forma de Aminopaed® dentro de las primeras 24h de vida, junto con aportes habituales de glucosa (4-6mg/kg/min), líquidos (70-80ml/kg/día) y electrolitos (1-2 mEq/kg/día de gluconato cálcico 10%). Los aminoácidos se aumentan a razón de 0,5-1g/kg/día hasta alcanzar un máximo de 3,5g/kg/día al tercero o cuarto día de vida. Los lípidos se inician el segundo día de vida a 1g/kg/día, aumentándose de 0,5-1g/kg/día hasta un máximo de 3,5g/kg/día.
El grupo control lo formaron los RNPT nacidos entre febrero de 2005 y marzo de 2007 alimentados por vía parenteral según protocolo tradicional en el que el aporte de aminoácidos se iniciaba el segundo o tercer día de vida a razón de 1g/kg/día con aumentos de 0,5g/kg/día, y los lípidos al 3.°-4.° día a dosis de 1g/kg/día. Las cantidades finales de aminoácidos y lípidos, así como el aporte de glucosa, líquidos y electrolitos, eran los mismos que en el nuevo protocolo.
El estudio se realizó con la aprobación del comité de investigación de nuestro hospital.
Se realizó un seguimiento de los pacientes hasta los 28 días de edad posnatal o hasta el alta de la unidad de cuidados intensivos neonatal.
Se recogieron de cada paciente: sexo, EG, peso, longitud y perímetro de cráneo (PC) al nacimiento, grado de afectación orgánica en las primeras 24h de vida (principalmente, síndrome de distrés respiratorio y alteraciones del equilibrio ácido base) y variables de evolución somatométrica (peso, longitud y PC a los 28 días de vida; peso mínimo en el periodo de estudio y a qué día de vida corresponde, días que tarda en recuperarse el peso al nacimiento y velocidad de ganancia ponderal (g/kg/día). Se evaluó la aparición de posibles efectos adversos asociados a la NP (colestasis, incremento de los niveles de urea y creatinina, hiperglucemia, acidosis metabólica, sepsis asociada a catéter), incidencia de comorbilidades (sepsis, necesidad de soporte respiratorio y hemodinámico, displasia broncopulmonar, enterocolitis necrotizante, persistencia del conducto arterioso) y mortalidad durante el periodo de estudio.
Valoramos así la repercusión del aporte precoz de aminoácidos sobre su crecimiento. La variable ΔPeso, definida como la diferencia de peso entre el nacimiento y el final del periodo de seguimiento, se consideró la variable principal y se utilizó para el cálculo del tamaño muestral.
Los datos fueron analizados mediante el programa SPSS v.15.0 (Chicago, Illinois, EEUU). Se calculó un tamaño muestral de 24 sujetos en cada grupo como necesario para detectar al menos una diferencia del 20% en la variable principal ΔPeso (poder 0,9, error alfa 0,05). Se asumieron unas pérdidas del 20%, por lo que se estimó un número necesario de 29 pacientes en cada grupo. Las variables cualitativas se compararon mediante la prueba de la chi al cuadrado y las variables continuas por la prueba de la t de Student para muestras independientes si la distribución de la variable era normal (prueba de Kolgomorov-Smirnov > 0,05) y mediante U de Mann-Whitney si la condición de normalidad no podía ser asumida. Se realizó además un análisis de correlación de Pearson entre las variables g/kg de proteínas en las primeras 24h y lípidos en las primeras 48h con la variable principal del estudio ΔPeso (nivel de significación p < 0,01). Se realizó un análisis post hoc comparando las características de los pacientes que recibieron o no insulina.
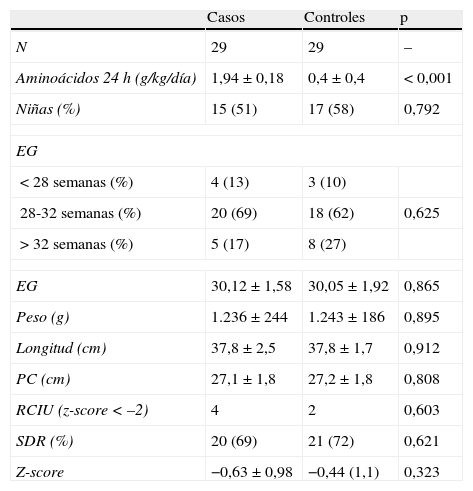
ResultadosDe los 58 pacientes estudiados no hubo diferencias significativas entre ambos grupos en cuanto a las características basales de sexo, EG, peso, longitud y PC (tabla 1).
Características basales
| Casos | Controles | p | |
| N | 29 | 29 | – |
| Aminoácidos 24 h (g/kg/día) | 1,94±0,18 | 0,4±0,4 | < 0,001 |
| Niñas (%) | 15 (51) | 17 (58) | 0,792 |
| EG | |||
| < 28 semanas (%) | 4 (13) | 3 (10) | |
| 28-32 semanas (%) | 20 (69) | 18 (62) | 0,625 |
| > 32 semanas (%) | 5 (17) | 8 (27) | |
| EG | 30,12±1,58 | 30,05±1,92 | 0,865 |
| Peso (g) | 1.236±244 | 1.243±186 | 0,895 |
| Longitud (cm) | 37,8±2,5 | 37,8±1,7 | 0,912 |
| PC (cm) | 27,1±1,8 | 27,2±1,8 | 0,808 |
| RCIU (z-score < –2) | 4 | 2 | 0,603 |
| SDR (%) | 20 (69) | 21 (72) | 0,621 |
| Z-score | −0,63±0,98 | −0,44 (1,1) | 0,323 |
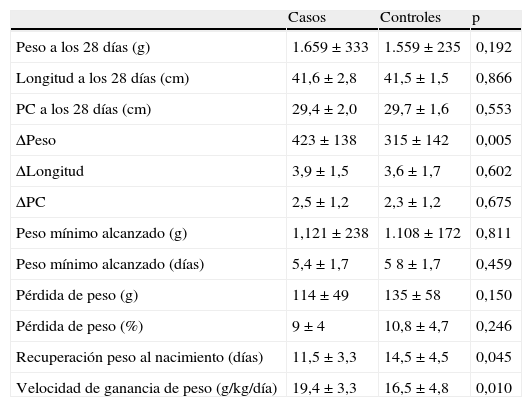
Los pacientes que recibieron NP según el nuevo protocolo tuvieron una ganancia de peso significativamente mayor que el grupo control (423±138g vs. 315±142g; p=0,005) con una velocidad de ganancia ponderal diaria mayor (19,4±3,3 vs. 16,5±4,8; p=0,010) y además recuperaron antes el peso al nacimiento (11,5±3,3 días vs. 14,5±4,5 días; p=0,045). La evolución de la longitud y PC fue similar en ambos grupos (tabla 2).
Evolución somatométrica
| Casos | Controles | p | |
| Peso a los 28 días (g) | 1.659±333 | 1.559±235 | 0,192 |
| Longitud a los 28 días (cm) | 41,6±2,8 | 41,5±1,5 | 0,866 |
| PC a los 28 días (cm) | 29,4±2,0 | 29,7±1,6 | 0,553 |
| ΔPeso | 423±138 | 315±142 | 0,005 |
| ΔLongitud | 3,9±1,5 | 3,6±1,7 | 0,602 |
| ΔPC | 2,5±1,2 | 2,3±1,2 | 0,675 |
| Peso mínimo alcanzado (g) | 1,121±238 | 1.108±172 | 0,811 |
| Peso mínimo alcanzado (días) | 5,4±1,7 | 5 8±1,7 | 0,459 |
| Pérdida de peso (g) | 114±49 | 135±58 | 0,150 |
| Pérdida de peso (%) | 9±4 | 10,8±4,7 | 0,246 |
| Recuperación peso al nacimiento (días) | 11,5±3,3 | 14,5±4,5 | 0,045 |
| Velocidad de ganancia de peso (g/kg/día) | 19,4±3,3 | 16,5±4,8 | 0,010 |
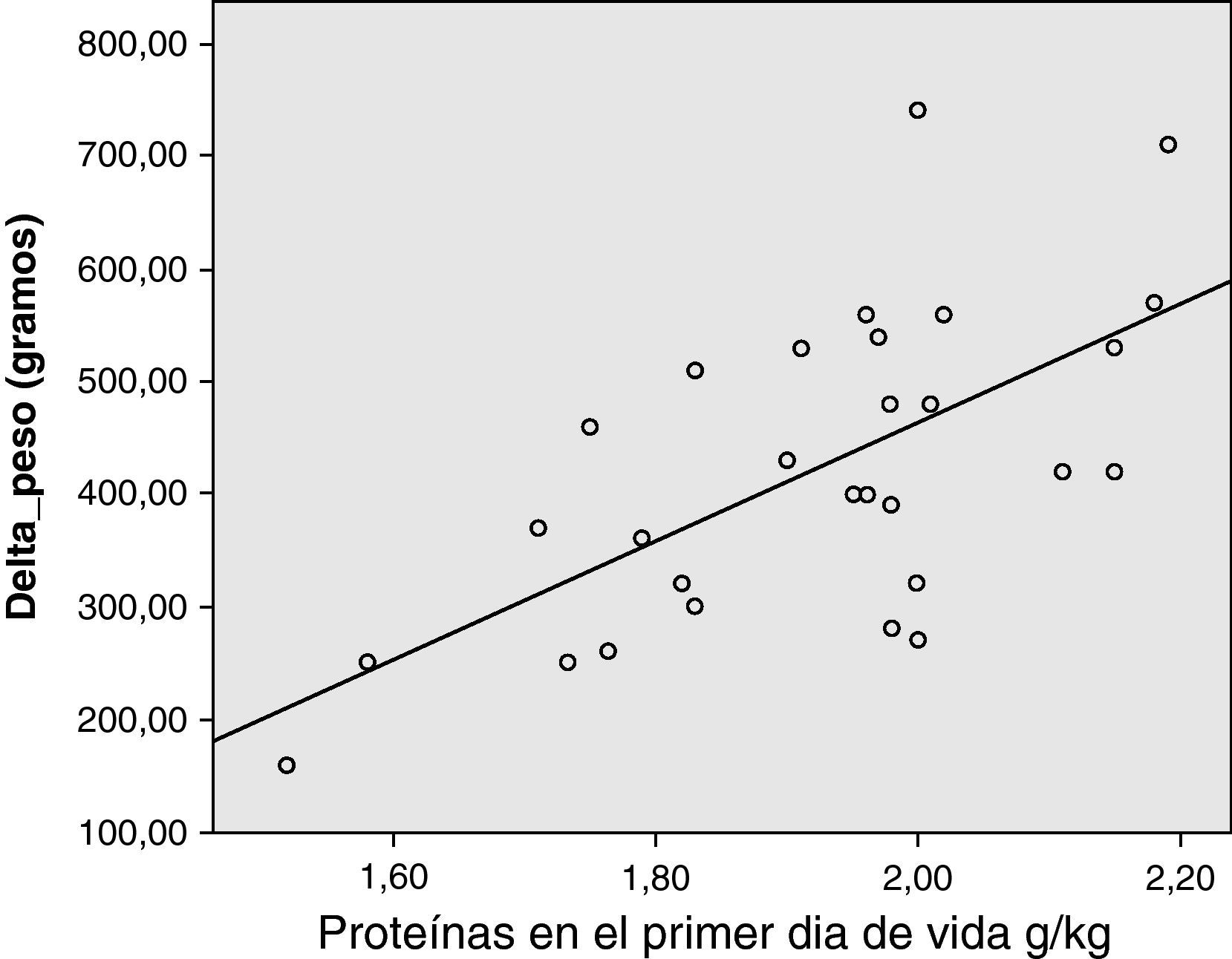
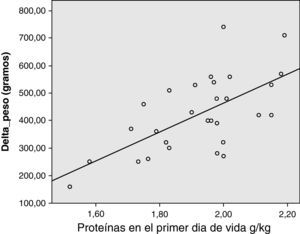
El análisis post hoc de correlación entre la variable principal ΔPeso y el aporte de proteínas en g/kg el primer día de vida mostró una correlación positiva moderada y significativamente estadística (coeficiente de correlación de Pearson 0,733, p<0,01) (fig. 1).
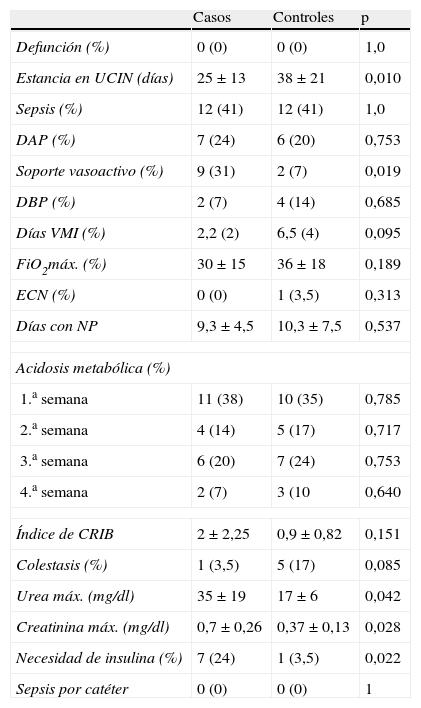
Ninguno de los pacientes incluidos falleció. No hubo diferencias en la presencia de complicaciones o necesidad de soporte respiratorio, aunque sí encontramos mayor necesidad de soporte vasoactivo en el grupo de estudio. El nuevo protocolo de NP se asoció a una menor estancia en la UCIN (tabla 3).
Comorbilidades y posibles efectos adversos de la nutrición parenteral
| Casos | Controles | p | |
| Defunción (%) | 0 (0) | 0 (0) | 1,0 |
| Estancia en UCIN (días) | 25±13 | 38±21 | 0,010 |
| Sepsis (%) | 12 (41) | 12 (41) | 1,0 |
| DAP (%) | 7 (24) | 6 (20) | 0,753 |
| Soporte vasoactivo (%) | 9 (31) | 2 (7) | 0,019 |
| DBP (%) | 2 (7) | 4 (14) | 0,685 |
| Días VMI (%) | 2,2 (2) | 6,5 (4) | 0,095 |
| FiO2máx. (%) | 30±15 | 36±18 | 0,189 |
| ECN (%) | 0 (0) | 1 (3,5) | 0,313 |
| Días con NP | 9,3±4,5 | 10,3±7,5 | 0,537 |
| Acidosis metabólica (%) | |||
| 1.a semana | 11 (38) | 10 (35) | 0,785 |
| 2.a semana | 4 (14) | 5 (17) | 0,717 |
| 3.a semana | 6 (20) | 7 (24) | 0,753 |
| 4.a semana | 2 (7) | 3 (10 | 0,640 |
| Índice de CRIB | 2±2,25 | 0,9±0,82 | 0,151 |
| Colestasis (%) | 1 (3,5) | 5 (17) | 0,085 |
| Urea máx. (mg/dl) | 35±19 | 17±6 | 0,042 |
| Creatinina máx. (mg/dl) | 0,7±0,26 | 0,37±0,13 | 0,028 |
| Necesidad de insulina (%) | 7 (24) | 1 (3,5) | 0,022 |
| Sepsis por catéter | 0 (0) | 0 (0) | 1 |
La duración de la NP fue similar en ambos grupos, al igual que la presencia de colestasis o acidosis. Sin embargo, el nuevo protocolo con aporte mayor de proteínas se asoció a cifras más elevadas de urea y creatinina durante el periodo de estudio sin una aparente relevancia clínica, así como a una más frecuente utilización de insulinoterapia (tabla 3). Los pacientes que recibieron insulina (7 pertenecientes al grupo de casos y 1 al grupo control) diferían significativamente en el peso al nacimiento (1.022±211g vs. 1.292±223g, respectivamente; p=0,026).
Se realizó un análisis post hoc comparando a los pacientes según precisaran o no insulina. No hallamos una mayor incidencia de retraso de crecimiento intrauterino (RCIU), definido como peso para la EG de < –2 z-score, siendo la media±desviación estándar de –0,67±0,66 z-scores en los pacientes que recibieron insulina y –0,49±1,05 en los que no precisaron insulinoterapia (p=0,845). Se encontró diferencia en cuanto al grado de prematuridad y de afectación orgánica (estimada por el índice de CRIB a las 12h de vida), que fue significativamente mayor en los pacientes que recibieron insulina, presentando EG e índice de CRIB de 29,23±1,76 y 3,5±3,27, respectivamente, en el grupo de insulina, y 30,22±1,74 y 1,1±1,08 en el grupo sin insulina con p de 0,021 y 0,012, respectivamente.
DiscusiónEste estudio fue realizado con el objeto de determinar si el aporte precoz de proteínas lograba mejorar los objetivos de crecimiento postnatal inmediato de los RNPT hospitalizados en nuestra unidad y detectar la aparición de complicaciones en relación con ese aporte. Estudios recientes parecen demostrar que la administración de proteínas en las primeras 24h de vida o, incluso, en la primera hora de vida no da lugar a complicaciones metabólicas o efectos secundarios importantes y, además, consigue mejorar la ganancia de peso al lograr un balance nitrogenado positivo y un menor déficit energético7–13. Los resultados de nuestro estudio son concordantes con los de dichas publicaciones, al conseguir una mejor ganancia ponderal, tanto en lo referente al peso final como a la velocidad de aumento de peso, siendo ambos grupos semejantes y, por tanto, comparables, en cuanto a características epidemiológicas, somatométricas y de patología asociada. Tampoco observamos mayor incidencia de complicaciones clínicas o metabólicas con el nuevo protocolo, salvo la necesidad de mayores requerimientos de insulina en el grupo que recibió NP precoz, lo cual difiere con el hecho de que la NP precoz se asocie a una menor intolerancia a la glucosa y mayores niveles de insulina endógena14,15.
En un estudio reciente16, observaron asociación entre hiperglucemia y grado de prematuridad y bajo peso al nacimiento, así como con la utilización de inotrópicos, la infusión intravenosa de lípidos y la presencia de sepsis. En este mismo estudio hallaron una fuerte asociación entre insuficiencia placentaria, con el consiguiente RCIU, y la aparición de hiperglucemia, aunque dicha asociación no resultó estadísticamente significativa. Nosotros realizamos un análisis post hoc comparando los pacientes que precisaron o no insulinoterapia y no hallamos una mayor incidencia de RCIU en el grupo de pacientes con insulina, pero sí hubo diferencia en cuanto al grado de prematuridad y de afectación orgánica, que fue significativamente mayor en estos pacientes. En RNPT de muy bajo peso al nacimiento se estima una prevalencia de hiperglucemia del 25-75% y, aunque la causa de esta intolerancia a carbohidratos no es del todo conocida, se cree que está en relación con la incapacidad para inhibir la gluconeogénesis en respuesta a la infusión de glucosa, el déficit absoluto o relativo de insulina y una mayor resistencia insulínica15,17, la cual además se encuentra potenciada en los pacientes en situación crítica. Esto podría contribuir a explicar las diferencias observadas.
Reese et al, en un estudio de 122 RN, observaron que el aporte de aminoácidos a 3,5g/kg/día no mejoraba el crecimiento neonatal y se asociaba a altos niveles plasmáticos de urea y de determinados aminoácidos18. Estos hallazgos probablemente estén relacionados con la inmadurez de las vías metabólicas de los niños prematuros y sugieren la utilización cautelosa de dosis altas de proteínas. Estas y otras observaciones han guiado nuestra decisión de optar por un protocolo menos «agresivo» en cuanto al aporte de aminoácidos en las primeras 24h en comparación con otras prácticas8,12,13. En nuestro estudio también observamos una mayor elevación de los niveles de urea en aquellos RNPT que recibieron dosis altas de proteínas, aunque no se observó ningún caso de insuficiencia renal. Publicaciones recientes no encuentran asociación entre la aparición de hiperamoniemia y el uso de soluciones de aminoácidos de forma precoz7,8,12, contrariamente a lo observado en estudios más antiguos19,20. Se puede argumentar que la elevación de los niveles de urea es una consecuencia lógica del incremento del aporte de proteínas e indica un correcto funcionamiento del metabolismo hepático. La medición rutinaria del amonio no forma parte de nuestro protocolo de NP y, además, desconocemos cuál es la elevación de los niveles de productos nitrogenados que sería de esperar se tradujese en un anabolismo eficaz y un mayor crecimiento somático. El metabolismo proteico en RNPT no es del todo conocido y continúan siendo inciertos los mecanismos por los cuales el incremento del aporte de aminoácidos se traduce en un efecto anabólico con mejoría del balance proteico21,22. Creemos que estos aspectos merecen ser estudiados en mayor profundidad.
Con nuestro estudio no podemos asegurar que los beneficios observados en el crecimiento se deban única y exclusivamente a las variaciones en el aporte proteico. Cabe la posibilidad de que en las diferencias observadas en nuestro estudio influya la mejora en la práctica clínica a lo largo del periodo de estudio, puesto que utilizamos controles históricos. El cálculo del tamaño muestral no ha previsto la potencia estadística necesaria para la detección de diferencias en efectos adversos y no existe un control de variables de confusión de forma que no podemos asegurar que los beneficios observados en el crecimiento se deban única y exclusivamente a las variaciones en el protocolo de nutrición. Esta limitación podría salvarse con la realización de un análisis de regresión logística. Sin embargo, el elevado número de covariables respecto al tamaño muestral desaconseja la realización de dicho análisis. En este sentido el análisis post hoc realizado entre los RN del nuevo protocolo muestra una correlación positiva moderada entre el nivel de aporte de proteínas en el primer día y la variable principal ΔPeso, lo cual apoya la relación causal entre el aporte de proteínas y la ganancia ponderal observada. No se encontró correlación con los lípidos iniciales. Un periodo de seguimiento más prolongado podría detectar diferencias en otros parámetros como el PC y la longitud, así como valorar la presencia de diferencias en el área del neurodesarrollo u otras enfermedades.
En conclusión, nuestro estudio apoya la evidencia científica creciente en cuanto a la práctica de una NP más agresiva, aunque son necesarios más estudios para conseguir un soporte nutricional óptimo tanto en cantidad como en calidad, adaptado a las necesidades específicas de cada prematuro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos al Dr. Fernando Calvo, del Servicio de Neonatología del Hospital de León, por sus útiles comentarios durante las revisiones del manuscrito.