El objetivo del estudio fue evaluar si el uso de heliox (79:21) administrado vía cánula nasal de bajo flujo mejora el trabajo respiratorio en lactantes con bronquiolitis aguda causada por virus respiratorio sincitial.
MétodosSe realizó un estudio prospectivo aleatorizado controlado. Todos los pacientes que cumplieron los criterios de inclusión se asignaron al azar a tratamiento con heliox (79:21) o con aire, administrados mediante cánula nasal a razón de 2 L/min durante un período ininterrumpido de 24 h. Se realizaron medidas basales, a las 2 h de iniciar el tratamiento y al completarse las 24 h.
ResultadosSe incluyeron 104 pacientes en el estudio. No se observaron diferencias significativas en la puntuación de la M-WCAS entre los dos grupos a las 2 h (4,3 vs. 4,1; p = 0,78) o al completarse las 24 h (4,2 vs. 4,3; p = 0,89). No hubo diferencias en las proporciones de participantes que progresaron a ventilación mecánica, CPAP-n u oxigenoterapia administrada mediante cánula nasal (RR: 1,0, 0,86 y 0,89; p = 1,0, 0,77 y 0,73). No hubo una reducción significativa en la duración de tratamiento, de 2,42 días en el grupo tratado con heliox y de 2,79 días en el grupo tratado con aire (p = 0,65). Tampoco hubo diferencias significativas entre los dos grupos bajo estudio en la saturación de oxígeno, PaO2 o PaCO2 a las 2 y a las 24 h de tratamiento.
ConclusionesNuestros datos no mostraron ningún efecto beneficioso del heliox a una concentración de 79:21 administrado vía cánula nasal de bajo flujo en cuanto a la mejoría de la dificultad respiratoria en lactantes con bronquiolitis aguda por VRS.
The aim of our study is to evaluate whether the use of heliox (79:21) delivered through a low flow nasal cannula would improve respiratory distress in infants with acute bronchiolitis caused by respiratory syncytial virus.
MethodsWe have conducted a prospective randomized controlled study. All patients fulfilled inclusion criteria were randomized to either heliox (79:21) or air via NC at 2 L/min for a continuous 24hours. Measurements were taken at baseline, after 2hours and at the end of the 24hours.
ResultsWe have included 104 patients into our study. The MCA-S did not show any significant difference between the two groups after 2hours 4.3 vs. 4.1 (P =.78), or at 24hours after 4.2 vs. 4.3 (P =.89). No difference was found in the proportion of participants progressed to MV, n-CPAP or oxygen via nasal cannula (RR 1.0, 0.86 and 0.89) (P= 1.0, .77 and .73). There was no notable reduction in length of treatment in Heliox group 2.42 days vs. 2.79 days in air group P =.65. The in oxygen saturation, PaO2, and PaCO2 did not to have any statistical difference between the two studied groups after 2hours and 24hours of treatment.
ConclusionOur data showed absence of any beneficial effect of heliox in a concentration (79:21) delivered through low flow nasal cannula in terms of respiratory distress improvement in infants with RSV acute bronchiolitis.
El helio es un gas inerte menos denso que el aire. Por lo tanto, el dióxido de carbono (CO2) se difunde con más facilidad por el helio que en el aire1. El helio favorece el flujo laminar y reduce las turbulencias en vías aéreas obstruidas, disminuyendo su resistencia al aire inhalado2. De este modo, la respiración de una mezcla gaseosa de oxígeno y helio (heliox) reduce la resistencia al flujo de la vía aérea y por tanto el trabajo respiratorio, especialmente en trastornos asociados con un aumento de la resistencia de la vía aérea3. Así, el heliox se puede utilizar en pacientes con obstrucción alta o baja de la vía aérea4 o bronquiolitis5,6. En pacientes con respiración espontánea, el heliox puede administrarse a través de distintas interfases, incluyendo mascarillas faciales conectadas5 a un reservorio que se mantiene inflado mediante un flujo de gas suficiente7 y a sistemas semicerrados que reducen el consumo de heliox a menos de 1 L/minuto, comparable al consumo con cánulas nasales de bajo flujo8,9. El heliox se puede administrar en modalidad invasiva realizando los ajustes necesarios en el sistema de ventilación mecánica4.
El virus respiratorio sincitial (VRS) es un virus ARN perteneciente a la familia Paramyxoviridae. Tras un período de incubación que puede durar hasta 8 días, comienza a replicarse en el epitelio nasofaríngeo para luego diseminarse al epitelio bronquiolar, dando lugar a una infección de las vías respiratorias bajas10. Según progresa la infección, la mucosa epitelial se inflama, con una producción elevada de secreciones mucosas seguida de necrosis celular y regeneración. Por último, la obstrucción de las vías aéreas de bajo calibre produce atrapamiento aéreo, con el consecuente incremento en la resistencia de las vías aéreas bajas11.
Debido a sus propiedades, un número creciente de estudios ha investigado el uso de heliox como terapia coadyuvante para mejorar la oxigenación en pacientes con infección de vías respiratorias bajas por VRS ventilados mecánicamente; no obstante, los datos disponibles actualmente no apoyan el uso de heliox en estos pacientes3.
El objetivo de nuestro estudio era evaluar si el uso de heliox (79:21) administrado mediante cánula nasal de bajo flujo (CNBF) consigue mejorar la dificultad respiratoria en lactantes con bronquiolitis aguda por VRS.
MétodosParticipantesLos criterios de inclusión fueron: edad de un mes a 2 años de edad e ingreso en la planta de pediatría por bronquiolitis aguda causada por VRS. El estudio se llevó a cabo entre mayo de 2015 y agosto de 2016. El diagnóstico de bronquiolitis se basó en la presencia de criterios clínicos tales como tos, taquipnea, retracciones costales, espiración alargada, sibilancias y signos de hiperinsuflación pulmonar en la radiografía de tórax. La detección del virus respiratorio sincitial como agente etiológico de la bronquiolitis se realizó mediante pruebas de detección directa de antígenos en muestras de secreciones nasofaríngeas. Se incluyó en el estudio a aquellos pacientes que presentaron con clínica de dificultad respiratoria al ingreso pero que mantuvieron saturaciones de oxígeno del 93% o superiores sin necesidad de oxígeno suplementario. Previo consentimiento informado de al menos uno de los padres o tutores legales, los pacientes que cumplieron los criterios de inclusión se asignaron al azar a tratamiento con heliox (79:21) o a tratamiento con aire (21%), administrados por medio de cánulas nasales a razón de 2 L/min y de manera ininterrumpida durante 24 h.
Se excluyeron del estudio aquellos lactantes que requirieron oxígeno suplementario o ventilación mecánica, o con cardiopatías congénitas (cortocircuitos izquierda-derecha significativos, en presencia o ausencia de hipertensión pulmonar, o cortocircuito derecha-izquierda). También se excluyeron pacientes con enfermedad pulmonar crónica conocida, incluyendo displasia broncopulmonar o procesos con hiperrespuesta bronquial. Tampoco se incluyeron pacientes para los que no se obtuvo consentimiento informado.
Aspectos éticos y consentimiento a la participaciónEl proyecto de investigación fue aprobado por el Comité institucional de investigación de la Facultad de Medicina de la Universidad de El Mansura, Egipto, con expediente n.° R2/17.10.35.
Se obtuvo el consentimiento informado de al menos uno de los padres de cada uno de los participantes en el estudio.
Diseño del estudioSe realizó un estudio prospectivo aleatorizado y controlado. Tras obtenerse el consentimiento informado, los participantes se asignaron al azar a recibir heliox (79:21) (Advanced Technology Company) o aire vía CNBF a 2 L/min durante 24 h seguidas, mediante aleatorización por bloques realizada por ordenador. Los participantes se distribuyeron en bloques de 4 pacientes, de manera que la variabilidad dentro de los bloques fuera menor que la variabilidad entre bloques. A continuación, los pacientes de cada bloque fueron asignados aleatoriamente a cada tratamiento.
En casos en los que en algún momento la saturación de oxígeno se mantuvo entre el 93-90% durante 10 min o descendió por debajo del 90%, se retiró al lactante del estudio y se administró oxígeno suplementario según la prescripción del médico a cargo.
La escala clínica de asma de Wood modificada (M-WCAS)12 es un instrumento empleado para valorar variaciones temporales en la dificultad respiratoria con una puntuación máxima de 11. Se midieron las constantes vitales antes de iniciar el tratamiento y cada hora durante el tratamiento, mientras que la presión parcial de dióxido de carbono (PaCO2), la presión parcial de oxígeno (PaO2) y el M-WCAS se recogieron al inicio, cada hora durante las primeras 6 h de tratamiento, y luego a intervalos de 6 h hasta su finalización.
Detección del virus respiratorio sincitialLa detección del VRS se realizó mediante la prueba TRU RSV (Meridian Bioscience, Inc., EE. UU.) en muestras de secreciones nasofaríngeas. La prueba TRU RSV es un inmunoanálisis de captura para la detección rápida de antígenos de VRS en muestras humanas. La prueba emplea anticuerpos monoclonales contra la proteína de fusión y las nucleoproteínas del VRS conjugados con oro coloidal (anticuerpos detectores). Las muestras de secreciones nasofaríngeas de los participantes se obtuvieron mediante escobillado con hisopo de algodón y se enviaron en medio de transporte (solución salina al 0,85%) al laboratorio de microbiología para su procesamiento. La prueba se llevó a cabo siguiendo las instrucciones del fabricante.
Mediciones y evaluación de resultadosAntes de iniciar el protocolo de estudio, se realizó radiografía de tórax a cada paciente para evaluar la presencia de hiperinsuflación pulmonar (diafragma al nivel de la cara anterior de la sexta costilla torácica). Previa aplicación de crema anestésica, se extrajeron muestras de sangre de cada participante mediante punción arterial para medir la PaCO2 y la PaO2 basales, a las 2 h de tratamiento y al completarse las 24 h. La escala M-WCAS se empleó para evaluar cambios en la dificultad respiratoria, recogiéndose al menos una hora después de cualquier manipulación (como por ejemplo, extracción de sangre) antes de iniciarse el tratamiento, y después a las 2 h y las 24 h tras su inicio. Todos los pacientes se manejaron de manera uniforme de acuerdo a un único protocolo11,13. La saturación de oxígeno se monitorizó de manera continua mediante pulsioxímetro (Masimo; Irvine, CA, EE. UU.). El resto de las variables se midieron cada hora durante las primeras 6 h y a continuación a intervalos de 6 h hasta alcanzar las 24 h e interrumpirse el tratamiento con heliox. Se analizaron los datos obtenidos.
Medidas de resultadoLa medida de resultado primaria fue el cambio en el grado de dificultad respiratoria, evaluado mediante el M-WCAS a las 2 y 24 h de tratamiento. Las medidas de resultado secundarias fueron el tiempo total de tratamiento requerido para obtener una mejoría en la dificultad respiratoria sostenida durante 1 hora con respiración de aire ambiente y un trabajo respiratorio mínimo (frecuencia respiratoria normal y ausencia de aleteo nasal, tiraje traqueal, gruñidos, cabeceos, cianosis o uso de músculos accesorios con excepción de tiraje intercostal leve) y la proporción de pacientes que requirieron oxígeno suplementario o soporte respiratorio en cada grupo.
Cálculo del tamaño muestralLa inclusión de 53 pacientes en cada rama permitiría la detección de una diferencia de 0,75 puntos en el M-WCAS, asumiendo una desviación estándar con respecto a la media de 1,2 puntos, mediante la prueba t de Student para dos muestras independientes con un poder del 90% y un error α de 5% a 2 colas, con el nivel de significación establecido en 0,05.
Análisis estadísticoSe empleó la prueba de Mann-Whitney para comparar la duración del tratamiento entre los grupos de estudio, y los resultados se expresaron mediante la mediana y el rango intercuartílico. El nivel de significación estadística se estableció en p < 0,05. El riesgo relativo se calculó mediante la prueba de Chi cuadrado. La población se describió como media/proporción con el correspondiente intervalo de confianza del 95%. Se realizó análisis de supervivencia mediante el método de Kaplan-Meier para la variable de duración de tratamiento hospitalario en ambos grupos. Todos los análisis estadísticos se realizaron con el paquete SPSS versión 19.0 (IBM, Chicago, IL, EE. UU.).
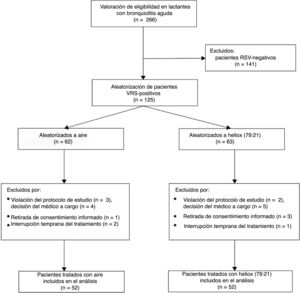
ResultadosDurante el período de estudio, 266 lactantes fueron ingresados en nuestra planta pediátrica con bronquiolitis aguda y considerados para su participación en el estudio. De ellos, tan solo 104 pacientes elegibles se incluyeron en los protocolos de estudio, asignándose 52 a cada rama, como muestra el diagrama que resume el flujo de pacientes antes y después de la aleatorización (fig. 1). Los valores basales de todas las variables medidas en los pacientes fueron similares en ambos grupos (tabla 1).
Características basales de ambos grupos
| Variable | Heliox (n =52) | Aire (n =52) | p |
|---|---|---|---|
| Edad (mes) | 11,7(7,1-18,5) | 12,1(6,9-17,8) | 0,68 |
| Peso (kg) | 10,4 (9,9-11,7) | 10,8 (10,1-11,6) | 0,86 |
| FR (rpm) | 65,6 (61,2-72,1) | 64,9 (60,7-71,8) | 0,79 |
| PaO2 (mmHg) | 56,8(52,3-61,1) | 57,1 (49,9-62,2) | 0,78 |
| PaCO2 (mmHg) | 47,9(45,2-51,1) | 46,8(44,2-52,4) | 0,69 |
| SpO2 (%) | 94,9(93,1-97,4) | 95,2(93,4-98,0) | 0,85 |
| M-WCAS | 4,2(5,0-3,2) | 4,3(4,9-3,6) | 0,89 |
FR: frecuencia respiratoria; M-WCAS: escala clínica de asma de Wood modificada.
A las 2 h de iniciarse el tratamiento, no se observaron mejorías significativas en la saturación de oxígeno o la PaO2 en el grupo tratado con heliox en comparación con el tratado con aire (p = 0,85 y p = 0,76, respectivamente). Tampoco hubo diferencias significativas en la PaCO2 entre ambos grupos (p = 0, 69), como muestra la tabla 2. Tras 24 h de tratamiento, seguían sin detectarse diferencias significativas entre los dos grupos en la saturación de oxígeno (p = 0,85), la PaO2 (p = 0,76) y la PaCO2 (p = 0,69), como muestra la tabla 3.
Diferencias entre los grupos de estudio a las 2 h de iniciarse el tratamiento
| Variable | Heliox (n =52) | Aire (n =52) | p |
|---|---|---|---|
| FR (rpm) | 63,8 (55,3-69,5) | 65,2 (60,1-74,1) | 0,67 |
| PaO2 (mmHg) | 57,2(52,3-61,1) | 56,9 (49,9-62,2) | 0,76 |
| PaCO2 (mmHg) | 47,9(45,2-51,1) | 46,8(44,2-52,4) | 0,69 |
| SpO2 (%) | 95,2(93,1-97,4) | 94,8(93,4-98,0) | 0,85 |
| M-WCAS | 4,3(5,0-3,2) | 4,1(4,9-3,6) | 0,72 |
FR: frecuencia respiratoria; M-WCAS: escala clínica de asma de Wood modificada.
Diferencias entre los grupos de estudio a las 24 h de iniciarse el tratamiento
| Variable | Heliox (n =52) | Aire (n =52) | p |
|---|---|---|---|
| FR (rpm) | 63,8 (55,3-69,5) | 65,2 (60,1-74,1) | 0,67 |
| PaO2 (mmHg) | 57,2(52,3-61,1) | 56,9 (49,9-62,2) | 0,76 |
| PaCO2 (mmHg) | 47,9(45,2-51,1) | 46,8(44,2-52,4) | 0,69 |
| SpO2 (%) | 94,9(93,1-97,4) | 95,2(93,4-98,0) | 0,85 |
| M-WCAS | 4,2(4,8-3,4) | 4,3(4,7-3,6) | 0,89 |
FR: frecuencia respiratoria; M-WCAS: escala clínica de asma de Wood modificada.
La escala clínica de asma de Wood modificada tampoco evidenció diferencias significativas entre los dos grupos a las 2 h de tratamiento (p = 0,78), y la puntuación fue prácticamente la misma en cada grupo al completarse las 24 h de tratamiento (p = 0,89), como muestra la tabla 3.
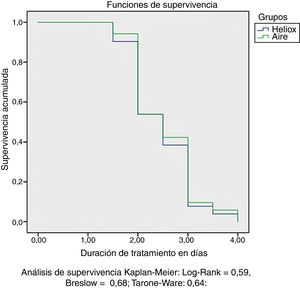
El análisis de datos no mostró diferencias entre ambos grupos en la proporción de pacientes que pasaron a requerir ventilación mecánica, CPAP-n u oxígeno suplementario administrado por CN (tabla 4). Tampoco hubo una reducción notable en la duración del tratamiento en el grupo tratado con heliox en comparación con el grupo tratado con aire (p = 0,65). El análisis de supervivencia mediante el método de Kaplan-Meier no mostró diferencias significativas en la duración del tratamiento entre ambos grupos, como puede observarse en la figura 2.
Proporción de participantes que requirieron soporte respiratorio en los grupos de estudio
| Variable, n (%) | Heliox (n =52) | Aire (n =52) | RR (IC 95%) | p |
|---|---|---|---|---|
| Ventilación mecánica | 2 (3,8) | 2 (3,8) | 1,0 (0,14–6,8) | 1,0 |
| CPAP nasal | 6 (11,5) | 7(13,4) | 0,86 (0,31–2,4) | 0,77 |
| Oxígeno vía cánula nasal | 13 (25) | 14 (26,9) | 0,89 (0,47–1,7) | 0,73 |
No se observaron efectos adversos en relación con el tratamiento. Todos los pacientes se recuperaron completamente y sin secuelas.
DiscusiónCuando el helio se mezcla con oxígeno, se produce un gas menos denso que el aire14 que puede reducir el trabajo respiratorio en procesos de obstrucción de la vía aérea mediante la reducción de la resistencia al flujo y el incremento de la ventilación alveolar15–21.
En nuestro estudio, el uso de helio mezclado con aire a una concentración de 79:21 sin adición de oxígeno suplementario no consiguió reducciones significativas en la escala clínica del asma empleada para la evaluación de la dificultad respiratoria ni mejoras en la oxigenación durante la fase inicial del tratamiento en pacientes con bronquiolitis aguda por VRS. Nuestros resultados son consistentes con los de Wurzel et al.22, que no observaron efectos positivos del uso de heliox a las 24 h de iniciar el tratamiento en las medidas de resultado, incluyendo el intercambio gaseoso, medidas de función pulmonar, puntuación en la escala clínica de patología respiratoria o duración total de la estancia hospitalaria.
No obstante, nuestro estudio previo en el que se utilizó helio con oxígeno suplementario al 30% (70:30) administrado mediante CNAF encontró mejoras transitorias en la oxigenación durante la fase inicial de tratamiento en pacientes con bronquiolitis aguda por VRS, aunque hubo un rápido declive tras 2 h de tratamiento. Esta mejoría con el uso de heliox con concentración de 70:30 en la fase inicial de tratamiento que describimos previamente podría estar asociada a la mayor concentración de oxígeno empleada y al mecanismo de acción del heliox, que facilita el flujo de oxígeno en vías aéreas estrechas. También podría deberse al efecto del soporte respiratorio administrado mediante CNAF23. De manera similar, en una revisión Cochrane reciente, Morra et al. encontraron datos sobre los efectos beneficiosos de corta duración de la inhalación de heliox en combinación con dexametasona oral o intramuscular en niños con crup grave o moderada4. Otros autores también han descrito mejorías a corto plazo que podrían deberse al uso concomitante de ventilación no invasiva (CPAP-n) más que a los efectos del heliox en sí mismo20. La ausencia de un aumento en la eliminación de CO2 en pacientes con bronquiolitis aguda por VRS observada en nuestro estudio fue consistente con los hallazgos del estudio anterior en el que se utilizó heliox (30:70) administrado mediante CNAF23, y con los descritos por Gross et al.3, que no encontraron efectos beneficiosos de heliox con mezclas a distintas concentraciones en la PaCO2 de lactantes con bronquiolitis grave por VRS ventilados mecánicamente. Kneyber et al. también han publicado resultados similares, si bien los pacientes en su estudio revestían mayor gravedad y tenían valores de PaCO2 más altos24. Por lo tanto, es necesario tener en cuenta que el heliox no tiene un efecto terapéutico intrínseco, tratándose más bien de una medida temporal a emplear hasta que el tratamiento definitivo surta efecto o se resuelva el cuadro25. En consecuencia, el heliox solo ha de considerarse como terapia coadyuvante en el manejo de la obstrucción grave de la vía aérea.
En nuestro estudio, el uso del heliox no se asoció a una reducción notable en la proporción de pacientes que acabaron requiriendo ventilación mecánica, CPAP-n u oxígeno suplementario. Chowdhury et al. describieron resultados similares en pacientes con bronquiolitis no causada por VRS con el uso de heliox administrado a la misma concentración vía CNBF9. Tampoco observamos una reducción significativa en la estancia hospitalaria en pacientes con bronquiolitis causada por VRS tratados con heliox, al contrario que Chowdhury et al., que observaron una reducción de casi la mitad en los días de tratamiento en el grupo tratado con heliox en comparación con el grupo tratado con aire9.
No se observaron efectos adversos del tratamiento. Todos los pacientes se recuperaron completamente y sin secuelas.
Ninguno de los participantes, independientemente del tratamiento al que fueron asignados, sufrió efectos adversos, y el heliox fue bien tolerado. No obstante, cabe mencionar algunas de las limitaciones de nuestro estudio. Se utilizaron cánulas nasales de bajo flujo, que no son la mejor interfase para administrar esta mezcla gaseosa, ya que las cánulas nasales de alto flujo, la CPAP-n y la ventilación mecánica son métodos mejores. Por añadidura, no se pudo enmascarar la asignación al tratamiento debido a las diferencias existentes entre los sistemas empleados en la administración de gases, mientras que el reducido tamaño de la muestra no permitió discriminar entre subtipos clínicos en base a la gravedad, factores que deberían ser abordados en investigaciones futuras.
ConclusionesNuestros datos no mostraron ningún efecto beneficioso de la adición de helio al aire en cuanto a la reducción del trabajo respiratorio en lactantes con bronquiolitis aguda por VRS. Por lo tanto, hay que interpretar con cautela los datos emergentes sobre la eficacia del heliox en la reducción del trabajo respiratorio, ya que no se ha establecido con claridad si el heliox produce o no efectos beneficiosos durante el tratamiento de la bronquiolitis aguda por virus respiratorio sincitial.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.