Analizar los medicamentos que reciben los pacientes pediátricos en el ámbito extrahospitalario y la información disponible sobre los mismos.
Pacientes y métodosEstudio transversal, observacional y descriptivo realizado en una muestra de pacientes menores de 14 años atendidos en urgencias del Servicio de Pediatría del Consorcio Hospital General Universitario de Valencia entre junio 2005 y agosto 2006. Se cuantifican y clasifican los medicamentos utilizados antes de acudir a urgencias y se analiza la información sobre su uso que contiene el Vademécum Internacional Medicom y la ficha técnica.
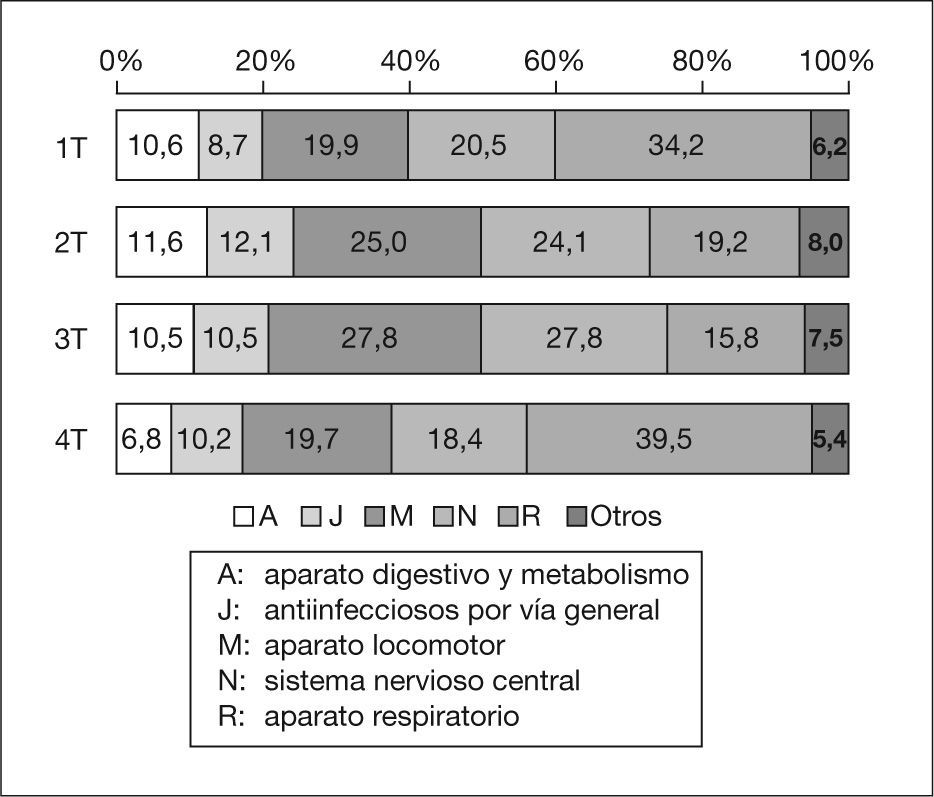
ResultadosSe recogió información sobre 462 niños con media de edad de 5,2 años (intervalo de confianza del 95% [IC 95%]: 4,9-5,6). De ellos, 336 reciben 667 medicamentos (152 distintos) que contienen 864 principios activos (161 diferentes). En el 34,3 % de los casos el uso es por automedicación. Los menores de 4 años reciben medicamentos en mayor proporción que los mayores (80,2 y 67,4%, respectivamente). Los pacientes reciben entre 1 y 7 medicamentos (media 2,0). Los que toman 2 o 3 medicamentos son menores que los que toman uno. Cinco grupos terapéuticos de la Clasificación anatómico-terapéutico-química (ATC) incluyen el 93,1% de los medicamentos (R [aparato respiratorio]: 26,5%; M [aparato locomotor]: 23,8%; N [sistema nervioso central]: 22,8 %;J [antiinfecciosos por vía general]: 10,6% y A [aparato digestivo y metabolismo]: 10,0%). Para 40 de los 152 medicamentos no hay información pediátrica en las fuentes consultadas.
ConclusionesCasi tres cuartas partes de los niños atendidos en urgencias toman medicamentos antes de acudir a este servicio, en muchos casos por automedicación. La información sobre uso pediátrico de medicamentos es incompleta y presenta incongruencias. Es necesario fomentar la investigación clínica sobre los efectos del tratamiento farmacológico en los niños para mejorar la información sobre su uso.
To analyse the drugs taken in paediatric outpatients and the information available on these drugs.
Patients and methodsA cross-sectional, observational, descriptive study was carried out. The study involved a sample of children under 14 years seen in the Emergency Room of the HGUV from June 2005 to August 2006. The medicines they received were quantified and classified, and the information on these drugs available in the Vademecum International Medicom and in the Summary of Product Characteristics, were analysed.
ResultsOf the 462 children (mean age 5.2 (95% CI 4.9-5.6)) in-cluded, 336 received 667 medicines (152 different medicines) that contained 864 drugs (161 different drugs). In 34.3 % of the cases it was for self-medication. Children under 4 years received more drugs than the older group (80.2% in the younger group and 67.4% in the older). Patients received from 1 to 7 medicines (mean 2.0). Children receiving 2 or 3 medicines were younger than those who received one. Five therapeutic groups of the Anatomical-Therapeutical-Chemical Classification (ATC) include the 93.1% of the drugs administered (R: 26.5%; M: 23.8%; N: 22.8%; J: 10.6% and A: 10.0%). In the information sources consulted there was no information available on paedi-atric use for 40 of the 152 medicines used.
ConclusionsAlmost 75 % of patients seen in the Emergency Room were already receiving drugs before they arrived at the hospital, in many cases as a result of self-medication. The information available on the paediatric use of drugs is deficient. Clinical research is required to study the effects of pharmacological treatment on children and to improve the information on their use.
En el proceso de autorización de un nuevo medicamento es fundamental disponer de los resultados de ensayos clínicos que demuestren su eficacia y seguridad. A partir de éstos se establecen las indicaciones autorizadas y se redactan la ficha técnica y el prospecto para informar a profesionales sanitarios y a pacientes de las condiciones de uso del medicamento. La utilización de medicamentos en niños tiene peculiaridades, pero generalmente éstos no participan en los ensayos previos a la autorización, por lo que no se dispone de información sobre el uso en pediatría1–3. Un elevado porcentaje de los medicamentos que se utilizan en niños, tanto en Europa como en Estados Unidos, no están autorizados para su uso en este grupo de edad4–12. Razones éticas y legales pueden justificar que no se realicen ensayos, pero también existen razones económicas, ya que los niños suponen una cuota de mercado pequeña para la mayor parte de los medicamentos3,13.
Ante la ausencia de información, los pediatras deben extrapolar datos procedentes de estudios realizados en adultos, lo que deja a los pacientes pediátricos en situación de inferioridad en cuanto a la utilización correcta de los medicamentos y puede generar fracaso terapéutico o incluso situaciones de riesgo14. En 1968 Shirkey15 calificó a los niños como “huérfanos terapéuticos” por la falta de información sobre los efectos de los medicamentos en este grupo de edad y la situación no ha cambiado mucho desde entonces16.
El uso de medicamentos en condiciones diferentes de las autorizadas constituye un experimento incontrolado en el que el paciente es incluido sin su consentimiento. Para algunos esta situación es más un problema administrativo o legal que científico17 y, en ocasiones, las sociedades científicas hacen recomendaciones que la favorecen12. En España, la ley de garantías y uso racional de los medicamentos de 2006 no dice de forma expresa que no se puedan utilizar los medicamentos en condiciones diferentes de las autorizadas, pero una publicación reciente del Ministerio de Sanidad18 califica de uso incorrecto la utilización en condiciones no autorizadas y advierte a los profesionales sanitarios de los riesgos legales que conlleva y de que deben leer siempre la ficha técnica antes de prescribir un medicamento.
En la última década tanto en Estados Unidos como en Europa se han producido cambios legislativos para favorecer la investigación de medicamentos en niños. En el caso de Estados Unidos, la Food and Drug Administration (FDA) puede exigir la realización de ensayos en población pediátrica para ciertos medicamentos, lo que se acompaña de una prolongación de su patente19. En Europa está aprobada desde enero de 2007 una reglamentación similar que no estará plenamente en vigor hasta el año 20092,20. Los nuevos fármacos pueden beneficiarse de estos cambios, pero es difícil que afecten a los medicamentos introducidos en terapéutica hace años y que no están protegidos por una patente3,21,22.
Una revisión sobre los medicamentos aprobados por la Agencia Europea del Medicamento (EMEA)23 en el período 1995–2005 pone de manifiesto que la situación en Europa no ha mejorado respecto a años anteriores en cuanto al número de medicamentos con información pediátrica, que es aproximadamente un tercio de los aprobados.
Para valorar cómo se utilizan los medicamentos se necesita analizar su uso real en cada lugar concreto. Las amplias diferencias que se observan entre países semejantes ponen de relieve la influencia de factores culturales, médicos, económicos e incluso políticos24. Los estudios de utilización de medicamentos en niños son escasos. Además, la mayoría de la información se refiere a niños hospitalizados y muchas veces procede de análisis de bases de datos que no informan del uso real sino de la prescripción.
Ante la ausencia de estudios de utilización de medicamentos en pediatría en nuestro país, el objetivo del presente trabajo es valorar los medicamentos que reciben los niños fuera del hospital, tanto por prescripción médica como por automedicación o consejo farmacéutico y la información disponible sobre su uso.
PACIENTES Y MÉTODOSEstudio transversal, observacional y descriptivo de utilización de medicamentos. Se registran, cuantifican y clasifican los medicamentos usados por niños menores de 14 años antes de acudir a urgencias del Servicio de Pediatría del Consorcio Hospital General Universitario de Valencia (CHGUV). Éste es un hospital general que atiende a unos 350.000 habitantes de la ciudad de Valencia y su área metropolitana, de los cuales unos 46.000 son menores de 15 años.
El estudio se inició el 17 de junio de 2005 y el último paciente se incluyó el 19 de agosto de 2006. Se incluyen niños atendidos en 6 días elegidos al azar cada uno de los meses del estudio excluyendo pacientes con enfermedad neoplásica o infección conocida por virus de la inmunodeficiencia humana (VIH). La información se obtiene mediante entrevista a los padres o acompañantes que realiza siempre la misma persona. Se pregunta por la medicación que está recibiendo el niño y se registra en una hoja diseñada al efecto. Se recogen datos demográficos y antropométricos, los antecedentes clínicos y la enfermedad actual de cada paciente y para cada medicamento: el nombre comercial, la indicación para la que se está usando, la pauta de administración y el origen de la prescripción, incluyendo los que se administran por automedicación o por consejo farmacéutico.
Los medicamentos se clasifican por su principio activo y el grupo de la Clasificación anatómico-terapéutico-química (ATC) al que pertenecen utilizando la base de datos del Consejo General de Colegios Oficiales de Farmacéuticos (www.portalfarma.com). Se revisa, para cada uno de los medicamentos, la información sobre uso pediátrico contenida en la monografía del Vademécum Internacional Medicom (V-I) vigente en el momento de recogida de los datos (45.a de 2004 y 46.a de 2005) y en la edición electrónica del mismo. Para los medicamentos no incluidos en el V-I se utiliza, si existe, la ficha técnica disponible en la página web de la Agencia Española del Medicamento y Productos Sanitarios (AEMPS) (http://sinaem.agemed.es:83/presentacion/principal.asp).
Con la información obtenida se clasifican los medicamentos en cuatro grupos: a) medicamentos con uso autorizado en pediatría; b) medicamentos con uso autorizado en pediatría pero con limitaciones para edad o peso; c) medicamentos sin información sobre uso pediátrico, y d) medicamentos para los que se contraindica el uso en pediatría o no se recomienda por ausencia de estudios.
Se ha calculado el tamaño muestral teniendo en cuenta los datos de utilización de medicamentos en niños de la Encuesta Nacional de Salud de 200325 y la pirámide de población de la provincia de Valencia. Considerando la peor situación estadística (p = q = 0,5) y utilizando la fórmula para el cálculo del tamaño muestral para detección de acontecimientos (uso de medicamentos antes de acudir al hospital) en una población finita con una precisión del 5 % y un error alfa de 0,05, se obtiene un valor de 381 individuos.
Análisis estadísticoSe aplican técnicas de estadística descriptiva. Las variables cualitativas se expresan mediante frecuencias absolutas y porcentajes con sus intervalos de confianza del 95 % (IC 95 %). Para las variables cuantitativas se calcula la media aritmética, la desviación estándar (DE) y el intervalo de confianza y cuando procede la mediana y el intervalo interacuartílico (IQ).
La comparación entre medias se realiza mediante la prueba de t de Student para valores independientes, y entre proporciones mediante la prueba de chi al cuadrado, en ambos casos con límite de significación del 5 %. Para valorar la relación entre variables categóricas se calcula la razón de proporciones (odds ratio [OR]) y su intervalo de confianza.
Aspectos éticosAunque se trata de un estudio de no intervención se proporcionó información a los padres o tutores sobre el mismo y se solicitó su autorización verbal para la recogida de los datos. Sólo se incluyeron los niños cuyos representantes aceptaron participar. El protocolo fue aprobado por el Comité Ético de Investigación Clínica (CEIC) y la comisión de investigación del CHGUV.
RESULTADOSCaracterísticas de la muestraSe han recogido datos de 462 pacientes (237 niños y 225 niñas), de los que 192 son menores de 4 años. La media de edad es 5,2 (DE: 3,7; IC 95 % 4,9–5,6) años. No existen diferencias significativas entre las edades de uno y otro sexo.
MedicamentosReciben medicamentos 336 pacientes (72,7 %; IC 95 %: 68,6–76,8), lo que supone el 74,3 % de los niños y el 71,1 % de las niñas, sin diferencia significativa entre sexos (OR: 1,17; IC 95 %: 0,93–1,46).
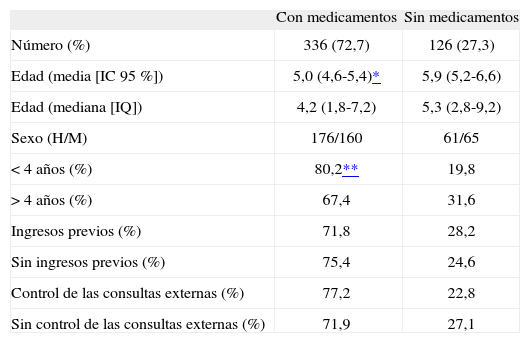
Los pacientes que reciben medicamentos tienen edad significativamente menor que los que no lo hacen. Además, el porcentaje de niños menores de 4 años que recibe medicamentos es significativamente mayor que el de mayores de esta edad (OR: 1,96; IC 95 %: 1,53-2,50). No existen diferencias para otras características entre ambos grupos (tabla 1). Durante el tercer trimestre (julio-septiembre) el porcentaje de niños que recibe medicamentos (59,5 %) es significativamente menor al de los otros tres (1.er trimestre: 78,3 %; 2.o trimestre: 77,2 %; 4.o trimestre: 76,0 %) entre los cuales no hay diferencias. El número medio de medicamentos es de 2,0 (DE: 1,1; rango: 1–7), sin diferencias entre trimestres. Los pacientes que reciben un solo medicamento son 141, 103 pacientes reciben dos, y 92, tres o más. Los niños que toman un solo medicamento son significativamente mayores (5,7 años; IC 95 %: 5,1-6,3) que los que toman dos (4,5 años; IC 95 %: 3,8-5,2) o tres (4,3 años; IC 95 %: 3,4-5,2]). No existen diferencias en cuanto al sexo.
Características de los niños según reciban o no medicamentos
| Con medicamentos | Sin medicamentos | |
| Número (%) | 336 (72,7) | 126 (27,3) |
| Edad (media [IC 95 %]) | 5,0 (4,6-5,4)* | 5,9 (5,2-6,6) |
| Edad (mediana [IQ]) | 4,2 (1,8-7,2) | 5,3 (2,8-9,2) |
| Sexo (H/M) | 176/160 | 61/65 |
| < 4 años (%) | 80,2** | 19,8 |
| > 4 años (%) | 67,4 | 31,6 |
| Ingresos previos (%) | 71,8 | 28,2 |
| Sin ingresos previos (%) | 75,4 | 24,6 |
| Control de las consultas externas (%) | 77,2 | 22,8 |
| Sin control de las consultas externas (%) | 71,9 | 27,1 |
IQ: intervalo intercuartílico; IC: intervalo de confianza.
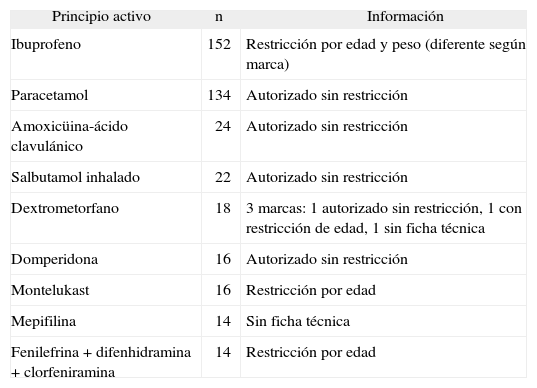
En total, se han registrado 667 medicamentos (152 diferentes) que contienen 864 principios activos (161 diferentes). El principio activo más frecuente es el ibuprofeno (152 veces), seguido del paracetamol (134), la amoxicilina (41) y el salbutamol (27). Un total de catorce principios activos aparecen 10 o más veces; 86 medicamentos y 79 principios activos suponen el 90 % del total. Los medicamentos, marcas, que aparecen más veces contienen ibuprofeno o paracetamol.
La mayor parte de los medicamentos se administran de forma aguda (93,3 %). Sólo 38 pacientes reciben 45 medicamentos de forma crónica, el montelukast es el principio activo más frecuente. La vía de administración más utilizada es la oral (86,2 %), seguida de la inhalatoria (5,5 %), la tópica (3,6 %) y la rectal (3,4 %).
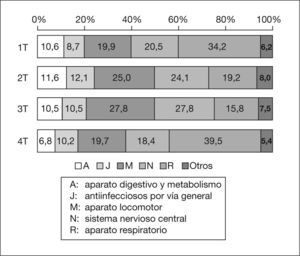
Los 152 medicamentos diferentes se pueden agrupar por su composición en 108 tipos distintos. De ellos, 115 (75,7 %) tienen un solo principio activo, 16 dos y 11 tres; los otros 10 contienen entre 4 y 12 principios activos. Según la clasificación ATC, los medicamentos del grupo R (aparato respiratorio), que incluye descongestionantes nasales, antiasmáticos, mucolíticos, antitusígenos y antihistamínicos, suponen el 26,5 % del total. Le siguen, por orden de frecuencia, el grupo M (aparato locomotor) (23,8 %), en el que está incluido el ibuprofeno; el N (sistema nervioso central) (22,8 %), que incluye el paracetamol; el J (antiinfecciosos por vía general) (10,6 %) y el A (aparato digestivo y metabolismo) (10,0 %), en el que se encuentran los antieméticos, antidiarreicos y las vitaminas. El resto de grupos supone el 6,9 % del total. El patrón cualitativo es semejante para los cuatro trimestres, pero el grupo R presenta un mayor porcentaje en el primero y el cuarto (fig. 1).
Los medicamentos se utilizan para el tratamiento de 72 cuadros clínicos distintos. El más frecuente es la fiebre (210 veces), seguido de la tos (67) y la infección de vías respiratorias superiores (66).
La mayor parte de los medicamentos (378) han sido prescritos por pediatras a 213 pacientes. La mitad de los pacientes (168) recibe 229 medicamentos por automedicación, en muchos casos, además de los prescritos por el médico. En 108 de estos pacientes el motivo para la automedicación es la fiebre. La prescripción en 52 medicamentos para 33 pacientes procede de médicos de familia y sólo 8 pacientes toman 8 medicamentos por consejo farmacéutico. El número medio de medicamentos por automedicación es de 1,4 (DE: 0,6) por paciente, valor que es significativamente menor (p = 0,023) que el que procede de la prescripción por pediatras (1,8 [DE: 0,9]) o médicos de familia (1,6 [DE: 0,9]).
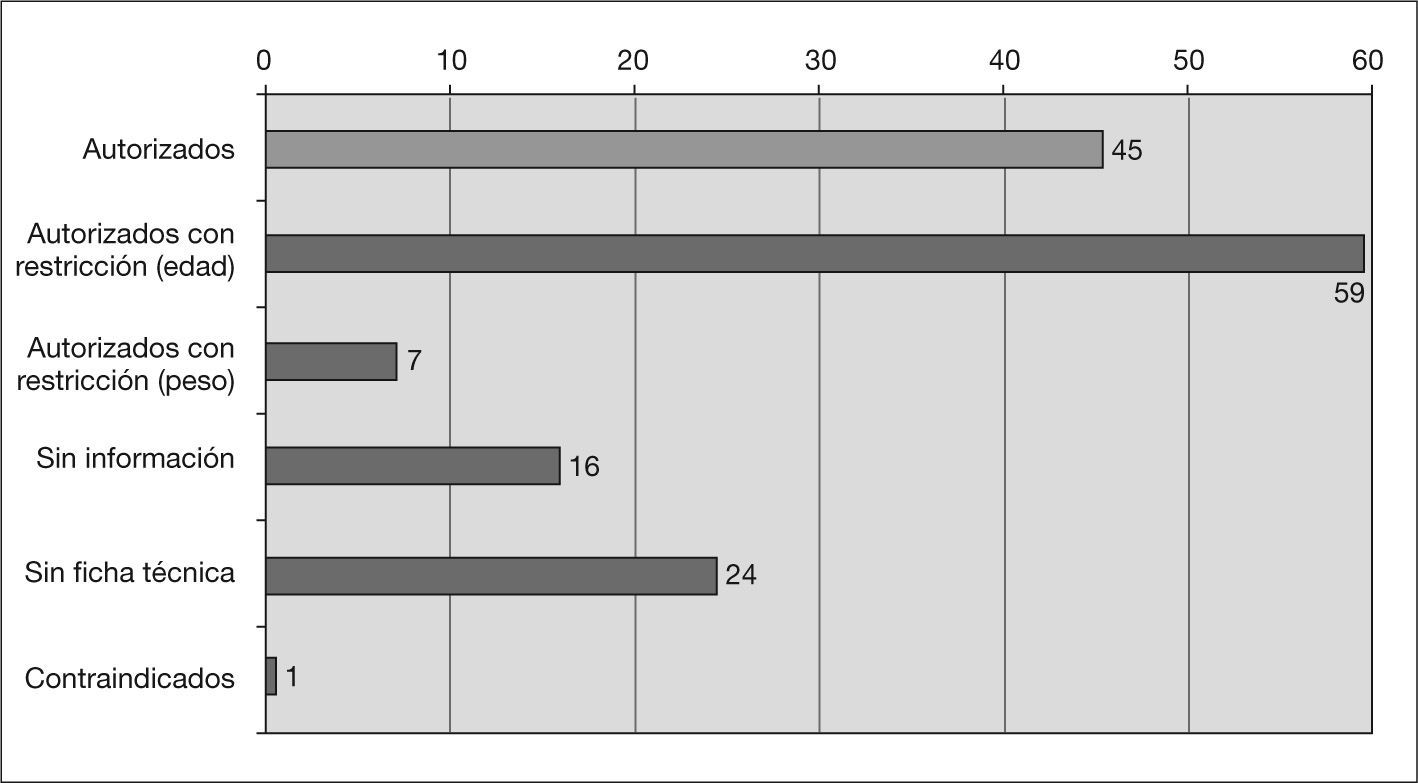
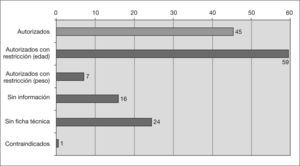
Información sobre uso pediátrico en V-I y fichas técnicasDe los 152 medicamentos diferentes, 111 tienen uso autorizado en pediatría. De ellos 45 están autorizados sin restricciones, 59 sólo a partir de cierta edad y 7 a partir de cierto peso. Para 40 medicamentos no existe información sobre uso en pediatría en el V-I, de los cuales para 24 no existe ficha técnica en la página web de la AEMPS (2 han sido dados de baja en 2006) y para los otros 16 existe ficha técnica, pero tampoco contiene información sobre uso pediátrico. En la tabla 2 se recoge la situación de los principios activos más utilizados (tabla 2). Sólo un medicamento cuyo principio activo es el ácido acetilsalicílico está contraindicado en pediatría (fig. 2). Para 20 de los 24 medicamentos que no disponen de ficha técnica se ha localizado información en las siguientes fuentes: 6 en el V-I edición de 2003, 13 en la edición de 1997 y uno en un anuncio aparecido en una revista pediátrica.
Información para uso pediátrico de los principios activos más utilizados
| Principio activo | n | Información |
| Ibuprofeno | 152 | Restricción por edad y peso (diferente según marca) |
| Paracetamol | 134 | Autorizado sin restricción |
| Amoxicüina-ácido clavulánico | 24 | Autorizado sin restricción |
| Salbutamol inhalado | 22 | Autorizado sin restricción |
| Dextrometorfano | 18 | 3 marcas: 1 autorizado sin restricción, 1 con restricción de edad, 1 sin ficha técnica |
| Domperidona | 16 | Autorizado sin restricción |
| Montelukast | 16 | Restricción por edad |
| Mepifilina | 14 | Sin ficha técnica |
| Fenilefrina + difenhidramina + clorfeniramina | 14 | Restricción por edad |
El 26,3 % de los 152 medicamentos diferentes han sido necesariamente utilizados al margen de las condiciones de autorización, puesto que no existe información o están contraindicados. Esta situación afecta a 82 prescripciones (12,3 % del total) y a 74 pacientes (22,7 %).
DISCUSIÓNEste estudio muestra que tres cuartas partes de los niños que acuden a urgencias pediátricas están recibiendo medicamentos que en muchos casos proceden de automedicación. El porcentaje es similar al obtenido por Cazzato et al26 en una muestra mayor de pacientes pediátricos atendidos en consulta extrahospitalaria en Italia, pero algo superior al obtenido en otro estudio italiano27. El mayor porcentaje de niños menores de 4 años que reciben medicamentos, junto con la menor edad de los que reciben dos o tres, coincide con los resultados de otros autores en cuanto a una mayor utilización de medicamentos en los niños más pequeños26,28. Durante los meses de verano desciende el porcentaje de pacientes tratados, lo que apoya la necesidad de registrar la época del año en que se realizan los estudios de utilización para poder comparar resultados. Tres de los cuatro estudios de diseño prospectivo que hemos localizado han sido realizados en Francia8,29 e Italia12 y no recogieron datos de todas las estaciones. El cuarto, realizado en Israel30, sí lo hizo pero no encontró diferencias. Otro estudio transversal con datos de prescripción farmacéutica en Holanda11 que recoge información de todo el año no especifica si existen diferencias.
El número medio de medicamentos es pequeño y dos tercios de los niños reciben uno o dos. En un trabajo31 realizado en Valencia en 1991 y 1992 se obtuvo una media de 4,4 medicamentos por paciente, pero se recogía la medicación administrada en el mes anterior al ingreso hospitalario. En un estudio realizado en Tenerife en 198828 se encontró un valor superior a tres medicamentos por paciente. En otro estudio reciente24 que incluye pacientes pediátricos atendidos en atención primaria en cinco países europeos, entre ellos España, con pacientes de Tenerife, Valencia y Barcelona, el número medio de medicamentos oscila entre 1,3 y 2,9, siendo próximo a dos para los pacientes incluidos por pediatras valencianos.
Los medicamentos usados en pediatría se limitan a pocos grupos terapéuticos, con predominio de los del aparato respiratorio. Un dato novedoso es la presencia de los medicamentos del grupo M debida a la amplia utilización del ibuprofeno como antitérmico, situación que no se daba en otros estudios28,31 por la fecha en que se realizaron, pero que se observa en los posteriores al año 20008,11,12,29 con la excepción del estudio de cohortes británico publicado en 200732. En concordancia con lo observado en un estudio anterior33, el grupo R tiene mayor presencia en los meses de otoño e invierno. La utilización de antibióticos es baja, de alrededor del 10 %, lo que contrasta con otros estudios, aunque el ámbito de recogida de la información puede explicarlo. Resulta llamativo que a pesar de lo extendido del uso de antibióticos en automedicación en nuestro país34, hemos registrado muy pocos casos. Además, la prescripción de este grupo se reduce a cuatro subgrupos del grupo J de la ATC, con claro predominio de la asociación amoxicilina-ácido clavulánico, que en algunos casos, como en la amigdalitis aguda, no está justificado porque aunque esté autorizado no es la mejor alternativa.
La prescripción de medicamentos se realiza mayoritariamente por pediatras y en un pequeño porcentaje por médicos de familia, el consejo farmacéutico en nuestro estudio representa poco más del 1 % de los medicamentos. Sin embargo, la tasa de automedicación es elevada, el hecho de que la fiebre sea el signo más frecuente podría justificar, en parte, este uso. En un estudio27 en consultas de pediatría en Italia, se observó que la mitad de los niños estaban recibiendo al menos un medicamento en el momento de acudir a la consulta que en el 28,4 % se debía a automedicación.
La información sobre las condiciones de uso de los medicamentos en pediatría está condicionada por la falta de ensayos clínicos en este grupo de edad, lo que hace que la información que proporcionan los fabricantes de los medicamentos sea con frecuencia escasa o que no exista13,22. Además, si existe, a veces es difícil de encontrar. En España el V-I es la fuente más utilizada por los médicos para obtener información sobre medicamentos y aunque no es un formulario oficial, buena parte de su contenido tiene el respaldo de la administración sanitaria35. En un trabajo anterior pusimos de manifiesto la ausencia de información pediátrica sobre los fármacos antihipertensivos36. En el presente estudio no hemos encontrado información para más del 25 % de los medicamentos analizados. En 20 casos no aparece la monografía en el V-I vigente ni la ficha técnica en la página web de la AEMPS, aunque sorprendentemente aparece en ediciones anteriores del V-I. Parece lógico que los profesionales busquen la información en la edición más actual o en la versión electrónica, no que recurran a ediciones atrasadas. Todo ello demuestra que obtener información fiable sobre las condiciones de uso de medicamentos en niños en nuestro país puede resultar difícil y la necesidad de que la administración y los fabricantes pongan esa información a disposición de los profesionales sanitarios. A partir de enero de 2007 la AEMPS ha modificado su página web37 y ha incluido el prospecto de muchos de los medicamentos para los que no existe ficha técnica, si bien, advierte de que se trata de un documento informativo no válido a efectos jurídicos.
Un medicamento para el que no se puede obtener información puede considerarse de uso no autorizado14,38. Desde el punto de vista científico, la información podría obtenerse de otras fuentes, pero la situación legal y administrativa no es clara, sobre todo si tenemos en cuenta el contenido de la publicación del Ministerio de Sanidad comentada anteriormente18. Por otra parte, el uso de medicamentos en condiciones diferentes de las autorizadas podría tener consecuencias legales y, de hecho, genera un elevado porcentaje de las denuncias presentadas contra los médicos, e incluso contra la industria farmacéutica en Estados Unidos39.
Hay un aspecto llamativo, que es la existencia de datos no coincidentes entre fichas técnicas de medicamentos con la misma composición. Es el caso del dextrometorfano, en el que en función de la marca se modifican las condiciones de uso, o del ibuprofeno, en el que unas marcas autorizan su uso en niños a partir de los 5kg de peso y otras a partir de los 7kg, a pesar de que sus fichas técnicas están aprobadas en fechas próximas. El BNF for children40, formulario británico para pediatría, aconseja el uso a partir de 7kg. Estas disparidades se deben a que las fichas técnicas se redactan para cada medicamento en lugar de ser comunes para todos los que contienen un mismo principio activo. Lo lógico sería la existencia de una única ficha por principio activo, como ya se hace en Estados Unidos41.
Nuestro estudio tiene limitaciones. Aunque la muestra es representativa de los pacientes que acuden al CHGUV, no podemos afirmar que lo sea de la población general, pero dada la procedencia de la prescripción podría ser un buen reflejo del uso de medicamentos en niños en atención primaria. Por otra parte, al recoger la información por medio de entrevistas con los padres, puede haber inexactitudes en el tratamiento, que aunque probablemente es el real puede no coincidir con el prescrito por los médicos. Los estudios de utilización de medicamentos reflejan la situación en un lugar y un momento preciso, de ahí la dificultad para comparar entre estudios y para extrapolar los resultados de unos a otros. En este sentido es interesante que se estén realizando estudios sobre el conocimiento y las actitudes de los profesionales sanitarios sobre el uso de medicamentos en niños12,42,43.
Los niños deberían recibir sólo medicamentos con una relación beneficio-riesgo favorable, pero para ello es necesario mejorar la información sobre uso pediátrico y promover acciones formativas dirigidas a los padres y a los profesionales sanitarios44–46. Disponer de un formulario que recoja de forma ordenada la evidencia disponible sobre medicamentos en este grupo de edad podría ayudar a resolver el problema. Iniciativas como la traducción, adecuándolo a la realidad española, del BNF for children, como ya se ha hecho en Italia47 y para adultos en España, podría ser muy interesante, pero no podemos olvidar que resulta absolutamente necesario estimular la investigación clínica de los efectos de los medicamentos en niños y que ésta no se limite a los protegidos por patente. La EMEA ha publicado un listado de medicamentos sin patente cuya investigación en niños se considera prioritaria48, pero eso sólo podrá hacerse si las autoridades sanitarias ponen los medios adecuados, tanto en lo que respecta a la financiación como a la formación de investigadores.