El síndrome de Moebius (SM) se caracteriza por la parálisis facial congénita no progresiva y la limitación de la abducción ocular debido a la afectación de los pares craneales séptimo (facial) y sexto (motor ocular externo), respectivamente. Su prevalencia se estima en uno de cada 125.000 nacidos vivos, con igual incidencia en ambos sexos1. Su etiología es desconocida; se ha asociado a factores genéticos y ambientales, como isquemia fetal y uso de fármacos como el misoprostol durante la etapa temprana del embarazo2. Si bien es ampliamente conocido como SM, desde el punto de vista dismorfológico constituye realmente una secuencia ya que una alteración inicial durante el desarrollo embrionario produciría una cascada de eventos secundarios.
El SM puede ser diagnosticado en forma precoz en el periodo neonatal. Son hallazgos característicos la succión deficiente debido al cierre incompleto de los labios, la ausencia de expresión facial, el cierre incompleto de los párpados durante el sueño, el escurrimiento de la saliva y el estrabismo convergente1.
Las alteraciones de la deglución y de la respiración son frecuentes en los neonatos con este síndrome. Aproximadamente el 90% de los pacientes presentan anomalías cráneo-faciales que predisponen a la obstrucción respiratoria en el recién nacido3.
Se revisan de forma retrospectiva 7 neonatos (5 varones) con SM asistidos en el servicio de otorrinolaringología durante el periodo 2006-2018, analizando las características clínicas, los hallazgos endoscópicos y de la videofluoroscopia de la deglución y el tratamiento (tabla 1).
Manifestaciones clínicas, anomalías cráneo-faciales, hallazgos endoscópicos y de la videofluoroscopia de la deglución, y tratamiento de los pacientes con SM
| P1 | P2 | P3 | P4 | P5 | P6 | P7 | |
|---|---|---|---|---|---|---|---|
| Síntomas respiratorios relacionados con la deglucióna | |||||||
| Estridor inspiratorio | Sí | Sí | Sí | Sí | Sí | No | Sí |
| Apneas del sueño | Sí | Sí | Sí | No | No | No | No |
| Dificultad respiratoria | Grave | Grave | Grave | Leve | No | Leve | No |
| Dificultad en la succión | Sí | Sí | Sí | Sí | Sí | Sí | Sí |
| Ahogo y tos con la alimentación | Sí | Sí | Sí | Sí | No | No | Sí |
| Babeo | Sí | Sí | Sí | Sí | Sí | Sí | Sí |
| Anomalías cráneo-faciales | |||||||
| Micrognatia | Sí | Sí | Sí | Sí | Sí | Sí | No |
| Retrognatia | Sí | Sí | Sí | No | No | No | No |
| Alteración del paladar | Fisura palatina | Paladar ojival | Fisura palatina | Fisura submucosa | Paladar ojival | Fisura palatina | No |
| Hallazgos endoscópicosb | |||||||
| Glosoptosis | Grave | Grave | Grave | Moderada | Leve | Leve | No |
| Laringe | Signos de RGE | Signos de RGE | LM Signos de RGE | Signos de RGE | LM | Normal | LM |
| Faringe | Lago faríngeo | Lago faríngeo | Lago faríngeo | Faringe pequeña | Normal | Normal | Normal |
| Hallazgos en la videofluoroscopiac | |||||||
| Reflujo faringo nasal | Sí | Sí | Sí | Sí | Sí | Sí | Sí |
| Derrame posterior | Sí | Sí | Sí | Sí | Sí | Sí | Sí |
| Residuos | Sí | Sí | Sí | Sí | Sí | Sí | Sí |
| Penetración | Sí | Sí | Sí | Sí | Sí | Sí | Sí |
| Aspiración | Sí | Sí | Sí | No | No | No | No |
| Reflujo gastroesofágico | Sí | Sí | Sí | Sí | Sí | Sí | Sí |
| Tratamiento | |||||||
| Traqueotomía | Sí | Sí | Sí | No | No | No | No |
| Alimentación espesada | No | No | No | Sí | Sí | Sí | Sí |
| Gastrostomía | Sí | Sí | Sí | No | No | No | No |
| Funduplicatura de Nissen | Sí | No | Sí | No | No | No | No |
LM: laringomalacia; P: paciente; Signos de RGE: signos indirectos de reflujo gastroesofágico (edema y eritema de aritenoides, y congestión de mucosa de la pared faríngea posterior); SM: síndrome de Moebius.
Todos presentaban estrabismo y parálisis facial bilateral (fig. 1). Tres pacientes (42,9%) tenían el antecedente materno de uso de abortivo (misoprostol) durante el primer trimestre del embarazo. Un paciente presentaba asociación con la anomalía de Poland (hipoplasia del músculo pectoral mayor) y 2 pacientes, con la secuencia de Pierre-Robin (retrognatia, fisura palatina y glosoptosis).
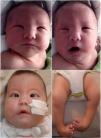
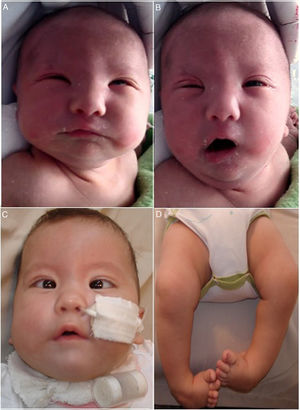
A y B) Recién nacido con parálisis facial bilateral en reposo (A) y durante el llanto (B): A) Se observa cierre incompleto de la comisura palpebral (lagoftalmos). B) La asimetría facial es evidente durante el llanto. Se observa la «cara en máscara» con conservación parcial de la musculatura facial inferior derecha (desviación de la comisura bucal homolateral). C) Mismo paciente de A y B a los 3 meses de vida, con sonda nasogástrica y cánula de traqueotomía. Se evidencia el estrabismo convergente y la implantación baja del pabellón auricular. D) Pie equino varo bilateral.
Se observó micrognatia, alteraciones del paladar y glosoptosis en 6 casos (85,7%) y retrognatia en 3 casos (42,9%). Los 3 pacientes con dificultad respiratoria grave fueron intubados utilizando un laringoscopio de comisura anterior (Holinger) por un médico otorrinolaringólogo entrenado en el manejo de vía aérea difícil pediátrica, y posteriormente se realizó la traqueotomía.
La videofluoroscopia de la deglución evidenció en todos los pacientes penetración laríngea, y en 3 casos (42,9%), aspiración a vía aérea inferior. En los 7 pacientes se colocó sonda nasogástrica en los primeros días de vida. Todos recibieron tratamiento antirreflujo y realizaron rehabilitación temprana de la deglución.
Otros hallazgos fueron: compromiso de otros pares craneales (n: 4), hipotonía (n: 6), pie equino varo (n: 7), cardiopatía (n: 2), malformaciones torácicas y de oído externo (n: 4).
El tiempo medio de seguimiento fue de 6 años. Dos pacientes permanecen con cánula de traqueotomía y gastrostomía, y presentan retraso del lenguaje, autismo y conductas autolesivas (P1 y P3). El otro paciente (P2) fue decanulado a los 3 años de edad. Actualmente se alimenta por vía oral con todas las consistencias y tiene un buen desempeño cognitivo, al igual que los restantes casos.
El SM es clínicamente heterogéneo. El diagnóstico diferencial debe realizarse con diversas enfermedades que producen parálisis facial: traumatismo neonatal (uso de fórceps), parálisis facial congénita hereditaria, distrofia miotónica, enfermedades infecciosas (otitis, herpes zóster), neoplasias y síndrome de Guillain-Barré, entre otras.
Al igual que en otras series encontramos una fuerte asociación entre el intento de aborto con misoprostol y el subsecuente nacimiento de un individuo con SM2.
Es fundamental la rehabilitación temprana de la deglución. La combinación de rehabilitación motora y la modificación de la alimentación permiten mejorar la deglución. En la mayoría de los casos la capacidad de alimentación mejora con el crecimiento. Cuando no es posible la alimentación oral segura y eficaz, debe indicarse la gastrostomía.
La retromicrognatia puede provocar el desplazamiento posterior de la lengua hacia la faringe (glosoptosis) ocasionando la obstrucción respiratoria. La mayoría de los pacientes responden al tratamiento postural, aunque en ocasiones extremas hay que realizar una traqueotomía. La distracción mandibular es en la actualidad el tratamiento de elección, permite evitar la traqueotomía y otros procedimientos menos efectivos como la glosopexia.
Muchos niños con SM requieren intervenciones quirúrgicas, por ejemplo, cirugía reconstructiva facial y/o corrección de estrabismo. El riesgo anestésico es elevado4.
La apertura bucal limitada, la retromicrognatia, la glosoptosis y el paladar hendido son hallazgos frecuentes en los pacientes con SM, y se asocian a falla o dificultad en la intubación. En estos pacientes debe considerarse la ventilación espontánea y evitar el uso de relajantes musculares. La máscara facial y la cánula de Guedel pueden ser de utilidad. La máscara laríngea y el fibrobroncoscopio son métodos alternativos que deben estar disponibles4–6.
El cuidado de los niños con SM requiere un equipo multidisciplinario. La rehabilitación temprana es esencial para optimizar la recuperación de las distintas funciones alteradas y mejorar el pronóstico y la calidad de vida de estos niños.