La lesión hepática inducida por fármacos debida a quimioterapia es una causa importante de morbilidad en enfermos oncológicos aunque sus manifestaciones clínicas son poco conocidas.
ObjetivoEl objetivo del presente estudio fue determinar las características (formas de presentación, gravedad y tipo de lesión) de la hepatotoxicidad por quimioterapia en niños tratados por cáncer.
Pacientes y métodoSe incluyó en el estudio a un total de 22 enfermos oncológico en los que, tras descartar otras causas de aumento de transaminasas (infecciosa, metabólica, autoinmune o hereditaria), se concluye, según la escala de causalidad CIOMS, que se trata de un episodio posible, probable o definido de lesión hepática por fármacos.
ResultadosTodos los niños tuvieron más de un episodio de hepatotoxicidad, en total se analizan 98 episodios. Metotrexato fue el fármaco implicado con mayor frecuencia. El patrón histológico de daño predominante fue hepatocelular. Solo 2episodios fueron clasificados de graves.
ConclusionesLa hepatotoxicidad idiosincrásica por quimioterapia es frecuente, la tendencia es a la recidiva con la reexposición y, aunque no suele tener consecuencias importantes, la elevada frecuencia hace aconsejable establecer algoritmos de seguridad estandarizados con controles muy estrictos de enzimas hepáticas durante los períodos de alto riesgo de quimioterapia.
Drug-induced liver injury due to chemotherapy is an important cause of morbidity in cancer patients, although its clinical manifestations are poorly understood.
ObjectiveThe objective of the present study was to determine the characteristics (forms of presentation, severity, and type of injury) of hepatotoxicity due to chemotherapy in children treated for cancer.
Patients and methodA total of 22 oncological patients were included in the study, after ruling out other causes of increased transaminases (infectious, metabolic, autoimmune, or hereditary), according to the CIOMS causality scale, it is concluded that it was a possible, probable or definite episode of hepatic injury by drugs.
ResultsAll children had more than one episode of hepatotoxicity, and a total of 98 episodes are analysed. Methotrexate was the most commonly implicated drug. The histological pattern of predominant damage was hepatocellular. Only 2episodes were classified as serious.
ConclusionsIdiosyncratic hepatotoxicity due to chemotherapy is frequent, with a tendency to relapse with re-exposure. Although it does not usually have important consequences, the high frequency makes it advisable to establish standardised safety algorithms with very strict monitoring of liver enzymes during high periods of risk in chemotherapy.
La lesión hepática inducida por fármacos (DILI) debida a quimioterapia es una causa importante de morbilidad en enfermos oncológicos. La mayoría de los casos de hepatotoxicidad inducida por la quimioterapia son idiosincrásicos y no tienen una firma clínica o histológica única que sea distinta de otros agentes que causan DILI1. Los principales mecanismos subyacentes a la hepatotoxicidad relacionada con la quimioterapia se basan en la producción de metabolitos reactivos generados por reacciones de oxidación en fase i, daño inmunológico o alteraciones en la función mitocondrial. La hepatopatía subyacente y la afectación hepática por el propio tumor pueden ser modificadores importantes de la lesión hepática1.
Debido a que los beneficios (remisión del cáncer) son altos, también lo son los riesgos que el oncólogo y el paciente deben estar dispuestos a asumir.
En cualquier caso, el daño relacionado con los fármacos utilizados para el cáncer todavía se evalúa mal debido a la subestimación clínica relativa y al difícil diagnóstico diferencial2.
La leucemia linfoblástica aguda (LLA) es una enfermedad maligna que representa el 25% de todas las neoplasias malignas en los niños3,4. Aproximadamente, el 80% de todos los pacientes afectados se pueden curar, pero la resistencia a la terapia y sus efectos tóxicos siguen siendo problemas clínicos graves4,5. Como resultado, el foco de la investigación está cambiando lentamente de tratar de aumentar las tasas de supervivencia a reducir las toxicidades relacionadas con la quimioterapia6. En la actualidad, la columna vertebral de la terapia de mantenimiento para LLA consiste en 6-mercaptopurina oral y metotrexato semanal3. A pesar de sus grandes beneficios, estos medicamentos están asociados a altos grados de hepatotoxicidad y mielosupresión, que a menudo limitan su uso7. De hecho, la toxicidad de la quimioterapia es una causa común de morbimortalidad en niños con LLA, así como una fuente frecuente de secuelas a medio y largo plazo. Estos efectos adversos a menudo son consecuencia de la toxicidad directa en el tejido sano, como resultado de la baja especificidad mostrada por estos medicamentos y se vuelven más frecuentes a medida que se intensifica el tratamiento.
En este escenario, es obvio que cualquier factor capaz de modificar la farmacocinética o la farmacodinamia de los fármacos de quimioterapia tiene el potencial de ser crítico para la aparición de efectos adversos graves en los pacientes con LLA.
El objetivo del presente estudio fue determinar las características (formas de presentación, gravedad y tipo de lesión) de la hepatotoxicidad por quimioterapia en niños tratados por cáncer.
Pacientes y protocolo de estudioLos niños incluidos en el presente estudio pertenecen al registro español de hepatopatías tóxicas en la población pediátrica. Se trata de un registro que comenzó a funcionar en Granada en el año 2008. A través de 3proyectos financiados se han recogido 193 sospechas de hepatopatías tóxicas en niños. Este registro pretende realizar una vigilancia prospectiva de las hepatopatías asociadas a medicamentos y productos de herboristería en la población pediátrica mediante la creación de una red multicéntrica y multidisciplinaria para el estudio de la DILI en pediatría.
Una descripción detallada de la estructura operativa del registro, el registro de datos y la determinación de casos ha sido descrita en otra publicación8.
Los criterios para DILI en el momento de las inclusiones de los niños en el estudio incluyen9 una relación cronológica entre la ingesta de medicamentos y el inicio de la hepatitis, así como la presencia de cualquiera de las siguientes condiciones: un nivel de alanina aminotransferasa (ALT) de más de 5veces superior al límite superior de la normalidad (LSN); un nivel de fosfatasa alcalina (ALP) de más de 2veces por encima del LSN, o un nivel de ALT de más de 3veces superior al LSN, con la elevación simultánea de los niveles de bilirrubina a más de 2veces por encima del LSN. El patrón de lesión hepática se puede evaluar por el valor R, donde R=(ALT/ULN) / (ALP/ULN), con R ≥ 5, que refleja un patrón hepatocelular, 2<R<5, que refleja un patrón mixto, y R ≤ 2, que refleja un patrón colestásico de lesión hepática.
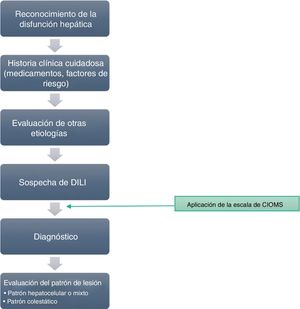
Si se detecta una de las anteriores señales de alarma, los casos son notificados mediante un protocolo estructurado que descarta posibles causas alternativas. En todos los pacientes se obtiene una historia clínica detallada en lo que respecta a antecedentes de enfermedad biliar o hepática, así como información sobre factores de riesgo asociados a enfermedad hepática. Los marcadores serológicos de hepatitis aguda viral se determinan en todos los pacientes previamente al diagnóstico de hepatotoxicidad así como la ceruloplasmina sérica y una batería de autoanticuerpos relacionados con enfermedades hepáticas de origen autoinmune. El protocolo de trabajo se presenta en la figura 1.
Descartadas enfermedades infecciosas, metabólicas, autoinmunes y hereditarias, se han incluido aquellos casos que cumplían los criterios clínicos y, además, cuya evaluación de causalidad al fármaco haya sido estimada como posible, probable o definida por la escala de CIOMS/RUCAM9-11, que evalúa los criterios cronológicos, el curso de la enfermedad, los factores de riesgo, la información disponible sobre hepatotoxicidad del medicamento, la exclusión de otras causas y la respuesta a la readministración del medicamento (tabla 1).
Escala de CIOMS/RUCAM
| Tipo hepatocelular | Tipo colestásico o mixto | Evaluación | |
|---|---|---|---|
| Tiempo desde inicio | |||
| Incompatible | La reacción ocurre antes de la ingesta del fármaco, o más de 10 días después de finalizar (excepto para fármacos de metabolismo lento) | La reacción ocurre antes de la ingesta del fármaco, o más de 30 días después de finalizar (excepto para fármacos de metabolismo lento) | Sin relación |
| Desconocido | Cuando la información no está disponible para calcular el tiempo desde el inicio | Insuficiente documentación | |
| Tratamiento inicial | Tratamiento subsiguiente | Tratamiento inicial | Tratamiento subsiguiente | Puntuación | |
|---|---|---|---|---|---|
| Con inicio del tratamiento | |||||
| Sugestivo | 5-90 días | 1-15 días | 5-90 días | 1-90 días | +2 |
| Compatible | <5 días o> 90 días | > 25 días | <5 días o> 90 días | > 90 días | +1 |
| Con final del tratamiento | |||||
| Compatible | <15 días | <15 días | <30 días | <30 días | +1 |
| Evolución | Diferencia entre el pico de ALT (SGOT) y el límite superior de valores normales | Diferencia entre el pico de FA (o TB) y el límite superior de valores normales | |
|---|---|---|---|
| Después de cesar la ingesta | |||
| Altamente sugestivo | Disminución> 50% en 8 días | No aplicable | +3 |
| Sugestivo | Disminución> 50% en 30 días | Disminución> 50% en 180 días | +2 |
| Compatible | No aplicable | Disminución <50% en 180 días | +1 |
| Inconcluso | No información o disminución> 50% después del día 30 | Persistencia o aumento o no información | 0 |
| En contra tipología del fármaco | Disminución <50% después del día 30 o incremento recurrente | No situación. No aplicable | –2 |
| Si lo continúa tomando | |||
| Inconclusivo | En todas las situaciones | En todas las situaciones | 0 |
| Factores de riesgo | Etanol | Etanol o embarazo | |
|---|---|---|---|
| Presencia | +1 | ||
| Ausencia | 0 | ||
| Edad> 50 años | +1 | ||
| Edad <50 años | 0 |
| Tratamiento concomitante | |
|---|---|
| • No o no información o tratamiento concomitante con incompatibilidad desde el inicio del tratamiento | 0 |
| • Tratamiento concomitante compatible o sugestiva desde el inicio del tratamiento | –1 |
| • Tratamiento concomitante conocido como hepatotóxico y con compatibilidad o indicativo con el inicio del tratamiento | –2 |
| • Tratamiento concomitante con evidencia para este efecto (positivo «rechalenge» o test validado) | – 3 |
| Búsqueda de causas no relacionadas con fármacos | ||
|---|---|---|
| Grupo I (6 causas) | Todas las causas (grupos ii y ii) razonablemente descartadas | +2 |
| Reciente infección viral con VHA (IgM anti-VHA) o VHB (IgM anti-VHB) o VHC (anti-VHC y test no A no B), obstrucción biliar (ultrasonografía), alcoholismo (AST/ALT> 2), historia reciente de hipotensión aguda (particularmente si hay enfermedad cardíaca) | Las 6 causas del grupo i razonablemente descartadas | +1 |
| Grupo II | 4 o 5 causas del grupo i razonablemente descartadas. | 0 |
| Complicaciones de enfermedad subyacente: clínica o biológico | Menos de 4 causas del grupo i razonablemente descartadas | –2 |
| Contexto sugerente de infección por CMV, VEB o herpes virus | Causas no farmacológicas altamente probable | –3 |
| Información previa de hepatotoxicidad del fármaco | |
|---|---|
| • Reacción identificada en la ficha técnica del producto | +2 |
| • Reacción publicada pero no identificada en la ficha técnica | +1 |
| • Reacción desconocida | 0 |
| Respuesta a la administración | |||
|---|---|---|---|
| • Positiva | Duplica ALT con el fármaco a solas | Duplica FA (o TB) con el fármaco a solas. | +3 |
| • Compatible | Duplica ALT con los fármacos juntos dados al mismo tiempo en la primera introducción | Duplica FA (o TB) con los fármacos juntos dados al mismo tiempo en la primera introducción | +1 |
| • Negativa | Incremento de ALT pero menor que en las mismas condiciones para la primera administración | Incremento de FA (o TB) pero menor que en las mismas condiciones para la primera administración | –2 |
| • No dada o no interpretable | Otras situaciones | Otras situaciones | 0 |
El presente estudio se ha llevado a cabo de acuerdo con la última versión de la Declaración de Helsinki. El proyecto cuenta con la aprobación del Comité de Ética provincial. En todos los casos se firmó, por parte de los padres o tutores, el consentimiento informado para la inclusión del enfermo en el estudio.
ResultadosSe incluyó en el estudio a un total de 22 enfermos, 14 fueron hombres y 8 mujeres. La edad media fue de 5,45 años, con un rango de 1 a 13 años. En la tabla 2 se presentan las principales característica epidemiológica y analíticas de los pacientes.
Características epidemiológicas y analíticas de los enfermos
| Caso | Sexo | Edad | Enfermedad de base | N.° episodios | Fases tratamiento | Citostático | Dosis acumulada(unidades para Peg-asp, mg resto de fármacos) | ALT media, U/l | Gravedad | International normalized ratio |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Varón | 5 | LLA | 5 | Consolidación, mantenimiento | MTX | 12.935 | 331 | No grave | Normal |
| 2 | Varón | 4 | LLA | 3 | Consolidación, mantenimiento | MTX | 9.680 | 758,3 | 1 grave, 3 no graves | 1,8 |
| 3 | Varón | 3 | LLA | 2 | Mantenimiento | 6-MP | 2.790 | 347 | No grave | Normal |
| 4 | Varón | 5 | LLA | 3 | Mantenimiento | MTX+6-MP | 19.100+14.332 | 324,7 | No grave | Normal |
| 5 | Mujer | 3 | LLA | 4 | Inducción, mantenimiento | 6-MP | 4.120 | 353,5 | No grave | Normal |
| 6 | Mujer | 4 | LLA | 4 | Consolidación, mantenimiento | MTX+6-MP | 7.801+3.612 | 581,7 | No grave | Normal |
| 7 | Varón | 7 | LLA | 10 | Bloques AR, mantenimiento | Peg-asp, tioguanina, 6-MP | 7801.583,4,10.695 | 523,3 | No grave | Normal |
| 8 | Mujer | 5 | LLA | 3 | Mantenimiento | MTX+6-MP | 15.700+11.100 | 732,3 | No grave | Normal |
| 9 | Varón | 4 | LLA | 2 | Mantenimiento | MTX+6-MP | 13.361+7812 | 447,5 | No grave | Normal |
| 10 | Mujer | 5 | LLA | 4 | Inducción, reinducción, mantenimiento | 6-MP | 2.420 | 442,25 | No grave | Normal |
| 11 | Varón | 1 | LLA | 3 | Mantenimiento | MTX+6-MP | 11.100+8.940 | 340 | No grave | Normal |
| 12 | Varón | 5 | LLA | 5 | Consolidación, intensificación, mantenimiento | MTX | 13.470 | 597,6 | No grave | Normal |
| 13 | Mujer | 3 | LLA | 6 | Inducción, mantenimiento | 6-MP | 5.100 | 829,3 | No grave | Normal |
| 14 | Mujer | 12 | LLA | 4 | Inducción, intensificación, mantenimiento | MTX | 24.860 | 333,25 | No grave | Normal |
| 15 | Varón | 5 | LLA | 7 | Inducción, intensificación, mantenimiento | ASPMTX+6-MP | 83.200, 8.471+18.085 | 353,7 | No grave | Normal |
| 16 | Mujer | 9 | LLA | 5 | Reinducción, mantenimiento | Tioguanina, MTX | 462,22.344 | 392,8 | No grave | Normal |
| 17 | Varón | 6 | LLA | 4 | Consolidación, intensificación, mantenimiento | MTX+6-MP | 11.370+3641 | 491,25 | 1 grave, 3 no graves | 1,7 |
| 18 | Varón | 5 | LLA | 6 | Inducción, mantenimiento | 6-MP | 13.512 | 617,8 | No grave | Normal |
| 19 | Varón | 3 | Linfoma linfoblástico | 7 | Mantenimiento | MTX+6-MP | 13.200+12948 | 282,7 | No grave | Normal |
| 20 | Varón | 5 | LLA | 4 | Inducción, mantenimiento | 6-MP | 6.123 | 354 | No grave | Normal |
| 21 | Varón | 13 | Linfoma linfoblástico | 4 | Reinducción, mantenimiento | Tioguanina, MTX+6-MP | 1.344, 34.578+16.454 | 426,5 | No grave | Normal |
| 22 | Varón | 8 | Histiocitosis | 3 | Mantenimiento | MTX+6-MP | 281+4752 | 436,3 | No grave | Normal |
ASP: asparaginasa; LLA: leucemia linfoblástica aguda; 6-MP: 6-mercaptopurina; MTX: metotrexato; Peg-asp: asparaginasa pegilada.
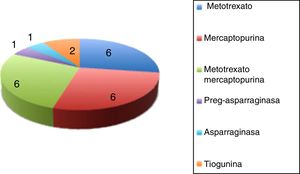
Todos los niños tuvieron más de un episodio de DILI. En total, se analizan 98 episodios de hepatotoxicidad. Metotrexato fue el fármaco más implicado en los episodios de DILI, hasta en 94 de los 98 episodios intervino como fármaco implicado, de manera aislada en 62 (63,3%) de los episodios y combinado con mercaptopurina en 32 (32,6%). La dosis media acumulada de metotrexato en el momento de aparecer la DILI fue de 11.086,2mg (70-34.578mg).
La mayoría de los niños (19 de ellos, que representan un 86,4%) estaban en tratamiento por LLA, 2 pacientes (9%) presentaban un linfoma y un paciente (4,5%) estaba tratado de una histiocitosis.
El protocolo de tratamiento fue SHOP 2005 en 9 de los niños en tratamiento por LLA (47,3% de los niños con LLA) y SEHOP-Pethema 2014 en 10 de los pacientes con LLA (52,63%). El protocolo de tratamiento en los enfermos tratados por linfoma fue Euro-LB02.
En la figura 2 se representa el fármaco o combinación de fármacos que desencadenó DILI.
En cuanto al momento del tratamiento en el que aparece el primer episodio de DILI, en 6enfermos fue en inducción, en 6enfermos fue en consolidación, en 7 niños en mantenimiento, en 2enfermos en reinducción iib y en un paciente en bloque AR-2.
El patrón de lesión predominante, basado en el valor R calculado a partir del primer análisis de muestra de sangre después del reconocimiento DILI, fue hepatocelular (n=90), seguido de mixto (n=8); no hubo ningún episodio colestásico.
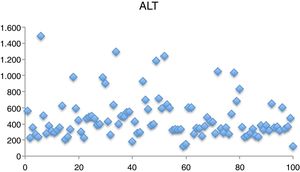
Los valores medios de AST fueron de 208,72 U/l (43-929), los de ALT 471,8 U/l (123-1.488) (fig. 3), ALP 240,72 U/l (63-402), gammaglutamil transpeptidasa 54,75 U/l (10-220) y bilirrubina 1,04mg/dl (0,3-3,47).
Cuando se evaluó la causalidad según la escala de CIOMS12, se encontró un diagnóstico de probabilidad como posible en un caso (4,5%), probable en 4 casos (18,2%) y muy probable o definida en 17 de los casos (77,3%)9.
En cuanto a la gravedad, solo 2 de los episodios presentaron coagulopatía y, por tanto, fueron calificados de graves13.
Se realizó ecografía en 18 pacientes, 3presentaron patrón de esteatosis, 2pacientes mostraron hepatomegalia y el resto de las ecografías no mostró hallazgos patológicos.
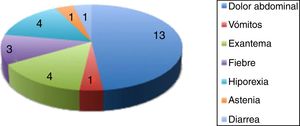
La clínica acompañante al aumento de enzimas hepáticas se muestra en la figura 4.
Con respecto a la actitud en el tratamiento que determinó el episodio de DILI, se decidió reducir la dosis y continuar el tratamiento en 42 de los episodios de hepatotoxicidad (42,8%) y en 46 (46,9%) ocasiones se decidió suspensión temporal del tratamiento con reducción de la dosis en el siguiente ciclo con el mismo fármaco. En 7 ocasiones (7,1%) se optó por suspensión temporal del tratamiento con retraso del siguiente ciclo que se realizó con una dosis reducida. Se decidió la interrupción total del tratamiento en un caso. En 3 episodios se mantuvo una actitud expectante y no se modificaron las dosis de tratamiento ni la secuencia del mismo.
DiscusiónPese a que la hepatotoxicidad por fármacos utilizados en el tratamiento del cáncer es bien conocida, no existen trabajos en la literatura que hayan analizado los episodios de DILI en niños oncológicos de forma estandarizada como se ha realizado en el presente trabajo.
La selección de un régimen antineoplásico para un paciente de oncología se basa primero en la disponibilidad de medicamentos efectivos y, luego, en un equilibrio de las posibles toxicidades relacionadas con el tratamiento, con la condición clínica del paciente y las comorbilidades asociadas12. Aunque la hipertransaminasemia se observan comúnmente en esta población de pacientes, la identificación de su etiología es a menudo difícil. La inmunosupresión, los fenómenos paraneoplásicos, las enfermedades infecciosas, las metástasis y la polifarmacia pueden ensombrecer la situación. Son necesarios protocolos estandarizados, como se ha realizado en este trabajo, para conocer mejor la toxicidad hepática de la quimioterapia.
Las 2categorías principales de DILI son intrínsecas/dependientes de la dosis e idiosincrásicas/independientes de la dosis. La primera se refiere a fármacos que son capaces de causar daño hepático de manera predecible en humanos o en modelos animales cuando se administran en dosis suficientemente altas. El hecho de que la elevación de transaminasas se haya repetido en el 100% de los enfermos estudiados, a pesar de que en el 95,9% se redujo la dosis, induce a pensar que los episodios de hepatotoxicidad por quimioterapia son idiosincrásicos y, por tanto, independientes de las dosis.
Como el diagnóstico de DILI sigue siendo de exclusión, se trata de uno de los trastornos más difíciles que deben ser manejados por oncólogos pediátricos. Los mecanismos multifactoriales parecen ser la base de la DILI14. Los factores de riesgo relacionados con el fármaco desempeñan un factor importante; metotrexato fue el medicamento implicado en el 95,9% de los episodios de hepatotoxicidad observados en el presente estudio. De los factores de riesgo relacionados con el huésped, los episodios previos de DILI fueron los más importantes en nuestra población, pues, en todos los casos, se produjeron nuevos episodios al reintroducir el fármaco. Otros factores de tipo ambiental han sido relacionados también con la hepatotoxicidad en oncología: características metabólicas del paciente (p. ej., obesidad), el tipo de dieta, el consumo de alcohol, café y tabaco, la terapia multimedicamentosa, el estado inmunológico y el estado nutricional14-16. El presente estudio no puede poner de manifiesto estos factores ambientales por el bajo número de pacientes que integran la muestra. Son necesarios estudios multicéntricos amplios para determinar la importancia de los factores ambientales.
Después de un desafío positivo, los pacientes que reciben beneficios de un medicamento muy crítico para su enfermedad, o incluso para su vida como ocurre en los pacientes oncológicos, sin duda pueden ser considerados para la reexposición a fármacos17, como ocurrió con los pacientes analizados. Estudios clínicos prospectivos recientes, que examinan cientos de eventos de reintroducción, actualmente definen una nueva exposición positiva al fármaco como un nivel de ALT de 3-5 × LSN o mayor, que generalmente ocurre mucho más rápidamente que la DILI inicial12,14,15. La reexposición a fármacos puede ser apropiada para medicamentos críticos, cuando no hay alternativas más seguras disponibles y el beneficio objetivo del paciente excede su riesgo16.
Desde una perspectiva nosográfica, existe una propensión a tratar de distinguir los diversos patrones de daño hepático y asociar fármacos específicos con cada patrón. Sin embargo, no siempre es posible hacer tales asociaciones. El patrón clínico de hepatotoxicidad puede variar según la interacción entre los factores del fármaco (dosis, biodisponibilidad y duración del tratamiento) y los factores del huésped (edad, sexo y absorción del fármaco)18. El presente estudio no pudo poner de manifiesto diferencias entre el patrón de DILI y los distintos fármacos, puesto que metotrexato intervino en la mayoría de los episodios (95,9%) de hepatotoxicidad, bien de forma aislada (63,3%) o asociado con mercaptopurina (32,6%). Además, el 91,8% de las reacciones fueron de tipo hepatotóxico. El patrón mixto fue raro (8,2%), sin haber detectado ninguna reacción de tipo colestásico.
Se han utilizado los marcadores tradicionales de daño hepático (ALT, ALP y bilirrubina); no obstante, hay que señalar que, en niños con cáncer, los patrones de daño hepático pueden estar determinados por las condiciones patológicas y eventos subyacentes descritos en la literatura tales como apoptosis, necrosis y necroptosis, inflamación, estrés oxidativo y activación del sistema inmunitario18. Son necesarios nuevos biomarcadores de DILI para la detección temprana de hepatotoxicidad, que, además, ayuden al diagnóstico más adecuado en las circunstancias que están presentes en enfermos oncológicos.
Recientemente, se ha publicado que la esteatosis hepática previa puede afectar a la susceptibilidad y los patrones de DILI19. No se conoce la importancia que pueda tener este hecho en la población pediátrica en la que la esteatosis hepática constituye la primera causa de hipertransaminasemia.
El diagnóstico de DILI se basa en el diagnóstico diferencial de exclusión de otras etiologías plausibles. En pacientes con cáncer tratados mediante tratamiento con terapias anticancerosas, la identificación de DILI grave es especialmente desafiante, debido a las complejidades de la polifarmacia anticancerosa y a que los mecanismos por los cuales las terapias anticancerígenas pueden causar daño hepático en individuos susceptibles no son todavía completamente conocidos20-22. Este hecho condicionó que no hayan podido ser incluidos en el registro otros niños oncológicos con aumento de transaminasas pero sin que la escala de CIOMS los clasificara como posible DILI al perder peso la probabilidad por la enfermedad subyacente y los rigurosos criterios de selección.
A pesar de que se han establecido los criterios para estandarizar la lesión hepática, las modificaciones de la dosis a menudo se basan en el juicio clínico empírico. Por lo tanto, es esencial una comprensión exhaustiva de las manifestaciones hepatotóxicas de los agentes quimioterapéuticos más comunes20. En el presente estudio, el clínico encargado de tratamiento decidió, en la mayoría de los casos (95,9%), la reducción de la dosis del fármaco, bien continuando la cadencia de tratamiento o retrasando la pauta siguiente. En el momento actual, no existen pautas establecidas para la decisión de la medida terapéutica más correcta ante la aparición de un episodio de DILI. Los oncólogos que intervinieron en el tratamiento de los niños del presente trabajo decidieron conductas terapéuticas distintas ante la hipertransaminasemia detectada (conducta expectante, mantener dosis y retrasar el ciclo posterior, disminución de dosis o retraso del ciclo posterior, fundamentalmente); no existió, pues criterio estandarizado.
La tasa de reintroducción positiva del 100% hace recomendar una reintroducción controlada y prudente de fármacos que han producido un primer episodio de DILI. Dos de los episodios de hepatotoxicidad han sido clasificados como graves, por lo que es necesario establecer algoritmos de seguridad estandarizados con controles muy estrictos de enzimas hepáticas durante los períodos de alto riesgo. No consideramos la posibilidad de interrupción definitiva del fármaco que ha provocado un episodio de DILI por tratarse de medicamentos críticos, sin que existan alternativas seguras disponibles, de manera que el beneficio objetivo del paciente excede su riesgo.
FinanciaciónEl presente estudio ha sido financiado por el Instituto de Salud Carlos III y cofinanciado por el Fondo Europeo de Desarrollo Regional (FEDER) (números de contrato: PI12 / 00378, SAS-PI-0239/2012, AC-0073-2013). CIBEREHD es financiado por el Instituto de Salud Carlos III. Las fuentes de financiamiento no tuvieron participación en el diseño del estudio; en la recopilación, análisis e interpretación de datos; en la redacción del informe o en la decisión de enviar el manuscrito para su publicación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.