El manejo de la bronquiolitis aguda (BA) es controvertido. Con frecuencia se emplean en ella procedimientos diagnósticos y terapéuticos no sustentados en evidencia científica. El objetivo de este estudio multicéntrico nacional en España es conocer la variabilidad y la idoneidad del manejo de la BA en atención primaria.
MétodosSe realizó un estudio transversal descriptivo (de octubre del 2007 a marzo del 2008) de todos los casos de BA (criterios de McConnochie) tratados en una muestra de 60 centros de salud pertenecientes a 11 comunidades autónomas de España, que no precisaron ingreso. Se realizó una comparación por comunidades autónomas.
ResultadosSe recogieron 940 casos. Encontramos un uso restringido de pruebas diagnósticas, aunque con diferencias significativas entre comunidades. Se constata un amplio uso de beta-2-adrenérgicos inhalados (63,2%) u orales (17,4%), y en menor grado de corticoides orales (24,6%) y otros tratamientos de eficacia no aclarada (antibióticos, corticoides inhalados, bromuro de ipratropio, etc.), observando una variabilidad significativa entre comunidades. En la fase aguda hay un uso inadecuado de tratamientos en el 74,8% y en la fase de mantenimiento en el 47,4%.
ConclusionesHay discrepancias entre la práctica clínica habitual y el manejo basado en la evidencia de las BA ambulatorias, empleándose de forma mayoritaria tratamientos considerados inadecuados. La variabilidad en la indicación de broncodilatadores o corticoides entre comunidades ilustra acerca de la falta de fundamento y el margen de mejora.
The management of acute bronchiolitis (AB) is controversial. The aim of this multicenter nationwide study in Spain is to determine the variability in the management of AB in Primary Care centers.
MethodsA cross-sectional observational study (from October 2007 to March 2008) was conducted on all cases of AB (McConnochie criteria) seen in a sample of 60 Health Care Centers from 11 regions of Spain, who did not require hospital admission. A comparison between autonomous communities was made.
ResultsA total of 940 cases were collected. It was found that there was a low use of diagnostic tests, although with significant differences between communities. There was an excessive use of inhaled (64.1%) or oral (17.8%) beta 2-adrenergics, and to a lesser degree of corticosteroids (25%) and other treatments of unclear efficacy (antibiotics, bronchodilators, oral, inhaled corticosteroids, ipratropium bromide, etc...). The treatment methods in the different communities varied significantly. In the acute phase there was an inappropriate use of treatments in 74.8% of cases, and in 47.4% in the maintenance phase.
ConclusionsThere are discrepancies between routine practice and evidence-based management of outpatient AB, due to a wide use of inappropriate treatments. The variability in the prescription of bronchodilators or steroids between communities shows the lack of justification and there is scope for improvement.
La bronquiolitis aguda (BA) es la principal causa de ingreso por infección respiratoria aguda de vías bajas en el niño menor de 2 años y tiene gran repercusión en todos los niveles asistenciales. Aunque la mayor parte de la evidencia disponible procede de estudios realizados en el medio hospitalario, la mayoría de los casos de BA son leves y pueden ser manejados ambulatoriamente. Las pruebas diagnósticas y los tratamientos que se indican en la práctica clínica varían enormemente entre áreas y sistemas sanitarios1,2, sin que dicha variabilidad se corresponda con diferencias en la gravedad de los pacientes o con las recomendaciones de guías de práctica clínica vigentes en dichas áreas3-6.
En la BA no se requiere habitualmente el empleo de pruebas complementarias7. Tan solo ocasionalmente necesitaremos recurrir a ellas para descartar diagnósticos alternativos, clasificar la gravedad del compromiso respiratorio o indicar algún procedimiento diagnóstico o terapéutico suplementario. Asimismo, solo un pequeño porcentaje de pacientes requiere ingreso hospitalario8, que suele estar motivado por la necesidad de recibir cuidados como la administración de oxígeno suplementario, la aspiración de secreciones o la alimentación enteral. Pese a la existencia de múltiples ensayos clínicos en los últimos 25 años sobre las potenciales intervenciones farmacológicas en la BA9,10 (principalmente broncodilatadores, antiinflamatorios y antivíricos), existe un escaso avance en el manejo de los casos de BA, con estudios reiterados (ocasionalmente contradictorios) y con escasas novedades (heliox, suero salino hipertónico, etc.). En BA se mantiene la cuestión de definir el medicamento correcto para el paciente adecuado, en la dosis apropiada y en el tiempo oportuno11.
En un estudio más amplio sobre el manejo de la BA en España12, hemos tenido la oportunidad de recoger una amplia muestra de pacientes atendidos en atención primaria, en los que se ha analizado la variabilidad en el empleo de procedimientos diagnósticos y terapéuticos. Dichos procedimientos han sido contrastados con una serie de criterios de adecuación, basados en las recomendaciones de una conferencia de consenso13. En este trabajo describimos el patrón clínico de las BA atendidas ambulatoriamente en nuestro país y un análisis comparativo de la idoneidad entre las distintas áreas geográficas.
Material y métodosDiseño: estudio transversal descriptivo de los casos de BA diagnosticados en atención primaria. Se seleccionaron para este estudio los casos diagnosticados en consultorios extrahospitalarios y centros de atención primaria, que no precisaron ingreso. Los 60 centros participantes pertenecían a 11 comunidades autónomas. La información de este estudio descriptivo forma parte del Proyecto aBREVIADo (Bronquiolitis-Estudio de Variabilidad, Idoneidad y Adecuación), en el que se emplean como patrón de referencia las recomendaciones elaboradas en la Conferencia de Consenso sobre BA13.
Período de estudio: meses de octubre del 2007 a marzo del 2008, ambos inclusive.
Criterios de inclusión: todos los casos de BA diagnosticados en el periodo de estudio según los criterios de McConnochie14: primer episodio agudo de dificultad respiratoria con sibilancias, precedido por un cuadro catarral de vías altas (rinitis, tos, con/sin fiebre), que afecta a niños menores de 2 años.
Criterios de exclusión: pacientes con antecedente de episodios previos de sibilancias.
Sistemática de recogida de casos: incluía el registro consecutivo de casos diagnosticados por los médicos colaboradores en el estudio, así como la revisión periódica de bases de datos informatizadas, listados o copias de informes, para el registro de casos diagnosticados por otros médicos. En las búsquedas automáticas se consideraron los siguientes códigos de la clasificación internacional de enfermedades (CIE 9 Modificación Clínica), tanto en posición principal como secundaria: 466.1: bronquiolitis; 079.6: infección por VRS; 466.11: bronquiolitis por VRS; 466.19: bronquiolitis, y otras; 493: asma. Asimismo se realizaron búsquedas textuales del término «bronquiolitis». Los resultados de las búsquedas fueron comprobados manualmente.
Se diseñó un cuestionario para la recogida de las variables de estudio que comprendían datos generales, síntomas-signos, factores de riesgo, pruebas diagnósticas y tratamiento, cuyos ítems vienen definidos en un estudio previo13. Se diseñó una escala de gravedad recopilando las variables que han demostrado, en estudios previos, una adecuada concordancia interobservador15-21: frecuencia respiratoria, ventilación pulmonar, sibilancias, tiraje y conciencia, medidos tras la adecuada aspiración de secreciones (0 a 2 para cada componente; puntuación máxima 10). Los tratamientos se diferenciaron según su uso en la fase aguda de la enfermedad (tratamientos administrados en el lugar del diagnóstico y aquellos recomendados para su administración en las 24 h inmediatas al mismo) y en la de mantenimiento.
Se clasificó la idoneidad del tratamiento en la fase aguda y en la de mantenimiento catalogando los procedimientos terapéuticos como de primera elección, uso alternativo o inadecuado, según los criterios de la Conferencia de Consenso13.
Aspectos éticos: se recomendó expresamente no realizar ninguna modificación en el manejo habitual de los pacientes con BA. La información fue recogida de forma anónima, sin registrar los datos de identificación de los pacientes.
Aspectos estadísticos: el procesamiento estadístico se realizó con SPSS versión 11.5.1 (número de serie 9036057). No se realizó una estimación del tamaño muestral necesario por ámbitos, dado que en casi todos los centros se recogía a todos los pacientes diagnosticados de BA. No obstante, habíamos calculado que submuestras de 150 pacientes permitirían estimar porcentajes con una precisión de ±8% y discriminar diferencias de porcentajes de al menos el 15% (para porcentajes teóricos del 50%, valor más desfavorable, error α del 5% y β del 20%).
Se calcularon medidas de centralización y de tendencia de las variables cuantitativas y análisis de frecuencias de las variables cualitativas, globalmente y por comunidades autónomas. Para el análisis de variabilidad se agruparon las comunidades con menos de 50 casos. Se estimaron intervalos de confianza para las principales medidas. Se realizó una comparación de variables por áreas mediante prueba de la χ2 o pruebas exactas para variables cualitativas y el análisis de la varianza para variables cuantitativas.
Se realizó una estimación de los porcentajes de tratamientos inadecuados por comunidades autónomas, ajustados mediante regresión logística no condicional por edad, antecedente de apnea o prematuridad, escala de gravedad > 5 y saturación de oxígeno al diagnóstico < 94%. Se realizó una codificación de variables tipo «desviación» para todas las variables (estima la diferencia de cada categoría respecto la media de todas). Se utilizó una estrategia de modelización «hacia atrás» basada en los cambios en el cociente de verosimilitudes.
ResultadosEn los meses de octubre del 2007 a marzo del 2008 se recogieron 940 BA diagnosticadas en los consultorios extrahospitalarios y centros de atención primaria que no precisaron ingreso. Estos casos suponen el 16,6% de todas las BA incluidas en el estudio global (5.636) y el 90,9% de las BA recogidas en atención primaria (riesgo de ingreso 9,1%; intervalo de confianza del 95% [IC del 95%], 7,5 a 11,0%). Las comunidades autónomas que recogieron más casos fueron la Comunidad Valenciana (206), Castilla y León (199), Madrid (183), Asturias (121) y Cataluña (88). Otras comunidades que incorporaron casos fueron Andalucía (38), Extremadura (29), Aragón (28), Galicia (24), Cantabria (13) y País Vasco (11).
La máxima incidencia de casos se produjo en los meses de diciembre (25,7%), noviembre (24,6%), enero (18,2%) y octubre (14,3%), que comprendieron el 82,6% de los casos. El 54,5% de los casos eran varones. La media de edad fue de 0,62 años (IC del 95%, 0,60 a 0,65), con un predominio de niños entre 3 meses y un año.
Los principales datos clínicos constatados son, por orden de frecuencia: tos (99,8%), rinitis (80,7%), rechazo de las tomas (37%), vómitos (21,4%) y fiebre mayor de 38°C (19,6%). Es infrecuente la presencia de apneas (1,8%) o deshidratación (0,7%). Tenían una puntuación media en la escala de gravedad de 1,45 (desviación estándar 1,57; mediana 1), presentando más de 4 puntos solo el 4,4%.
Un 9,1% de los casos tenían antecedente de prematuridad y un 1,4% de cardiopatía congénita. Otros factores de riesgo son muy infrecuentes: displasia broncopulmonar (0,2%), otras neumopatías crónicas (0,1%) y inmunodeficiencia (0,1%). El 13,5% de los casos tenían antecedente de atopia materna.
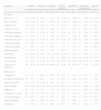
En la tabla 1 se presentan las pruebas diagnósticas realizadas y los principales resultados de las mismas. La saturación de oxígeno se midió en el 18,2% de los casos. Se realizaron pruebas de identificación del VRS en el 8,1% (siendo el 54,1% de ellas positivas), radiografía de tórax en el 8,1% y alguna analítica sanguínea en el 3,1%. En la tabla 2 se presenta la variabilidad de las principales pruebas por comunidades, observándose una heterogeneidad importante y significativa para la mayoría de ellas.
Pruebas diagnósticas realizadas y resultados principales
| Pruebas diagnósticas | n = 940 | |
| n | % | |
| Saturación oxígenoMedida al diagnóstico | 171 | 18,2% |
| Media ± DE | 95,9 ± 3 | |
| < 94% | 28 | 3,0% |
| RX tórax realizada | 76 | 8,1% |
| Hiperinsuflación | 31 | 3,3% |
| Atelectasias | 5 | 0,5% |
| Infiltrados | 11 | 1,2% |
| Fuga aérea | 4 | 0,4% |
| VRS realizado | 76 | 8,1% |
| VRS positivo | 40 | 4,3% |
| Gasometría realizada | 5 | 0,5% |
| Hemograma realizado | 20 | 2,1% |
| Proteína C reactivaRealizada | 29 | 3,1% |
| Procalcitonina realizada | 16 | 1,7% |
| Hemocultivo realizado | 8 | 0,9% |
Se presentan recuentos y porcentajes, salvo que se indique otra cosa.
DE: desviación estándar; RX radiografía; VRS virus respiratorio sincitial
Pruebas diagnósticas realizadas por comunidades autónomas
| Pruebas diagnósticas | Asturias121 | Cataluña88 | Castilla y León199 | Madrid183 | Comunidad Valenciana206 | Otras143 | ||||||
| n | % | n | % | n | % | n | % | n | % | n | % | |
| Saturación oxígenoMedida al diagnóstico | 38 | 31,4% | 5 | 5,7% | 44 | 22,1% | 44 | 24,0% | 10 | 4,9% | 30 | 21,0% |
| RX tórax realizada | 9 | 7,4% | 5 | 5,7% | 17 | 8,5% | 18 | 9,8% | 13 | 6,3% | 14 | 9,8% |
| VRS realizado | 9 | 7,4% | 5 | 5,7% | 37 | 18,6% | 4 | 2,2% | 9 | 4,4% | 12 | 8,4% |
| Hemograma realizado | 6 | 5,0% | 0 | 0,0% | 8 | 4,0% | 0 | 0,0% | 1 | 0,5% | 5 | 3,5% |
Se presentan recuentos y porcentajes, salvo que se indique otra cosa.
Todas las variables muestran heterogeneidad significativa (p < 0,001) excepto la radiografía de tórax.
RX: radiografía; VRS virus respiratorio sincitial.
En la tabla 3 se presentan los tratamientos utilizados durante la fase aguda y de mantenimiento de la BA, globalmente y por comunidades. En las tablas 4 y 5 se presenta la clasificación de la idoneidad de los tratamientos global y por comunidades, incluyendo una estimación del porcentaje de tratamiento inapropiado, ajustada por diferencias en la edad, antecedente de apnea o prematuridad, escala de gravedad y saturación de oxígeno al diagnóstico.
Principales tratamientos en fase aguda y de mantenimiento globalmente y por comunidades autónomas (recuentos y porcentajes)
| Tratamientos | Total940 | Asturias121 | Cataluña88 | Castilla y León199 | Madrid183 | Comunidad Valenciana206 | Otras143 | |||||||
| n | % | n | % | n | % | n | % | n | % | n | % | n | % | |
| Fase aguda | ||||||||||||||
| Beta-2+ oral | 164 | 17,4% | 43 | 35,5% | 1 | 1,1% | 20 | 10,1% | 43 | 23,5% | 21 | 10,2% | 36 | 25,2% |
| Beta-2+ inhalado | 594 | 63,2% | 42 | 34,7% | 77 | 87,5% | 151 | 75,9% | 91 | 49,7% | 153 | 74,3% | 80 | 55,9% |
| Antibiótico oral | 112 | 11,9% | 15 | 12,4% | 3 | 3,4% | 29 | 14,6% | 34 | 18,6% | 17 | 8,3% | 14 | 9,8% |
| Antibiótico i.v./i.m. | 3 | 0,3% | 1 | 0,8% | 0 | 0,0% | 0 | 0,0% | 2 | 1,1% | 0 | 0,0% | 0 | 0,0% |
| Fisioterapia respiratoria | 74 | 7,9% | 13 | 10,7% | 0 | 0,0% | 3 | 1,5% | 16 | 8,7% | 29 | 14,1% | 13 | 9,1% |
| Adrenalina nebulizada | 17 | 1,8% | 2 | 1,7% | 0 | 0,0% | 3 | 1,5% | 5 | 2,7% | 0 | 0,0% | 7 | 4,9% |
| Corticoides por vía oral | 231 | 24,6% | 51 | 42,1% | 2 | 2,3% | 46 | 23,1% | 20 | 10,9% | 35 | 17,0% | 77 | 53,8% |
| Corticoides inhalados | 49 | 5,2% | 0 | 0,0% | 2 | 2,3% | 7 | 3,5% | 4 | 2,2% | 21 | 10,2% | 15 | 10,5% |
| Corticoides parenteral | 8 | 0,9% | 2 | 1,7% | 0 | 0,0% | 3 | 1,5% | 1 | 0,5% | 2 | 1,0% | 0 | 0,0% |
| Bromuro ipratropio | 13 | 1,4% | 1 | 0,8% | 2 | 2,3% | 1 | 0,5% | 2 | 1,1% | 5 | 2,4% | 2 | 1,4% |
| Antitérmicos | 237 | 25,2% | 18 | 14,9% | 10 | 11,4% | 68 | 34,2% | 63 | 34,4% | 47 | 22,8% | 31 | 21,7% |
| Humidificación | 251 | 26,7% | 27 | 22,3% | 5 | 5,7% | 53 | 26,6% | 81 | 44,3% | 59 | 28,6% | 26 | 18,2% |
| Lavados Nasales | 591 | 62,9% | 45 | 37,2% | 48 | 54,5% | 109 | 54,8% | 145 | 79,2% | 161 | 78,2% | 83 | 58,0% |
| Aspiración vías respiratorias | 359 | 38,2% | 49 | 40,5% | 40 | 45,5% | 38 | 19,1% | 86 | 47,0% | 71 | 34,5% | 75 | 52,4% |
| Mantenimiento | ||||||||||||||
| Antitusígenos | 25 | 2,7% | 0 | 0,0% | 0 | 0,0% | 10 | 5,0% | 1 | 0,5% | 12 | 5,8% | 2 | 1,4% |
| DescongestivosMucolíticos | 50 | 5,3% | 12 | 9,9% | 1 | 1,1% | 13 | 6,5% | 4 | 2,2% | 18 | 8,7% | 2 | 1,4% |
| Beta-2+ por vía oral | 68 | 7,2% | 33 | 27,3% | 0 | 0,0% | 6 | 3,0% | 6 | 3,3% | 17 | 8,3% | 6 | 4,2% |
| Beta-2+ inhalado | 351 | 37,3% | 19 | 15,7% | 67 | 76,1% | 79 | 39,7% | 69 | 37,7% | 80 | 38,8% | 37 | 25,9% |
| Antibióticos | 68 | 7,2% | 11 | 9,1% | 1 | 1,1% | 10 | 5,0% | 17 | 9,3% | 12 | 5,8% | 17 | 11,9% |
| Corticoides por vía oral | 80 | 8,5% | 21 | 17,4% | 4 | 4,5% | 11 | 5,5% | 1 | 0,5% | 8 | 3,9% | 35 | 24,5% |
| Corticoides inhalados | 43 | 4,6% | 6 | 5,0% | 0 | 0,0% | 6 | 3,0% | 8 | 4,4% | 11 | 5,3% | 12 | 8,4% |
| Bromuro ipratropio | 2 | 0,2% | 0 | 0,0% | 0 | 0,0% | 0 | 0,0% | 0 | 0,0% | 1 | 0,5% | 1 | 0,7% |
| Montelukast | 27 | 2,9% | 5 | 4,1% | 0 | 0,0% | 16 | 8,0% | 1 | 0,5% | 4 | 1,9% | 1 | 0,7% |
Todas las variables presentaron heterogeneidad significativa (todas p < 0,001 menos adrenalina inhalada en fase aguda, antibiótico de mantenimiento, corticoides inhalados de mantenimiento, que tuvieron p < 0,05), excepto antibiótico parenteral en fase aguda, corticoides parenterales en fase aguda y bromuro de ipratropio en fase aguda y mantenimiento.
i.m.: intramuscular; i.v.: intravenoso.
Idoneidad de los tratamientos en fase aguda y de mantenimiento (recuentos y porcentajes)
| N = 940 | ||
| N | % | |
| Fase aguda | ||
| Primera elección | 149 | 15,9% |
| Uso alternativo | 88 | 9,4% |
| Inadecuado | 703 | 74,8% |
| Uso alternativo | ||
| Beta-2+ o adrenalina en moderado-gravesa | 62 | 6,6% |
| Corticoides sistémicos asociados a broncodilatador en moderado-gravesa | 26 | 2,8% |
| Uso inadecuado | ||
| Beta-2+ o adrenalina | 284 | 30,2% |
| Corticoides sistémicos | 94 | 10,0% |
| Otros tratamientos inapropiadosb | 150 | 16,0% |
| Varios criterios inapropiados | 175 | 18,6% |
| Fase mantenimientoc | ||
| Primera elección | 444 | 47,2% |
| Uso alternativo | 50 | 5,3% |
Idoneidad de los tratamientos en fase aguda y de mantenimiento, por comunidades autónomas (recuentos y porcentajes)
| Tratamientos | Asturias121 | Cataluña88 | Castilla y León199 | Madrid183 | Comunidad Valenciana206 | Otras143 | ||||||
| n | % | n | % | n | % | n | % | n | % | n | % | |
| Fase aguda | ||||||||||||
| Primera elección | 26 | 21,5% | 9 | 10,2% | 22 | 11,1% | 48 | 26,2% | 33 | 16,0% | 11 | 7,7% |
| Uso alternativo | 6 | 5,0% | 6 | 6,8% | 23 | 11,6% | 19 | 10,4% | 19 | 9,2% | 15 | 10,5% |
| Inadecuado | 89 | 73,6% | 73 | 83,0% | 154 | 77,4% | 116 | 63,4% | 154 | 74,8% | 117 | 81,8% |
| Ajustadoa | 53,9% | 66,2% | 60,8% | 42,8% | 57,8% | 68,2% | ||||||
| (IC 95%) | (44,3 a 63,2%) | (54,5 a 76,1%) | (52,4 a 68,5%) | (35,6 a 50,4%) | (49,7 a 65,5%) | (59,0 a 76,2%) | ||||||
| Fase mantenimiento | ||||||||||||
| Primera elección | 57 | 47,1% | 21 | 23,9% | 97 | 48,7% | 101 | 55,2% | 93 | 45,1% | 75 | 52,4% |
| Uso alternativo | 1 | 0,8% | 2 | 2,3% | 12 | 6,0% | 19 | 10,4% | 7 | 3,4% | 9 | 6,3% |
| Inadecuado | 63 | 52,1% | 65 | 73,9% | 90 | 45,2% | 63 | 34,4% | 106 | 51,5% | 59 | 41,3% |
| Ajustadoa | 43,3% | 63,7% | 36,5% | 25,6% | 41,4% | 34,1% | ||||||
| (IC del 95%) | (35,2 a 51,8%) | (53,6 a 72,7%) | (30,2 a 43,3%) | (20,4 a 31,5%) | (34,9 a 48,3%) | (27,3 a 41,5%) | ||||||
Heterogeneidad significativa para ambas fases (p<0,001).
Las características de nuestro estudio, por número de casos y distribución (940 lactantes menores de 2 años con primer episodio de BA recogidos de 60 centros participantes pertenecían a 11 comunidades autónomas), permiten obtener datos representativos de las características epidemiológicas y el manejo diagnóstico-terapéutico de esta entidad en atención primaria en España. Pocos estudios han analizado series de pacientes ambulatorios con BA1,2,22, aunque algunas encuestas de opinión a pediatras se centraban en este ámbito23-25.
Pruebas diagnósticasEn nuestra serie solo se midió la saturación de oxígeno en el 18,2% de los casos. La medición de la saturación de oxígeno es una práctica recomendable, al menos al diagnóstico, ya que facilita una valoración objetiva de la gravedad, diferente de la ofrecida por otros signos y síntomas. El bajo porcentaje de medición puede deberse a que la mayoría de los pacientes tenían BA leves. Aunque en los últimos años se ha generalizado la disponibilidad de pulsioxímetros en los centros de salud, desconocemos si resultan apropiados para la medición de la saturación de oxígeno en el lactante.
Otras pruebas diagnósticas, como la identificación de la presencia del VRS o la radiografía de tórax, solo han sido empleadas en un 8,1% de los casos. A diferencia de la medición de la saturación de oxígeno, recomendable al menos al diagnóstico, no está clara la utilidad clínica de la utilización de estas otras pruebas. En algún otro estudio se han observado porcentajes similares de uso de la radiografía1. Con respecto a los hallazgos radiológicos (se observaron atelectasias o infiltrados en un 10-15% de las radiografías), no sabemos si tuvieron alguna repercusión en nuestros pacientes. Aunque se ha descrito que estos hallazgos se asocian a mayor gravedad de la BA, mayor riesgo de ingreso y uso de antibióticos, no hay evidencia sobre la utilidad clínica de la radiografía de tórax en estos pacientes7.
La identificación del virus responsable de la BA no se recomienda en pacientes ambulatorios por no resultar útil para el manejo del paciente. Tan solo nos ofrece información epidemiológica, que podría ser usada en la agrupación de casos en el medio hospitalario. Aunque podría argumentarse que el diagnóstico de una infección vírica permitiría descartar el uso de antibióticos, estos resultan claramente inapropiados en la BA.
Como era de esperar, en nuestra serie es excepcional recurrir a análisis de sangre. Con estos análisis se trata de descartar infecciones bacterianas asociadas. Algo parecido se ha observado en otro serie francesa1. Aunque es habitual que en los menores de 3 meses con BA y fiebre asociada se realicen hemogramas, hemocultivos u otros marcadores biológicos de infección bacteriana22, se ha comprobado que el riesgo de infección bacteriana asociada es muy bajo, por lo que estas pruebas parecen prescindibles7.
Intervenciones terapéuticasEn nuestro estudio se constata un amplio uso de broncodilatadores inhalados y, en menor grado, de corticoides sistémicos y otros tratamientos de eficacia no aclarada (antibióticos, broncodilatadores orales, corticoides inhalados, bromuro de ipratropio, etc.). El perfil terapéutico del paciente ambulatorio en fase aguda se compone del uso mayoritario de beta-2-adrenérgicos inhalados (63,2%) u orales (17,4%), un 24,6% corticoides sistémicos y un 11,9% antibióticos, junto a tratamientos sintomáticos (lavados nasales, aspiración de secreciones, antitérmicos y humidificación). Solo el 1,8% recibió adrenalina inhalada.
Como tratamiento de mantenimiento, aproximadamente la mitad de los pacientes reciben broncodilatadores inhalados (37,3%) u orales (7,2%) y un pequeño porcentaje, corticoides (orales el 8,5% e inhalados el 4,6%), antibióticos (7,2%) o montelukast (2,9%).
Se han publicado algunas encuestas de opinión realizadas a médicos, la mayoría de ellos pediatras, sobre el manejo habitual de los pacientes ambulatorios con BA23-25. Se indican de forma generalizada beta-2-agonistas (entre un 66 y un 99% de las respuestas), aunque solo un porcentaje de ellos los consideran de uso sistemático (entre un 2 y un 62%)23-25. Los corticoides sistémicos se indican entre un 27 y un 90% (1 a 36% de forma sistemática)23-25, los corticoides inhalados alrededor del 40% y los antibióticos entre un 11 y un 56% (2% de forma sistemática). Sin embargo, la indicación de adrenalina a nivel ambulatorio es escasa. El amplio uso de tratamientos reflejado en las encuestas contrasta con las recomendaciones de guías y protocolos vigentes en los distintos países implicados. La fisioterapia respiratoria, terapia de difícil estandarización y estudio, recomendada de forma generalizada en países como Francia25, apenas se refleja en otros entornos.
Dos estudios que ofrecen datos sobre el manejo terapéutico real de pacientes con BA, ambos franceses, muestran un menor uso de beta-2-agonistas y corticoides, y el empleo generalizado de fisioterapia respiratoria1,2. Sin embargo, los estudios de series de pacientes hospitalarios o de urgencias de otros países26-30, incluido el nuestro31,32, sugieren un uso extendido de los broncodilatadores al margen de la gravedad del paciente. Con respecto al empleo del suero salino hipertónico nebulizado, del que evidencia reciente sugiere cierta eficacia9, ni nuestro estudio ni otros previamente publicados permiten describir su implantación en la práctica clínica.
Existe amplia información y, por tanto, es bien reconocido que en el tratamiento de la BA9,13: a) lo fundamental es realizar las medidas de soporte sintomáticas frente al manejo de la fiebre, las secreciones respiratorias y la hiporexia, así como de la dificultad respiratoria y la hipoxemia; b) se puede valorar el uso alternativo de la prueba terapéutica con salbutamol o adrenalina nebulizada (mejor con suero salino hipertónico) en casos moderados-graves seleccionados y mantenerlos solo si se documenta respuesta positiva por medios objetivos (escala de gravedad clínica); c) cabe plantear la posible utilización de ciertos tratamientos (heliox, surfactante y/o ribavirina) en casos graves de BA bien seleccionados, y d) se considera inapropiado el uso de la mayoría del resto de fármacos (corticoides, salbutamol por vía oral, adrenalina subcutánea, bromuro de ipratropio, antibióticos, inmunoglobulinas, etc.).
Pese a estos datos fundamentados, sigue sorprendiendo que en nuestro medio haya un elevado uso de ciertos fármacos en todas o alguna de las fases de tratamiento de la BA: beta-2 estimulantes inhalados (63,2% en la fase aguda y 37,3% en la fase de mantenimiento), beta-2 estimulantes por vía oral (17,4% en la fase aguda y 7,2% en la fase de mantenimiento), corticoides orales (24,6% en la fase aguda y 8,5% en la fase de mantenimiento), antibióticos (12,2% en la fase aguda y 7,2% en la fase de mantenimiento) y corticoides inhalados (5,2% en la fase aguda y 4,6% en la fase de mantenimiento).
Mientras que el uso de broncodilatadores puede estar justificado en pacientes con BA moderada a grave, en otros pacientes el margen potencial de beneficio es tan pequeño que no justifica su uso. Algo similar ocurre con los esteroides sistémicos, asociados o no a los broncodilatadores. Aunque el empleo de estos tratamientos es una práctica habitual, no hay una clara evidencia sobre su efectividad9,13 y cualquier beneficio a los pacientes es poco probable. Cabría esperar que el paciente ambulatorio, habitualmente leve, recibiera de forma excepcional tratamiento broncodilatador; sin embargo, el uso de beta-2 estimulantes apenas se diferencia del uso general en nuestra serie completa, formada por pacientes más graves atendidos en el medio hospitalario12.
La eficacia de la adrenalina nebulizada combinada con esteroides sistémicos fue discutida en nuestra conferencia de consenso. De acuerdo con los resultados de un ensayo clínico publicado por Plint et al.33, esta combinación podría reducir ligeramente el riesgo de ingreso a los 7 días. No obstante, este efecto no era significativo después del ajuste para comparaciones múltiples (4 grupos de tratamiento) y el grupo tratado tenía un mayor riesgo atópico (no significativo, pero del mismo tamaño que el efecto observado). Una revisión sistemática reciente ha considerado este estudio para apoyar el efecto de la dexametasona y la adrenalina nebulizada34, en discordancia con revisiones anteriores35. Hasta que nuevos estudios específicamente diseñados para poner a prueba este tratamiento combinado se encuentren disponibles, se consideró solo como una alternativa ante pacientes con clínica moderada o grave.
Cuando clasificamos la idoneidad de nuestros tratamientos, siguiendo los criterios establecidos en la conferencia de consenso9,13, y como consecuencia de considerar que los broncodilatadores con o sin corticoides solo estaban justificados como ensayo terapéutico en pacientes moderados-graves, encontramos que son inadecuados el 74,8% de los tratamientos en la fase aguda y el 47,4% en la fase de mantenimiento. Una clara muestra de sobreutilización de tratamientos no eficaces. La variabilidad observada entre comunidades en el uso de broncodilatadores, corticoides o antibióticos ilustra de la falta de fundamento de su uso y del amplio margen de mejora existente. Resulta llamativo que el porcentaje de uso inapropiado de tratamientos en la fase aguda oscile entre un 42,8 y un 68,2%. Todavía mayor es la variabilidad en el porcentaje de tratamiento inapropiado en la fase de mantenimiento (25,6 a 63,7%).
El manejo de los casos de BA es uno de los ejemplos de la medicina actual en donde la práctica diaria («lo que hacemos») se separa con más frecuencia de la deseable de la evidencia científica («lo que sabemos»). Esto da lugar a prácticas clínicas muy dispares, más relacionadas con las preferencias individuales de los médicos que atienden niños con BA, o con las «modas» temporales, que con la gravedad de los episodios y su ajuste a criterios probados36.
FinanciaciónProyecto financiado con una beca de la Fundación-Hospital Torrevieja para el periodo junio 2007-junio 2009 (código de protocolo: BECA0001).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Hospital de Torrecárdenas. Almería (M.D. Gámez Gómez, J. Batlles Garrido, J.E. Cabrera Servilla, I. García Escobar, F. Giménez Sánchez, L. Ruiz Tudela), C. Salud Candelaria. Sevilla (A. Fernández Valverde, M.G. Bueno Rodríguez, I. Ramón Faba, M. Praena Crespo).
C. Salud Fuentes del Ebro. Zaragoza (J.A. Castillo Laita, R. Macipe Costa), Hospital Infantil Universitario Miguel Servet. Zaragoza (C. Campos Calleja, M.C. García Jiménez, R. Pérez Delgado, Y. Romero Salas).
C. Salud Contrueces (M. López Benito), C. Salud El Llano (V. Martínez Suárez, M. García Balbuena), C. Salud Infesto (I. Mora Gandarillas), C. Salud La Magdalena (J.I. Pérez Candás), C.S. La Felguera (M. Fernández Pérez, C. Gonzavo Rodríguez), C. Salud Laviada (A. Cobo Ruisánchez, B. Yáñez Meana), C. Salud Natahoyo (A. Hernandez Encinas), C. Salud Otero (B. Domínguez Aurrecoechea), C. Salud Pravia (M. García Adaro, R. Buznego Sánchez), C. Salud Tineo (M. Fernández Francés), C. Salud Puerta La Villa (I. Franco, S. Ballesteros), C. Salud Sama (M. Benito Martín, A.J. Mira López, M. Fernández López), Hospital Cabueñes. Gijón (C. Molinos Norniella, C. Pérez Méndez, E. Fernández Fernández, J. Fernández Antuña), Hospital Central de Asturias. Oviedo (J. Rodríguez Suárez, S. Jiménez Treviño, F. Álvarez Caro).
Hospital Universitario Materno Infantil. Las Palmas de Gran Canarias (S. Todorcevic, M.R. García Luzardo).
C. Salud Buelna (A. Bercedo Sanz), Hospital Marqués de Valdecilla. Santander (M.J. Cabero Pérez, L. Álvarez Granda, E. Pérez Belmonte).
Hospital Complejo Asistencial de León. León (S. Lapeña López de Armentia, R. Morales Sánchez, L. Fernández Pérez), C. Salud Jardinillos. Palencia (S. Alberola López, I. Pérez García), C. Salud Pintor Oliva. Palencia (A.B. Camina Gutiérrez, J.G. Santos García), C. Salud Venta de Baños. Palencia (I. Casares Alonso), C. Salud Villamuriel. Palencia (A. Cano Garcinuño), Hospital Río Carrión. Palencia (C. Urueña Leal, J.M. Andrés de Llano, J.E. Fernández Alonso, J.M. Bartolomé Porro), C. Salud Ciudad Rodrigo. Salamanca (M.C. Sánchez Jiménez, M.J. Estévez Amores), C. Salud Ledesma. Salamanca (M. Mendoza Sánchez), C. Salud Miguel Armijo. Salamanca (J. López Ávila), C. Salud San Bernardo. Salamanca (A. Martín Ruano), C. Salud Santa Marta. Salamanca (J. Martín Ruano, B. de Dios Martín), Hospital Complejo Hospitalario de Salamanca. Salamanca (S. Fernández de Miguel, J.M. Sánchez Granados, O. Serrano Ayestaran), Hospital Clínico Universitario. Valladolid (F. Conde Redondo, A. del Río López, V. Matías del Pozo), Hospital Río Hortega. Valladolid (F. Centeno Malfaz, C. Alcalde Martín, B. Bello Martínez, L. Crespo Valderrábano, C. Gutiérrez Abad), C. Salud Benavente Sur. Zamora (M.E. Vázquez Fernández), C. Salud Parada de Molino. Zamora (A. Cortés Gabaudán), C. Salud Puerta Nueva. Zamora (M.M. Miguélez Vara, P. Pérez García), C. Salud Santa Elena. Zamora (S. García Vicente), C. Salud Virgen de la Concha. Zamora (M. A. Prieto Figuero, M.J. Piorno Hernández, M. Jesús Moro Pérez), Hospital Virgen de la Concha. Zamora (C. Ochoa Sangrador, A.F. Bajo Delgado, A. Fernández Testa), Hospital General de Segovia. Segovia (C. Ortega Casanueva).
ABS Llefiá. Badalona. Barcelona (G. Ruiz Aragón), ABS-7 La Salut. Barcelona (P. Aizpurua Galdeano), Hospital Sant Joan de Déu. Barcelona (G. Claret Teruel, S. Fernández Ureña), Hospital Universitari Germans Trias i Pujol. Badalona. Barcelona (M. Méndez Hernández, F. Brossa Guerra, J. Fàbrega Sabaté), ABS Girona-3. Gerona (R.B. Cortés Marina, E. Fortea Gimeno), ABS Girona-4. Gerona (J.C. Buñuel Alvarez, C. Vila Pablos), Hospital Josep Trueta. Gerona (S. Uriel Prat, Ll. Mayol i Canals).
C. Salud Acequión. Alicante (C. Buhedo Gordillo, G. Rinero de Campos), C. Salud El Cabo. Alicante (M.J. Mateo Moraleda, T. Pérez Martín, A. Redondo, A. Sanguino, B. Sepulcre, B. Serra, A. Tosao), C. Salud El Campello. Alicante (J. Galiano Olivares), C. Salud Guardamar del Segura. Alicante (C.P. Rico Uriós), C. Salud Hospital Provincial. Alicante (M.C. Sirvent Mayor, M.J. Fernández Tarí), C. Salud La Mata. Alicante (M.S. Fuggini), C. Saud Mutxamel. Alicante (L. Comino Almenara, E. Gutiérrez Roble, A. Melnikova, M. Riva), C. Salud Rojales i Benijofar. Alicante (A. Bernabé Gutiérrez, I. Degtyareva), Hospital de Orihuela. Alicante (V. Cañadas Olmo, F. Goberna Burguera), Hospital de San Juan. Alicante (J.L. Mestre Ricote), Hospital de Torrevieja. Alicante (J. González de Dios, C. Rivas Juesas), C. Salud Gran Vía. Castellón (E. Fabregat Ferrer, M.J. Palomares Gimeno), Hospital de La Plana. Villarreal. Castellón (J. Colomer Pellicer), C. Salud La Eliana. Valencia (I. Úbeda Sansano, M. Romero García), C. Salud de Meliana. Valencia (A. Plaza Miranda), Consultorio Auxiliar Albalat de la Ribera. Valencia (C. Sánchez Medina), Consultorio Auxiliar Barrio de la Luz. Valencia (T. Álvarez de Laviada Mulero), C. Salud Padre Jofré. Valencia (P. Barona Zamora), C. Salud Serrería I. Valencia (M. Asensi Monzó).
C. Salud Talavera la Real. Badajoz (C.M. Gómez Málaga), C. Salud Urbano-I. Badajoz (J.J. Cuervo Valdés), C. Salud Villanueva de la Serena Sur. Badajoz (D. Barroso Espadero).
C. Salud Santa Comba. La Coruña (M.E. Amigo Ferreiro), Hospital Arquitecto Marcide. Ferrol. La Coruña (E. García Fernández, A.I. García Villar, R.M. Romaris Barca, M. Santos Tapia), Hospital Clínico de Santiago. Santiago de Compostela. La Coruña (A. Miras Veiga, F. Martinón Torres, N. Martinón Torres, L. Redondo Collazo), Hospital Virxe da Xunqueira. Cee. La Coruña (M.I. Quintela Fernández), Hospital Monforte. Monforte de Lemos. Lugo (S.A. Fernández Cebrián, M.J. Pita Pérez, F. J. Vadillo González), Hospital da Costa. Burela. Lugo (A.G. Andrés Andrés, P. Lago Manchado), Hospital Complejo Hospitalario de Ourense. Orense (C. Lorenzo Legerén, M. Berrocal Castañeda, J.M. Iglesias Meleiro), Complejo Hospitalario Universitario de Vigo. Pontevedra (E. González Colmenero, J. Antelo Cortizas, E. García Martínez, A. Ruiz Conde).
C. Salud Barrio del Pilar (P. González Rodríguez), C. Salud Canillejas (O. Cortés Rico), C. Salud Entrevías-Área 1 (M. Aparicio Rodrigo), C. Salud General Ricardos (G. Orejón de Luna, M.M. Martín Mate), C. Salud Guayaba (M. Duelo Marcos, C. Indaberea Iguaran, A. Nuñez Giralda, F. Muñoz Velasco), C. Salud Juncal (L. Perdikidis Oliveri), C. Salud Mar Báltico-Área 4 (J.L. Montón Álvarez, V. Orbe León), C. Salud Potes. Área 11 (M. Fernández Rodríguez), Hospital Gregorio Marañón (M.M. Guerrero, R. Marañón Pardillo, A. Peñalba Cítores).
C. Salud Bidebieta, Gipuzkoa (M. Callén Blecua), Hospital Universitario Donostia, Gipuzkoa (J. Korta Murua, F.J. Mintegui Aramburu, I. Olaciregui Echenique, E. Rezola Arcelus), Hospital Universitario Basurto, Vizcaya (C. González Díaz), Hospital Universitario Cruces, Baracaldo, Vizcaya (J. Sánchez Echaniz).