El objetivo del estudio fue analizar la incidencia de efectos trombóticos relacionada con la administración de factor vii humano recombinante activo (rFVIIa) en el tratamiento de la hemorragia grave tras la cirugía cardiaca.
Material y métodosEstudio retrospectivo de casos-controles pareado, de 2 años de duración, que incluyó a 72 niños ingresados en cuidados intensivos y tratados con rFVIIa por una hemorragia grave, durante o tras la cirugía cardiaca. Utilizamos un grupo control de 63 pacientes, estadísticamente comparables en cuanto a sexo, peso, diagnóstico, riesgo quirúrgico según la clasificación RACHS-1 y las características quirúrgicas.
ResultadosNo existieron diferencias significativas en la incidencia de fenómenos trombóticos (20% en casos y 28% en controles, p=0,540), ni en la mortalidad (16% en casos y 9,5% controles, p=0,208).
ConclusiónEn nuestra serie, el tratamiento con rFVIIa ha demostrado ser útil en el control de la hemorragia incoercible en niños sometidos a cirugía cardiaca, y no parece aumentar el riesgo de fenómenos trombóticos ni la mortalidad en el periodo postoperatorio.
The objective of this study was to analyze the incidence of thrombotic complications related to recombinant human factor viia (rFVIIa) therapy for severe postoperative bleeding in cardiac surgery.
Material and methodsA retrospective matched case-control study was conducted over two years, including 72 children admitted to intensive care unit and treated with rFVIIa because of a severe bleeding during or after cardiac surgery. A control group of 63 patients was chosen, who were statistically comparable in sex, weight, diagnosis, surgical risk according RASCH-1 score, and surgical characteristics, was chosen.
ResultsThere were no significant differences between cases and controls either in the rate of thrombosis (20% vs 28%, P=.540), or in the mortality rate (16% vs 9.5%, P=.208).
ConclusionsIn our study, the rFVIIa therapy was shown to be useful in controlling severe operative bleeding in pediatric cardiac surgery, but does not seem to increase the risk of thrombotic complications or mortality rate in the postoperative pe riod.
El rFVIIa es una sustancia estructuralmente casi idéntica al factor de la coagulación viia humano, que produce un aumento en la formación local de factor xa, trombina y fibrina, independientemente del factor tisular1.
Inicialmente el rFVIIa fue concebido para tratar la hemorragia en pacientes hemofílicos A o B con inhibidores al factor viii o ix2. En los últimos años su papel como agente procoagulante se ha utilizado en otro tipo de pacientes, como aquellos con hemorragia incoercible tras cirugía o hemorragia grave de otras etiologías3.
Un reciente metanálisis en adultos ha encontrado un aumento de riesgo de fenómenos trombóticos arteriales en pacientes ancianos4. En niños existen pocos estudios que hayan analizado los efectos secundarios del rFVIIa5,6, incluyendo a los pacientes sometidos a cirugía cardiaca7,8. Su administración en pacientes con oxigenación de membrana extracorpórea (ECMO) no parece aumentar el riesgo de trombosis9-11.
El objetivo de nuestro estudio fue analizar la incidencia de fenómenos trombóticos en niños sometidos a cirugía cardiaca tratados con rFVIIa por hemorragia grave.
Pacientes y métodosSe realizó un estudio retrospectivo, analítico, de casos-controles, pareado, mediante revisión de historias clínicas, incluyendo a pacientes menores de 16 años ingresados cuidados intensivos neonatales o pediátricos entre enero del 2008 y diciembre del 2009 sometidos a cirugía cardiaca y tratados con rFVIIa por hemorragia grave. Se definió hemorragia grave como la persistencia de sangrado excesivo que impedía la adecuada visión del campo quirúrgico o que producía hipovolemia sintomática (deterioro hemodinámico), a pesar de transfusión de plasma fresco congelado, concentrado de plaquetas y de fibrinógeno (refractaria a la transfusión), además de revertir la heparinización guiada con los valores de ACT. Se administró una dosis de rFVIIa a 90 μg/kg de forma intravenosa lenta, y se repitió una segunda dosis a las 2 h en caso de persistencia de la hemorragia.
Los controles fueron seleccionados entre los pacientes de edad similar al caso asignado a los que no se hubiera administrado rFVIIa, con una cardiopatía de fisiología similar y sometidos al mismo procedimiento quirúrgico o a uno con una dificultad y riesgos parecidos (valorado mediante la puntuación RASCH-112).
Se recogieron las siguientes variables: edad, sexo, peso, cardiopatía y cirugía realizada, tiempo de circulación extracorpórea (CEC), uso y duración del clampaje aórtico, utilización de parada circulatoria y temperatura mínima durante la CEC. También se recogió información relativa al control del sangrado, de la aparición de trombosis en cualquier localización y de accidentes cerebrovasculares (ACV), y de la mortalidad. Los trombos se localizaron a partir de exploraciones complementarias realizadas por criterios clínicos (alteraciones neurológicas, alteración de la perfusión de miembros, mal funcionamiento de catéter…), y en el caso de los trombos intracardiacos o de las prótesis, mediante las ecocardiografías de control rutinario diario realizadas a estos pacientes.
El análisis estadístico se realizó con el programa SPSS. Los datos referentes a variables cuantitativas se presentan como mediana (P25-P75) y se compararon utilizando las pruebas de la chi al cuadrado y estadístico exacto de Fisher. Las variables cualitativas se expresan como frecuencias y porcentajes, y se compararon mediante la prueba de la U de Mann-Whitney. Se consideró significativo un valor de p<0,05.
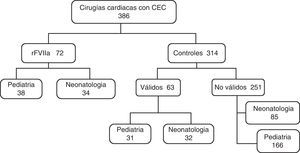
ResultadosDurante el periodo de estudio, se realizaron 386 cirugías cardiacas con CEC; 72 pacientes (18,6%) recibieron rFVIIa, 2 de ellos asistidos con ECMO previamente a la administración de rFVIIa. Entre los restantes, 63 pacientes cumplieron los criterios para poder ser seleccionados como controles (fig. 1). En el grupo de niños mayores de un mes, se incluyen 17 trasplantes (12 casos y 5 controles).
En la tabla 1 se presentan las características clínicas basales y operatorias de cada uno de los grupos. No encontramos ningún trastorno de la coagulación en ningún paciente durante la cirugía ni a posteriori.
Características clínicas basales y operatorias de casos y controles
| Casos, n (IC95%) | Controles, n (IC95%) | p | |
| Niños | |||
| Edad, meses | 16,5 (6,0-63,0) | 60,0 (6,0-96,0) | 0,188 |
| Sexo, % varones | 58 | 39 | 0,148 |
| Peso, kg | 9,5 (6,1-17,8) | 16,0 (6,9-23,0) | 0,242 |
| Fisiología univentricular, % | 28,9 | 36,7 | 0,604 |
| RACHS-1a% RASCH-1 ≥ 4 | 3,0 (3,0-4,5)40 | 3,0 (3,0-4,5)36 | 0,998 |
| CEC, min | 236 (182-324) | 166 (125-234) | 0,001 |
| Uso clampaje, % | 78 | 71 | 0,578 |
| Clampaje, min | 91 (56-144) | 67 (47-108) | 0,222 |
| Parada circulatoria, % | 39 | 35 | 0,805 |
| Neonatos | |||
| Edad, meses | 0,2 (0,1-0,4) | 0,2 (0,1-0,4) | 0,897 |
| Sexo, % varones | 62% | 72% | 0,441 |
| Peso, kg | 3,1 (2,7-3,4) | 3,3 (2,9-3,8) | 0,075 |
| Fisiología univentricular, % | 38,2 | 34,4 | 0,802 |
| RACHS-1% RASCH-1 ≥ 4 | 4,0 (4,0-6,0)78 | 4,0 (3,0-6,0)72 | 0,608 |
| CEC, min | 194 (160 -243) | 172 (132-203) | 0,106 |
| Uso clampaje, % | 91 | 94 | 0,667 |
| Clampaje, min | 98 (63-123) | 89 (58-114) | 0,603 |
| Parada circulatoria, % | 78 | 75 | 0,768 |
CEC: circulación extracorpórea; PCT: parada circulatoria total; clampaje: clampaje aórtico.
No existieron diferencias significativas entre los casos y los controles en edad, sexo, peso o fisiología ventricular (tabla 1), ni tampoco en los grupos de cardiopatías (datos no mostrados) ni en la escala RACHS-1. En el grupo pediátrico la duración de la CEC fue mayor, incluso tras excluir del análisis los niños trasplantados.
El rFVIIa se administró en todos los casos por una hemorragia no controlada con otros tratamientos, bien en el quirófano tras la salida de CEC o en el postoperatorio inmediato. En 15 pacientes (20%) fue necesaria la administración de una segunda dosis. Se logró el control de la hemorragia en un 77% de los casos, sin existir diferencias significativas entre neonatos (83%) y niños (71%), p=0,363.
La tabla 2 recoge la incidencia de fenómenos trombóticos y la mortalidad de ambos grupos. Se encontraron complicaciones trombóticas graves (ACV) en 8 pacientes (5 casos y 3 controles), no existiendo diferencias significativas en relación al tratamiento con rFVIIa (p=0,718), ni con la edad (p=0,982), ni con el número de dosis de rFVIIa administradas (p=0,513).
Frecuencia de eventos trombóticos y mortalidad por subgrupos
| Casos | Controles | Casos vs. controles | ||
| Neo | Niños | Neo | Niños | |
| ACV | ||||
| 3 (8,8%) | 2 (5,2%) | 1 (3%) | 2 (6,4%) | p=0,718 |
| Trombosis de catéter u otrosa | ||||
| 8 (23,5%) | 3 (7,9%) | 15 (46,8%) | 2 (6,4%) | p=0,201 |
| Mortalidad | ||||
| 4 (11,7%) | 8 (21%) | 6 (18,7%) | 0 (0%) | p=0,208 |
Se encontraron trombos asociados a catéter o en otras localizaciones (intracardiaco, en conductos o prótesis vasculares) en un 20% del total de los pacientes, sin relación con el empleo de rFVIIa (p=0,201). Sin embargo, estos eventos fueron más frecuentes en el grupo neonatal 23/66 (34,8%) que en el pediátrico 5/69 (7,2%) p=0,002), con un mayor número de trombos en catéter en los neonatos del grupo control (tabla 2).
Por otro lado, se encontró relación entre el uso de parada circulatoria y la aparición de trombos (el 31 frente al 14%; p=0,027), pero no con los ACV (el 4,2 frente al 7,5%; p=0,456). Tampoco existió relación entre la duración de CEC (p=0,336) o del clampaje aórtico (p=0,953) y la presencia de complicaciones trombóticas.
Fallecieron 18 pacientes, 12 (16,6%) tratados con rFVIIa y 6 controles (9,5%), sin existir diferencias (p=0,208). En ningún caso el fallecimiento fue atribuible al tratamiento con rFVIIa.
DiscusiónEl rFVIIa se utiliza cada vez más en el tratamiento de las hemorragias graves de muy diversas causas, aunque estas indicaciones todavía no han sido aceptadas por las agencias de medicamentos6,13,14. Sus principales ventajas son la eficacia y rapidez en el control de la hemorragia, y su acción hemostática local, que disminuye los efectos adversos sistémicos.
Aunque se han publicado varios estudios con resultados favorables en cuanto a efectividad y variables en cuanto a la seguridad, la mayoría de ellos tiene un tamaño muestral pequeño, con indicaciones de administración dispares y sin grupos control7,13,15.
En nuestra serie, los niños que requirieron la administración de rFVIIa fueron sometidos a procedimientos quirúrgicos de enorme complejidad y gravedad, como se evidencia por los tiempos de CEC más prolongados (incluso tras excluir a los pacientes trasplantados) y por la distribución de los mismos en las categorías altas de RACHS-1, lo que debe tenerse en cuenta al evaluar el porcentaje de niños que presentaron hemorragia grave y la mortalidad en el grupo de casos. A pesar de ello, el rFVIIa demostró su utilidad en el control de sangrado periquirúrgico grave.
El diseño de casos-controles pareado utilizado permite controlar factores de confusión relevantes para el riesgo de desarrollo de eventos trombóticos, como la complejidad del procedimiento quirúrgico16 y la edad y la inmadurez de los pacientes17.
En nuestro estudio, no encontramos relación entre el uso de rFVIIa y el desarrollo de ACV o trombos. La incidencia de efectos adversos graves como el ACV fue similar a la observada en el grupo de controles y a otras series de niños sometidos a CEC18, lo que sugiere que no es debido al uso de rFVIIa.
El grupo de neonatos presentó una mayor incidencia global de trombos en relación con el catéter, al igual que en otros estudios6. Esto podría ser debido a factores mecánicos relacionados con la mayor desproporción del calibre del catéter con el de la cava y el sistema femoroilíaco en comparación con los niños mayores, con una mayor viscosidad sanguínea (hematocrito más alto) y, por otro lado, con factores propios de la inmadurez, que les confiere un mayor riesgo tanto de sangrado como de hipercoagulabilidad17,19.
Sin embargo, a pesar de tener un mayor tamaño muestral que otros estudios6,7,20 y disponer de un grupo control, nuestro trabajo presenta la limitación de ser retrospectivo. Por ello, es necesario realizar estudios prospectivos que avalen la seguridad del rFVIIa.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.