Introducción
Los conocimientos actuales sobre los determinantes fisiológicos del tamaño testicular en los adultos son escasos. Algunos estudios han demostrado una correlación positiva entre el volumen testicular y la talla, el peso, el índice de masa corporal y la superficie corporal 1. El macroorquidismo se define como un volumen testicular mayor que el correspondiente al percentil 95 para la edad. Esta entidad suele aparecer asociada al síndrome X frágil o a otras formas inespecíficas de retraso mental 2,3. Otras posibles causas de aumento bilateral del tamaño testicular son el hipotiroidismo severo de larga evolución en la etapa prepuberal, los restos adrenales en la hiperplasia suprarrenal congénita, los macroadenomas secretores de la hormona foliculoestimulante (FSH), los tumores locales y los linfomas 1,4. En ocasiones no se encuentra ninguna patología que explique el aumento del tamaño gonadal; en estos casos se emplea el término de macroorquidismo benigno idiopático2. Presentamos un caso de macroorquidismo bilateral en un niño de 11,5 años. En la analítica básica, el estudio hormonal, la ecografía testicular, la resonancia magnética (RM) cerebral, el estudio genético y la biopsia testicular no se encontró ninguna anomalía que justificase este exagerado aumento bilateral del volumen testicular.
Observación clínica
Un niño de 11,5 años fue remitido por su pediatra al Servicio de Cirugía Pediátrica de nuestro hospital, por haber detectado en una revisión un aumento excesivo del volumen testicular. Se realizó una ecografía testicular por la que fue diagnosticado de hidrocele bilateral y se le realizó una evacuación quirúrgica del hidrocele. Como la escasa cantidad de líquido extraído no justificaba el enorme tamaño testicular del paciente, se decidió obtener en el mismo acto quirúrgico una biopsia del testículo izquierdo. El volumen testicular no disminuyó tras la intervención. Posteriormente, el paciente fue remitido al Servicio de Endocrinología Pediátrica para evaluación de un macroorquidismo bilateral.
Antecedentes personales
Embarazo y parto normales. Al nacimiento el peso fue de 3.650 g y midió 51 cm. El desarrollo psicomotor era normal, con buen rendimiento escolar. No se había detectado ningún cambio en la velocidad de crecimiento.
Antecedentes familiares
La madre tenía 37 años, era sana y tuvo la menarquia a los 13 años. El padre tenía 42 años y era sano. El volumen testicular del padre era de 20 ml. No existían antecedentes de macroorquidismo en la familia.
Exploración física
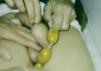
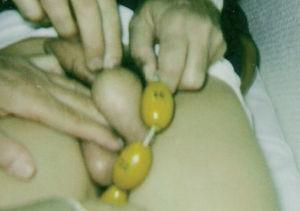
Se objetivó una talla de 149 cm y un peso de 42 kg (ambos se encontraban en el percentil 75 según las curvas de crecimiento de Hernández). No se observaron rasgos dismórficos ni manchas cutáneas. Tenía una pubarquia de grado II-III de Tanner. La longitud del pene era de 6 cm y estaba discretamente engrosado. Mediante comparación con el orquidómetro de Prader se estimó un volumen testicular derecho de 30 ml e izquierdo de 35 ml (figs. 1 y 2). La piel escrotal no estaba hiperpigmentada. El resto de la exploración física fue normal.
Figura 1. Fotografía de los genitales del paciente.
Figura 2. Medición del testículo izquierdo mediante comparación con el orquidómetro de Prader. Se estima un volumen testicular aproximado de 40 ml.
Pruebas complementarias
El hemograma y la bioquímica sanguíneas fueron normales. La edad ósea, según los estándares de Greulich y Pyle era de 11,5 años. El estudio hormonal mostró los siguientes resultados: FSH 5,28 mU/ml (normal: 1-10,5), LH 1,21 mU/ml (normal: 1-7), prolactina 4,85 ng/ml (normal: 0-17), testosterona 2,31 ng/ml (normal: 2,80-9,00), estradiol 12 pg/ml (normal: 0-40), 17-OH-progesterona 1,40 ng/ml (normal: 0,4-3,30), TSH 3,53 μU/ml (normal: 0,25-4,94), T4: 1,32 ng/dl (normal: 0,70-1,64). Se solicitaron marcadores tumorales. La β -HCG era inferior a 1 U/ml y la a -fetoproteína 1,74 ng/ml (normales). El cariotipo fue 46XY normal y el estudio molecular para el síndrome X frágil resultó negativo. En la ecografía testicular se visualizaron unos testes de aspecto puberal, de ecogenicidad homogénea y con vascularización normal. En la RM cerebral del área selar no se halló ninguna anomalía.
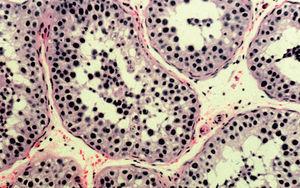
La descripción anatomopatológica de la biopsia testicular izquierda fue la siguiente: el diámetro tubular medio era de 163 μ (el normal adulto es de 180-200), y en la mayoría de los túbulos se observaba luz. En el estudio cuantitativo del epitelio seminífero por sección transversal se encontraron 13 espermatogonias (normal adulto: 17-25), 16 espermatocitos de primer orden (normal adulto: 25-37), 17 espermátidas jóvenes (normal adulto: 30-44), 4 espermátidas adultas (normal adulto: 21-29), 21 células de Sertoli (normal adulto: 9-12). El intersticio carecía de células de Leydig adultas, y sólo se observan algunos precursores de aspecto fibroblástico. No se observó lesión ocupante de espacio ni infiltrados inflamatorios (fig. 3).
Figura 3. Imagen de la biopsia testicular.
Discusión
El volumen testicular normal en el adulto puede variar entre 15 y 25 ml. Un tamaño gonadal inferior a 15 ml se considera un indicador fiable de la existencia de alguna lesión o disfunción del epitelio seminífero 1. Sin embargo, apenas se ha estudiado la fisiopatología y el significado clínico de los testículos cuyo volumen supera el límite de 25 ml.
El macroorquidismo es una entidad infrecuente en niños y adolescentes. Generalmente se encuentra asociado a retraso mental, alargamiento facial y orejas prominentes, que indican síndrome X frágil, que se produce por una expansión de la repetición del trinucleótido CGG localizada en el primer exón del gen FMR1 en Xq27.35,6. A pesar de que el excesivo volumen testicular que presentaba nuestro paciente no se acompañaba de ningún otro rasgo propio del citado síndrome, se solicitó el estudio del gen FMR1, y no se detectó ninguna alteración.
El hipotiroidismo severo de larga evolución en la infancia puede ocasionar un macroorquidismo bilateral sin signos de virilización. La causa de esta asociación no está clara. Al parecer, la elevación de la hormona tiroestimulante (TSH) podría estimular la secreción de FSH, sin actuar sobre la liberación de la hormona luteoestimulante (LH). Las concentraciones aumentadas de FSH producirían una hiperplasia de las células de Sertoli 4,7. En nuestro caso, el paciente no tenía clínica de hipotiroidismo, y las determinaciones de TSH y T4L resultaron normales.
En los niños afectados de déficit de 21-hidroxilasa mal controlados, el aumento de la hormona adrenocorticotropa (ACTH) puede originar una hiperplasia de restos adrenales testiculares, lo que produce un aumento importante del tamaño testicular 8. El patrón histológico de esta entidad es muy similar al observado en los tumores de células de Leydig, lo que puede dar lugar a orquidectomías innecesarias 9. En nuestro paciente las pruebas de imagen, los valores sanguíneos de 17-OH-progesterona y la biopsia testicular descartaron la existencia de una hiperplasia testicular de restos adrenales.
Los macroadenomas hipofisarios productores de FSH pueden producir un incremento del tamaño testicular que se debe a un aumento en la longitud de los túbulos seminíferos. Tras la extirpación tumoral, desciende la concentración de FSH en sangre y regresa el tamaño testicular 10. Se han publicado 2 casos de macroorquidismo bilateral asociado a macroprolactinoma, pero se desconoce la relación entre ambas entidades 11. En el caso que presentamos, tanto las determinaciones de las hormonas hipofisarias como la RM del área selar resultaron normales.
Los linfomas testiculares primarios, que ocasionalmente pueden ser bilaterales, pueden producir un aumento del volumen testicular, en especial en pacientes ancianos 12. Los tumores testiculares primarios no suelen presentarse de forma bilateral.
En la literatura médica aparece publicado un caso de macroorquidismo en un varón de 24 años con déficit congénito de aromatasa causado por una mutación en el gen CYP1913. En otros casos afectados de la misma enfermedad, el volumen testicular es normal 14 o inferior a la normalidad 15. En nuestro paciente no hemos considerado este diagnóstico, dado que la concentración de estrógenos es normal y no existe retraso de edad ósea.
En el estudio anatomopatológico llama la atención el aumento del número de células de Sertoli en comparación con los parámetros normales en adultos. En la literatura médica existe un caso de macroorquidismo sin pubertad precoz asociado a un síndrome de McCune Albright en un niño de 3 años. En la biopsia, como sucede en nuestro paciente, se halló una hiperplasia de células de Sertoli sin que existiese maduración de las células de Leydig, lo que se atribuyó a una mutación activadora del gen Gsα expresada principalmente en las células de Sertoli 16.
En el caso que presentamos, las pruebas complementarias realizadas permitieron descartar todas las patologías hasta el momento descritas como causantes del macroorquidismo bilateral, por lo que se emitió el diagnóstico de macroorquidismo benigno idiopático.
El elevado número de células de Sertoli halladas en la biopsia a pesar de ser la concentración de FSH normal, induce a especular sobre una posible hiperfunción del receptor de la FSH en el túbulo seminífero, que produciría una hiperplasia de las células de Sertoli, que es la que condicionaría el aumento del tamaño testicular 2. Se ha descrito una mutación activadora en heterozigosis en el exón 10 del receptor de la FSH en un paciente hipofisectomizado, que, a pesar de tener concentraciones indetectables de gonadotropinas en sangre, mantenía la capacidad reproductora y un volumen testicular normal 17,18. Recientemente, se han hallado otras mutaciones en el mismo exón que conducen a una hiperfunción del receptor de la FSH en mujeres que padecen un síndrome de hiperestimulación ovárica espontánea 19,20. Esta mutación del receptor de gonadotropinas podría ser la causante de algunos casos del llamado macroorquidismo benigno idiopático 4.
Correspondencia: Dra. M. Álvarez-Acevedo García.
Marqués de Lozoya, 25, 6A, 28007 Madrid. España.
Correo electrónico: malvaracevedo@yahoo.es
Recibido en enero de 2005.
Aceptado para su publicación en agosto de 2005.