El linfoma anaplásico de células grandes (LACG) es una enfermedad poco frecuente en la infancia. Su localización más habitual es ganglionar o cutánea; la presentación endobronquial es extremadamente rara. A continuación se presenta el caso clínico de un varón de 10 años, en el que se llegó al diagnóstico de LACG endobronquial casualmente, al realizarle estudios por una lesión ósea benigna, debido a la ausencia de síntomas respiratorios inicialmente.
Anaplastic large cell lymphoma is a very rare disease in childhood. The most common location of this lymphoma is lymph node and skin, with endobronchial involvement being extremely rare. We report a case of a 10-year-old boy diagnosed by chance with an endobronchial anaplastic large cell lymphoma, while he was being investigated for a a benign bone disease, due to the initial absence of respiratory symptoms.
El linfoma anaplásico de células grandes (LACG) es una enfermedad poco frecuente en pacientes pediátricos. Representa el 10% de los linfomas en la infancia.
Es una entidad clasificada en el grupo de los linfomas no Hodgkin que inicialmente se consideraba un subtipo de histiocitosis maligna.
La enfermedad se caracteriza por afectar típicamente a los ganglios, principalmente periféricos, mediastínicos y abdominales, acompañado de síntomas generales (fiebre, astenia, anorexia, pérdida de peso, etc.). En menor frecuencia afecta a tejidos extraganglionares, clásicamente a la piel y al tejido pulmonar1–3. La localización endobronquial es muy rara aunque hay algunos casos descritos en la literatura médica.
El diagnóstico del LACG se realiza mediante criterios morfológicos (células de gran tamaño con núcleo excéntrico arriñonado) y por la expresión en las células tumorales del antígeno CD30 (Ki-1 o BERH-2), el antígeno EMA y el receptor de interleucina-2. La translocación t (2;5) (p23;q35) se ha descrito en más del 80% de los casos de LACG infantil3.
Caso clínicoVarón de 10 años de edad, previamente sano, que ingresó en este hospital por presentar dolor e impotencia funcional del tobillo izquierdo de 3 meses de evolución, lo que le dificultaba la marcha; no presentaba ninguna otra clínica acompañante ni traumatismo previo de la zona. En la exploración presentaba una leve tumefacción del tobillo, doloroso a la palpación, pero sin limitación de la movilidad del pie.
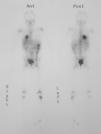
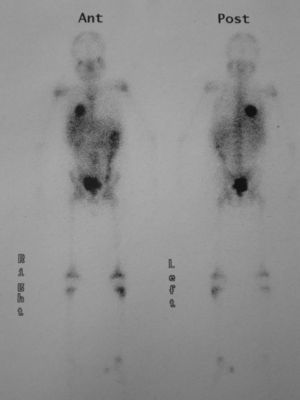
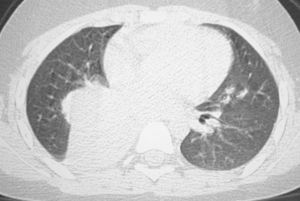
Se le practicó una radiografía del tobillo, en la que se apreció una lesión lítica en la epífisis distal de la tibia izquierda. Durante el estudio ampliado de la lesión ósea, mediante gammagrafía con galio se detectó la captación del marcador en las áreas distal y proximal de la tibia izquierda y la presencia de una masa en la base pulmonar derecha (fig. 1). Mediante tomografía computarizada (TC) de tórax se comprobó que se trataba de una masa hiliar derecha de 5,7×6,1×4cm, con una atelectasia pulmonar asociada, sin adenopatías mediastínicas o hiliares (fig. 2).
Durante los días de ingreso hospitalario el paciente comenzó a presentar dolor costal derecho y tos ocasional, sin disnea; permaneció afebril o con febrícula intermitente.
Se realizó biopsia pulmonar mediante toracoscopia, en la que no se encontraron células tumorales descubriéndose un derrame pleural asociado. Ante la sospecha de neumonía de causa infecciosa con derrame pleural paraneumónico se administró tratamiento antibiótico intravenoso con cefotaxima durante 15 días.
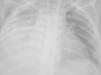
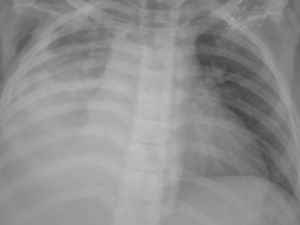
El paciente presentó mala evolución clínica, con deterioro respiratorio progresivo y con atelectasia masiva del pulmón derecho (fig. 3), lo que obligó a su intubación y conexión a ventilación mecánica.
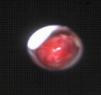
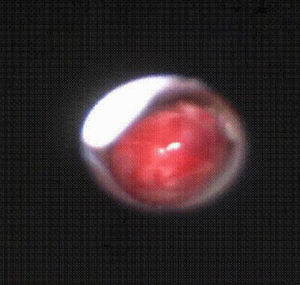
Posteriormente, cuando la situación del paciente lo permitió, se practicó una fibrobroncoscopia flexible y se descubrió una tumoración lobulada muy vascularizada y friable que emergía del bronquio principal derecho y se extendía hasta la carina, de la que se tomó una biopsia (fig. 4). El resultado de la biopsia confirmó el diagnóstico anatomopatológico de LACG con marcadores CD30 y ALK positivos. El estudio de extensión de la enfermedad fue negativo.
Simultáneamente se realizó una biopsia de la lesión ósea, que confirmó que se trataba de una displasia ósea fibrosa (una lesión benigna no relacionada con la enfermedad tumoral maligna diagnosticada en el paciente).
Se administró tratamiento quimioterápico según protocolo internacional para el tratamiento de los LACG de grupo de alto riesgo:
- •
Prefase: 5mg/m2/día (día 1 y día 2) y 10mg/m2/día (día 3 a día 5) de dexametasona; 200mg/m2/día (día uno y día 2) de ciclofosfamida, y tratamiento intratecal con hidrocortisona, arabinósido de citosina y metotrexato.
- •
Ciclo A1: 10mg/m2/día de dexametasona; 1g/m2/día (día uno) de metotrexato; 800mg/m2/día (del día uno al día 5) de ifosfamida; 300mg/m2/día (del día 4 al día 5) de arabinósido de citosina; 100mg/m2/día (del día 4 al día 5) de etopósido, y triple tratamiento intratecal.
Tras los 2 primeros ciclos de quimioterapia la respuesta tumoral fue favorable, con mejoría radiológica, lo que permitió disminuir los parámetros ventilatorios. Sin embargo, el paciente presentó posteriormente una mala evolución respiratoria y desarrolló un síndrome de distrés respiratorio del adulto refractario al tratamiento, que provocó el fallecimiento del enfermo 23 días después de su ingreso en la unidad de cuidados intensivos pediátricos.
DiscusiónLas manifestaciones extraganglionares del LACG son principalmente en la piel y, con menor frecuencia, en los huesos, el hígado, el bazo, el riñón, el pulmón, la pleura y el tracto gastrointestinal1–3. La presentación endobronquial es una forma clínica muy rara en pediatría y generalmente se presenta en pacientes con enfermedad diseminada. Hay pocos casos descritos con afectación exclusivamente endobronquial1–4. En 1986, Rose et al5 describieron 2 patrones de crecimiento de los linfomas no hodgkinianos endobronquiales: tipo i, caracterizado por infiltración submucosa difusa en el contexto de un linfoma sistémico intratorácico o extratorácico y clínica de neumonitis por probable diseminación linfohematógena (más frecuente), y el tipo ii, caracterizado por masa única en la luz de la vía aérea, con adenopatías regionales secundarias y clínica de obstrucción bronquial, sibilancias y atelectasias, probablemente debida al crecimiento de novo en el tejido linfoide asociado al bronquio.
El hallazgo de una masa endobronquial en un paciente obliga al diagnóstico diferencial entre las lesiones benignas (hamartomas, hemangiomas, papilomas, seudotumores inflamatorios y leiomiomas) y los tumores malignos (tumor carcinoide bronquial, adenoma bronquial, carcinoma mucoepidermoide, carcinoma adenoideo quístico y LACG6–8).
El crecimiento de una masa en la luz bronquial es generalmente lento e insidioso, por lo que va a generar en el paciente una sintomatología poco específica y hará difícil diagnosticar la enfermedad subyacente de forma precoz, como pueden ser neumonías recurrentes, atelectasias persistentes, sibilancias que no mejoran con broncodilatadores y tos improductiva, entre otros. Si se acompaña de sintomatología general, como los síntomas B de los linfomas o la liberación de histamina por parte de los tumores carcinoides (síndrome carcinoide), ésta contribuirá a su diagnóstico más precoz6. En algunos casos, los pacientes pueden presentar disnea grave por obstrucción de la luz bronquial, como ocurrió en este paciente.
El diagnóstico de la tumoración endobronquial se realiza por medio de las pruebas de imagen (radiología simple y TC), en las que se puede evidenciar una atelectasia pulmonar, la propia masa endobronquial y si se acompaña de afectación ganglionar mediastínica. El fibrobroncoscopio permite localizar la masa y realizar la toma de una muestra para anatomía patológica e inmunohistoquímica9. Igualmente facilita la realización del tratamiento local de la enfermedad e incluso la colocación de stents endobronquiales10, lo que permite la mejoría de la capacidad respiratoria del paciente.
Es importante destacar que la vía de elección de la biopsia es fundamental para obtener una muestra apropiada y permitir el diagnóstico y el tratamiento precoz de la enfermedad; se recomienda la vía de acceso endobronquial7,10. El inadecuado abordaje de la biopsia tumoral inicial en este paciente demoró el diagnóstico de la enfermedad.
El tratamiento del LACG se ha llevado a cabo con diferentes protocolos en los principales grupos de trabajo europeos: Alemania (protocolo NHL-BFM 86 y BFM 90)11, Francia (estudios HM89 y HM91)12, Reino Unido (UKCCSG 9001, 9002 y 9003)13 e Italia (AIEOP, LNH 91)14. En éstos se emplearon diferentes pautas de tratamiento poliquimioterápico con duración variable y presentaron resultados diversos en la supervivencia de los pacientes.
Posteriormente se inició el estudio del grupo Europeo15 con la intención de comparar los diferentes resultados y establecer los factores pronósticos. Incluye datos de los 225 niños tratados con protocolos BFM, SFOP y UKCCSG, con resultados de supervivencia global y libre de eventos a los 5 años de seguimiento del 81 y el 69%, respectivamente. Los mejores resultados se obtienen con el protocolo alemán, que es menos intensivo que el protocolo francés en términos de duración y de dosis acumulada de ciclofosfamida y adriamicina. El protocolo que recomienda el grupo Europeo, que es el que adopta actualmente la Sociedad Española de Hematología y Oncología Pediátrica, se basa en las pautas de tratamiento del grupo alemán.
Tras el análisis de los datos de los pacientes, se han establecido como principales factores de mal pronóstico la afectación mediastínica, la participación visceral (pulmonar, hepática o esplénica) y la presencia de lesiones cutáneas. El tratamiento debe estratificarse de acuerdo con estos factores de riesgo15.
Este paciente presentó una evolución desfavorable posiblemente secundaria a la demora en el diagnóstico, debido a la ausencia de síntomas respiratorios inicialmente y a la elección inadecuada de la vía de abordaje para la biopsia; además, asociaba un factor de mal pronóstico clínico relacionado son el LACG, como es la localización mediastínica.