La enfermedad metabólica ósea del prematuro (EMOP) es una entidad reconocida en neonatología, que se caracteriza por una insuficiente mineralización ósea. Afecta principalmente a los recién nacidos pretérmino (RNPT) en las primeras semanas de vida posnatal, y puede derivar en una densidad ósea inferior a la esperada para su edad gestacional (EG) y talla1,2, además de otras complicaciones a corto y largo plazo.
La EMOP es de origen multifactorial, y aún no se han establecido criterios diagnósticos precisos debido a la falta de consenso en los biomarcadores característicos. Esta falta de consenso en el diagnóstico dificulta cuantificar su incidencia, que se refleja variable en la literatura entre un 20 y 35% de los recién nacidos con extremado bajo peso1–4.
Las complicaciones asociadas a la EMOP, como la dependencia prolongada del respirador, el riesgo de fracturas, el desarrollo óseo anómalo, las alteraciones oculares y el fallo renal, no solo repercuten gravemente en el paciente, sino también en sus familias, al prolongar las hospitalizaciones y aumentar el estrés emocional; y en el sistema sanitario, ya que implican un aumento en el gasto sanitario y en el uso de recursos4,5.
Hasta el momento, la hipofosfatemia y la hiperfosfatasia han sido los marcadores más utilizados para el diagnóstico de la EMOP1, aunque no existe consenso sobre los umbrales considerados patológicos. Por ejemplo, en el protocolo de la Sociedad Española de Neonatología (SENeo) 2023, la hipofosfatemia (<4mg/dl) y la hiperfosfatasia (>500UI/l) son los marcadores propuestos para el riesgo de osteopenia, pero estos valores difieren entre los distintos centros y protocolos, subrayando la necesidad de unificar criterios y abordar esta patología de manera más homogénea.
Por esta razón, realizamos un estudio prospectivo y transversal, mediante encuestas online a neonatólogos españoles durante el año 2023. El objetivo principal fue analizar el consenso en la interpretación de los biomarcadores, el diagnóstico y el tratamiento de la EMOP en las unidades neonatales españolas.
La encuesta constaba de 12 preguntas: 8 relacionadas con el diagnóstico (valores normales de fósforo y fosfatasas alcalinas [FA], criterios de cribado, momento de realización, población a la que se debe realizar y metodología), y 4 sobre el manejo (inicio y finalización del tratamiento, controles y seguimiento)1–4. Se consideró consenso con un acuerdo ≥75% (tabla 1).
Listado de las 12 preguntas incluidas en la encuesta distribuidas según área de estudio
| Preguntas | Respuesta más votada | ||
|---|---|---|---|
| Diagnósticas | Valor patológico fósforo | <5mg/dl | 33% |
| Valor patológico FA | >500UI/l | 60,5% | |
| Cuándo realizar cribado | 4 semanas de vida | 58% | |
| Influencia del tipo de lactancia en el momento de iniciar el cribado | No | 94% | |
| Población cribada | RNPT<1.500g o con EG<32 semanas, sin tener en cuenta otros factores de riesgo | 67% | |
| Método de cribado | Analítica sanguínea y orina | 58% | |
| Inclusión PTH y vitamina D en el cribado | Sí | 50% | |
| Diagnóstico radiológico | No | 81,5% | |
| Terapéuticas | Tratamiento | Aumentar fortificación al máximo y si se requiere, añadir suplementos de calcio y/o de fósforo | 80% |
| Primer control postratamiento | A las 2 semanas del cribado | 80% | |
| Cuando retirar el tratamiento | Normalización de las FA | 78% | |
| Seguimiento | Sí | 98,8% | |
Se incluye la respuesta más votada y el porcentaje de acuerdo de esta. Se ha considerado acuerdo cuando el porcentaje es ≥75% y está marcado en color verde.
FA: fosfatasas alcalinas; PTH: parathormona; RNPT: recién nacidos pretérmino.
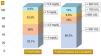
Se recibieron 81 respuestas (n=81). No se alcanzó consenso sobre la población a la que se debe realizar el cribado, los estudios que se deben realizar ni sobre los valores considerados patológicos de los parámetros diagnósticos, en particular el fósforo y las FA. En cuanto al fósforo considerado más frecuentemente en la bibliografía como patológico (<5,5mg/dl)1,3, solo es considerado patológico por el 8,6% de los encuestados. Las FA se consideraron elevadas (>500UI/l) en el 60,5% de los casos (fig. 1). El 58% de los neonatólogos realizaban el primer cribado a las 4 semanas de vida (tabla 1).
En cuanto a la población a la que se realizaba el cribado, la mayoría (67%) indicaba el cribado para RNPT<1.500g o con EG<32 semanas, sin tener en cuenta otros factores de riesgo. Este cribado se realizaba mediante análisis de sangre y orina en el 58% de los casos. En cuanto a la solicitud de PTH y vitamina D, estas solo se solicitaban de primera instancia en la mitad de las unidades (tabla 1).
Respecto al tratamiento, el 80% de los encuestados aumentaba la fortificación y añadía suplementación oral si era necesario. El primer control postratamiento se realizaba a las 2 semanas en el 80% de los casos. A pesar de que la EMOP presenta hallazgos radiológicos específicos, el 81,5% de los encuestados no realizaba estudios de imagen. Finalmente, el 78% de los neonatólogos retiraba la suplementación cuando se normalizaban los valores de las FA (tabla 1).
Las principales limitaciones del estudio estuvieron relacionadas con el diseño de la encuesta, que fue anónima y no incluyó información sobre el centro de trabajo, nivel asistencial ni experiencia del encuestado. Sin embargo, consideramos que los resultados obtenidos reflejan la variabilidad diagnóstica y terapéutica que rodea a esta enfermedad.
En conclusión, actualmente la EMOP es una enfermedad de incidencia incierta, con biomarcadores sin umbrales claramente definidos como se refleja en los datos recogidos en nuestra encuesta. Existe una amplia variabilidad en el manejo diagnóstico y terapéutico de esta enfermedad en las diferentes unidades de neonatología en España. La falta de protocolos establecidos dificulta el manejo adecuado de estos pacientes, aumentando el riesgo de complicaciones1–5. Por ello, esperamos que este trabajo inspire esfuerzos conjuntos para revisar y unificar los distintos protocolos ofreciendo una propuesta más clara y concisa de criterios diagnósticos y manejo para esta entidad tan frecuente en las unidades de neonatología.