La nutrición enteral exclusiva (NEE) ha demostrado ser más efectiva que los esteroides para alcanzar la curación mucosa sin sus efectos secundarios.
ObjetivosDeterminar la eficacia de la NEE para inducir la remisión clínica y mejorar el grado de inflamación mucosa en pacientes con EC durante su primer brote.
Material y métodosRevisión de las historias clínicas de pacientes con EC tratados con NEE durante su primer brote. El grado de inflamación mucosa se estimó mediante la calprotectina fecal (CF). Se definió remisión como PCDAI < 10.
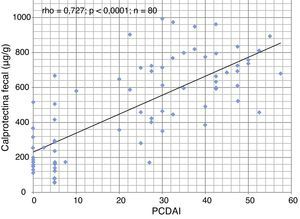
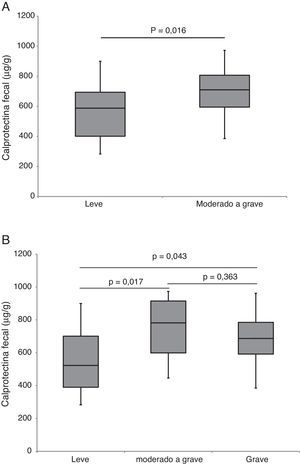
ResultadosSe incluyó a 40 pacientes (24 varones) con una edad al diagnóstico de 11,6 ± 3,6 años. La duración de la NEE fue de 6,42 semanas (RIC 6,0-8,14). De los 34 pacientes que completaron el período de NEE, 32 (94% en el análisis por protocolo) alcanzaron la remisión clínica. Este porcentaje descendió al 80% en el análisis por intención de tratar. La tasa de cumplimiento fue del 95%. Los valores de CF fueron significativamente más altos en pacientes con brotes moderados y graves. La CF basal fue de 680μg/g y descendió de forma significativa a 218μg/g al final del periodo de NEE (p < 0,0001). Hubo correlación estadísticamente significativa entre CF y PCDAI (rho=0,727; p < 0,0001). La introducción precoz del tratamiento con tiopurinas (antes de las 8 semanas) no se asoció a una mejor evolución durante el seguimiento.
ConclusionesLa NEE administrada durante 6-8 semanas es efectiva para inducir la remisión clínica y mejorar el grado de inflamación mucosa. No encontramos diferencias en términos de mantenimiento de la remisión en pacientes tratados precozmente con tiopurinas.
Exclusive enteral nutrition (EEN) has been to be more effective than corticosteroids in achieving mucosal healing without their side effects.
ObjectivesTo determine the efficacy of EEN in terms of inducing clinical remission in newly diagnosed CD children and to study the efficacy of this therapeutic approach in improving the degree of intestinal mucosa inflammation.
Materials and methodsThe medical records of patients with newly diagnosed Crohn's disease treated with EEN were reviewed retrospectively. The degree of mucosal inflammation was assessed by fecal calprotectin (FC). Remission was defined as a PCDAI<10.
ResultsForty patients (24 males) were included, the age at diagnosis was 11.6±3.6 years. Of the 34 patients who completed the EEN period, 32 (94% per-protocol analysis) achieved clinical remission. This percentage fell to 80% in the intention-to-treat analysis. The compliance rate was 95%. Duration of EEN was 6.42 weeks (IQR 6.0–8.14). FC was significantly higher in patients with moderate and severe disease. Median baseline FC levels (680μg/g) decreased significantly to 218μg/g (P<0.0001) after EEN. We found a statistically significant correlation between FC and PCDAI (rho=0.727; P<0.0001). Early use of thiopurines (< 8 weeks) versus subsequent use was not associated with improved outcomes during the follow-up.
ConclusionsEEN administered for 6-8 weeks is effective for inducing clinical remission and decreasing the degree of mucosal inflammation. We did not find differences in terms of maintenance of remission in patients treated early with thiopurines.
La enfermedad de Crohn (EC) es un trastorno inflamatorio crónico idiopático. Su curso natural se caracteriza por brotes de actividad que alternan con períodos de remisión. El control de la inflamación intestinal es crucial para prevenir la progresión del daño intestinal y el desarrollo de posibles complicaciones1.
La incidencia de la EC en la infancia y la adolescencia es aproximadamente de 3 casos por cada 100.000 habitantes (rango, 1-8/100.000 habitantes), y en la última década ha aumentado tanto en España como en el resto de Europa2. Hasta un 20% de los casos de EC se diagnostican antes de los 18 años de edad. Los casos en niños y en adultos difieren en el inicio de la enfermedad, su curso natural y los regímenes de tratamiento. Otra diferencia importante es el retraso del crecimiento, ya que hasta el 46% de los niños y adolescentes diagnosticados de EC presentan una disminución de la velocidad de crecimiento previo al comienzo de cualquier otra sintomatología, y solo el 12% tiene una velocidad de crecimiento normal al diagnóstico3. Esto no solo se observa en el momento del diagnóstico, sino que también tiene una prevalencia variable durante el seguimiento4. También ha de tenerse en cuenta que la aparición de enfermedades crónicas durante la infancia va asociada a una morbilidad psicológica considerable susceptible de afectar a las relaciones personales, el desarrollo puberal, el rendimiento académico y el cumplimiento del tratamiento.
Hay un amplio abanico de objetivos terapéuticos a conseguir, entre los que se incluyen controlar la inflamación, curar la mucosa, alterar la progresión de la enfermedad, prevenir los efectos adversos del tratamiento y garantizar un crecimiento y un desarrollo adecuados5,6. Se ha comprobado que la nutrición enteral exclusiva (NEE) es más efectiva que los esteroides —y sin los efectos secundarios de estos— para lograr la remisión mucosa y transmural, un estado asociado a una evolución más favorable en los años siguientes, una menor tasa de hospitalización y un uso menos frecuente de fármacos biológicos7-11.
La calprotectina es una proteína fijadora de calcio que posee propiedades antimicriobianas. La calprotectina fecal es liberada del citroplasma de los neutrófilos activados y sus niveles en heces aumentan durante la inflamación intestinal12. Los niveles de calprotectina fecal (CF) se correlacionan con los índices endoscópicos de adultos y niños diagnosticados de enfermedad inflamatoria intestinal (EII). Se trata de un marcador biológico no invasivo y con una elevada sensibilidad y especificidad, que permite monitorizar la actividad inflamatoria y predecir la recaída clínica12-17.
ObjetivosLos objetivos del presente estudio fueron determinar la eficacia de la NEE para inducir la remisión clínica en pacientes diagnosticados de EC y para mejorar el grado de inflamación mucosa utilizando como marcador no invasivo la CF y evaluar la eficacia del tratamiento concomitante. Otro objetivo fue conocer si la introducción precoz del tratamiento con tiopurínicos (antes de las 8 semanas) mejoraba la evolución a largo plazo en comparación con su introducción tras la recaída clínica.
Materiales y métodosEstudio retrospectivo observacional en el que se incluyeron los pacientes menores de 14 años diagnosticados de EC y que recibieron nutrición enteral exclusiva durante su primer brote de enfermedad. El diagnóstico de EC se realizó atendiendo a criterios clínicos, endoscópicos, histológicos y radiológicos18. Quedaron excluidos los pacientes diagnosticados de colitis ulcerosa, colitis indeterminada, colitis eosinofílica o colitis infecciosa.
Todos los pacientes recibieron fórmula polimérica, Modulen IBD® o Resource IBD® (un mismo producto comercializado con nombres diferentes), que se prepararon de igual modo mezclando 1.700ml de agua con 400g de producto, lo que daba lugar a 2.000ml de fórmula (1kcal/ml). El volumen a administrar se calculó empleando la fórmula de Schofield, que estima el gasto energético basal19. Las tomas se incrementaron gradualmente hasta alcanzar el volumen pautado en 3-5 días y solo se permitió la ingesta de agua durante el tratamiento. La NEE se administró durante un período de 6 a 8 semanas.
Los datos recogidos fueron edad, sexo, antecedentes familiares de EII, tiempo transcurrido desde el diagnóstico y el tratamiento farmacológico concomitante. El fenotipo de la EC se estableció atendiendo a la clasificación de París20. Se evaluó a todos los pacientes al comienzo y al final del período de NEE, las variables que se analizaron fueron peso, talla, índice de masa corporal (IMC), proteína C reactiva (PCR), velocidad de sedimentación globular (VSG), albúmina, hemograma, CF (Calprest®, Eurospital, Italia) y el índice de actividad de la enfermedad de Crohn pediátrica (PCDAI)21,22. El peso y la talla se midieron con el paciente descalzo y en ropa interior. Las muestras para la determinación de la CF fueron tomadas por el paciente en su domicilio el día antes de la prueba y se entregaron refrigeradas al laboratorio para su análisis inmediato. La remisión clínica se definió como un PCDAI < 10 y la respuesta clínica como un cambio de más de 12,5 puntos sobre el PCDAI basal tras 6-8 semanas de NEE. Los niveles de CF se consideraron normales si se encontraban por debajo de los 50μg/g de heces. Las puntuaciones Z del peso, talla e IMC se calcularon utilizando los datos del Estudio Español del Crecimiento23.
Análisis estadísticoLas variables que seguían una distribución normal se expresaron como media ± desviación estándar y las variables con distribuciones no normales como mediana y rango intercuartílico (RIC). La normalidad de la distribución de los datos se comprobó mediante la prueba de Kolmogorov-Smirnov. Se utilizaron la prueba de la t de Student y la prueba de los rangos con signo de Wilcoxon para muestras pareadas, y la prueba de Chi cuadrado para comparar proporciones. Para comparar los niveles de CF en relación con el PCDAI se aplicó el test no paramétrico de Kruskal Wallis y si se rechazaba la hipótesis de igualdad, para ver que grupos difieren entre sí, se compararon 2 a 2 mediante la prueba de Mann Whitney con la corrección de Bonferroni. El análisis de supervivencia se realizó mediante el método de Kaplan-Meier. Las curvas de supervivencia se compararon mediante la prueba de log rank. El nivel de significación estadística se estableció en p < 0,05.
ResultadosCaracterísticas de los pacientesSe incluyó a 40 pacientes; 24 eran varones (60%) con una edad al diagnóstico de 11,6 ± 3,6 años (tabla 1). Seis pacientes tenían antecedentes familiares de EII (EC en 4 y colitis ulcerosa en 2). El tiempo transcurrido desde la aparición de síntomas hasta el diagnóstico fue de 4,2 meses (RIC 2,3-12,1), siendo ligeramente menor en los pacientes con historia familiar de EII (4,7 meses [RIC 2,4-12,2] vs. 3,5 meses [RIC 1,4-8,5], p = 0,394).
Características de los pacientes tratados con nutrición enteral exclusiva
| Varones | 24/40 (60%) | |
| Edad al diagnóstico (años) | 11,6 ± 3,6 | |
| Antecedente familiar de EII | 6/40 (15%) | |
| Tiempo de evolución al diagnóstico (meses) | 4,2 (RIC 2,3-12,1) | |
| Clasificación de París | ||
| L1 | 6 (15%) | |
| L2 | 5 (12,5%) | |
| L3 | 16 (40%) | |
| L3+L4 (extensa) | 13 (32,5%) | |
| B1 | 39 (97,5%) | |
| B2 | 1 (2,5%) | |
| Perianal (p) | 13 (32,5%) | |
| Retraso del crecimiento (G1) | 11 (27,5%) | |
| PCDAI | PCDAIa | PCDAIb |
| Leve | 11 (27,5%) | 10 (25%) |
| Moderado | * | 8 (20%) |
| Grave | 29 (72,5%) | 22 (55%) |
| Tratamiento al inicio de la NEE | ||
| 5-ASA | 13 (32,5%) | |
| Metronidazol | 7 (17,5%) | |
| 5-ASA y metronidazol | 18 (45%) | |
| Metronidazol y azitromicina | 1 (2,5%) | |
| Ninguno | 1 (2.5%) | |
EII: Enfermedad Inflamatoria Intestinal; PCDAI: índice de actividad de la enfermedad de Crohn pediátrica; RIC: rango intercuartílico.
El nivel basal de CF fue de 680μg/g (RIC 524-796) y descendió significativamente a 218μg/g (RIC 149-402; p < 0,0001) tras la NEE. Encontramos una correlación estrecha (fig. 1) entre la CF y el PCDAI (rho = 0,727; p < 0,0001). La CF fue significativamente más alta (p = 0,04) en pacientes con enfermedad moderada y grave (fig. 2).
Al inicio de la NEE, los pacientes estaban recibiendo mesalazina (32,5%), metronidazol (17,5%) o ambos (45%) como tratamiento concomitante (tabla 1). Una vez se hubo revisado y optimizado su calendario de vacunaciones, 27 de los 40 pacientes (67,5%) iniciaron tratamiento con azatioprina con dosis de entre 2,5 y 3,0mg/kg/día, en una mediana de 9 días (RIC 0-19). En 2 casos fue preciso suspender la azatioprina, en uno por intolerancia (dolor abdominal y náuseas) y en otro por pancreatitis; en ambos pacientes se cambió a 6-mercaptopurina sin incidencias.
Respuesta a la nutrición enteral exclusivaSeis pacientes no completaron las 6-8 semanas de NEE; 2 decidieron abandonarla tras 2 semanas y otros 4 recibieron esteroides tras 3 semanas de NEE al no constatarse respuesta. La NEE se administró por vía oral, salvo en un paciente, que requirió sonda nasogástrica. La duración de la NEE fue de 6,4 semanas (RIC 6-8,1). De los 34 pacientes que completaron el período de NEE, 32 (94% en el análisis por protocolo) alcanzaron la remisión clínica. Este porcentaje descendió al 80% en el análisis por intención de tratar. La tasa de cumplimiento fue del 95%. Se observó un aumento significativo en el peso, niveles de albúmina, hemoglobina y hematocrito junto con un descenso significativo de la CF, PCR, VSG, leucocitos y plaquetas (tabla 2) al final de la NEE.
Aspectos clínicos antes y después de la NEE
| Antes de la NEE | Después de la NEE | Valor p | |
|---|---|---|---|
| Peso, puntuación Z media | −0.68 | −0,56 | 0,042 |
| Talla, puntuación Z media | −0,55 | −0,47 | 0,275 |
| IMC, puntuación Z media | −0,09 | 0,001 | 0,024 |
| PCDAI | 40 (RIC 28-47,5) | 5 (RIC 0-5) | <0,0001 |
| CF (μg/g) | 680 (RIC 524-796) | 218 (RIC 149-402) | <0,0001 |
| PCR (mg/l) | 33,9 (RIC 16,5-67,2) | 3,1 (RIC 2,4-9,0) | <0,0001 |
| VSG (mm/h) | 29 (RIC 21,5-49) | 11 (RIC 7-16) | <0,0001 |
| Albúmina (g/dl) | 3,2 (RIC 2,7-3,6) | 4,1 (RIC 3,7-4,3) | <0,0001 |
| Hemoglobina (g/dl) | 11,4 (RIC 9,9-12,3) | 12,8 (RIC 11,5-13,3) | <0,0001 |
| Hematocrito (%) | 35,2 (RIC 31,7-37,7) | 38 (RIC 35-39,7) | <0,0001 |
| Leucocitos (×103/μl) | 10,6 ± 3,6 | 7,7 ± 2,6 | <0,0001 |
| Plaquetas (×103/μl) | 533 ± 140 | 443 ± 150 | <0,0001 |
CF: calprotectina fecal; NEE: nutrición enteral exclusiva; IMC: índice de masa corporal; PCDAI: índice de actividad de la enfermedad de Crohn pediátrica; PCR: proteína C reactiva; RIC: rango intercuartílico; VSG: velocidad de sedimentación globular.
Todos los pacientes toleraron bien la NEE y no hubo ninguno que declarara haber experimentado efecto secundario alguno durante este período. Al finalizar la NEE, se introdujeron progresivamente los diferentes grupos de alimentos sin incidencias.
No se apreciaron diferencias significativas en la tasa de respuesta en relación a la gravedad del brote según el PCDAI21 (91% vs. 76%, p = 0,136), aunque sí se encontraron diferencias en la respuesta al aplicar los nuevos puntos de corte del PCDAI22 (90% en EC leve, 100% en EC moderada y 68,2% en EC grave; p = 0,05). También se hallaron diferencias estadísticamente significativas en relación con la localización de la EC (88% para L1+L3 vs. 50% para L2; p = 0,047), si bien solo 5 pacientes tuvieron una localización L2 de la EC.
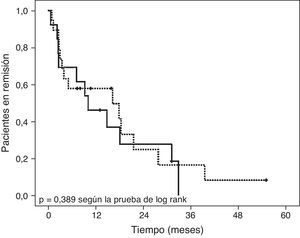
SeguimientoDiecinueve de los 32 pacientes (59,4%) que alcanzaron la remisión clínica habían comenzado tratamiento precoz (≤ 8 semanas después de iniciar la NEE) con azatioprina (tabla 3). Al final del periodo de seguimiento (fig. 3), 5 pacientes (26,3%) tratados con azatioprina como terapia de mantenimiento y 2(15,3%) que no habían recibido tratamiento de mantenimiento continuaban en remisión (diferencia del 11%; intervalo de confianza [IC] del 95%,−3,13% a 25,13%; p = 0,389). No se detectaron diferencias entre grupos en el tiempo transcurrido hasta la recaída (8,1 meses [RIC 3.18] en el grupo de azatioprina precoz vs. 10 meses [2,6-24,6] en el grupo de azatioprina tardía; p = 0,954). La duración mediana del período de seguimiento fue de 2,9 años (RIC 1,8-4,8) para ambos grupos.
Comparación de los pacientes con tratamiento precoz (≤ 8 semanas) o posterior (> 8 semanas) con inmunomoduladores, al diagnóstico y durante el seguimiento
| Tratamiento precoz con IM (≤ 8 semanas) | Tratamiento posterior con IM (> 8 semanas) | Valor p | |
|---|---|---|---|
| Número de pacientes | 19 | 13 | |
| Edad al diagnóstico (años) | 10,9 ± 2,8 | 11,9 ± 3,8 | 0,910 |
| Tiempo de evolución al diagnóstico (meses) | 6,4 (RIC 3,7-12,2) | 2,5 (RIC 1,4-4,1) | 0,005 |
| L1 | 4/19 (21%) | 2/13 (15%) | 0,530 |
| L2 | 1/19 (5%) | 1/13 (8%) | 0,655 |
| L3 | 14/19 (74%) | 10/13 (77%) | 0,052 |
| L4a o L4b | 9/19 (47%) | 2/13 (15%) | 0,066 |
| Retraso del crecimiento | 3/19 (16%) | 5/13 (38%) | 0,219 |
| Afectación perianal | 8/19 (42%) | 3/13 (23%) | 0,233 |
| IMC, mediana (kg/m2) | 16,7 (RIC 15,4-18,5) | 16 (RIC 14-19,3) | 0,383 |
| PCDAI, mediana | 35 (RIC 27,5-42,5) | 40 (RIC 30-46,2) | 0,545 |
| CF, media (μg/g) | 680 ± 154 | 596 ± 210 | 0,326 |
| PCR, mediana (mg/l) | 22 (RIC 16-47) | 62 (RIC 23-85) | 0,142 |
| VSG, mediana (mm/h) | 27 (RIC 20,7-39) | 51 (RIC 22-62) | 0,024 |
| Albúmina, mediana (g/dl) | 3,3 (RIC 2,9-3,5) | 3 (RIC 2,4-3,9) | 0,588 |
| Plaquetas, media (×103/μl) | 506 ± 107 | 547 ± 149 | 0,735 |
| Niveles altos de TPMT | 11/13 (84,6%) | 4/6 (66,7%) | 0,373 |
| Niveles intermedios de TPMT | 2/13 (15,4%) | 2/6 (33,3%) | 0,373 |
| Seguimiento | |||
| Tiempo hasta la recaída (meses) | 8,1 (RIC 3-18) | 10 (RIC 2,6-24,6) | 0,954 |
| Tasa de recaída a los 12 meses | 9/19 (47,3%) | 7/13 (53,8%) | 0,719 |
| Tasa de recaída a los 18 meses | 1/7 (14,3%) | 1/5 (20%) | 0,793 |
| Tasa de recaída a los 24 meses | 3/6 (50%) | 1/4 (25%) | 0,429 |
| Seguimiento medio (años) | 2,83 (RIC 1,1-4,7) | 2,57 (RIC 1,8-5,43) | 0,343 |
| Suplementación con fórmula enteral | 18/19 (94,7%) | 12/13 (92,3%) | 0,613 |
| Duración de la suplementación (meses) | 12 (RIC 6,9-22,37) | 10,7 (RIC 3,5-66,9) | 0,933 |
| Tratamiento con prednisona durante el seguimiento | 4/19 (21%) | 11/13 (84,6%) | 0,001 |
| Cambio de patrón clínico en la EC (B1 a B2) | 0/19 | 1/13 | 0,406 |
| Tratamiento con IFX o ADA durante el seguimiento | 11/19 (58%) | 5/13 (38%) | 0,473 |
| Intervalo (meses) del diagnóstico al inicio de terapia anti-TNF | 15,8 (RIC 3-23) | 11 (RIC 8-57) | 0,583 |
Nuestro estudio muestra que la NEE induce la remisión clínica y bioquímica, y la recuperación de peso en pacientes con nuevo diagnóstico de EC. Aunque no se realizó una endoscopia al finalizar la NEE, la marcada reducción en la CF indica una clara mejoría en el grado de inflamación de la mucosa intestinal12-15. La tasa de curación mucosa alcanzada con la NEE es similar, en muchos casos, a la obtenida por los anti-TNF, y mayor que con los esteroides9-11,24-26. Las publicaciones que argumentan estos resultados pueden estar sesgadas ya que es mucho más probable que la NEE se administre en pacientes al debut o con enfermedad leve-moderada a diferencia de lo que ocurre con los esteroides o anti-TNF, reservados para casos graves o con mayor tiempo de evolución. No obstante, al contrario que los esteroides, la NEE tiene un efecto positivo sobre el crecimiento lineal, con un incremento en la velocidad de crecimiento y en la densidad mineral ósea en los 6 meses posteriores al inicio de la NEE27-30.
En un estudio reciente de 34 pacientes11, el 58% de los pacientes tratados con NEE alcanzaron la remisión endoscópica (evaluada mediante el índice SES-CD31) y el 21% alcanzó la remisión transmural, evaluada por medio de entero-resonancia magnética. Los autores demostraron que la remisión endoscópica precoz se asociaba a tasas menores de recaída endoscópica, a un uso menor de la terapia anti-TNF-α y a un número menor de ingresos un año después del diagnóstico. La respuesta fue más favorable en pacientes con diagnósticos más recientes. El mismo estudio muestra que la inducción de la remisión con esteroides en lugar de con la NEE aumenta el riesgo de falta o pérdida de respuesta a la terapia anti-TNF-α.
La eficacia de la NEE se observó por primera vez al comienzo de los años 70, cuando se descubrió que el estado clínico y nutricional de algunos pacientes había mejorado con el tratamiento con una fórmula elemental mientras esperaban a ser operados. Aunque se desconocen los mecanismos de acción de la NEE, existen varias hipótesis al respecto, como la modificación de la flora intestinal, la eliminación de la captación de antígenos alimentarios, la disminución de la síntesis intestinal de mediadores inflamatorios debido a una reducción de la cantidad de grasa en la dieta o el aporte de micronutrientes al intestino inflamado32.
Un análisis de los datos de más de 25 estudios pediátricos muestra que la eficacia global de la NEE es del 84% (IC del 95%, 81%-87%), si bien los estudios diferían en las fórmulas enterales utilizadas, los criterios de remisión clínica y la duración del tratamiento. La tasa de cumplimiento es muy alta, alcanzando el 90% (IC del 95%, 88%-92%). No se han encontrado diferencias en las tasas de remisión o de cumplimiento en relación con la fórmula enteral utilizada (polimérica, semielemental o elemental) ni con suplementos de glutamina o de triglicéridos de cadena media33. En nuestra serie solo se empleó un tipo de fórmula específica para la EC enriquecida con TGF-β, no permitiéndose la ingesta de ningún otro alimento, salvo agua durante el período de NEE. La nutrición enteral parcial (con el 50% de las calorías provenientes de una dieta normal) ha demostrado ser menos efectiva que la NEE34. Otras modalidades, como permitir que un 20% de las calorías diarias estimadas proviniesen de otros alimentos, no han mostrado una eficacia menor35.
En un primer momento se pensó que la terapia nutricional era más efectiva en pacientes con afectación ileal que en aquellos con afectación exclusivamente colónica. Actualmente, no se dispone de datos para establecer una correlación entre la respuesta a la NEE y el fenotipo de la enfermedad36. Hemos de añadir que en nuestra serie se apreciaron diferencias significativas en relación con la localización, aunque el número de pacientes con afectación exclusivamente colónica fue muy reducido.
Si bien nuestro estudio no fue diseñado para analizar el impacto del tratamiento precoz con tiopurinas en la evolución de la enfermedad tras la inducción de la remisión, se observó que, aunque no hubo diferencias en el mantenimiento de la remisión entre pacientes con tratamiento precoz (≤ 8 semanas) y con tratamiento tardío (> 8 semanas) (véase la tabla 3), los pacientes tratados precozmente requirieron menos esteroides durante el seguimiento (p = 0,001). Nuestros resultados concuerdan con los de otros estudios realizados tanto en niños11,37 como adultos38,39 y difieren de los resultados publicados por Markovitz et al.40 Es posible que esta discrepancia entre estudios pediátricos se deba, en parte, a que ninguno de los pacientes en el estudio de Markovitz et al.40 fue tratado con NEE para inducir la remisión, ya que es sabido que es poco probable conseguir la curación de la mucosa mediante el tratamiento con esteroides. Se requieren más estudios para establecer recomendaciones sobre el momento óptimo del inicio del tratamiento con inmunomoduladores en la EC pediátrica.
Este estudio ofrece información valiosa sobre la eficacia de la NEE en la EC pediátrica. La limitación más importante es el número reducido de pacientes, que probablemente lleva a subestimar el efecto de las tiopurinas en el análisis retrospectivo de los datos, y que dificulta la obtención de información más consistente.
En conclusión, la administración de NEE durante 6-8 semanas es efectiva en la inducción de la remisión clínica y bioquímica, mejorar los parámetros antropométricos y reducir el grado de inflamación de la mucosa intestinal. La CF permite monitorizar la respuesta a la NEE y el control del grado de inflamación de la mucosa. Los pacientes tratados precozmente con tiopurinas recibieron menos esteroides durante el seguimiento. El período de NEE es clave para la actualización del calendario vacunal y para la solicitud de las pruebas complementarias necesarias antes de comenzar el tratamiento inmunosupresor.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.
Agradecemos a los profesores Arie Levine y Julián Panés sus valiosas aportaciones a este manuscrito.