Los recién nacidos pequeños para su edad gestacional (PEG) presentan mayor riesgo de sufrir diversas enfermedades, tales como talla baja, obesidad infantil y sus comorbilidades metabólicas.
Pacientes y métodosEstudio de 883 pacientes obesos (47% niñas/53% niños; edad: 10,33±3,32 años, IMC:+3,93±1,42 SDS) con seguimiento prospectivo (5 años) del crecimiento para registro de talla adulta (n=104). Se compararon al diagnóstico según hubiesen presentado antropometría neonatal adecuada (AEG; n=810) o PEG (n=73), las siguientes variables: edad en primera consulta, talla estandarizada (Z-score) respecto a talla diana, edad ósea, predicción de talla adulta, IMC estandarizado (Z-score), glucemia, insulinemia, HOMA, colesterol total, HDL, LDL, triglicéridos, 25-OH-vitamina D, área bajo la curva (AUC) de glucemia/insulinemia en el TTOG, cocientes LDL/HDL y CT/HDL y niveles de IGF-I e IGFBP-3.
ResultadosLos pacientes nacidos PEG presentaban (a igualdad de edad, IMC-SDS, distribución étnica y puberal) una afectación más intensa del metabolismo lipídico (triglicéridos e índice triglicéridos/HDL superiores, ambos p<0,05) e hidrocarbonado (mayores niveles de glucemia, AUC de glucosa e insulina, HOMA, HbA1c y menor WBISI, todos p<0,05), así como menores niveles circulantes de vitamina D (p<0,05). Asimismo, presentaban un peor pronóstico de talla adulta con respecto a su talla diana (p<0,01), pese a mostrar un grado similar de aceleración de la maduración esquelética y niveles comparables de IGF-I e IGFBP-3 que los AEG.
ConclusionesEl antecedente de antropometría neonatal PEG se asocia a una mayor frecuencia e intensidad de alteraciones metabólicas y a un peor pronóstico de talla adulta en los niños y adolescentes obesos.
Small for gestational age (SGA) newborns show an increased risk of several diseases such as short stature, childhood obesity, and metabolic comorbidities.
Patients and methodsThe study included 883 obese patients (47% females/53% males; mean age: 10.33±3.32 years, BMI:+3.93±1.42 SD), with prospective follow-up (5 years) of growth, recording adult height when achieved (n=104). Comparisons at diagnosis, according to their neonatal anthropometry; adequate for gestational age (AGA; n=810) vs. SGA (n=73), were performed for the following features: age at their first visit, standardised height for target height (Z-score), bone age, adult height prediction, BMI (Z-score), glycaemia, insulinaemia, HOMA, total cholesterol, HDL, LDL, triglycerides, 25-OH-vitamin D, area under the curve (AUC) for glucose and insulin in the OGTT, LDL/HDL and triglyceride/HDL ratio, insulin-like growth factor (IGF-I) and IGF-binding protein 3 (IGFBP-3) serum levels.
ResultsDespite similar BMI-SDS, ethnic, and pubertal distribution in both groups, patients with SGA showed more severe changes in lipid profile (triglyceride and triglyceride/HDL ratio, both P<.05) and carbohydrate metabolism (higher glycaemia, glucose and insulin AUCs, HOMA, HbA1c and lower whole-body insulin sensitivity index (WBISI), all P<.05) and lower 25-OH vitamin D levels (P<.05). They also showed a poorer adult height prediction (adjusted for target height) (P<.01), despite a similar degree of advance in skeletal maturation and similar IGF-I and IGFBP-3 levels than AGA patients.
ConclusionsThe background of SGA neonatal anthropometry is associated with a higher prevalence and severity of metabolic comorbidities and to a poorer adult height prediction in obese children and adolescents.
La obesidad infantil se define en forma de riesgo de morbimortalidad precoz, causada por el acúmulo excesivo de tejido adiposo1. Del mismo modo, sobre la obesidad, como sobre otras enfermedades crónicas, ejercen su influencia múltiples factores que condicionan el ambiente intrauterino y de los primeros años de vida extrauterina. Así, la nutrición subóptima o la sobrenutrición intraútero, las prácticas nutricionales en los primeros meses de vida y la evolución ponderal durante la primera infancia pueden tener una función relevante en el desarrollo de obesidad y de enfermedades metabólicas en edades posteriores2.
El término pequeño para la edad gestacional (PEG) describe a un recién nacido cuyo peso o longitud se encuentran 2o más desviaciones estándar (SDS) por debajo de la media establecida para su población de referencia, su sexo y su edad gestacional3. Esta definición, basada exclusivamente en la antropometría neonatal, determina que los recién nacidos PEG constituyan un grupo tremendamente heterogéneo, siendo múltiples las posibles causas etiológicas (fetales, maternas, placentarias, etc.)4. Si bien el término PEG engloba tanto a los recién nacidos de peso bajo como de longitud reducida, puede ser de utilidad diferenciar 3grupos dentro de los nacidos PEG: de peso reducido (índice ponderal bajo), de longitud reducida o de peso y longitud disminuidos5. Esta clasificación permite orientar mejor el diagnóstico etiológico y el riesgo futuro de comorbilidades.
Se estima que entre el 2,3 y el 10% de todos los neonatos nacen PEG6,7. De ellos, la mayoría va a experimentar un crecimiento recuperador espontáneo antes de los 2 años de edad y un mínimo grupo entre los 2 y los 4 años; sin embargo, aproximadamente, el 15% no experimentan dicha recuperación, constituyendo esta una indicación aceptada para el tratamiento con hormona de crecimiento recombinante humana.
En los recién nacidos PEG que muestran crecimiento recuperador espontáneo, la ganancia ponderal rápida en los primeros años de vida que determina dicho crecimiento recuperador, tras un periodo intrauterino con un ambiente restrictivo para el desarrollo pondero-estatural, determina que estos niños incrementen su contenido graso corporal por encima del de los niños con antropometría adecuada al nacimiento8. Este «rebote adiposo», más precoz que el observado habitualmente en la infancia9, determina en estos pacientes un mayor riesgo para el desarrollo en edades posteriores de la vida de obesidad y comorbilidades metabólicas asociadas (que implican tanto el metabolismo hidrocarbonado como el metabolismo lipídico). Estos hallazgos son, en cierto modo, superponibles a los publicados en neonatos prematuros, que demuestran que el aumento de peso rápido en la infancia, incluso dentro de las primeras semanas de vida, puede conducir a la hipertensión, la obesidad y enfermedades relacionadas antes de la tercera década de la vida10-13.
Las alteraciones nutricionales durante la época intrauterina y posnatal precoz pueden condicionar, no solo la composición corporal14, sino también el crecimiento longitudinal a corto y largo plazo15,16, bien por la propia restricción de crecimiento durante la vida intrauterina, bien por experimentar una etapa de crecimiento recuperador (catch up) posnatal, o por la conjunción de ambos factores. En general, la obesidad infantil suele acompañarse de un crecimiento prepuberal más intenso, acompañado de un grado variable de aceleración de la maduración esquelética17. Sin embargo, en los pacientes con antecedentes antropométricos neonatales de PEG es esperable que este patrón de crecimiento se vea influido y condicionado por el potencial efecto deletéreo que, sobre el crecimiento longitudinal, puede ejercer la restricción de crecimiento prenatal.
Hasta la fecha, son múltiples los estudios que han evaluado el patrón de crecimiento posnatal y el riesgo de desarrollo de obesidad y comorbilidades asociadas en edades posteriores de la vida en neonatos PEG. Sin embargo, ha sido mucho menos explorada la observación inversa; esto es, la importancia del antecedente antropométrico neonatal PEG en la asistencia clínica a un niño o adolescente obeso, tanto en lo referente a las comorbilidades metabólicas como en lo referente a su crecimiento longitudinal.
El objetivo de este trabajo fue investigar, en una amplia cohorte de niños y adolescentes obesos, la eventual influencia ejercida por el antecedente de restricción del crecimiento prenatal (reflejado por una antropometría neonatal PEG) sobre sus características antropométricas (talla y gravedad de su obesidad) y metabólicas en comparación con los pacientes con antropometría neonatal adecuada a su edad gestacional (AEG).
Pacientes y métodosSe estudiaron 883 pacientes (415 [47%] niñas y 468 [53%] niños) con obesidad (IMC>+2 SDS para su edad y sexo, de acuerdo con las referencias poblacionales de Hernández et al.18) en un hospital terciario, en los que se habían excluido previamente causas sindrómicas o secundarias de obesidad, así como la existencia de enfermedad subyacente.
Ochocientos diez (810) presentaban antecedente de antropometría neonatal AEG (AEG, peso y longitud entre –2 y+2 SDS) y 73 antecedente de antropometría neonatal PEG (PEG, peso o longitud neonatal<–2 SDS de acuerdo con las referencias poblacionales de Carrascosa et al.19), constituyendo estos los grupos de comparación. Dentro de los pacientes PEG, no se incluyó a ningún paciente sin crecimiento recuperador espontáneo ni con tratamiento con rhGH y, como en el conjunto de la cohorte, se excluyó a todos los pacientes con causas sindrómicas o secundarias de obesidad, descartándose, asimismo, la existencia de enfermedad subyacente. No se excluyó, por el contrario, a los pacientes nacidos pretérmino (edad gestacional<37 semanas), que constituían un 8,2% del grupo PEG y un 7,9% del grupo AEG, respectivamente. Las características de los grupos PEG y AEG se detallan en la tabla 1.
Características antropométricas y metabólicas de la cohorte estudiada
| Pacientes (n=883) | PEG (n=73) | AEG (n=810) | Comparación PEG vs. AEG | |
|---|---|---|---|---|
| Edad (años) | 10,33±3,32 | 11,03±2,38 | 10,27±3,38 | NS |
| Sexo (%) | NS | |||
| Femenino | 47 | 39 | 47 | |
| Masculino | 53 | 60 | 52 | |
| Pubertad (%) | NS | |||
| Prepuberales | 54 | 56 | 54 | |
| Puberales | 45 | 43 | 45 | |
| Etnia (%) | NS | |||
| Caucásica | 79 | 72 | 79,6% | |
| Hispana | 16,9 | 21 | 16,4% | |
| Otras | 4,1 | 5 | 4% | |
| IMC ± SDS | 3,93±1,42 | 3,87±1,20 | 3,94±1,44 | NS |
| Cintura> p90 (%) | 93,1 | 95,3 | 92,8 | NS |
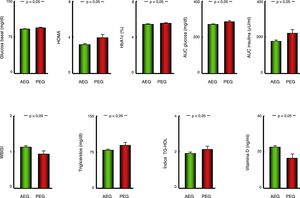
| Glucosa basal (mg/dl) | 92,67±7,17 | 95,18±7,38 | 92,44±7,11 | p <0,05 |
| Insulina basal (μU/ml) | 14,11±9,75 | 16,50±10,49 | 13,90±9,66 | NS |
| HOMA | 3,27±2,40 | 3,98±2,77 | 3,21±2,35 | P <0,05 |
| AUC glucosa (mg/dl) | 273,46±35,51 | 287,56±36,36 | 272,22±35,20 | P <0,05 |
| AUC insulina (μU/ml) | 180,30±115,99 | 223,68±128,03 | 178,39±117,56 | P <0,05 |
| WBISI | 1,13±0,60 | 0,95±0,56 | 1,14±0,61 | P <0,05 |
| HbA1c (%) | 5,47±0,34 | 5,55±0,36 | 5,46±0,34 | P <0,05 |
| Ácido úrico | 4,87±1,09 | 5,08±1,17 | 4,86±1,08 | NS |
| Colesterol total (mg/dl) | 158,80±25,63 | 160,82±30,20 | 158,61±29,55 | NS |
| LDL colesterol (mg/dl) | 97,17±25,66 | 98,80±24,58 | 97,02±25,76 | NS |
| HDL colesterol (mg/dl) | 45,36±10,64 | 43,13±8,95 | 45,56±10,76 | NS |
| VLDL colesterol (mg/dl) | 16,21±10,70 | 17,65±9,91 | 16,08±10,77 | NS |
| Triglicéridos (mg/dl) | 80,53±50,44 | 89,15±48,73 | 79,74±50,55 | p <0,05 |
| Índice TG-HDL | 1,95±1,52 | 2,16±1,35 | 1,93±1,54 | p <0,05 |
| 25 OH vitamina D (ng/ml) | 22,23±9,41 | 16,65±9,19 | 22,82±9,27 | p <0,05 |
| IGF-I (ng/ml) | 294,70±158,78 | 325,71±180,78 | 291,65±156,28 | NS |
| IGFBP3 (μg/ml) | 4,79±1,06 | 5,04±1,00 | 4,77±1,06 | NS |
AEG: pacientes con antropometría neonatal adecuada a la edad gestacional; AUC: Área bajo la curva; CT: colesterol total; HbA1c: hemoglobina glucosilada; HDL: colesterol HDL; IMC: índice de masa corporal; índice HOMA: de resistencia a insulina; LDL: colesterol LDL; PEG: pacientes con antropometría neonatal pequeña para la edad gestacional; TG: triglicéridos; VLDL: colesterol VLDL; WBISI: Whole Body Insulin Sensitivity Index.
En todos ellos se registró la edad cronológica al inicio de la obesidad y en su primera consulta, peso, talla e IMC (que se estandarizaron para edad y sexo)18, perímetro de cintura y estadio puberal20. Se estimó la edad ósea por medio de una radiografía de mano y muñeca izquierdas (método de Greulich y Pyle [G&P]), estableciéndose la predicción de talla adulta (método de Bailey y Pinneau) y comparándose con la talla genéticamente determinada (talla medio-parental modificada [+6,5cm en niños y –6,5cm en niñas]). Se realizó un seguimiento prospectivo (5 años) del crecimiento longitudinal registrándose la talla adulta en aquellos pacientes que la alcanzaron (n=104).
Tras 12 h de ayuno, se realizó una extracción sanguínea para determinación de: glucemia, insulinemia (inmunoanálisis de quimioluminiscencia Liaison® DiaSorin, Saluggia, Italia), hemoglobina glicosilada (HbA1c) (cromatografía líquida de alta resolución por intercambio iónico D10TM, BIO-RAD, Hercules, California, EE. UU.), colesterol total, fracciones de colesterol (VLDL, LDL, HDL) y triglicéridos (método colorimétrico enzimático Beckman® AU680, Brea, California, EE. UU.), ácido úrico, 25-OH-vitamina D (inmunoanálisis de quimioluminiscencia Lumipulse G®, Fujirebio Diagnostics AB, Göteborg, Suecia), IGF-I e IGFBP-3 (inmunoanálisis de quimioluminiscencia Liaison® DiaSorin), calculándose el índice HOMA como glucemia en ayunas ([mg/dl]×insulinemia en ayunas [μU/ml]/405).
En 569 pacientes se realizó una prueba de tolerancia oral a la glucosa, entre ellos 45 fueron nacidos PEG y 524 AEG (1,75g de glucosa/kg, máximo 75g), determinándose glucemia e insulinemia tras 30, 60 y 120 min de la ingesta de glucosa. En ellos se calculó el área bajo la curva (AUC) de glucosa e insulina (AUC; 0,25×basal+0,5×valor 30́+0,75×valor 60 min+0,5×valor 120 min) y el Whole Body Insulin Sensitivity Index (WBISI; 10,000/raíz de ([glucemia×insulinemia]×[glucemia media en TTOG×insulinemia media en TTOG])21.
El análisis estadístico de los datos se realizó empleando la versión 15.0 del software SPSS® para entorno Windows (MapInfo Corporation, Troy, NY, EE. UU.). Los niveles de los diferentes parámetros estudiados se expresan como media±desviación estándar o media±SDS para aquellos parámetros normalizados respecto a valores poblacionales. En todos los casos se estableció un valor p<0,05 como nivel de significación estadística. En el caso de variables paramétricas, las comparaciones entre las medias de 2grupos se realizaron mediante la prueba de t de Student para muestras independientes, previa comprobación de la distribución normal de los valores de la variable mediante el test de Kolmogorov-Smirnov. En los casos en los que la condición de normalidad no fue satisfecha, se aplicó el test de la U de Mann-Whitney para establecer la comparación entre ambos grupos. Las comparaciones entre muestras relacionadas no paramétricas se realizaron mediante el test de rangos de Wilcoxon.
El estudio y el protocolo de reclutamiento de pacientes fue aprobado por el Comité Ético del hospital y forma parte de un proyecto de investigación financiado por el Fondo de Investigación Sanitaria del Instituto de Salud Carlos III, de acuerdo con los Ethical Principles for Medical Research Involving Human Subjects, adoptados en la Declaración de Helsinki por la World Medical Association. Se obtuvo consentimiento informado de todos los progenitores o tutores legales de los pacientes participantes en el mismo, así como asentimiento en los pacientes mayores de 12 años.
ResultadosLa distribución respecto a sexo, pubertad y etnia en los grupos PEG y AEG no mostraba diferencias significativas, presentando los pacientes de ambos grupos un IMC-SDS medio similar (tabla 1).
Comorbilidades metabólicasLos pacientes obesos nacidos PEG presentan niveles significativamente superiores de glucemia, HbA1c e índice HOMA, así como mayores AUC de glucosa e insulina y menor índice WBISI en el TTOG que los nacidos AEG (fig. 1). Asimismo los pacientes con antecedentes antropométricos de PEG mostraban niveles circulantes más elevados de triglicéridos e índice triglicéridos/colesterol HDL (fig. 1) y menores de vitamina D que los pacientes nacidos AEG (tabla 1).
Representación gráfica (diagrama de barras) de los parámetros de metabolismo de los hidratos de carbono, perfil lipídico y vitamina D en pacientes con antecedente de AEG o PEG. Datos representados como media±error estándar de la media. AEG: pacientes con antropometría neonatal adecuada a la edad gestacional; AUC: área bajo la curva; HbA1c: hemoglobina glucosilada; HDL: colesterol HDL; índice HOMA: grado de resistencia a insulina; PEG: pacientes con antropometría neonatal pequeña para la edad gestacional; TG: triglicéridos; VLDL: colesterol VLDL; WBISI: Whole Body Insulin Sensitivity Index.
De acuerdo con los criterios de definición de síndrome metabólico (SM) postulados por la International Diabetes Federation22, de entre el subgrupo de pacientes mayores de 10 años de edad con el perímetro abdominal superior al percentil 90 para su edad, sexo y etnia, 94 pacientes cumplían criterios de SM (10,6%), 12 entre los PEG (16,4%) y 82 entre los AEG (10,1%), si bien esta diferencia de prevalencia entre grupos no alcanzaba significación estadística.
Crecimiento longitudinal y maduración esqueléticaLa talla media estandarizada de los pacientes del grupo AEG era superior a la del grupo PEG (p <0,001), pero también lo era su talla diana estandarizada (p <0,05) (tabla 2). Por este motivo, se compararon entre grupos los parámetros de crecimiento longitudinal considerados en relación con la talla diana de los pacientes.
Características de crecimiento de la cohorte estudiada
| Cohorte completa (n=883) | PEG(n=73) | AEG(n=810) | ComparaciónPEG vs. AEG | |
|---|---|---|---|---|
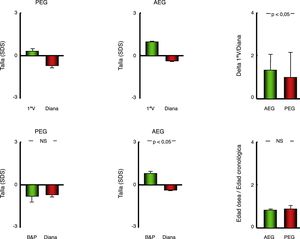
| Talla diana (Z-score) (SDS) | –0,40±1,00 | –0,69±1,26 | –0,37±0,97 | p <0,05 |
| Talla (Z-score) | 0,91±1,27 | 0,29±1,25 | 0,97±1,26 | p <0,05 |
| Talla SDS ± diana (Z-score) | 1,31±1,27 | 1,00±1,41 | 1,34±1,26 | p <0,05 |
| Edad ósea-cronológica (años) | 0,84±1,10 | 0,89±1,17 | 0,84±1,09 | NS |
| B&P (Z-score) ± diana (Z-score) | 0,32±1,34 | –0,40±1,40 | 0,40±1,31 | p <0,001 |
Valores estandarizados de acuerdo con las referencias poblacionales de Hernández et al., 1988.
AEG: pacientes con antropometría neonatal adecuada a la edad gestacional; B&P: pronóstico de talla estimado mediante el método de Bayley-Pinneau; PEG: pacientes con antropometría neonatal pequeña para la edad gestacional; SDS: Z-score.
Así se comprobó que todos los pacientes presentaban una talla estandarizada significativamente superior a su talla diana tanto en conjunto (+1,31±1,27 SDS), como en cada grupo por separado (PEG:+1,00±1,41 SDS y AEG:+1,34±1,26 SDS; todos p <0,001), si bien esta diferencia respecto a la talla diana fue significativamente superior en los AEG respecto a los PEG (p <0,05) (tabla 2) (fig. 2).
Representación gráfica (diagrama de barras) de los parámetros de crecimiento y maduración esquelética en pacientes con antecedente personal de AEG o PEG. Datos representados como media±error estándar de la media. AEG: pacientes con antropometría neonatal adecuada a la edad gestacional; B&P: pronóstico de talla estimado mediante el método de Bayley y Pinneau; PEG: pacientes con antropometría neonatal pequeña para la edad gestacional; SDS: desviación típica; 1.ª V: talla en la primera visita.
Asimismo, existía una aceleración significativa de la edad ósea respecto a la edad cronológica tanto en el conjunto de la cohorte (+0,84±1,10 años), como en los grupos PEG (+0,89±1,17 años) y AEG (+0,84±1,09; todos p <0,001), aunque en este caso no existía diferencia en el grado de aceleración de la maduración esquelética entre PEG y AEG. Por este motivo, la predicción de talla adulta (B&P) superaba a la talla diana en los AEG (p <0,001) pero no en los PEG (tabla 2) (fig. 2).
Tras 5 años de seguimiento, se pudo recoger la talla adulta de 104 pacientes (velocidad de crecimiento <1cm/año en el año previo), de los cuales 5 pertenecían al grupo PEG y 99 al grupo AEG. En consonancia con las diferencias entre grupos observadas en la predicción de talla adulta, la diferencia media entre la talla adulta alcanzada y la diana fue de+1,01cm±5,31 (+0,17±0,91 SDS) en el grupo AEG y de –4,93cm±9,74 (–0,81±1,62 SDS) en el grupo PEG.
DiscusiónEn este estudio realizado sobre una amplia cohorte de pacientes obesos, hemos constatado la existencia de una asociación entre el antecedente de antropometría neonatal PEG y una mayor intensidad de las comorbilidades metabólicas (resistencia insulínica y niveles de triglicéridos) junto con un peor pronóstico de talla adulta respecto a su talla diana, ante una obesidad de similar gravedad que la de los pacientes nacidos AEG.
El bajo peso al nacimiento es una de las principales causas de morbilidad en el periodo neonatal y, junto al crecimiento recuperador extrauterino, está asociado a un mayor riesgo de enfermedades en edades posteriores de la vida. Entre ellas destacan las alteraciones de la composición corporal, conociéndose que un mayor incremento de peso en los primeros años de vida se asocia a un mayor riesgo de adiposidad central23,24. Particularmente, en los niños nacidos PEG se ha comunicado cómo muestran más grasa hepática y visceral a los 6 años de edad, comparados con niños de la misma edad y similar IMC con peso AEG25, postulándose que la recuperación extrauterina del crecimiento intrauterino restringido determina un aumento de la adiposidad durante la rehabilitación nutricional, que puede en sí mismo favorecer la resistencia a la insulina, debido a un predominio en la acumulación de masa grasa frente a la masa muscular4,26. Probablemente, esta mayor adiposidad y su potencial predominio visceral pueden desempeñar una función relevante en las diferencias metabólicas observadas entre nuestras cohortes, a igualdad de IMC-SDS.
Estos hallazgos de una mayor resistencia a la acción de la insulina y mayores niveles de triglicéridos en los pacientes con el antecedente PEG concuerdan con la observación previa de una correlación inversa entre el peso al nacer y la prevalencia de resistencia a insulina y SM en niños y adultos jóvenes27, también indicado por la mayor prevalencia de SM observada en el grupo PEG vs. el grupo AEG. Más aún, el incremento de la resistencia a la acción de la insulina en relación con la rápida recuperación ponderal extrauterina es un hallazgo precoz ya demostrado en los 2 primeros años de vida y apoyado por la observación de que esta resistencia a insulina se observa exclusivamente en los RN-PEG que experimentan crecimiento recuperador espontáneo y no en los AEG ni en los PEG sin crecimiento recuperador28.
También es destacable el hallazgo de que los niveles de 25-OH-vitamina D eran menores en los pacientes con antecedente de PEG, que concuerdan con la postulación de esta condición como factor de riesgo para el déficit de vitamina D29,30. Más aún, debido al carácter liposoluble de esta vitamina, el mayor contenido de grasa corporal postulado en los pacientes nacidos PEG (a igualdad de IMC-SDS con los AEG) podría subyacer a las diferencias observadas entre nuestros grupos de pacientes31. Aun así, debido al gran número de factores que influyen en los niveles circulantes de vitamina D, particularmente en el caso de la obesidad, es preciso reconocer la dificultad inherente al análisis de estas diferencias, máxime ante limitaciones generales, como la ausencia de homogeneidad en la época del año en la que se extrajo la muestra de los pacientes (no consignada en nuestro estudio, lo que constituye una limitación del mismo), particularmente en una cohorte tan extensa como la presentada con un largo periodo de reclutamiento.
Un aspecto novedoso de este estudio es la evaluación del efecto sobre el crecimiento de la conjunción de 2condiciones (antropometría PEG y obesidad infantil) con efectos antagónicos sobre el mismo. Así, los recién nacidos con antropometría PEG suelen tener una talla más baja durante la infancia/adolescencia, alcanzando una talla adulta más baja32, mientras que los niños obesos, en general, suelen experimentar un crecimiento prepuberal más intenso, acompañado de un grado variable de aceleración de la maduración esquelética que determina una talla adulta similar o discretamente superior a la talla diana17. El conjunto de los pacientes obesos de nuestra cohorte parece ajustarse a este último patrón de crecimiento (todos, PEG y AEG con talla estandarizada superior a la diana y maduración esquelética acelerada), si bien el antecedente de antropometría neonatal PEG determina que este grado de «sobrecrecimiento respecto a la talla diana» sea menor que en los pacientes AEG, lo cual, con edad ósea acelerada en igual medida, hace que la predicción de talla adulta de los PEG (respecto a su diana) sea menor que la de los AEG, evidenciándolo los datos observados en los pacientes que alcanzaron su talla adulta.
Este hecho está muy probablemente influido por la necesidad de recuperación de la alteración del crecimiento prenatal que hace que los recién nacidos PEG tengan tantas menos posibilidades de alcanzar una talla adecuada a su contexto familiar cuanto menor es su longitud neonatal. Junto a ello, los pacientes PEG presentan modificaciones del eje suprarrenal y gonadal durante el periodo prenatal que pueden condicionar alteraciones en el proceso de la adrenarquia33 y de la pubertad34,35, determinando una pubertad más rápidamente progresiva, con rápida maduración esquelética, que puede condicionar una talla adulta por debajo de la talla diana36.
En conclusión, nuestros resultados sobre una amplia cohorte de pacientes pediátricos obesos indican que existe una asociación entre el antecedente antropométrico de PEG, un peor pronóstico de talla y una afectación más grave del metabolismo lipídico e hidrocarbonado en comparación con los pacientes obesos que habían nacido con una antropometría AEG.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Presentación previa: XXXVII Congreso de la Sociedad Española de Endocrinología Pediátrica (SEEP). Valencia, 2015.