La bacteriemia por Staphylococcus aureus (BSA) es una complicación rara de la estomatitis herpética en inmunocompetentes. Hasta el 20% de las BSA pueden complicarse con focos profundos de infección. Las complicaciones más frecuentes incluyen la osteomielitis, la endocarditis infecciosa y los abscesos profundos. Otras manifestaciones de las infecciones por Staphylococcus aureus (SA) son las causadas por toxinas, como el síndrome del shock tóxico estafilocócico (SSTS).
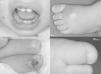
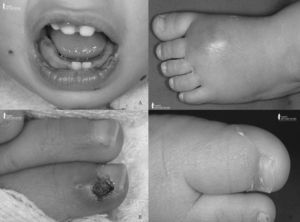
Una niña de un año de edad, con antecedentes de otitis media aguda recurrente, consultó en el Servicio de Urgencias por lesiones ulcerosas en la cavidad oral y fiebre de 48 horas de evolución. En la exploración física presentaba úlceras orales con vesículas periorales sugestivas de estomatitis herpética (fig. 1A). Por el importante compromiso orofaríngeo y la intolerancia oral fue ingresada.
Durante los primeros tres días de hospitalización evolucionó favorablemente y se objetivó un panadizo (fig. 1B). La etiología herpética fue confirmada mediante PCR (virus herpes simple 1).
El cuarto día de ingreso reinició fiebre hasta 39,7° C. En la analítica sanguínea destacaba leucocitosis con desviación a la izquierda (19.900 leucocitos/μl con 76% de neutrófilos y 14% de neutrófilos en banda), y una proteína C reactiva de 101mg/L (normal <15mg/L). La radiografía de tórax y el sedimento de orina fueron normales. Persistió febril durante 3 días con desarrollo de edema en la mano izquierda y ambos pies, y eritema conjuntival. El 3.er día de fiebre presentó un episodio de mala perfusión periférica sin hipotensión, con aumento de los parámetros inflamatorios en la analítica, por lo que se inició tratamiento con amoxicilina-ácido clavulánico endovenoso. Al aislarse Staphylococcus aureus meticilino-sensible en 2 muestras de hemocultivos, se cambió por cloxacilina. No se objetivaron en la exploración física otros focos de infección que la estomatitis, como posible origen de la bacteriemia. Tras el episodio de mala perfusión, presentó una erupción macular eritematosa evanescente, sin cumplir criterios del SSTS.
Por el aumento de los signos inflamatorios en las extremidades (fig. 1C), se realizó una gammagrafía ósea con 99Tc para descartar osteomielitis, con captación limitada a los tejidos blandos (celulitis/abscesos). La ecografía abdominal y la transfontanelar fueron normales. El ecocardiograma reveló un marcado aumento en la ecogenicidad (hiperrefringencia) de la pared de la arteria coronaria derecha, semejante a los cambios inflamatorios que se observan en la enfermedad de Kawasaki (EK). Sin embargo, el control ecocardiográfico a los 5 días fue normal, no pudiendo confirmarse la persistencia de esta alteración. A nivel analítico presentó anemia (hemoglobina mínima de 6,9g/dl), sin otros hallazgos presentes en la EK como elevación de la GPT, hipoalbuminemia, o leucocituria. Debido a la presencia de un microorganismo causal, a la rápida mejoría clínica, y a que no cumplía criterios de EK, no se tomaron medidas terapéuticas específicas de la EK. A los 15 días de ingreso comenzó con descamación a nivel periungueal (fig. 1D), y se objetivó trombocitosis (750.000plaquetas/μl) en los controles analíticos. Se completaron dos semanas de tratamiento antibiótico endovenoso, con resolución completa de la clínica, y se realizó un estudio de la inmunidad celular, humoral e innata que fue normal.
Los organismos que generalmente complican la estomatis herpética son las de la flora orofaríngea, como los estreptococos del grupo A y Kingella kingae. La BSA secundaria a una estomatitis herpética se ha descrito previamente en un paciente inmunodeprimido1.
La BSA es una enfermedad grave, que puede estar asociada con el desarrollo de infección diseminada en un 20% de los casos. En pacientes inmunocompetentes, sin otros factores predisponentes, la presencia de complicaciones como osteomielitis, endocarditis infecciosa o abscesos profundos, son clínicamente evidentes y la búsqueda de complicaciones no se recomienda en pacientes asintomáticos2. Debido a las manifestaciones cutáneas en nuestro paciente y la sospecha de afectación ósea, se amplió el estudio pero no se objetivó otro foco profundo de infección.
La superposición en la presentación clínica de las infecciones sistémicas por SA (y también aquellas mediadas por toxinas como el SSTS) y la EK pueden causar dificultades en el diagnóstico y manejo de estas entidades, como se describe en la literatura3. La afectación coronaria típica de la EK también puede estar presente en pacientes con SSTS4. Se han descrito casos de infección por SA, que cumplieron criterios de EK5,6. La asociación entre la infección por SA y la EK fue sugerida por Leung et al, quienes describieron una serie de 16 casos de EK, con aislamiento de la toxina-1 del SSTS en 11 pacientes7. También se informó de la presencia de toxinas estafilocócicas en otros tres casos de EK complicados con enfermedad arterial coronaria8. De esta manera, la superposición clínica de estas entidades podría ser explicada por la teoría de los superantígenos. Los superantígenos microbianos pueden estimular hasta un 25% del pool de linfocitos, lo que causa una activación inmunitaria generalizada, responsable de la sintomatología9. En cuanto al tratamiento, ha sido publicada la respuesta a las gammaglobulinas en infecciones por SA refractarias a la antibioticoterapia5,10.
En resumen, nuestro caso ilustra claramente las dificultades en el diagnóstico y tratamiento de estos pacientes en los que las manifestaciones clínicas de una infección sistémica por SA pueden generar cuadros Kawasaki-like. El conocer esta posibilidad puede ayudar a dirigir el tratamiento. Las medidas terapéuticas pueden incluir las de ambas entidades.