Los trastornos generalizados del desarrollo (TGD) son procesos caracterizados por presentar déficits en múltiples áreas de la conducta. El resultado son alteraciones en la interacción social, la comunicación verbal y no verbal, y la presencia de intereses restrictivos y repetitivos. La importancia de su diagnóstico precoz radica en la posibilidad de la intervención temprana y su efecto en el pronóstico del paciente. Como el diagnóstico de TGD se ha incrementado en los últimos años, se plantea la detección de situaciones clínicas de fácil identificación en el primer año de vida que permitan mejorar el diagnóstico y facilitar la intervención temprana.
Pacientes e intervencionesSe estudia a 37 pacientes con TGD y 69 controles sanos de forma ambispectiva, a los que se les practica somatometría básica, exploraciones neurológicas y recogida de datos de variables del cuestionario modificado para la detección de riesgo de autismo (MCHAT).
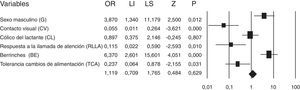
ResultadosLa proporción de varones (OR: 3,87; IC del 95%, 1,23-12,96), el retraso en los primeros bisílabos (TGD=20,1±23 meses vs control=10,8±10,3 meses; p<0,01), la ausencia de contacto visual (OR: 0,05; IC del 95%, 0,01-0,29), la falta de respuesta a la llamada de atención (OR: 0,12; IC del 95%, 0,02-0,67) y el aumento de «berrinches» (OR: 6,37; IC del 95%, 2,39-17,34) fueron significativamente superiores en el grupo con TGD.
ConclusionesLas diferencias que hemos detectado entre ambos grupos no pueden constituir un sistema diagnóstico de certeza en este periodo; sin embargo, creemos que deben ser considerados signos de alarma en el contexto de retrasos madurativos de lactantes y preescolares, a la vez que sugieren la existencia de un fenotipo precoz de TGD.
Pervasive development disorders (PDD) conditions characterised by deficits in many areas of behaviour, such as delay in social interactions, abnormalities in verbal and non-verbal communication, and the presence of the restrictive and repetitive interests. The relevance of early diagnosis is based on the fact that early intervention could have a beneficial effect on the long term outcome. Due to the increase of the PDD diagnosis in the recent years, we aimed to study easily detectable clinical traits during the first year of life, leading to an improvement in the diagnosis.
Patients and interventionsA prospective and retrospective study was conducted on 37 PDD patients and 69 healthy controls. Somatometric and neurological examinations were performed and a questionnaire with several variables from the Modified Checklist for Autism in Toddlers (M-CHAT) completed by the parents.
ResultsThe male to female ratio (OR: 3.87; 95% CI: 1.23-12.96), delay in the first disyllabic words (PDD=20.1±23 months vs Control=10.8±10.3 months; P<.01), absence of visual contact (OR: 0.05; 95% CI: 0.01-0.29), the lack of response to attention call (OR: 0.12; 95% CI: 0.02-0.67), and the increase in tantrums (OR: 6.37; 95% CI: 2.39-17.34), were significantly higher in the PDD group.
ConclusionsThe differences detected between groups can not been considered as a diagnostic tool of certainty in this time period, however, we believe that they should be considered in the context of maturational delay, as alarm signs in infants and toddlers, as well as suggesting the existence of an early pervasive development phenotype.
Los trastornos generalizados del desarrollo (TGD) están constituidos por un grupo heterogéneo de procesos, que se caracterizan por afectar múltiples áreas funcionales de la conducta con intensidades y prevalencias variables1. El resultado son un retraso y una desviación de los patrones normales del desarrollo que afectan, de forma más significativa, a tres áreas del comportamiento, tales como alteraciones en las relaciones sociales e interacción, alteraciones en el lenguaje verbal y no verbal, y la presencia de patrones e intereses restrictivos y repetitivos de conducta2. A pesar de que los pacientes muestran déficits nucleares comunes, existe una marcada variabilidad en su severidad, incluso el nivel de funcionamiento intelectual puede variar desde el retraso mental profundo a una inteligencia normal o incluso alta en algunas áreas3.
En el epígrafe TGD, en el Manual diagnóstico y estadístico de los trastornos mentales (DSM-IV) se incluyen diferentes entidades, como son el trastorno autista, el trastorno de Rett, el desintegrativo de la infancia, el trastorno de Asperger y el TGD no especificado (incluido autismo atípico)1,4. Si bien, en la práctica, el trastorno de Rett y el desintegrativo se pueden identificar con facilidad, los otros grupos se mueven en un continuo clínico que encaja mejor en el diagnóstico de trastorno del espectro autista.
Su etiología, si bien no completamente aclarada, es fundamentalmente genética, implicando desde anomalías monogénicas hasta alteraciones multigénicas. Su expresión proteómica deficiente, bien en la neurotransmisión, o bien a través de anomalías estructurales del SNC, provoca un manejo anormal del filtrado y gestión de los estímulos sensoriales que recibe el paciente, y respuestas ejecutoras alteradas. Otros factores epigenéticos y ambientales, como la exposición prenatal y preconcepcional a tóxicos, infecciones víricas connatales o pérdidas del confort fetal, pueden inducir cuadros indistinguibles del TGD5–7.
En la actualidad, la incidencia de este tipo de patología se estima entre un 20-30 por 10.0001,7, siendo más prevalente en niños que en niñas con una proporción que se ha fijado mayoritariamente en 3:1. Estos datos sugieren un incremento crudo de la prevalencia del TGD que se supone es debida a un mayor conocimiento clínico de la enfermedad y por tanto a un aumento de la eficacia de su diagnóstico8.
El diagnóstico se realiza a una media de edad comprendida entre los 3-4 años, a pesar del hecho de que la mayoría de los padres relatan la sensación de que «algo iba mal» hacia los 18 meses de edad y generalmente buscaban ayuda médica hacia los 2 años, siendo la opinión más extendida entre los familiares el haber deseado conocer el problema mucho antes, ya que intuyen que hubiese sido beneficioso para sus hijos intervenir de forma más temprana1. La importancia del diagnóstico precoz radica en el efecto favorable que este tiene sobre la calidad de vida y el pronóstico del paciente, al poder proporcionar un tratamiento y planificación educativa temprana, dar apoyo y educación a los padres y aportar los cuidados pediátricos generales apropiados para este tipo de pacientes. En este sentido, se han desarrollado programas de educación sanitaria, que permite a los pacientes con TGD que se familiaricen con su entorno asistencial, facilitándoles el acceso a los seguimientos básicos de cualquier paciente en edad pediátrica1,9,10.
Sin embargo, aunque existen experiencias previas de detección de trastornos de conducta como el TDAH en el quinto trimestre de la vida11, el diagnóstico precoz del TGD no está exento de trabas a edades tempranas. La dificultad que representa para los padres la detección de síntomas que le caracterizan, la falta de experiencia e información de los profesionales de atención primaria en relación a estos procesos, el temor al sobrediagnóstico y, por último, la esperanza de que los síntomas pudieran remitir de forma espontánea son las causas principales de esta dificultad diagnóstica.
Dado que esta patología en los últimos años ha incrementado su prevalencia y la importancia que el retraso del diagnóstico puede tener en la intervención sobre el niño, se plantea en este estudio la de detección de signos, síntomas y anomalías de los hitos del desarrollo en el primer año de vida, que permitan mejorar la capacidad diagnóstica de desarrollo de cuadros de TGD para intervenir precozmente y obtener un pronóstico más favorable.
Hipótesis y objetivosEn respuesta a este enunciado, formulamos la siguiente hipótesis nula: los pacientes afectados de TGD no presentan patrones de comportamiento anómalo en los primeros meses de vida cuando se comparan con un grupo control.
En contraposición, formulamos como hipótesis válida lo siguiente: los pacientes afectados de TGD presentan signos y síntomas sugestivos de su patología neuroconductual en los primeros meses de vida cuando se comparan con un grupo control.
Por lo tanto, nos planteamos como objetivo de este estudio encontrar marcadores clínicos de fácil exploración en el periodo de lactante y preescolar, que puedan indicar un aumento de riesgo en la aparición posterior de TGD.
Pacientes e intervencionesMediante una recogida de datos de forma ambispectiva, basada en historias clínicas y entrevistas personales y telefónicas estructuradas durante el año 2009, se diseña un estudio de casos y controles.
Se estudia a 37 pacientes consecutivos (media de edad = 6±4,3 años) de la consulta de neuropediatría del departamento 17 de la Agencia Valenciana de Salud diagnosticados de TGD (grupo TGD) según los criterios DSM-IV y considerándose criterios de exclusión el presentar alguna enfermedad metabólica, neurodegenerativa o síndrome neurocutáneo que presentara, como manifestación clínica, rasgos de conducta de TGD.
Se comparan con 69 pacientes del mismo departamento de salud (media de edad = 5,6±2,5 años) (grupo control), atendidos en las consultas externas hospitalarias de pediatría, que acudían de forma consecutiva para la realización de un preoperatorio de traumatología, otorrinolaringología y oftalmología, y que no presentaran ningún criterio diagnóstico de TGD ni ninguna afectación neurosensorial secundaria a los procesos quirúrgicos por los cuales iban a ser atendidos.
Durante la visita se realizan estudios somatométricos y exploraciones neurológicas. Se pasa un cuestionario a los padres que contiene las siguientes variables: fecha de nacimiento (FN), género (G), edad (E), número de hermanos (NH), orden de nacimiento (ON), presencia y fecha de aparición del contacto visual (CV), sonrisa social (SS), presentación de cólicos del lactante (CL), sedestación (SD), bisílabos con significado (BS), respuesta a la llamada de atención (RLLA), preferencia por algún objeto (PO), «berrinches» (BE) y tolerancia a los cambios de alimentación (TCA), variables validadas que proceden del cuestionario modificado para la detección de riesgo de autismo (MCHAT)12,13 y que, a pesar de su naturaleza retrospectiva, en experiencia de los autores, se recuerda de forma más fidedigna por parte de los padres.
Los resultados se analizan mediante la prueba de е de Student para variables cuantitativas (SPSS16.0) y odds ratio (OR) para variables cualitativas (módulo Stadcalc de Epiinfo 6.0).
La cumplimentación de los datos obtenidos de forma presencial o telefónicamente se realizó con consentimiento, atendiendo a la normativa vigente para este tipo de estudios en el hospital de desarrollo del trabajo.
ResultadosCuando analizamos G, el número de varones en el grupo TGD fue significativamente superior al del grupo Control (OR: 3,87; IC del 95%, 1,23-12,96). La relación niños/niñas en el grupo TGD fue de 4:1, mientras que en el grupo de control formado aleatoriamente, fue de 1,6:1 (fig. 1) (tabla 1).
Asociación de variables cualitativas analizadas
| Variable | Grupo TGD | Grupo control | Odds ratio | Intervalo de confianza |
| Sexo (masculino) | 32/5 | 43/26 | 3,87 | (1,23-1296) |
| Contacto ojo-ojo | 22/12 | 67/2 | 0.05 | (0,01-0,29) |
| Sonrisa social | 34/1 | 69/0 | – | – |
| Cólico | 11/23 | 24/45 | 0,9 | (0,34-2,23) |
| Atiende | 27/7 | 67/2 | 0,12 | (0,02-0,67) |
| Berrinches | 26/10 | 20/49 | 6,37 | (2,39-17,34) |
| Tolerancia alimentaria | 27/7 | 65/4 | 0,24 | (0,05-1,01) |
Nuestros resultados muestran que la edad de presentación de BS en los pacientes del grupo TGD (media de edad TGD=20,1±23 meses) fue significativamente superior (p = 0,01) que la del grupo control (media de edad control=10,8±10,3 meses) (tabla 2). El NH, ON, el peso, la talla, el perímetro cefálico con sus correspondientes Z-score, el SS, la edad gestacional (EG), y la edad de inicio de seguimiento con su correspondiente Z-score no presentaron diferencias significativas (tabla 2).
Comparación de variables independientes de tipo cuantitativo entre pacientes con TGD y grupo control
| Variable | Grupo TGDMedia±DE | ControlesMedia±DE | p |
| N.° de hermanos | 1,69±0,67 | 1,81±0,85 | NS |
| N° de orden hermano | 1,47±0,56 | 1,54±0,76 | NS |
| Peso | 29,4±17,2 | 25±15 | NS |
| Z-score peso | 0,22±1,1 | –0,1±0,96 | NS |
| Talla | 118,9±22,1 | 112,83±16,6 | NS |
| Z-score talla | 0,34±1,4 | –0,1±1,1 | NS |
| Perímetro craneal | 50,8±3,5 | 50,8±2,4 | NS |
| Z-score PC | 0,001±1,3 | 0,003±0,87 | NS |
| Tiempo presentación de sonrisa social (meses) | 1,85±1,1 | 1,82±0,7 | NS |
| Tiempo de sedestación (meses) | 12,2±15,3 | 7,7±7,4 | NS |
| Primeros bisílabos(meses) | 20,1±23 | 10,8±10,3 | 0,010 |
| Edad gestacional(semanas) | 38,3±2.4 | 39,7±1,4 | NS |
| Edad inicio de seguimiento | 6±4,3 | 5,6±2,5 | NS |
| Z-score de edad | 0,1±1,3 | –0,1±0,8 | NS |
NS: no significativo.
El CV durante la lactancia en el grupo TGD fue significativamente inferior al del grupo control (OR: 0,05; IC del 95%, 0,01-0,29). La ausencia del CV fue 20 veces menos frecuente entre los pacientes control que entre los del grupo TGD. En el mismo sentido, la RLLA en el grupo TGD fue significativamente inferior al grupo Control (OR: 0,12; IC del 95%, 0,02-0,67). En el grupo de control, la falta de RLLA fue 8 veces menor que en los pacientes TGD. La presencia de BE en el grupo TGD fue significativamente superior al de control (OR: 6,37; IC del 95%: 2,39-17,34). La presencia de BE en el grupo TGD fue 6 veces más probable que en el control. Por último, la TCA en el grupo TGD fue significativamente inferior al del grupo Control (χ2=5,22; p=0,022). Si bien la falta de TCA fue 4 veces menor que en los controles, el IC no excluyó del todo a la unidad, por lo su significación no se pude aceptar como válida (tabla 1) (fig. 1).
DiscusiónNuestros resultados sugieren que en edades precoces de la vida existen algunas circunstancias en los pacientes que acaban desarrollando un TGD que les diferencia de los normales. El recuerdo de la prevalencia del retraso en la aparición de los BS, la disminución del CV, la disminución de la RLLA, el aumento en el número de BE y la escasa TCA sugieren objetivamente en este estudio ser signos indicadores de un mayor riesgo de desarrollar un patrón de conducta TGD en edades posteriores.
Sin embargo, factores reconocidos en estudios previos14, como indicadores de TGD, tales como retraso en la SS, la presencia de CL y la edad gestacional no se mostraron indicativos en este estudio, probablemente por ser factores sobre los que la cultura sanitaria de la población ya tiene prejuicios de idoneidad, por lo que los padres tienden a adoptar los recuerdos hacia la normalidad.
El retraso en la aparición de los primeros BS en los pacientes afectados por TGD es un hecho bien contrastado en la literatura consultada15. De hecho, Pickles et al.16 en 2009 constataron dicha característica, aunque puntualizaron que más que el retraso del lenguaje, lo que era altamente específico del TGD era la pérdida del mismo.
A pesar de la necesidad del diagnóstico precoz, no disponemos en la actualidad de ningún marcador biológico para el TGD y, por tanto, la detección de esta patología debe focalizar su atención en la valoración de la conducta clínica17. Dentro de los comportamientos estudiados, el CV, la RLLA y los BE pueden ser indicadores de un fenotipo con más riesgo de desarrollo posterior de TGD, algo que es compartido por otros autores que utilizan estas conductas para elaborar posteriormente un test de cribado12,13 dirigido a los niños de atención primaria y que debería ser aplicado específicamente a los 18 y 24 meses para tratar de identificar a pacientes con riesgo de trastorno evolutivo17. Sin embargo, indicadores como retraso en la SS, identificada por estos autores como conducta de riesgo, no ha resultado estadísticamente significativa en nuestro estudio. Esto puede ser debido a las limitaciones de nuestro estudio, en la que parte de los datos recogidos son de naturaleza retrospectiva y, por lo tanto, dependientes de la falta de memoria de los padres, si bien estos problemas eran iguales para los dos grupos14.
La nula TCA también es un tema investigado en los niños con TGD, principalmente en los pacientes autistas, en los que se les ha descrito como comedores selectivos con escasa TCA justificada probablemente por los problemas de procesamiento sensorial que manifiestan estos pacientes18.
Las diferencias que hemos detectado entre el grupo TGD y el grupo control no pueden constituir un sistema diagnóstico en este periodo. Sin embargo, creemos que deben ser signos de alarma a tener en cuenta entre los profesionales dedicados a la asistencia de niños en este periodo de edad, para así realizar un diagnóstico lo más precoz posible y conseguir un mejor pronóstico.
En resumen, podemos establecer en relación a nuestros resultados, que existe un fenotipo premórbido de TGD detectable durante el periodo de lactante. Si bien se debe profundizar en métodos de observación clínica más específicos adaptados a esta edad, para poder llegar a establecer de forma más eficiente los riesgos reales de desarrollar trastorno del espectro autista en edades posteriores que pudieran beneficiarse de intervenciones precoces.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.