El ácido docosahexaenoico (DHA) es un ácido graso poliinsaturado de la serie n-3, al que se atribuyen múltiples funciones que están todavía en estudio. En prematuros y neonatos se ha puesto de manifiesto su influencia sobre el desarrollo visual y neurológico; sin embargo, están en estudio los efectos sobre determinadas enfermedades crónicas neurológicas, inflamatorias o metabólicas. Los requerimientos de DHA no están determinados, aunque los aportes deben basarse en imitar la composición de la lactancia materna y, en niños mayores y mujeres gestantes y/o lactantes, asegurar la ingesta de pescado azul al menos 2 veces por semana. Es fundamental reconocer la necesidad de suplementos de este ácido graso en algunas enfermedades con dietas restringidas o alteraciones metabólicas que ocasionen un déficit, pero también conocer las evidencias científicas sobre los efectos que produce en diferentes situaciones. Esta revisión actualiza la información existente, con el fin de proponer un aporte adecuado de DHA en diversas edades y patologías.
Docosahexaenoic acid (DHA) is a n-3 polyunsaturated fatty acid with multiple functions, although these are still under study. The development of visual and neurological functions have been demonstrated in premature infants and neonates, however, its effects are still being studied in certain chronic neurological diseases, and inflammatory and metabolic disorders. The DHA requirements are not fixed but recommendations must be based on an intake similar to the composition of breastfeeding, and in older children and during pregnancy and lactation, to ensure consumption of oily fish at least twice a week. It is essential to recognise the need for supplementation of this fatty acid in some diseases that require restricted diet, and in metabolic alterations resulting in a deficiency, but also know the scientific evidence on the effects produced in different situations. This review updates this information to propose an adequate intake of DHA at different ages and in different diseases.
Los lípidos son componentes estructurales de todos los tejidos y son indispensables para la síntesis de las membranas celulares. El cerebro, la retina y otros tejidos nerviosos son particularmente ricos en ácidos grasos poliinsaturados de cadena larga (AGPI-CL). Muchos estudios clínicos y epidemiológicos han mostrado efectos positivos de estos ácidos grasos sobre el desarrollo neurológico del niño, cáncer, enfermedades cardiovasculares y más recientemente, en otras enfermedades como en el déficit de atención e hiperactividad1–6. Además de su papel estructural, estos ácidos grasos contrarrestan la inflamación, la agregación plaquetaria, la hipertensión y la hiperlipidemia. Estos efectos beneficiosos pueden estar mediados por distintos mecanismos, incluyendo la alteración en la composición de membranas celulares y su función, la expresión génica o el ser precursores de la producción de eicosanoides7.
Desde 1950 se conocen los efectos del aceite de pescado y se aconseja un consumo habitual de este alimento, rico en AGPI-CL n-3. Recientemente, muchas entidades científicas han recomendado aumentar la ingesta de ácidos grasos n-3, y concretamente de ácido docosahexaenoico (DHA) en embarazadas y en la infancia, fundamentalmente en prematuros, neonatos y lactantes alimentados con fórmula artificial, así como en aquellos niños con patologías crónicas en las que puede existir un déficit. De hecho, además de los módulos de suplementos, también han aparecido en el mercado alimentos enriquecidos con estos ácidos grasos como los huevos, yogurt o leche para asegurar el consumo de la población general8.
A partir de diversos estudios, fundamentalmente en neonatos, la mejoría cognitiva y en el desarrollo de la visión se ha asociado particularmente con la ingesta de DHA, reforzando aún más la necesidad de que en el crecimiento y desarrollo del lactante debe asegurarse un aporte adecuado. Igualmente, se han observado efectos positivos en otras situaciones como en la prevención de enfermedades inflamatorias y mejoría en determinadas enfermedades crónicas. El objetivo de esta revisión es actualizar los conocimientos sobre los efectos del DHA y las recomendaciones para asegurar una ingesta adecuada con efectos beneficiosos sobre la salud en la infancia.
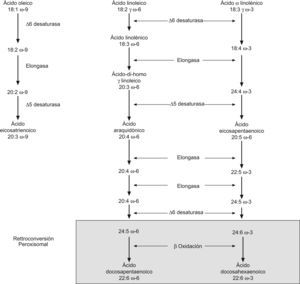
Fisiología del DHAEn la ruta de la síntesis de DHA, se precisan enzimas para realizar la elongación/desaturación de la cadena y que son compartidos por los ácidos grasos n-3 y n-69. Por ello, cuando aumenta la velocidad de síntesis del DHA, como ocurre en la infancia, el proceso puede estancarse en los precursores, incluso a pesar de la abundancia de éstos (ácido α-linolénico [ALA], o ácido eicosapentaeinoico [EPA]) (fig. 1)10. Aunque el ácido 22:6n-3 o DHA se encuentra en pequeña cantidad en la mayoría de los tejidos, es un componente mayoritario de la estructura cerebral, formando parte de las membranas celulares, participando en la función de transmisión de señales y en el crecimiento neuronal. Conforma un 30–40% del total de ácidos grasos en los bastones de los segmentos externos de la retina, incrementando la fluidez de la membrana, modificando la movilidad de las proteínas y la actividad de los enzimas que son críticos en la transducción de señales visuales11.
El DHA es fundamental en la concepción, crecimiento y desarrollo del embrión y en el niño. En el neonato, los niveles de DHA dependen de las concentraciones plasmáticas en la madre en relación a la nutrición durante el embarazo, y del tamaño de la placenta y las proteínas transportadoras12. El gradiente transplacentario de DHA parece ser mayor conforme avanza la gestación siendo transferidos en el tercer trimestre entre 30–45mg/d de los depósitos maternos al feto13. Tras el nacimiento se produce un rápido descenso de los niveles de ácido araquidónico (AA) y DHA hasta de un tercio sobre los niveles intrauterinos. El riesgo de daño neurológico aumenta en niños pretérmino menores de 1.500g en los que además de los niveles disminuidos se suma la obligatoriedad del uso de fórmulas alimentarias mediante nutrición enteral o parenteral carentes o pobres en estos ácidos grasos. Las necesidades son mayores al nacimiento por el rápido enriquecimiento en lípidos que precisan las membranas celulares, de hecho, algunos estudios sugieren que hacer depender este suministro únicamente a partir del ALA es insuficiente, especialmente en niños pretérmino, en los que esta actividad enzimática es aún muy inmadura14. Por ello, la suma de las reducidas concentraciones de DHA y AA intraútero en niños prematuros, el menor suministro tras el nacimiento y las posteriores necesidades, dan lugar a la aparición de moléculas inflamatorias y favorecedoras de isquemia, estando los niños prematuros expuestos a muchas de las complicaciones propias de esta etapa en las que el cerebro y los vasos sanguíneos tienen más tendencia a la fragilidad y ruptura de membranas.
La disminución de DHA en el cerebro y retina interfiere con la normal neurogénesis y función neuronal así como en las cascadas de señalización visual11. Durante la etapa postnatal, las conexiones neuronales se crean y refuerzan con la estimulación y si esta se pierde, puede ocasionarse una pérdida transitoria de agudeza visual y cambios en las funcionales corticales15. El DHA es precursor de docosanoides de los que deriva la neuroprotectina D1, que inhibe el estrés oxidativo y favorece la supervivencia celular. Las recientemente descritas nuevas funciones moleculares del DHA presentan una oportunidad para desarrollar nuevas terapias en prematuros, e incluso en enfermedades neuronales y retinianas degenerativas16.
Requerimientos e ingesta recomendada de DHAEl DHA no se considera un ácido graso esencial ya que se puede sintetizar a partir de los ácidos linoleico (LA) y especialmente ALA, que sí son considerados esenciales. No obstante, dada la limitada y alta variabilidad en la formación del DHA a partir del ALA (1–5%), y debido a sus críticas funciones sobre el desarrollo visual y neurológico, y sobre otros sistemas, debe ser considerado condicionalmente esencial en etapas tempranas de la vida, así como en la prevención de la enfermedad cardiovascular9. Sin embargo, los requerimientos mínimos de DHA o las ingestas dietéticas recomendadas (DRI) en la infancia son aún desconocidos17 y es difícil por varias razones. Además de poder ser sintetizado a partir de sus precursores, las concentraciones en el plasma que representen una deficiencia no están claras, y tampoco están determinadas las pruebas complementarias clínicas y de laboratorio para determinar un déficit y el tiempo de suplementación para observar efectos concluyentes18.
Teniendo en cuenta que el conocimiento científico es aún incompleto, las recomendaciones se deben enfocar individualmente más bien como patrones dietéticos. En estudios recientes, se han observado ingestas bajas de DHA en niños escolares en los que la ingesta de pescado azul era escasa, aunque no se han evaluado las consecuencias reales sobre la salud19. No hay suficiente evidencia para aumentar la ingesta de DHA en niños sanos entre 2–18 años, con el fin de aumentar el desarrollo físico o neurológico o para conseguir determinados beneficios funcionales. Entre estos últimos, también destaca la dieta enriquecida en DHA para la mujer gestante, la lactancia materna y el consumo de pescado para promocionar la salud y disminuir el riesgo de enfermedades crónicas en los adultos, que pueden ser aplicables a niños mayores de 2 años9,17. La OMS ha consensuado unas recomendaciones de aproximadamente entre 400–1.000mg de n-3 por semana en adultos, mediante el consumo de pescado. En mujeres gestantes y durante la lactancia materna se recomiendan al menos 200mg/d de DHA que se consiguen con la ingesta de dos raciones de pescado a la semana, y por otra parte, raramente superan la ingesta tolerable de contaminantes20,21. Además, aunque aún no hay datos unánimes que avalen la recomendación de los AGPI-CL en la infancia, debemos seguir imitando la composición de la leche materna de madres bien nutridas como una guía de recomendación para las fórmulas infantiles. En niños con enfermedades crónicas que supongan un riesgo de déficit, habrá que valorar la suplementación o enriquecimiento de la dieta13. El aporte de ácidos grasos n-3 en la infancia depende de la lactancia materna, y de la propia ingesta de pescado que va aumentando con la edad22. Hasta hace unos años han existido multitud de posibilidades para la suplementación basadas en el uso de diferentes tipos de aceites y otros suplementos que contienen AGPI-CL pero el exceso de LA en algunos aceites vegetales hace que se reduzca la formación de DHA debido a la inhibición de la Δ6 –desaturasa. Sin embargo, el aceite de pescado provee de AGPI-CL n-3 como el DHA y el EPA. No obstante, la alternativa actual para mejorar la mezcla de AGPI-CL de las fórmulas infantiles es añadirlos directamente. El DHA incluido en las fórmulas suele provenir del aceite de pescado, del huevo u organismos unicelulares, entre otros21. Igualmente, para el uso en niños mayores, también existen suplementos con DHA puro o incluido en módulos.
Aporte de DHA en neonatos y lactantesEn niños nacidos a término, hay fuertes argumentos teóricos a favor de la suplementación con AGPI-CL, fundamentalmente con la idea de imitar a la leche materna, aunque los resultados de los estudios de intervención en relación con cambios en el desarrollo neurológico y visual son todavía controvertidos23. Aún así es difícil ya que la variabilidad de la cantidad de DHA en la leche materna es importante (0,17−0,99% del total de ácidos grasos), en mujeres de distintas zonas geográficas con ingestas muy diferentes24 con una media del 0,5% en el calostro y de 0,25% en la leche madura (7–8mg/dl)25.
Las etapas de embarazo y lactancia son críticas y precisan que las mujeres lactantes aseguren una ingesta suficiente de DHA. En algunos estudios se han observado ingestas escasas de DHA en las embarazadas15. Igualmente, el ofrecimiento de la lactancia materna durante al menos 6 meses asegura unos niveles de DHA mayores respecto al consumo de fórmulas artificiales26.
La evaluación de una fórmula artificial suplementada debe basarse en su capacidad para conseguir los efectos funcionales y sobre el desarrollo, similares a los que proporciona la leche materna. Por ello, es necesario valorar las respuestas bioquímicas, metabólicas y funcionales de las fórmulas suplementadas con DHA o AGPI-CL. Basados en los resultados de diferentes estudios, desde 1994 a la actualidad diversas organizaciones internacionales han recomendado la inclusión de EPA y DHA en las fórmulas infantiles cuando la lactancia materna no sea posible9. En los últimos años, un comité de expertos ha concluido que, basados en las evidencias de estudios de suplementación con DHA, en la fórmula infantil se deben añadir al menos el 0,2% de los ácidos grasos como DHA pero estos niveles no deben exceder el 0,5% de los ácidos grasos ya que no se ha evaluado suficientemente una ingesta mayor21. Además, las fórmulas con DHA deben contener también AA, y el EPA no debe exceder los niveles de DHA21. Teniendo en cuenta que la introducción de alimentos como el pescado, los huevos o las vísceras se produce a partir del año aproximadamente, es conveniente prolongar la lactancia materna tanto tiempo como sea posible y/o asegurar los aportes a partir de fórmulas suplementadas, al menos hasta conseguir la de estos alimentos26.
Efectos sobre la saludLos ácidos grasos esenciales no fueron considerados como tales hasta 1960, cuando se comenzó a evidenciar patología por déficit de lípidos en dietas parenterales. Estos niños presentaban una alteración en el crecimiento así como sequedad, descamación y engrosamiento de la piel como una manifestación del déficit de LA. La deficiencia de ácidos grasos esenciales n-3 también causa patología dermatológica pero de una manera más subclínica y normalmente asociada a la deficiencia por n-6 y de otros micronutrientes. Se han estudiado en estos pacientes efectos negativos en el desarrollo neurológico, en la función visual y neuropatía periférica. A partir de entonces se han estudiado los efectos de los n-3 sobre la salud (tabla 1). Aunque los niños alimentados con fórmulas habituales pueden presentar valores más bajos de almacenamiento de DHA en el cerebro en un periodo que es crítico para el desarrollo, si se encontraran evidencias experimentales de que la dieta con DHA mejora la función cerebral, este sería considerado realmente un nutriente condicionalmente esencial. Diversos estudios clínicos han demostrado mejorías en la agudeza visual y el desarrollo cognitivo en niños con mayores aportes de DHA durante la lactancia o en prematuros tras suplementos en las fórmulas1,2,27–29. Sin embargo, otros autores utilizando fórmulas suplementadas no han obtenido resultados concluyentes3. Estos hallazgos no se pueden atribuir únicamente a los AGPI-CL. Existen además, otros factores de confusión en los resultados como pequeño tamaño de las muestras estudiadas, la sensibilidad de los diferentes métodos de medida y las proporciones de los distintos ácidos grasos de las fórmulas administradas o el tiempo de suplementación, y que pueden explicar las discrepancias en los resultados18,30.
Posibles efectos de los ácidos grasos n-3 sobre la salud
| Actuación de los ácidos grasos n-3 | Efectos sobre la salud |
| Crecimiento | Efecto positivo en pretérminos |
| Función visual | Mejora de la agudeza visual en neonatos |
| Función cognitiva | Mejora de funciones motoras y del aprendizaje |
| Perfil lipídico | Disminución de la hipertrigliceridemia |
| Tensión arterial | Disminución de la tensión arterial |
| Sistema inflamatorio | Efectos antiinflamatorios |
| Sistema inmune | Prevención de alergias y enfermedades autoinmunes |
Desde hace más de una década, también han ido apareciendo estudios para valorar el efecto de los AGPI-CL n-3 y n-6 sobre el crecimiento, especialmente en niños pretérmino. No obstante, los resultados que en un principio parecían adversos, se han contrarrestado con los de otros estudios en los que hay un efecto positivo sobre el peso31. Las razones de estos efectos no están dilucidadas aún y se han sugerido modificaciones metabólicas de los n-3 sobre los n-6, como alteraciones enzimáticas en el paso de n-3 a n-6, inhibición de la síntesis de eicosanoides, o alteraciones en la transcripción de genes que controlan la lipólisis y lipogénesis14.
El déficit de DHA afecta de forma importante a la neurotransmisión, a la capacidad de unión con los sustratos de los enzimas de membrana, a la actividad de los canales iónicos, o a la expresión génica11. Se ha asociado a enfermedades metabólicas con alteración en el sistema nervioso, o asociadas al envejecimiento. Esto ha dado lugar a investigaciones en diferentes patologías neurológicas para valorar el estado de los AGPI-CL y posibilidades de suplementaciones para mejorar los estados clínicos y evolución de los pacientes.
En los últimos años, se han atribuido a los ácidos grasos n-3 otros muchos beneficios sobre el sistema cardiovascular, inflamatorio o inmunológico, basados fundamentalmente en estudios en adultos. El consumo de productos enriquecidos con DHA ha permitido mejorar el perfil lipídico, glucosa y homocisteína de pacientes con síndrome metabólico o con dislipidemias32,33. Además, este ácido graso tiene un especial papel en la regulación de la tensión arterial aunque todavía hay que determinar la dosis adecuada y el tiempo de tratamiento. También tiene propiedades antiarrítmicas al aumentar la permeabilidad de la membrana de las células cardiacas y, en la infancia, se están evaluando sus efectos sobre parámetros hemodinámicos4.
Por otra parte, los AGPI-CL parecen modular la respuesta inmune y pueden tener un papel protector en alergias y otras enfermedades inflamatorias. Fundamentalmente, EPA/DHA incrementan los niveles de resolvinas y lipoxinas, que son moléculas que intervienen en la resolución de la inflamación. Además, parecen tener un efecto inhibitorio sobre determinadas moléculas inflamatorias como las interleuquinas 1 y 2, el factor de necrosis tumoral alfa o la proteína C reactiva e incluso suprimir a las células Th1. Al parecer, si el balance entre los factores inflamatorios y antiinflamatorios se altera por déficit de estos ácidos grasos, se facilita la aparición de enfermedades inflamatorias crónicas. Parte del efecto inmune de la leche materna para prevenir la aparición de alergias y enfermedades inflamatorias se ha asociado con sus mayores niveles de AGPI-CL, formando parte de la teoría de programación perinatal34. Sin embargo, en un metaanálisis reciente, con más de 3.000 estudios evaluados, no se observan datos concluyentes que indiquen beneficios de la suplementación con n−3 y n−6 en la prevención de enfermedades alérgicas35.
DHA y enfermedades crónicasEn algunas enfermedades, como en las mostradas en la tabla 2, existe una disminución del DHA, estando comprometida su importante funcionalidad. En estos casos, es importante realizar la suplementación nutricional para cubrir las deficiencias detectadas, así como valorar los efectos que esa intervención tiene como potencial terapéutico para la enfermedad. En determinadas patologías, la herramienta nutricional es apenas el único tratamiento que puede utilizarse, y esta puede proporcionar una mejora en la calidad de vida de las personas afectadas36.
Posibles indicaciones de empleo de DHA como módulo dietético en determinadas condiciones clínicas
| DHA en usos médicos especiales |
| Enfermedades peroxisomales: adrenoleucodistrofia ligada al cromosoma X |
| Fibrosis quística |
| Fenilcetonuria |
| Caquexia cancerosa |
| Trastornos metabólicos congénitos susceptibles de tratamientos dietoterápicos |
| SIDA |
Las deficiencias de DHA están asociadas a las enfermedades peroxisomales, a la hiperactividad, al déficit de atención, a la fenilcetonuria, a la fibrosis quística, a la enfermedad de Alzheimer y al propio proceso de envejecimiento, entre otros8.
Los niños con enfermedades crónicas, como los errores congénitos del metabolismo (aminoacidopatías, trastornos del ciclo de la urea, enfermedades peroxisomales) o la fibrosis quística, en ocasiones, debido a la restricción dietética a la que tienen que someterse, tienen restringidas las fuentes alimentarias de productos ricos en DHA. Por otro lado, la propia alteración metabólica puede contribuir al déficit a pesar de una terapia nutricional adecuada, sin que aún se conozcan los mecanismos fisiopatológicos en muchas de ellas36. En niños con fibrosis quística se están realizando ensayos clínicos con suplementos de DHA para tratar de mejorar la nutrición y crecimiento, la función pulmonar y pancreática, así como disminuir la producción de isoprostanos inflamatorios36,37. La suplementación con DHA tanto oral como parenteral, es eficaz para incrementar sus niveles tisulares. Las dosis utilizadas en la suplementación oral son de entre 50–70mg/kg/d de DHA, siendo bien absorbidos y tolerados, no observándose efectos adversos38.
En niños con fenilcetonuria (PKU) se ha observado que los déficits neurológicos no explicados por las variaciones en los niveles plasmáticos de fenilalanina pueden ser debidos a una disminución en el DHA. La síntesis de DHA está deteriorada por los productos del catabolismo del exceso de fenilalanina, hecho que se propone como un factor etiológico de la neuropatía característica de esta enfermedad39. Además, aunque el aporte de ALA en estos niños es adecuado, no parece suficiente para asegurar una conversión a DHA y, tras suplementar a estos niños con DHA, se han observado mejorías en los potenciales evocados visuales, y en tests de coordinación y función motora39. Aunque son necesarios más estudios en estos grupos de riesgo para establecer las dosis adecuadas, sí parece adecuado considerar este ácido graso esencial tanto en las madres gestantes afectadas de PKU como en pacientes que tienen niveles bajos de estos metabolitos esenciales. Además, la suplementación dietética en pacientes con PKU tiene potencial terapéutico y está indicada de forma más o menos continuada en función de la monitorización de los AGPI-CL. Dado que el desarrollo y, sobre todo el recambio de componentes como el DHA en el cerebro, continúa más allá de la primera infancia, sería razonable pensar que estos beneficios serían extensibles a la preadolescencia, la adolescencia y la edad adulta39,40.
En pacientes con defectos de la oxidación de ácidos grasos en peroxisomas y mitocondrias existe, por la propia alteración metabólica, déficit de DHA, que puede ser la responsable de transducción de señales alterada asociada con incapacidad para el aprendizaje, déficit cognitivo, y disfunción visual. En el síndrome de Zellweger, en el que hay una incapacidad para la síntesis de DHA, existen concentraciones reducidas de este en el cerebro y la retina, apareciendo en estos niños ceguera y atonía generalizada; la suplementación temprana con DHA puede mejorar el estado neurológico y visual de estos pacientes41.
Diversos estudios en los que se han utilizado suplementos de DHA en niños con patología neurológica como la dispraxia o dislexia, han evidenciado mejoría en las habilidades para la lectura y manipulación7. En niños con trastorno de déficit de atención e hiperactividad (TDAH), los síntomas y signos se mimetizan con aquéllos procedentes del déficit de DHA y, por ello en los últimos años, se han realizado diversos estudios para valorar la eficacia de la suplementación con DHA, con resultados aún contradictorios42,43. Muchos de estos pacientes pueden tener una deficiencia, con síntomas acompañantes debidos a una ingesta inadecuada, una deficiente conversión de los AGPI-CL o una alteración en su metabolismo. En un estudio reciente en adolescentes con TDAH, se ha confirmado que no hay diferencias en la ingesta en relación a niños sanos pero su concentración en sangre es menor, atribuyéndose a una metabolización diferente6. En otras patologías neurológicas como el autismo o la depresión en niños, también hay aún resultados muy inespecíficos que no permiten establecer pautas de tratamiento44.
Finalmente, es importante hacer mención a enfermedades crónicas como el cáncer o el SIDA, en las que los efectos beneficiosos de los AGPI n−3, a través de su acción inmunomoduladora y antiinflamatoria, sobre el crecimiento tumoral, el desarrollo de metástasis y la propia caquexia han sido evidenciados por muchos estudios aunque aún hay controversias. Por ello, estos pacientes deben ser considerados para valorar la suplementación5.
Efectos adversos potenciales de la suplementación con DHA y alternativasEn los alimentos, la fuente más importante de DHA es el pescado y el aceite de pescado. Sin embargo, con frecuencia, su sabor y olor a veces provoca efectos negativos como náuseas y rechazo a la ingesta, que contribuyen al riesgo de déficit. Otro de los factores que dificultan su ingesta es, que algunos pescados azules, especialmente en los de la escala trófica superior (tiburones, túnidos, salmónidos) hay contaminantes como el metil-mercurio, que pueden afectar fundamentalmente al desarrollo cerebral y al crecimiento en la infancia, por lo que hay que limitar su consumo, especialmente en mujeres gestantes y niños. En los aceites purificados de pescado, como los que se utilizan en las fórmulas lácteas, el problema son los residuos de plaguicidas como los policlorurobifenilos o dioxinas, aunque el riesgo cancerígeno parece ser bajo45. No obstante, la ingesta puede asegurarse tratando de consumir pescados no contaminados u otros pescados como boquerones y sardinas, marisco o procedentes de piscifactoría o en conserva. La otra fuente válida son los productos ricos en ALA, aunque su conversión a DHA es limitada. En los últimos años, tratando de asegurar una ingesta adecuada, se han comercializado productos manufacturados enriquecidos con DHA. Entre ellos, destacan los huevos procedentes de pollos que han consumido DHA (150mg/huevo). También se han suplementado la leche y otros productos lácteos, y la dieta de animales de granja. Todos estos productos, a pesar de sus propiedades biológicas, aún tienen poca aceptación debido a su sabor a pescado, su rápida caducidad y el mayor precio8.
El DHA, al ser un ácido graso muy insaturado, es muy susceptible a la peroxidación lipídica. Por ello, hay que garantizar la seguridad al usar fórmulas infantiles suplementadas con AGPI-CL, ya que se podrían generar radicales libres que afectaran a los tejidos. No obstante, tras diferentes estudios en niños, no se han detectado anomalías entre las concentraciones primitivas de lípidos peroxidados ni en la actividad enzimática antioxidante46.
En relación a efectos adversos propios de una dosis muy alta, en estudios randomizados se ha administrado hasta 1g/d de DHA o 2−7g/d de AGPI-CL n−3 sin observar efectos adversos, incluso en embarazadas13.
Una de las alternativas de suplementación en la infancia además de los alimentos, y sobre todo en niños con patologías crónicas en los que el DHA puede ser esencial, es mediante la administración de módulos o cápsulas de este ácido graso, haciendo una monitorización durante el tratamiento.
Comentarios y recomendacionesLos ácidos grasos omega-3 parecen tener beneficios sobre el sistema cognitivo y visual, y también tienen propiedades antiinflamatorias y sobre el sistema inmune con una función en la prevención de alergias y control de enfermedades autoinmunes.
En la infancia, aún no existen suficientes evidencias científicas sobre los beneficios de la suplementación con DHA en enfermedades como el autismo, el TDAH o enfermedades cardiovasculares o inflamatorias crónicas.
El DHA debe ser considerado esencial en determinadas situaciones como en el prematuro, y en enfermedades crónicas como la fibrosis quística, aminoacidopatías, y otras metabolopatías. En estos casos se debe asegurar su ingesta mediante suplementos y alimentos ricos en este ácido graso.
En mujeres embarazadas y durante la lactancia materna, es importante asegurar la ingesta de pescado (al menos 2 veces por semana), hasta que los niños puedan incluir alimentos ricos en n-3 en la alimentación complementaria.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Comité de Nutrición de la Asociación Española de Pediatría: J Dalmau Serra (Coordinador), M Gil-Campos, V Martínez Suárez, A Moráis López, L Moreno Aznar, JM Moreno Villares, F Sánchez-Valverde Visus.