El control glucémico postprandial es fundamental para conseguir los objetivos metabólicos en pacientes con diabetes mellitus tipo 1 (DM1). La nueva insulina faster aspart presenta un perfil farmacológico caracterizado por una absorción e inicio de acción más rápidos, mayor disponibilidad precoz y menor incremento de la glucosa postprandial. El objetivo principal del estudio fue analizar su eficacia en pacientes con DM1 tratados con un sistema integrado.
Pacientes y métodosEstudio analítico, longitudinal, prospectivo y multicéntrico, evaluando el empleo de faster aspart durante tres meses en pacientes en edad pediátrica con DM1 con sistema integrado MiniMed640G® tratados previamente con insulina aspart. Al inicio y final del estudio se analizaron para posterior comparación: glucosa media, porcentajes de tiempo en objetivo, tiempo en hipoglucemia e hiperglucemia, área bajo la curva (AUC) < 70 y > 180 mg/dL, glucosa media pre y postprandial en comidas principales, necesidades diarias de insulina, porcentaje basal/bolo y HbA1c. Se registraron complicaciones agudas y eventos adversos, y se evaluó grado de satisfacción mediante encuesta.
ResultadosSe incluyeron 31 pacientes de 13,49 ± 2,42 años de edad con DM1 de 7,0 ± 3,67 años de evolución. Faster aspart se asoció con menor porcentaje de tiempo en hiperglucemia > 180 mg/dL (25,8 ± 11,3 vs. 22,4 ± 9,5; p = 0,011) y > 250 mg/dL (5,2 ± 4,9 vs. 4,0 ± 3,6; p = 0,04) y AUC > 180 mg/dL (10,8 ± 6,5 vs. 9,3 ± 6,1; p = 0,03), incrementándose el tiempo en objetivo (71,4 ± 10,0 vs. 74,3 ± 9,2; p = 0,03) sin aumentar hipoglucemias. Las necesidades de insulina, porcentajes basal/bolo y HbA1c no se modificaron significativamente. Faster aspart fue bien tolerada y valorada por los participantes.
ConclusionesFaster aspart consigue un mejor control glucémico, aumentando el tiempo de glucosa en objetivo en niños y adolescentes con DM1 en tratamiento con un sistema integrado.
Post-prandial glucose control is essential to achieve metabolic goals in patients with type 1 diabetes mellitus (T1DM). The new «faster aspart» insulin has a pharmacological profile noted for its faster absorption and onset of action, and increased early availability, resulting in improved blood glucose control after meals. The main objective of the study was to analyse the efficacy of «faster aspart» vs. «insulin aspart» in children and adolescents with DM1 on sensor-augmented pump treatment.
Patients and methodsMulticentre, longitudinal and prospective analytical trial evaluating the use of faster aspart insulin for three months in children with T1DM with MiniMed640G® sensor-augmented pumps previously treated with aspart insulin. At the beginning and end of the study the following variables were analysed for subsequent comparison: mean sensor glucose, percentage of time in range, hypoglycaemia and hyperglycaemia, area under the curve (AUC) < 70 and > 180 mg/dL, mean sensor glucose pre and postprandial in main meals, daily insulin requirements, basal/bolus percentage, and HbA1c. Acute complications, adverse events and satisfaction survey were assessed.
ResultsThe study included 31 patients with a mean of 13.49 ± 2.42 years of age and with T1DM of 7.0 ± 3.67 years of onset. The use of faster aspart was associated with lower time in hyperglycaemia > 180 mg/dL (25.8 ± 11.3 vs. 22.4 ± 9.5; p = 0.011) and > 250 mg/dL (5.2 ± 4.9 vs. 4.0 ± 3.6; p = 0.04), lower AUC > 180 mg/dL (10.8 ± 6.5 vs. 9.3 ± 6.1; p = 0.03), and increased time in range (71.4 ± 10.0 vs. 74.3 ± 9.2; p = 0.03). No significant changes in hypoglycaemia, HbA1c, insulin requirements, and basal/bolus percentages were detected. Faster aspart was safe and well-evaluated by patients and caregivers.
ConclusionsFaster aspart achieves better glycaemic control by increasing glucose time in range in children and adolescents with T1DM on treatment with sensor-augmented pumps.
La diabetes mellitus tipo 1 (DM1) se caracteriza por hiperglucemia en ayunas y postingesta secundaria a una deficiente secreción de insulina debida a la destrucción autoinmune de las células beta pancreáticas. Los resultados del Diabetes Control and Complication Trial (DCCT)1,2 y, posteriormente, los del Epidemiology of Diabetes Interventions and Complications study (EDIC)3 demostraron la importancia de mantener cifras de glucemia cercanas a la normalidad para evitar las complicaciones microvasculares en personas con DM1. En adelante, el objetivo del tratamiento fue conseguir unas cifras de glucemia y hemoglobina glicosilada (HbA1c) lo más cercanas a la normalidad desde el inicio de la enfermedad. Sin embargo, los cambios de peso, composición corporal y sensibilidad insulínica dificultan la terapia en niños y adolescentes, de modo que solo una minoría alcanzan los objetivos glucémicos recomendados por las sociedades científicas4,5.
En la actualidad, el régimen de elección es la terapia intensiva basal-bolo que pretende remedar la secreción fisiológica pancreática mediante múltiples dosis de insulina subcutánea (MDI) o infusión subcutánea continua de insulina (ISCI)6. De implantación progresivamente creciente en las últimas dos décadas7, la terapia con ISCI se asocia a una mejoría del control glucémico y menor riesgo de hipoglucemia grave en comparación con la terapia con MDI8.
El control de la glucemia postprandial es un componente esencial para alcanzar los objetivos de HbA1c recomendados por las distintas sociedades científicas9,10, especialmente en aquellos pacientes con buen control global11. Asimismo, diversos estudios epidemiológicos respaldan que la hiperglucemia postprandial se asocia con un incremento del riesgo cardiovascular y de la mortalidad12,13, si bien los estudios de intervención en pacientes no han sido concluyentes14,15. En sujetos sanos, la presentación del alimento y el inicio de la ingesta estimulan una rápida liberación de insulina que suprime la secreción de glucagón (y con ello su estímulo sobre la producción hepática de glucosa) y promueve la captación periférica de glucosa, limitando la elevación postprandial de la glucemia. Este complejo y sofisticado sistema de regulación se encuentra alterado en pacientes con DM condicionando una mayor hiperglucemia postprandial. Así, la insulina ideal para utilizar en bolos sería una de inicio de acción muy rápido, con un pico breve y una vida media también muy corta.
En comparación con la insulina regular, los análogos de insulina de acción rápida o AAR (lispro, aspart y glulisina) presentan un inicio de acción más rápido (10-15 minutos) y una vida media más corta. Sin embargo, pese a estos avances en su formulación, los AAR continúan careciendo de un pico de acción lo suficientemente rápido para controlar la hiperglucemia postprandial y suprimir la producción hepática de glucosa16,17, presentando además una duración más larga en comparación con la insulina secretada de forma endógena.
En pacientes portadores de sistemas integrados (ISCI con monitorización continua de glucosa intersticial), el retraso en la absorción y acción del AAR, sumado al decalaje en las lecturas de glucosa en líquido intersticial por el sensor y un algoritmo integrador eficaz, constituye uno de los grandes retos para la consecución del asa cerrada (páncreas artificial)18.
La nueva insulina faster aspart es una formulación de insulina aspart que contiene dos excipientes adicionales: nicotinamida (vitamina B3) y L-arginina. La nicotinamida es responsable de una absorción más rápida al incrementar inicialmente los monómeros de aspart en el depósito subcutáneo y producir un efecto vasodilatador local transitorio19. La L-arginina actúa como agente estabilizante. En estudios de farmacocinética y farmacodinámica, la administración subcutánea de faster aspart muestra en comparación con aspart una aparición en la circulación dos veces más precoz, presentando en los primeros 30 minutos una exposición a la insulina dos veces mayor y una acción insulínica aproximadamente un 74% superior20. Además, aunque la concentración máxima alcanzada y el total de exposición a la insulina no difieren, el fin del efecto hipoglucemiante ocurre 12-14 minutos antes con faster aspart que con aspart. La variabilidad de acción de faster aspart, tanto inter como intraindividual, es baja y comparable con la de aspart. Resultados similares se han observado en estudios con niños y adolescentes con DM121. Administrada mediante ISCI, el perfil de absorción de faster aspart resulta ser aún mejor que con MDI, simulando más fielmente la secreción fisiológica de insulina. La exposición temprana a faster aspart es tres veces mayor y su efecto hipoglucemiante aproximadamente un 100% superior en los 30 primeros minutos, adelantándose el fin de su efecto hipoglucemiante 24 minutos en comparación con aspart22. En niños y adolescentes, la administración preprandial de faster aspart se asoció a una reducción significativa de la hiperglucemia postprandial comparada con aspart, sin riesgos adicionales23. En el mismo estudio, en términos de HbA1c, el empleo postprandial de faster aspart demostró su no inferioridad respecto a aspart, mientras que administrada de forma preprandial se asoció a una HbA1c significativamente menor.
El objetivo principal de este estudio es evaluar la repercusión del empleo de faster aspart sobre el control glucémico en niños y adolescentes con DM1 tratados con sistema integrado.
Pacientes y métodosDiseño del estudioEntre julio y octubre de 2019, se llevó a cabo un estudio analítico, longitudinal y prospectivo, con pacientes con DM1 en seguimiento en las Unidades de Diabetes Infanto-Juvenil de los Hospitales San Pedro de Alcántara (Cáceres) y Virgen del Puerto (Plasencia).
ParticipantesLos criterios de inclusión para formar parte del estudio fueron: pacientes en edad pediátrica con diagnóstico de DM1, tiempo de evolución de la enfermedad superior a un año y tratamiento previo durante al menos tres meses con sistema integrado MiniMed640G-SmartGuard® (Medtronic®, Northridge, CA) que empleaban insulina aspart. Se recogió por escrito el consentimiento informado de padres y pacientes ≥ 12 años. Cuando se llevó a cabo el reclutamiento, faster aspart disponía de indicación únicamente en pacientes mayores de 18 años con DM1 y DM2, aunque los estudios para su aprobación en edad pediátrica ya habían sido presentados y era inminente la ampliación de su indicación a pacientes a partir de un año de edad. Por este motivo, se recogió también consentimiento informado para su empleo.
El sistema integrado MiniMed640G-SmartGuard® suspende automáticamente la infusión de insulina cuando se prevé un descenso de la glucosa intersticial en los siguientes 30 minutos hasta 20 mg/dL por encima del límite preestablecido, siempre y cuando el valor de glucosa en el momento de la suspensión se encuentre 70 mg/dL o menos por encima de dicho umbral, permaneciendo suspendida la infusión de 30 minutos a dos horas. El aporte de insulina se reanudará de forma automática cuando la cifra de glucosa intersticial sea al menos 20 mg/dL superior a la cifra umbral y se prevea que en los siguientes 30 minutos se situará al menos 40 mg/dL por encima; el paciente puede reiniciar voluntariamente en cualquier momento la infusión si lo estima oportuno. Aquellos pacientes en cuya bomba no estaba activada la suspensión predictiva antes de hipoglucemia al iniciar el estudio, mantuvieron dicha función desactivada durante los siguientes tres meses para evitar que las diferencias encontradas pudieran ser atribuibles a esta modificación. La monitorización de glucosa (MCG) a tiempo real se realizó con el sensor Guardian®Sensor 3 y el transmisor Guardian®Link 3 (Medtronic®).
MétodosSe efectúo inicialmente una descarga de los datos registrados en la bomba correspondientes al último mes mediante el software CareLink® (Medtronic®): tiempo de uso de la MCG, glucosa intersticial media del último mes, coeficiente de variación (CV), glucosa intersticial media antes y dos horas después de las principales comidas, porcentaje de tiempo en objetivo (70-180 mg/dL), hipoglucemia (< 70 y < 54 mg/dL) e hiperglucemia (> 180 y > 250 mg/dL), área bajo la curva (AUC) en hipoglucemia (< 70 mg/dL) e hiperglucemia (> 180 mg/dL), necesidades diarias de insulina y porcentaje basal/bolo. Los límites del porcentaje de tiempo en objetivo, hiperglucemia e hipoglucemia se establecieron atendiendo a las recomendaciones consensuadas recientemente a nivel internacional24. Asimismo, se recogieron datos de antropometría (índice de masa corporal [IMC]25, desarrollo puberal) y se llevó a cabo una determinación de HbA1c (Afinion 2®, Abbott).
Durante los siguientes tres meses, los pacientes emplearon faster aspart en la bomba de insulina. Las familias fueron informadas al inicio del estudio acerca del perfil de acción de la nueva insulina y de la probable necesidad de reducir tiempos de espera entre bolo e inicio de ingesta. Se informó igualmente de la posibilidad de precisar cambios en la configuración de la bomba según los perfiles glucémicos obtenidos con faster aspart. Al margen de esta información, se mantuvieron las revisiones habituales en consulta sin que se realizara un seguimiento más estrecho ni formación adicional. Los pacientes continuaron empleando la información ofrecida por el sensor y modificando su actuación según flechas de tendencia del mismo modo en que lo venían realizando, de acuerdo con la formación recibida con anterioridad, sin que se dieran nuevas pautas al respecto.
Al finalizar el estudio, se llevó a cabo la recogida de las mismas variables registradas al inicio, así como de los problemas o eventos adversos detectados. Los padres y pacientes rellenaron también una encuesta de satisfacción en la que evaluaban del 1 al 5 el grado de satisfacción experimentado con la nueva insulina (1 = muy insatisfecho, 2 = insatisfecho, 3 = aceptable, 4 = satisfecho, 5 = muy satisfecho), así como su deseo o no de continuar empleándola.
Análisis estadísticoEl análisis estadístico de los datos se realizó con el programa SPSS® (Statistical Package for the Social Sciences) versión 24 para Windows® (IBM SPSS Statistics, Armonk, NY). La comparación de variables continuas se llevó a cabo mediante la prueba «t» de Student para datos relacionados si seguían una distribución normal y mediante el test de Wilcoxon si no lo hacían. Se estableció umbral de significación p < 0,05 para todas las pruebas estadísticas realizadas.
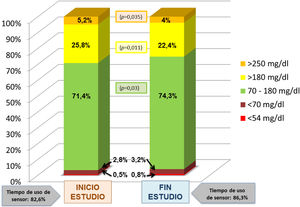
ResultadosDe un total de 45 pacientes que cumplían criterios de inclusión, aceptaron participar en el estudio 32 (17 mujeres y 15 varones), 81% púberes, con una edad media de 13,49 ± 2,42 años y un tiempo medio de evolución de la enfermedad de 7,0 ± 3,67 años. El tiempo medio transcurrido desde el debut hasta el inicio de la terapia con ISCI era de 2,23 ± 2,57 años. El resto de características basales de la muestra quedan recogidas en la tabla 1. Seis pacientes que aún no habían configurado en su bomba la suspensión predictiva antes de hipoglucemia mantuvieron esta función desactivada durante el período de estudio, empleando únicamente las alarmas previamente establecidas. Una participante abandonó el estudio por dolor abdominal sin coincidencia con los bolos. El tiempo medio de uso de la MCG fue del 82,6% al inicio del estudio y del 86,3% al finalizar el mismo.
Características basales de la muestra
| Media +/- DE | Rango | |
|---|---|---|
| Edad (años) | 13,49 ± 2,42 | (7,07-17,27) |
| Evolución DM (años) | 7,0 ± 3,67 | (1,94-15,83) |
| Edad al inicio ISCI (años) | 8,71 ± 3,81 | (0,95-14,07) |
| IMC (DE) | 0,05 ± 1,00 | (-1,36-2,03) |
| Necesidades insulina (UI/kg/día) | 0,83 ± 0,16 | (0,45-1,09) |
| Basal (%) | 43,72 ± 8,27 | (29-59) |
| Bolus (%) | 56,47 ± 8,47 | (41-71) |
| HbA1c (%) | 6,95 ± 0,54 | (5,7-8,4) |
| N° glucemias capilares/día | 5,91 ± 1,40 | (2,5-8,3) |
| Glucosa intersticial media (mg/dL) | 148,69 ± 15,97 | (113-196) |
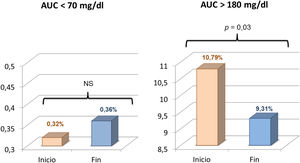
El análisis comparativo de los datos correspondientes al inicio del estudio y al último mes de uso de faster aspart reveló un descenso significativo de la glucosa intersticial media que pasó de 149 ± 16 a 145 ± 14 mg/dL (p = 0,04). El porcentaje de tiempo en objetivo (70-180 mg/dL) experimentó un aumento del 71,4 ± 10,0 al 74,3 ± 9,2% (p = 0,03). Disminuyó tanto el porcentaje de tiempo en hiperglucemia > 180 mg/dL (25,8 ± 11,3 vs. 22,4 ± 9,5%; p = 0,011) como > 250 mg/dL (5,2 ± 4,9% vs. 4,0 ± 3,6% (p = 0,035)). El AUC > 180 mg/dL se redujo también de forma significativa al pasar de 10,8 ± 6,5 a 9,3 ± 6,1 (p = 0,03). El tiempo en hipoglucemia (tanto < 70 como < 54 mg/dL) así como el AUC < 70 mg/dL aumentaron con el empleo de faster aspart pero sin alcanzar una diferencia significativa (figs. 1 y 2), tanto al analizar la muestra globalmente como al considerar separadamente los pacientes con y sin suspensión predictiva antes de hipoglucemia. La comparación entre ambos grupos no reveló diferencias significativas al inicio ni al final de estudio en cuanto el porcentaje de tiempo en hipoglucemia. El CV no se modificó significativamente (34,5 vs. 35,1; p > 0,03). Se observó una tendencia descendente en la cifra de HbA1c (6,95 a 6,85%) aunque nuevamente la diferencia no fue significativa. No se registraron hipoglucemias graves ni episodios de cetoacidosis aguda durante el estudio.
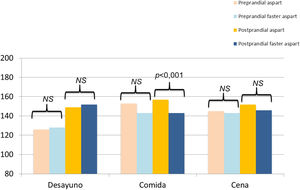
Al comparar la glucosa intersticial media antes y dos horas después de las principales ingestas (desayuno, comida y cena) se observó únicamente un descenso significativo del control postprandial tras la comida (156,9 ± 22,0 vs. 143,0 ± 23,9; p < 0,001). No se hallaron diferencias significativas al comparar las cifras de glucosa preprandial ni los valores postprandiales de desayuno y cena (fig. 3).
Las necesidades de insulina ajustadas por peso y su distribución en forma de basal/bolos no se modificaron de forma significativa tras el cambio de insulina. El IMC tampoco experimentó cambios significativos.
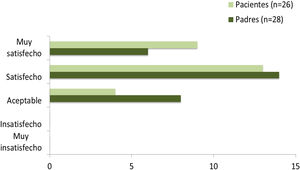
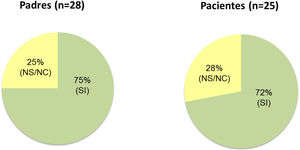
De las 31 familias que finalizaron el estudio, respondieron a la encuesta de satisfacción 28 cuidadores y 26 pacientes (cuatro de los cinco pacientes que no contestaron no contaban con madurez suficiente para responder). De ellos, el 85% de los pacientes y el 71% de los cuidadores se mostraron satisfechos o muy satisfechos con faster aspart (fig. 4). Al ser preguntados acerca de su deseo de continuar utilizando la nueva insulina el 75% de los padres y el 72% de los pacientes que contestaron lo hicieron afirmativamente (fig. 5). Los 31 participantes que concluyeron el estudio continuaron finalmente empleando faster aspart en el equipo de infusión.
El principal inconveniente/efecto adverso referido fue la sensación de dolor leve o prurito coincidiendo con la infusión de los bolos. La lista completa de comentarios referidos al respecto queda recogida en la tabla 2.
Eventos adversos referidos por los participantes
| Eventos adversos |
|---|
| Dolor leve/sensación urente con los bolos (n = 9). |
| Hipoglucemias (n = 8). |
| Burbujas al cargar reservorio (n = 4). |
| Mayor inestabilidad glucémica inicialmente (n = 3). |
| Menor efectividad de los bolos correctores (n = 2). |
| Oclusión del equipo /saturación de la zona de infusión (n = 1). |
Desarrollado con objeto de mimetizar más fielmente la respuesta pancreática ante la ingesta, el perfil farmacológico de faster aspart ha demostrado en diferentes estudios un mejor control de la glucemia postprandial26,27. Debido a que solo en fechas recientes ha sido autorizado su empleo en pacientes mayores de un año, la bibliografía disponible acerca de su uso en niños y adolescentes en general, y tratados con sistemas integrados en particular, es aún muy limitada. Este trabajo supone el primer estudio prospectivo en nuestro país del que tenemos conocimiento evaluando faster aspart en población pediátrica con DM1 tratada con sistema integrado con la metodología descrita, en vida real, fuera de un entorno clínico controlado.
Los resultados del presente estudio sugieren que la cinética de absorción acelerada de faster aspart se asocia, en comparación con aspart, a una mejoría significativa del control glucémico en pacientes con sistema integrado, incrementándose el tiempo en objetivo y disminuyendo el tiempo en hiperglucemia, sin aumentar significativamente el tiempo en hipoglucemia. Dado el perfil farmacológico de faster aspart, sería lógico pensar que el menor tiempo en hiperglucemia se debe a un mejor control de la excursión postprandial. Es sabido que en pacientes con buen control glucémico global, como es el caso de los participantes en este estudio, la mejoría está ligada precisamente a un mayor control de la hiperglucemia postprandial11. Sin embargo, únicamente encontramos una mejoría significativa de la glucosa postprandial en la comida principal. Esto podría deberse a que el análisis postprandial efectuado por el software de descarga de la bomba se ha realizado a las dos horas del bolo. Considerando que la disponibilidad de insulina con faster aspart en ISCI es unas tres veces mayor que con aspart en los 30 primeros minutos28, hubiera sido deseable obtener datos del postprandial temprano (una hora después del bolo) que tal vez hubieran revelado diferencias más notables, explicando mejor el descenso del porcentaje de tiempo en hiperglucemia. Tanto en población pediátrica como en adultos, otros estudios23,27 han demostrado menor elevación de la glucosa intersticial una y dos horas después del bolo al comparar aspart vs. faster aspart a favor de esta última.
La HbA1c disminuyó ligeramente con el uso de faster aspart aunque esta diferencia no fue estadísticamente significativa. De acuerdo con lo observado en otros estudios, un incremento del tiempo en objetivo del 10% (2,4 horas al día) se asocia a un descenso de la HbA1c de aproximadamente 0,6%29,30. En nuestro trabajo, el empleo de faster aspart se asoció a un incremento del tiempo en objetivo modesto aunque significativo, de casi el 3%, lo cual podría explicar la tendencia observada a un descenso de la HbA1c (0,1%).
El estudio ONSET 527 evaluó la eficacia de faster aspart vs. aspart en 472 adultos con DM1 en tratamiento con ISCI durante 16 semanas. Sin embargo, por motivos no del todo claros, la reducción de la HbA1c fue superior en el grupo tratado con aspart pese a que el grupo tratado con faster aspart consiguió un mejor control de la glucemia postprandrial. La necesidad de un ajuste de basales y bolos tras el cambio a faster aspart podría ser la causa de dicha discrepancia31. Aunque el cambio de insulina aspart a faster aspart se realice con una equivalencia 1:132, no se dispone actualmente de recomendaciones bien definidas y consensuadas en lo que al uso de faster aspart en ISCI se refiere. En nuestro estudio, no encontramos diferencias en la dosis total de insulina diaria ajustada por peso ni en la distribución de la misma entre basal y bolos al pasar de aspart a faster aspart. Tampoco se encontraron diferencias en el estudio ONSET 723, llevado a cabo también en población pediátrica, si bien en este caso los pacientes se hallaban en tratamiento con MDI. Aún así, de acuerdo con lo apuntado por otros autores a partir de la experiencia derivada de la práctica clínica31, conviene hacer énfasis en la necesidad de revisar la configuración de la bomba tras cambiar a faster aspart, siendo de gran ayuda para ello la MCG, así como un adecuado conocimiento de la composición de los alimentos y de su índice glucémico. De igual modo, el empleo de diferentes tipos de bolo también debería ser tenido en cuenta dado que podría influir en el tiempo de insulina activa33.
El período postprandial precoz generalmente se caracteriza por una baja incidencia de hipoglucemias, sin embargo, en algunos estudios, faster aspart se ha asociado con un mayor riesgo de hipoglucemia entre las una a dos horas postingesta26,27. Nuestro estudio ha valorado la glucosa postprandial a las dos horas de la administración del bolo, sin distinguir entre período postprandial temprano y tardío. En las apreciaciones de los participantes recogidas al finalizar el estudio, encontramos que ocho pacientes referían hipoglucemias postprandiales o rápido descenso de la glucosa intersticial tras el bolo. Dada la absorción acelerada de faster aspart, parece prudente replantear el tiempo de espera entre bolo e ingesta, así como valorar la necesidad de efectuar ajustes en los bolos para evitar las hipoglucemias en el período postprandial temprano en caso de ingesta retrasada, alto contenido de grasa o en pacientes con gastroparesia32. Por otro lado, el mejor solapamiento entre la acción de faster aspart y la elevación de la glucemia postprandial reduciría el riesgo de hipoglucemias tardías (a las tres a cuatro hortas) observado con los AAR34, aunque esto tampoco ha sido analizado en nuestro trabajo. Es preciso señalar que algunos de los estudios realizados valoraban la glucemia postprandial tras una ingesta líquida estándar26,27. Sin embargo, en estudios que como el presente evalúan experiencias en vida real, elegir el momento óptimo para valorar adecuadamente la glucemia postprandial puede resultar discutible.
Resulta llamativo que el análisis por separado de los pacientes que tenían configurada la parada predictiva y los que no, no revela diferencias significativas entre ambos grupos en cuanto a porcentaje de tiempo en hipoglucemia. Sería de esperar un mayor tiempo en hipoglucemia en los pacientes sin parada predictiva, tanto antes como después del estudio; sin embargo, probablemente debido al pequeño tamaño muestral, no se objetiva dicha diferencia.
Paralelamente, es también muy posible que los distintos algoritmos y guías prácticas de recomendaciones acerca del modo de actuación con base en las tendencias proporcionadas por la MCG35,36 deban ser igualmente revisados y adaptados a las características de faster aspart.
Los eventos adversos referidos al finalizar el estudio corroboran la seguridad y buena tolerancia de faster aspart reportada en otros estudios23,27,34. La sensación dolorosa ó urente con los bolos, inconveniente más frecuentemente señalado en nuestro estudio, ya había sido descrita previamente31. La menor efectividad de los bolos correctores respecto a lo esperado también ha sido referida por algunos usuarios, replanteándose la idoneidad de modificar el tiempo de insulina activa. Otros problemas descritos fueron la aparición de burbujas al cargar el reservorio y la necesidad de realizar cambios del equipo de infusión con mayor frecuencia. Esto último, referido por un solo paciente, ya había sido reportado con anterioridad31, si bien un estudio previo determinó una compatibilidad similar de aspart y faster aspart al ser empleadas en ISCI37.
Salvo una paciente que abandonó el estudio por dolor abdominal (sin coincidencia con los bolos), la totalidad de los participantes continuaron empleando faster aspart finalizados los tres meses de estudio. La posibilidad de acortar los tiempos de espera entre administración de bolos e ingesta (especialmente en caso de hiperglucemia preprandial) se convierte en una gran ventaja, pues en la vida real la experiencia nos muestra que con frecuencia, y en contra de lo recomendado, los pacientes prescinden de dicho intervalo de tiempo o esperan insuficientemente38. Asimismo, se facilita un mejor control en aquellos pacientes con un comportamiento impredecible en relación a la ingesta y que precisan administrar el bolo tras la misma (por ej., lactantes, malos comedores o en enfermedades intercurrentes).
El diseño de nuestro estudio limita la fortaleza de las conclusiones extraídas al no tratarse de un ensayo clínico aleatorizado y doble ciego. A ello se añade el pequeño tamaño muestral y el hecho de que el estudio se haya realizado en pacientes con buen control glucémico. Aunque en pacientes que parten de un peor control resulta más probable encontrar una mejoría significativa tras una intervención39, el presente estudio evidencia que incluso en pacientes motivados con buen control glucémico existe aún margen para seguir mejorando.
En resumen, de forma concordante con publicaciones previas, este estudio apoya el potencial beneficio de faster aspart en la terapia con ISCI. Su empleo en niños y adolescentes con DM1 y sistema integrado se asocia a una reducción de la cifra de glucosa intersticial media, disminución del tiempo e intensidad de las hiperglucemias e incremento del tiempo en objetivo, sin aumento significativo de las hipoglucemias. Se observa una tendencia descendente, aunque no significativa en la cifra de HbA1c. Aunque debe valorarse la necesidad de realizar modificaciones en la configuración de la bomba tras el cambio de insulina, no observamos diferencias significativas en las necesidades de insulina ni en la proporción basal/bolos. Faster aspart es segura y bien valorada. La limitada evidencia en la práctica clínica actualmente disponible suscita la necesidad de realizar nuevos estudios para definir mejor la verdadera utilidad de faster aspart y optimizar su beneficio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.