La glucoquinasa es uno de los principales reguladores de la glucemia plasmática en ayunas. Numerosas mutaciones en el gen de la glucoquinasa (GCK) se han identificado como base molecular de la diabetes monogénica. Recientemente se han descrito polimorfismos en su promotor que se asocian a incrementos en la glucemia plasmática en ayunas. Se presenta a un niño de 7 años y 7 meses con sobrepeso y antecedentes de diabetes en dos generaciones previas. En la sobrecarga oral de glucosa presentó alteración de la glucemia en ayunas y a las 2h, con respuesta de insulina elevada. Las alteraciones analíticas mejoraron tras pérdida ponderal manteniendo una discreta hiperglucemia en ayunas. El estudio de las diabetes monogénicas más frecuentes, MODY subtipos 1, 2 y 3, fue negativo, encontrándose la variante alélica (G/A) en el polimorfismo rs1799884, localizado en el promotor de GCK.
Glucokinase is one of the most important regulators of fasting glucose levels. There are several mutations in the glucokinase gene (GCK) which are linked with monogenic diabetes. Recently, a polymorphism in its promoter has been described, which is associated with impaired fasting glucose levels. We present a 7 years and 7 months old boy with overweight and a familial background of diabetes in two previous generations. In the oral glucose tolerance test, he had impaired fasting glucose levels and after two hours, with a high insulin response. Laboratory abnormalities improved after weight loss, but he maintains a slight fasting hyperglycaemia. The molecular study of the most common monogenic diabetes forms, MODY subtypes 1, 2, and 3, was negative. The allelic variant G/A was however detected at the GCK promoter polymorphism rs1799884.
La glucemia está estrechamente regulada en periodos de ayuno y con cualquier ingesta alimentaria. Uno de los principales reguladores de la homeostasis de la glucosa plasmática en ayunas es la enzima glucoquinasa (GCK), que se expresa predominantemente en el páncreas y el hígado y cataliza la primera reacción limitante de la glucólisis. El polimorfismo del promotor de la GCK GCK-30 G/A (rs1799884) se ha asociado con un incremento de la glucemia plasmática en ayunas y una reducción de la función de la célula beta1. Sin embargo, su contribución a la diabetes tipo 2 es menos conocida.
Observación clínicaPaciente varón de 7 años y 7 meses que refería sensación de mareos e inestabilidad de un año de evolución en relación con la ingesta de cantidades abundantes de hidratos de carbono de absorción rápida, ejercicio intenso y ayunas. Durante los episodios fue valorado en el servicio de urgencias y por su pediatra, realizándose controles de glucemias y presión arterial (PA), que fueron normales. La exploración cardiológica fue normal (incluido electrocardiograma y ecocardiograma). Las analíticas sanguíneas realizadas fueron normales salvo glucemia en ayunas 105mg/dl.
Antecedentes familiares: padres sanos, no consanguíneos. Madre 36 años, IMC 18,98kg/m2, diabetes gestacional en todas sus gestaciones. Padre 37 años, IMC 31,5kg/m2. Abuelo materno diagnosticado de diabetes tipo 2 a los 74 años de edad, en tratamiento con antidiabéticos por vía oral, ausencia de obesidad. Hermana de 3 años sana. Talla diana 177,4cm. Sin otros antecedentes de interés.
Antecedentes personales: embarazo: controlado, diabetes gestacional (tratamiento dietético). Parto, vaginal, eutócico a término. Somatometría al nacimiento: peso 3,100kg (–0,75 DS), no recuerdan longitud. Periodo neonatal normal. Lactancia materna 11 días. Incremento ponderal progresivo desde los 5 años de edad.
Exploración física: peso=40,7kg (+2,45 DS), talla=142,1cm (+2,78 DS), IMC=20,24kg/m2 (+1,44 DS), PA normal. Sobrepeso abdominal, no acantosis nigricans. Tanner I, testes 2cc.
Exploraciones complementarias: edad ósea 8 años 6 meses (TWRUS-II). Glucemia basal 131mg/dl, insulina basal 10,2 uU/ml, péptido C basal 2,13 ng/ml (0,9-4). HbA1c 5,5% (4-6), índice HOMA 3,29. El resto de la bioquímica y el análisis sistemático sanguíneo fueron normales. Sobrecarga oral de glucosa (SOG) con glucemia basal de de 131mg/dl y glucemia a los 120min de 156mg/dl con respuesta aumentada de insulina (tabla 1). Anticuerpos antiislotes pancreáticos, antiinsulina, antitirosinfosfatasa y antiglutámico decarboxilasa negativos. Ante resultados de SOG se realizó nueva analítica con glucemia basal 97mg/dl, insulina basal 11,6 uU/ml, índice HOMA 2,77. Se realizó monitorización continua de glucosa intersticial con sistema CGMS®, objetivándose controles glucémicos normales. Se indicó dieta hipocalórica pobre en hidratos de carbono de absorción rápida y modificación de estilo de vida para corrección de sobrepeso. Se realizó el estudio genético de diabetes MODY, subtipos 1, 2 y 3 (GCK, HNF1A y HNF4A).
Sobrecarga oral de glucosa con glucemia, insulinemia y péptido C concomitante
| Tiempos | Glucemia (mg/dl) | Insulinemia(uU/ml) | Péptido C (ng/ml) |
| Basal (0 min) | 131 | 10,2 | 2,13 |
| 30 min | 189 | 168,5 | 10,9 |
| 60 min | 129 | 40,4 | 7,05 |
| 90 min | 152 | 54,2 | 6,35 |
| 120 min | 156 | 66,9 | 9,24 |
| 150 min | 139 | 32,7 | 5,66 |
| 185 min | 135 | 32,6 | 6,29 |
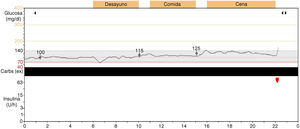
Evolución: el paciente permaneció asintomático, con normalización de IMC (IMC actual 19,34kg/m2 [+0,22 DS]) y controles glucémicos con discreta hiperglucemia en ayunas en algunas de las analíticas realizadas. Presentó talla alta, con maduración ósea acelerada, y ritmo de crecimiento normal (5cm/año), con determinaciones hormonales suprarrenales normales. A los 8 años y 10 meses se repitió la SOG, con glucemia basal 120mg/dl y a los 120min de 113mg/dl con insulinemia basal de 13,9 uU/ml y a los 90min de 43,5 uU/ml (glucemia concomitante 137mg/dl), sin poder aportar más datos de insulinemia por problemas de hemolización de la muestra. Índice HOMA 4,11 y HbA1c normal. El estudio de inmunidad pancreática se repitió y fue negativo. Se realizó una nueva monitorización continua de glucosa (Guardian RealTime®) con glucemias normales (fig. 1). En analíticas realizadas posteriormente se objetivaron glucemias basales entre 89mg/dl y 110mg/dl, con cifras de insulinemia en torno a 10 uU/ml. El estudio genético ha demostrado negatividad para los genes GCK, HNF-1α y HNF4A, hallándose la variante alélica (G/A) del polimorfismo rs1799884 en heterocigosis en el promotor de la GCK.
DiscusiónLa variación de los niveles de glucemia plasmática en ayunas se ha relacionado en pacientes adultos con el riesgo futuro de diabetes tipo 2 y de patología cardiovascular2. Se ha descrito que los efectos genéticos explican el 54,8% de la variabilidad de los niveles de glucosa en la población europea, identificándose varios polimorfismos de un único nucleótido que influyen en los niveles de la glucemia en ayunas: rs1799884 en la GCK; rs780094 y rs1260326 en la proteína reguladora de la GCK (GCKR); rs560887 en la subunidad catalítica 2 de la glucosa 6 fosfatasa (G6PC2-ABCB11), y rs387153 y rs10830963 en el receptor de melatonina 1 B (MTNR1B)2–4. Uno de los principales reguladores de la glucosa plasmática en ayunas es la enzima GCK, que se expresa predominantemente en el páncreas y el hígado, y cataliza la primera reacción limitante de la glucólisis. En las células betapancreáticas, la GCK controla la secreción y biosíntesis de insulina, regulando a nivel hepático la síntesis de glucógeno y la gluconeogénesis1,4,5. Las mutaciones en heterocigosis inactivantes en el gen GCK son las más frecuentemente relacionadas con diabetes monogénicas (MODY 2), mientras que las activantes se asocian con hiperinsulinemia de la infancia. Mutaciones en homocigosis de GCK se han descrito igualmente en un bajo número de casos con diabetes neonatal permanente1,4,5. La variante –30 G/A rs1799884 reside en una región específica del promotor de la GCK y es importante para la regulación de ésta. Dicho polimorfismo se ha asociado en adultos con un incremento de la glucemia plasmática en ayunas y una reducción de la función de la célula beta; sin embargo, su contribución a la diabetes tipo 2 es menos conocida, existiendo resultados dispares1. Algunos metaanálisis sugirieron el efecto modesto pero significante en el riesgo de diabetes tipo 26. No obstante, estudios más recientes muestran que si bien el polimorfismo rs1799884 (–30G/A) se asoció a glucemias plasmáticas en ayunas elevadas, éstas se mantuvieron estables en el tiempo sin incrementar el riesgo de diabetes tipo 2 en los portadores de este alelo1. Nuestro paciente presentó clínica sugestiva de hipoglucemia, sin confirmación bioquímica, con alteración de la glucemia en ayunas y de la glucemia a las 2h constatada en la SOG. Asimismo, presentó respuesta incrementada de la secreción de insulina con pico máximo de 168,5 uU/ml y péptido C elevado. A todos estos datos se suma el sobrepeso, atípico en la diabetes monogénica, y los antecedentes familiares de diabetes en las dos generaciones previas. Existe, por tanto, una patología hidrocarbonada con incremento de la respuesta insulínica, aunque la insulinorresistencia en la infancia no está bien definida. Si utilizamos criterios de adultos, existe insulinorresistencia cuando el pico de insulina durante la SOG es superior a 150 uU/ml o el valor a los 120min es superior a 75 uU/ml7. La sintomatología y las alteraciones analíticas presentaron una mejoría manifiesta tras normalización de peso, persistiendo una leve alteración de la glucemia en ayunas que se manifestó de forma no constante en las analíticas realizadas. En el estudio de diabetes monogénica se descartaron los 3 subtipos más frecuentes (MODY 2, MODY 3 y MODY1). Al estudiar el gen GCK, se halló un polimorfismo en heterocigosis en el promotor de la glucoquinasa rs1799884 (G/A), el cual, como hemos descrito anteriormente, se asocia a una alteración de la glucemia en ayunas que parece no progresiva con la edad y no asociada a un mayor riesgo de diabetes tipo 2 en el futuro1. No obstante, no existen datos en la infancia, pues la mayoría de los estudios del polimorfismo rs1799884 están realizados en adultos en los que no se encuentra evidencia significativa de una interacción entre la edad y las variantes alélicas del polimorfismo en los niveles de glucemia plasmática en ayunas. Es decir, la glucemia plasmática en ayunas no tiende a alterarse con la edad, aunque el estudio está realizado en individuos de ascendencia europea, no pudiendo generalizarse a otros grupos étnicos8. En este paciente no se ha realizado una búsqueda de polimorfismos de un único nucleótido en otras regiones, lo cual pudiera ser clínicamente importante en función de resultados de publicaciones recientes. Reiling et al2 observan un efecto combinado de los alelos de riesgo (rs1799884 GCK; rs780094 y rs1260326 GCKR, rs560887 G6PC2 y rs387153 y rs10830963 MTNR1B) en los niveles de glucemia plasmática en ayunas, con un incremento de 0,05 mmol/l por cada alelo de riesgo adicional. Sus datos muestran que los portadores de menos de tres alelos de riesgo tienen un riesgo bajo de diabetes tipo 2, mientras que aquellos con más de cinco alelos de riesgo tienen un incremento de susceptibilidad de diabetes tipo 2. También describen que el número de alelos de riesgo además influye en la edad a la cual el trastorno llega a ser manifiesto. Por tanto, la combinación de estos polimorfismos influye en el riesgo futuro de diabetes y en la edad al diagnóstico de la misma2.
En nuestro paciente, la valoración a medio y largo plazo nos irá informando de la evolución metabólica de esta alteración genética. El arma terapéutica más importante es el mantenimiento del normopeso instaurado a través de medidas higiénico-dietéticas y cambios en el estilo de vida.
FinanciaciónEste trabajo ha sido en parte financiado por el Fondo de Investigación Sanitaria, proyecto PI06/90459 (IP: Ángel Campos Barros).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.