La lactancia materna es la forma más segura de alimentación para los lactantes: aporta la totalidad de los nutrientes necesarios en la primera etapa de la vida, protege contra las infecciones y tiene múltiples beneficios para la salud y el desarrollo integral de los niños. La Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO) y la Organización Mundial de la Salud (OMS) recomiendan la lactancia materna exclusiva hasta los 6 meses de vida y en combinación con otros alimentos hasta los 2 años. Sin embargo, y a pesar de los esfuerzos en promover esta recomendación, en España en el año 2001, sólo el 23,6% de las madres seguían amamantando a sus hijos a los 6 meses1.
A pesar de haber fórmulas infantiles líquidas, estériles, listas para utilizar, las fórmulas infantiles en polvo (FIP) siguen siendo las más utilizadas como fuente de alimentación para lactantes de forma exclusiva o en combinación con otros alimentos. A diferencia de las primeras, estas fórmulas no son estériles y son, al igual que todos los productos lácteos, un excelente medio para el desarrollo de microorganismos potencialmente patógenos.
Las inadecuadas condiciones de producción, almacenamiento y manipulación de las fórmulas en polvo son un riesgo para la salud de los lactantes. Los microorganismos que pueden estar presentes en las fórmulas se han clasificado según las pruebas científicas acumuladas en relación a la asociación entre la presencia de microorganismos en las FIP y el desarrollo de enfermedad en los niños. En la categoría A de microorganismos con pruebas claras de causalidad se encuentran Enterobacter sakazakii y Salmonella enterica. En la categoría B de causalidad plausible pero no demostrada aún, se encuentran Klebsiella pneumoniae, Enterobacter cloacae, Escherichia coli y Acinetobacter spp., entre otros, y en la categoría C de causalidad menos plausible o no demostrada, se sitúan Basillus cereus, Clostridium difficile y Listeria monocytogenes, entre otros2.
E. sakazakii puede producir una enfermedad invasiva en todos los grupos de edad. Sin embargo, se consideran como de especial riesgo de desarrollar infecciones graves a los neonatos prematuros, los recién nacidos de bajo peso al nacer, los recién nacidos a término menores de 2 meses y los lactantes con algún déficit del sistema inmune2–4. En el medio hospitalario, donde la concentración de niños pertenecientes a estos grupos de riesgo es alta, las condiciones de almacenaje, preparación y manipulación de las FIP deben minimizar el riesgo de desarrollo de una enfermedad asociada a este microorganismo.
La FAO, la OMS, la Comisión Europea (CE) y diversas sociedades científicas han propuesto la aplicación de los principios del sistema de análisis de peligros y puntos de control crítico (APPCC) en la elaboración de guías para el almacenamiento, la preparación, la manipulación y la distribución de fórmulas infantiles, especialmente en el medio hospitalario. El sistema de APPCC permite identificar, evaluar y controlar los peligros significativos para la inocuidad de los alimentos5.
En el Hospital Universitario Vall d’Hebrón de Barcelona se producen mensualmente alrededor de 2.700 l de fórmulas infantiles para la alimentación de lactantes ingresados en los servicios del hospital. Este volumen de producción exige desarrollar un sistema que garantice la calidad microbiológica de las fórmulas y la trazabilidad del proceso. Esta guía para la preparación de fórmulas infantiles en el medio hospitalario, que sigue el sistema APPCC, es el resultado del trabajo colaborativo de los Servicios de Nutrición y Dietética, de Microbiología y de Medicina Preventiva y Epidemiología del Hospital Universitario Vall d’Hebron de Barcelona.
Bases científicas y organizativasUna vez determinada la necesidad de disponer de una guía de trabajo, se creó un equipo integrado por representantes de los 3 servicios involucrados. Se realizó una revisión exhaustiva de toda la información bibliográfica publicada, tanto nacional como internacional. Se han utilizado las guías propuestas por el Codex Alimentarius, las reuniones de expertos convocadas por la FAO en 2004 y 20062,6–8, las recomendaciones de la CE9 y la European Food Safety Authority (EFSA)10, así como la opinión del Comité de Nutrición de la Sociedad Europea de Gastroenterología, Hepatología y Nutrición (ESPGHAN)3. Se consideraron el Reglamento n.o 2073/2005 de la CE del 15 de noviembre de 2005, relativo a los criterios microbiológicos aplicables a los productos alimenticios11 y las directrices de la OMS para la preparación, almacenamiento y manipulación de preparaciones en polvo para lactantes12. También se utilizó la Guía para la aplicación del autocontrol basado en el sistema de APPCC, que publicó la Generalitat de Cataluña5.
El primer paso fue describir de forma detallada e individualizada las funciones del servicio y del personal que se encarga del almacenamiento, la reconstitución y la distribución de las FIP en el hospital. A continuación, se hizo una estimación de la producción total de las diversas fórmulas y se describió cada una, para esto se tuvieron en cuenta los ingredientes, las características fisicoquímicas y microbiológicas, la presentación del producto, las condiciones de conservación y cuáles eran las indicaciones principales de cada fórmula.
El equipo de trabajo realizó una visita a los lugares donde se almacenan y reconstituyen las fórmulas infantiles. En esta reunión se elaboró el diagrama de flujo de todas las actividades involucradas en la producción de las fórmulas, desde el momento en que se reciben los envases de leche en polvo hasta que se obtiene un biberón con la fórmula lista para utilizarse.
Sistema de análisis de peligros y puntos de control críticoEl Codex Alimentarius estructura el sistema de APPCC en 7 principios básicos que se deben cumplir obligatoriamente para la correcta aplicación del sistema. Estos principios se desarrollan en forma secuencial, tal como se describe a continuación.
Principio 1. Realizar un análisis de los peligros y la determinación de sus causas, así como las medidas preventivas específicas para cada uno de éstos. En este contexto, se entiende por peligro todo agente biológico, químico o físico presente en la fórmula infantil o las condiciones en las que ésta se encuentra, que puedan causar un efecto adverso para la salud.
Principio 2. Determinar los puntos de control crítico (PCC). Un PCC es la fase del proceso en la que se puede aplicar un control y que es esencial para prevenir o eliminar un peligro relacionado con la inocuidad de los alimentos o para reducirlo hasta un grado aceptable. Esta determinación se realiza sobre la base de un árbol de decisiones estructurado en 4 preguntas, que se repite para cada una de las etapas del proceso:
- ¿hay medidas preventivas para este peligro?
- ¿esta etapa está específicamente diseñada para eliminar o reducir el peligro a un grado aceptable?
- ¿puede haber una contaminación o aumentar el peligro hasta un grado inaceptable?
- ¿una etapa posterior puede eliminar o reducir el peligro hasta un grado aceptable?
Principio 3. Establecer los límites críticos para cada PCC detectado. El límite crítico es el criterio que marcará la diferencia entre la aceptabilidad y la inaceptabilidad del proceso en una fase determinada. Es importante que los límites críticos estén asociados a parámetros que sean fáciles y rápidos de medir u observar.
Principio 4. Una vez analizados los peligros y establecidos los PCC y sus límites, el cuarto principio es el establecimiento de un sistema de vigilancia para cada PCC. Este sistema de vigilancia debe incluir qué se vigila, cómo se vigila y dónde se vigila, la frecuencia y la persona responsable de la vigilancia del PCC, además de la creación de un sistema de registro de los resultados de la vigilancia.
Principio 5. Desarrollar por escrito las medidas correctoras, es decir, las acciones que se deben tomar cuando el sistema de vigilancia detecta una desviación respecto de los límites críticos establecidos que indican la pérdida del control del proceso en alguno de los PCC.
Principio 6. Comprobar el sistema, es decir, establecer los medios (métodos, procedimientos o ensayos) para verificar que toda la guía se aplica correctamente y constatar que se eliminan o se reducen efectivamente los peligros.
Principio 7. Establecer un sistema de documentación y registro de todo el proceso.
Los límites críticos establecidos en esta guía que hacen referencia a tiempos y temperaturas máximas se basan en los escenarios propuestos por la reunión de expertos de la FAO de 2006.
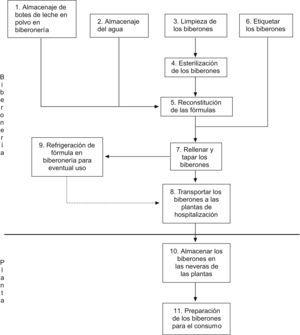
Etapas para la preparación de fórmulas infantilesSe identificaron 12 etapas en el proceso de elaboración de biberones con FIP. Las etapas y el diagrama de flujo se presentan en la figura 1. Todas las personas que participan en el proceso de elaboración de las fórmulas infantiles deben estar informadas de los riesgos asociados a la contaminación de las fórmulas infantiles y haber recibido capacitación en la manipulación de alimentos y específicamente en la implementación de esta guía para la preparación higiénica de las FIP.
Figura 1. Diagrama de flujo de las etapas para la elaboración de biberones con fórmulas infantiles en polvo.
Etapas 1 y 2. Almacenaje de botes de leche en polvo y agua para la elaboración de biberonesLos peligros biológicos detectados para estas etapas fueron la proliferación de microorganismos patógenos, como E. sakazakii y otras enterobacterias, en la leche almacenada y la contaminación con microorganismos potencialmente patógenos del agua que se utiliza para la reconstitución.
Las medidas preventivas adoptadas son la utilización de agua estéril embotellada y el almacenaje, tanto de los envases de leche como de los envases de agua, en un ambiente limpio, seco y a una temperatura menor de 20 °C. Además, se deben registrar los números de los lotes que se utilizan de todos los productos para la elaboración de las fórmulas. Tanto las condiciones de almacenaje como la elaboración de los registros se consideraron PCC y sus límites críticos se establecieron en la temperatura máxima de la sala de almacenaje a 22 °C (tolerancia de +2 °C respecto al objetivo), en la humedad relativa del aire en un máximo de 70% y en un registro de todos los lotes, sin excepción. El sistema de vigilancia para estas etapas se estableció mediante el control continuo y el registro diario de la temperatura y la humedad ambiental por termómetros de pared. El registro de los botes de leche utilizada debe contener el nombre del producto, el número de lote, la fecha de caducidad, el día de inicio de la utilización y el día en que se terminó de utilizar.
El tiempo máximo que los envases de leche en polvo pueden permanecer abiertos será de un mes. Pasado este tiempo se desecharán.
Las medidas correctoras en caso de que no se mantengan los límites críticos son los siguientes: no utilizar los botes de leche que se hayan almacenado en condiciones diferentes a las permitidas según los límites críticos, no utilizar aquellos envases de leche que presenten alteraciones visibles en el envase, no utilizar ningún bote de leche en polvo para la reconstitución de las fórmulas infantiles que no se haya registrado previamente, así como no utilizar el agua que se haya almacenado a mayor temperatura de la recomendada y que presente alteraciones visibles del envase.
Etapas 3 y 4. Limpieza y esterilización de los biberonesLos peligros detectados en estas etapas son la persistencia de restos de fórmula o contaminantes químicos procedentes del detergente que se utiliza para la limpieza previa y la persistencia de esporas potencialmente patógenas por fallo en el proceso de esterilización.
Esta etapa se considera un PCC y las medidas preventivas adoptadas son las siguientes: desarrollar un protocolo específico de limpieza y esterilización del material empleado para la preparación de las fórmulas infantiles, cuyo cumplimiento se vigilará continuamente; control químico en cada ciclo de esterilización mediante tira reactiva y control microbiológico rápido de la esterilización que se aplicará en el primer ciclo de esterilización de cada día y donde se vigilará la falta de detección de esporas viables. Además, una vez a la semana se realizará un control biológico del proceso de esterilización que será supervisado por personal ajeno a la unidad de biberonería. El límite crítico establecido es la falta de detección de esporas viables y el cumplimiento estricto de los protocolos de limpieza y esterilización, así como el viraje de la tira reactiva en todos los ciclos.
El material empleado para la preparación de las FIP debe lavarse rigurosamente con agua jabonosa caliente antes del proceso de esterilización. Se utilizará un cepillo especial para retirar los restos de fórmula de los biberones y tetinas.
En caso de falta de viraje de la tira reactiva en el control químico, las medidas correctoras propuestas son las siguientes: revisar el protocolo de esterilización, esterilizar los biberones en otro autoclave y no utilizar la autoclave hasta tener el resultado del control microbiológico rápido. En caso de resultado positivo en el control microbiológico rápido de la esterilización, no debe volver a utilizarse la autoclave, debe notificarse al Servicio de Medicina Preventiva, no deben utilizarse los biberones ni el material esterilizados en esta autoclave hasta reesterilizarlos, y deben recuperarse los biberones utilizados, registrar a los pacientes que los consumieron y notificarlo al servicio de mantenimiento correspondiente para que revise el esterilizador. Sólo puede volver a utilizarse después de 3 controles microbiológicos consecutivos negativos. En caso de resultado positivo en el control biológico semanal, además de las medidas anteriores, se debe poner especial atención en identificar a los pacientes que utilizaron los biberones insuficientemente esterilizados.
Etapa 5. Reconstitución de las fórmulasLos peligros biológicos detectados en esta etapa son la proliferación de microorganismos patógenos, como E. sakazakii y otras enterobacterias, y la contaminación externa con otros microorganismos potencialmente patógenos. Las medidas preventivas de esta etapa, que es un PCC, son las siguientes: aplicación de un protocolo de lavado de manos, limpieza y desinfección de superficies; temperatura de la sala de preparación de 20 °C o menor y utilizar agua estéril. La temperatura del agua al momento de la reconstitución no debe ser inferior a los 70 °C. Para la temperatura ambiental el límite es de 22 °C (tolerancia de +2 °C respecto al objetivo). El sistema de vigilancia se desarrollará en base al control continuo de la temperatura del agua previo a la reconstitución de las fórmulas y al control de la temperatura ambiental de la sala mediante termómetros de pared de registro continuo.
Las medidas correctoras en caso de que no se mantengan estos límites críticos son las siguientes: revisar el cumplimiento de los protocolos de lavado de manos, limpieza y desinfección de superficies; en caso de que la temperatura del agua esté por debajo del límite crítico, ésta no se debe utilizar para reconstituir la leche. En caso de que la temperatura ambiental sea mayor al límite crítico se debe utilizar el aire acondicionado para disminuir la temperatura hasta el máximo permitido. Por último, desechar los envases de agua en mal estado o que no garanticen la esterilidad del contenido.
Lavado de manos: las etapas que se seguirán para un correcto lavado de manos son: mojarse las manos, aplicar el jabón en envase de un solo uso con válvula dispensadora para evitar contaminaciones, friccionar todas las superficies de las manos, enjuagar las manos con abundante agua, no usar agua caliente ya que aumenta el riesgo de dermatitis, usar toallas de papel para secar las manos y para cerrar el grifo. No llevar joyas, uñas artificiales ni esmaltes. Las uñas deben estar lo suficientemente cortas para permitir una correcta limpieza. Deben lavarse las manos antes de iniciar el trabajo, antes y después de la preparación de las fórmulas, antes y después de usar guantes, antes de tocar material estéril o de sacar los materiales del esterilizador, después de tocar material contaminado, después de ir al lavabo, estornudar o limpiarse la nariz. Además, el uso de mascarilla durante la reconstitución y manipulación de las fórmulas infantiles debe ser obligatorio.
Etapas 6, 7 y 8. Etiquetaje, rellenado y transporte de los biberones a las plantas de hospitalizaciónLos peligros identificados para estas etapas son 2: por una parte, la mala identificación de los pacientes destinatarios de las fórmulas y, por otro, la proliferación de los microorganismos patógenos, como E. sakazakii y otras enterobacterias.
Las medidas preventivas propuestas son utilizar una etiqueta para cada biberón que contenga el nombre del paciente y su número de historia clínica, la planta de hospitalización, la fórmula preparada, la fecha y la hora de la reconstitución. Éste es un PCC y su límite se establece en que todos los biberones, sin excepción, deben estar etiquetados en el momento de salir de la sala de preparación. Todos los biberones que no estén correctamente etiquetados deben desecharse. Para evitar la proliferación de microorganismos, la preparación, el llenado y la refrigeración de los biberones se debe realizar inmediatamente después de la reconstitución. El límite de tiempo crítico para realizar este proceso se ha establecido en 2 h. El transporte de los biberones desde la sala de preparación hasta las neveras de las plantas de hospitalización infantil debe realizarse siguiendo un circuito que minimice los tiempos de transporte y no debe exceder las 2 h como límite crítico. Si se excede el tiempo de preparación y rellenado o si el tiempo de transporte es mayor del permitido, los biberones deben desecharse y hacer una revisión del procedimiento y los circuitos para disminuir los tiempos hasta el máximo aceptable.
Etapas 9 y 10. Refrigeración de los biberones en la sala de preparación y en las plantas de hospitalizaciónEl peligro identificado en estas etapas es la proliferación de microorganismos, como E. sakazakii y otras enterobacterias, que son potencialmente patógenas. El PCC es mantener la temperatura de refrigeración a 4 °C. A esta temperatura, tanto E. sakazakii como otras enterobacterias permanecen inactivos. El límite crítico se ha establecido en 8 °C (tolerancia de 4 °C sobre el objetivo). El tiempo de refrigeración no puede ser mayor de 24 h a la temperatura óptima. La vigilancia se establece por el control continuo de las temperaturas de las neveras a través de termómetros externos y del registro diario de máximos y mínimos.
Las medidas correctoras en caso de que la temperatura de refrigeración sea mayor a la permitida son la revisión del sistema de refrigeración y la identificación de las posibles causas que aumentan la temperatura de refrigeración. Si se sobrepasa la temperatura máxima durante más de una hora o el tiempo de refrigeración es mayor de 24 h, los biberones almacenados deben desecharse.
Etapa 11. Preparación de los biberones para el consumoEn esta etapa también está el peligro de proliferación de microorganismos patógenos. Las medidas preventivas son las siguientes: los biberones se deben retirar de las neveras sólo en el momento en que se van a calentar para el consumo; una vez calentados a una temperatura adecuada se deben consumir inmediatamente. Éste es un PCC y su límite se ha establecido en que el tiempo total desde que el biberón se saca de la nevera hasta acabar el consumo no debe ser mayor de 2 h. La vigilancia de este PCC debe ser continua en las plantas de hospitalización infantil por parte de las enfermeras supervisoras de planta. Según las recomendaciones de la OMS respecto a la preparación, el almacenamiento y la manipulación de las preparaciones en polvo para lactantes, el calentamiento de los biberones no debe realizarse en un horno de microondas por el peligro de quemaduras al no garantizar un calentamiento uniforme de la leche del biberón. El método de calentamiento que mejor preserva las características nutricionales y de seguridad de los biberones es sumergirlo en agua caliente hasta que alcance la temperatura de consumo alrededor de los 35 °C (baño María).
Los biberones que hayan permanecido a temperatura ambiente más de una hora antes del consumo deben ser desechados.
Actividades de comprobación de las etapas de preparación de fórmulas infantilesLas actividades de comprobación del sistema se han dividido en 2 partes, según el lugar físico donde se realizan:
1. En el Servicio de Biberonería. La enfermera supervisora comprobará de forma semanal que los registros creados para la vigilancia de las etapas que se desarrollan en la biberonería estén actualizados y contengan todas las medidas correctoras en caso de una incidencia. La comprobación se realizará específicamente de los registros de los lotes utilizados, los registros de control de temperatura ambiental, los registros de la hoja de carga y control químico de la esterilización, los registros de temperatura del agua y de las neveras de la biberonería.
El Servicio de Medicina Preventiva del hospital comprobará los resultados del control biológico que semanalmente se le realizará al proceso de esterilización.
De cada nuevo lote de fórmula que se utiliza se almacenará una muestra de la leche en polvo para analizarla con posterioridad, en caso de una incidencia, como puede ser la detección de E. sakazakii en alguno de los controles microbiológicos del proceso.
La enfermera supervisora de la biberonería realizará mensualmente la comprobación del estado de mantenimiento de las instalaciones, registrará las incidencias y solicitará su corrección.
2. En las plantas de hospitalización. Las enfermeras supervisoras de las plantas comprobarán semanalmente los registros de temperatura de las neveras que, en lo posible, deben ser exclusivas para el almacenamiento de los biberones preparados.
3. Análisis microbiológico de los biberones. Los controles microbiológicos del proceso de preparación de los biberones se realizarán cada vez que se inicie la utilización de un nuevo lote de fórmula en polvo. Se analizarán, en la biberonería, los biberones recién preparados y a las 24 h de refrigeración. Asimismo, se realizará un control microbiológico mensual en cada planta de hospitalización infantil de un biberón recién preparado y de otro biberón que lleve 24 h de refrigeración y de cada tipo de fórmula que esté disponible en ese momento. Los biberones se analizarán para la detección de E. sakazakii, Salmonella y enterobacterias, teniendo en cuenta para esto lo indicado en el reglamento 2073/2005 de la CE relativo a los criterios microbiológicos aplicables a los productos alimenticios. En este reglamento, vigente desde el 1 de enero de 2006, se especifican los criterios microbiológicos de seguridad alimentaria para E. sakazakii y Salmonella y como criterio de higiene del proceso el análisis de enterobacterias. Los límites propuestos en este reglamento son aplicables a las FIP o a las fórmulas líquidas fabricadas, listas para el consumo. Sin embargo, en el servicio de biberonería, los biberones se preparan de acuerdo con las necesidades nutricionales de cada paciente, por lo que la cantidad de polvo en la fórmula reconstituida puede variar de uno a otro. Dado que la legislación vigente no define límites precisos para este producto final (biberón listo para el consumo) se han elaborado los límites críticos de esta guía según el reglamento de la Unión Europea y el análisis de los resultados de las muestras analizadas los últimos 2 años por el Servicio de Microbiología. De esta forma, se ha establecido como criterio de seguridad alimentaria la ausencia de E. sakazakii y Salmonella, tal como lo indica el Reglamento de la Unión Europea, y como criterio de higiene del proceso se ha establecido menos de 3 unidades formadoras de colonias cada 100 ml en los biberones listos para el consumo. Asimismo, por criterios internos del Servicio de Microbiología se realizan controles de L. monocytogenes y Staphylococcus aureus. En la tabla 1 se resumen las condiciones de recogida, el método de detección, la frecuencia y el límite crítico establecido.
Tabla 1. Análisis microbiol ó gico de los biberones
| Procedimiento de recogida de muestra | Procedimiento de análisis | |||||||
| Descripción de la muestra | Condiciones de recogida | Quién recoge la muestra | Prueba | Método | Servicio que realiza el análisis | Límite Crítico | Frecuencia | Responsable |
| MUESTRAS BIBERONERÍA: Biberón con fórmula reconstituida de cada nuevo lote de leche en polvo utilizado | Se recogerá un biberón recién preparado y otro a las 24 horas de refrigeración en la biberonería. | |||||||
| Los biberones deben estar etiquetados especificando el lote, la concentración de polvo utilizada, la fecha y la hora de preparación | Biberonería | Análisis de enterobacterias, E. sakazakii y Salmonella | ISO 21528-1 EN/ISO 6579 ISO/DTS 22964 | Servicio de Microbiología | Salmonella y E. sakazakii: ausencia Enterobacteriaceae:<3UFC/100 ml | Cada vez que se inicie un lote nuevo de leche en polvo | Supervisora de biberonería | |
| Deben ser enviados inmediatamente al Servicio de Microbiología | ||||||||
| MUESTRAS DE PLANTA: Biberones con fórmula reconstituida refrigerados en plantas de hospitalización | Se recogerá un biberón recién preparado y otro a las 24 horas de refrigeración, de cada tipo de fórmula que esté disponible en las neveras de las plantas | Servicio de Medicina Preventiva | Análisis de enterobacterias, E. sakazakii y Salmonella | ISO 21528-1 EN/ISO 6579 ISO/DTS 22964 | Servicio de Microbiología | Salmonella y E. sakazakii: ausencia Enterobacteriaceae:<3UFC/100 ml | Mensual en cada planta de hospitalización según calendario anexo. | Servicio de Medicina Preventiva |
| Los biberones deben estar etiquetados especificando el lote, la concentración de polvo utilizada, la fecha y la hora de preparación y la planta de procedencia | ||||||||
| Deben ser enviados inmediatamente al servicio de Microbiología |
En caso de que el análisis microbiológico resulte positivo para E. sakazakii o Salmonella en las muestras recogidas en la biberonería, se tomarán las siguientes medidas:
- a) notificar al Servicio de Medicina Preventiva;
- b) inmovilizar los botes de leche en polvo correspondientes al número de lote afectado;
- c) no utilizar los biberones en la biberonería y en las plantas de hospitalización que se hayan preparado con leche en polvo procedente del lote afectado;
- d) enviar al Servicio de Microbiología nuevas muestras de leche en polvo, tanto del lote afectado como de los otros lotes de la misma marca comercial que se encuentren almacenados;
- e) identificar a los pacientes que puedan haber consumido leche del lote afectado y registrar si presentan alguna sintomatología relacionada;
- f) revisar el cumplimiento de los protocolos de lavado de manos, limpieza y desinfección de superficies y de esterilización,
- g) y revisar el cumplimiento de las medidas preventivas de cada uno de los puntos de control crítico del proceso.
En caso de resultado positivo en las muestras recogidas de las plantas, se tomarán las mismas medidas anteriormente descritas, con especial atención en identificar la planta de donde procede el biberón contaminado y a los pacientes que puedan presentar sintomatología relacionada, aunque hayan consumido biberones preparados con otros lotes de leche en polvo.
Consideraciones finalesEsta guía permite garantizar, hasta donde es posible, que las fórmulas infantiles que se preparan y consumen en un hospital, sean seguras para la alimentación de los lactantes ingresados en los servicios de pediatría. Entre sus fortalezas destaca que es un trabajo colaborativo entre diferentes servicios hospitalarios. Cada uno de éstos ha aportado su experiencia y conocimientos para adaptar a un ámbito particular la normativa existente y las diversas recomendaciones de organismos internacionales que llevaron al desarrollo de esta guía y los compromete en su cumplimiento. Además, establece claramente los criterios para otorgar un servicio de calidad, basado en la reglamentación vigente y en las recomendaciones de diversas organizaciones. Es un documento dinámico que favorece su actualización constante. Tanto los medios de vigilancia como los medios de comprobación del sistema permiten la adaptación a nuevos estándares o necesidades que aparezcan como resultado de la aplicación de esta guía.
Autor para correspondencia.
M. Campins Martí
Dirección: mcampins@vhebron.net