La oxigenoterapia es una herramienta fundamental para el tratamiento de la insuficiencia respiratoria, tanto aguda como crónica. Los objetivos principales que llevan a su empleo son tratar o prevenir la hipoxemia, tratar la hipertensión pulmonar y reducir el trabajo respiratorio y miocárdico. En situaciones agudas, su utilidad está ampliamente aceptada y en situaciones crónicas se ha extendido de forma importante. Sin embargo, sigue sin haber consenso en puntos fundamentales y son pocos los aspectos en los que la actuación entre los diferentes centros esté estandarizada.
El Grupo de Trabajo de Técnicas de la Sociedad Española de Neumología Pediátrica acordó elaborar unas recomendaciones avaladas por esta Sociedad sobre el empleo de este tratamiento, e incorporó las diferentes formas de actuación recogidas en revisiones recientes para intentar establecer sus indicaciones, disminuir los efectos colaterales y procurar una correcta adecuación del gasto económico. Se han incluido aspectos generales del tratamiento con oxígeno, como los mecanismos fisiológicos, las indicaciones para su empleo, tanto en situaciones agudas como crónicas, y los medios disponibles para su correcta administración. Se aborda asimismo el tratamiento del paciente con oxigenoterapia en domicilio y las situaciones especiales que pueden producirse.
Oxygen therapy has become a major tool for infants with acute and chronic respiratory failure. Appropriate goals when prescribing supplemental oxygen are reduction and prevention of hypoxemia, prevention and treatment of pulmonary hypertension and decrease in respiratory and cardiac overload. This is commonplace in the acute setting and is also becoming widespread in chronic pathologies. However, there is a lack of consensus on many fundamental issues, such as appropriate indications, desirable targets and outcome measures amongst centres, reflecting a variety of clinical practices.
The Techniques Group of the Spanish Society of Pediatric Pneumology undertook to design recommendations for a rational approach to oxygen therapy, reviewing the existing literature in order to establish its indications, benefits and potential risks as well as its cost-effectivenes. General aspects of oxygen treatment are reviewed including physiological mechanisms, indications, delivery systems and assessment methods. Management of patients on home oxygen therapy is also addressed with discussion of benefits and potential risks of supplemental oxygen use.
La oxigenoterapia se define como el aporte artificial de oxígeno (O2) en el aire inspirado; su objetivo principal es la oxigenación tisular, que se consigue cuando la presión parcial de O2 (pO2) en la sangre arterial supera los 60mmHg, lo que se corresponde, aproximadamente, con una saturación de hemoglobina del 90%. Hoy por hoy, la oxigenoterapia es la herramienta terapéutica fundamental en el tratamiento de los pacientes con insuficiencia respiratoria, tanto aguda como crónica.
El empleo de la administración de O2 en el fallo respiratorio agudo se inició ya en las primeras décadas del siglo xx . En cuanto a su empleo en situaciones de insuficiencia respiratoria crónica, se ha puesto de manifiesto una reducción significativa en la mortalidad secundaria a algunos procesos, como la enfermedad pulmonar obstructiva crónica del adulto. En el paciente pediátrico el empleo de la oxigenoterapia domiciliaria en situaciones crónicas, fundamentalmente la enfermedad pulmonar crónica de la prematuridad (EPCP), antes denominada displasia broncopulmonar (DBP), se ha extendido de forma importante. Sin embargo, sigue sin haber consenso en puntos fundamentales, y son pocos los aspectos en los que la actuación entre los diferentes centros, incluso en un mismo país, están estandarizados.
El Grupo de Trabajo de Técnicas de la Sociedad Española de Neumología Pediátrica acordó elaborar unas recomendaciones avaladas por esta Sociedad sobre el empleo de la oxigenoterapia. Como consecuencia, ha surgido este documento, en el que se han revisado las diferentes formas de actuación recogidas en revisiones recientes sobre el empleo de oxigenoterapia en el paciente pediátrico para intentar establecer sus indicaciones al mismo tiempo que disminuir los efectos colaterales y procurar una correcta adecuación del gasto económico. Se han incluido aspectos generales del tratamiento con O2, como los mecanismos fisiológicos, las indicaciones para su empleo, tanto en situaciones agudas como crónicas, y los medios disponibles para su correcta administración. Asimismo, se aborda el tratamiento del paciente subsidiario de recibir oxigenoterapia en el domicilio y se describen los posibles efectos secundarios que pueden derivar de este tratamiento y las situaciones especiales que pueden producirse.
Fundamentos fisiológicos de la oxigenoterapiaLos objetivos de la oxigenoterapia son tratar o prevenir la hipoxemia, tratar la hipertensión pulmonar (HTP) y reducir el trabajo respiratorio y miocárdico1. La oxigenoterapia está indicada cuando hay una situación de hipoxemia aguda o crónica con pO2 inferior a 55–60mmHg, cifra que se corresponde con una saturación de hemoglobina del 90%. Por debajo de estas cifras, la afinidad de la hemoglobina por el O2 disminuye rápidamente y el contenido total de O2 y el aporte de éste a los tejidos se ve afectado.
El empleo adecuado de la administración terapéutica de O2 se basa en el conocimiento de 2 aspectos fundamentales: los mecanismos fisiopatológicos de la hipoxemia y el impacto de la administración de O2 con sus efectos clínicos beneficiosos.
Fisiopatología de la hipoxemiaLa hipoxemia consiste en la disminución de la pO2 por debajo de 60mmHg, lo que se corresponde con saturaciones de O2 (SatO2) del 90%. La detección de hipoxemia se consigue con la medición de la pO2 y de la SatO2 de la hemoglobina mediante el pulsioxímetro. La hipoxia consiste en el déficit de O2 en los tejidos.
Se puede producir hipoxemia por 4 mecanismos distintos. En primer lugar, cuando hay una disminución en la presión de O2 del aire inspirado por una caída en la presión atmosférica (grandes alturas) o por una disminución de la concentración de O2 del aire, situación que se da por envenenamiento por gases tóxicos, por ejemplo. En segundo lugar, se puede producir hipoxemia por hipoventilación alveolar, que puede ser secundaria a un defecto o a una malfunción de los centros respiratorios (intoxicaciones, hipoventilación primaria, traumatismos craneales o accidentes cerebrovasculares) o en las enfermedades que alteran la mecánica ventilatoria. En tercer lugar, otra causa de hipoxemia son los procesos en los que se produce un defecto de difusión en la membrana alveolocapilar. En estos casos la hipoxemia ocurre por engrosamiento de la membrana alveolocapilar (enfermedades intersticiales), pérdida de superficie (enfisema) o llenado alveolar (neumonía)1. Por último, la causa más habitual de hipoxemia serían las situaciones en las que se altera la integración entre el espacio alveolar y el lecho vascular, es decir, las alteraciones de la ventilación/perfusión (V/Q). Cuando hay ocupación del espacio alveolar u obstrucción de la vía aérea, se tiene una disminución de la ventilación con un índice V/Q bajo, mientras que cuando hay descenso de la perfusión en áreas bien ventiladas, el índice V/Q será elevado.
Cuando se produce una situación de hipoxemia, se desarrolla una serie de mecanismos de compensación dirigidos a preservar el aporte de O2 a los tejidos. Algunos de estos mecanismos serán beneficiosos en cuanto a que mejorarán los aportes de O2, pero otros serán contraproducentes (figura 1). Desde el punto de vista ventilatorio, la hipoxemia se acompaña de un incremento de la ventilación alveolar que consigue elevar la pO2, pero al mismo tiempo aumenta el trabajo respiratorio, lo que puede conducir al agotamiento de la musculatura respiratoria y al fracaso respiratorio secundario. Desde el punto de vista cardiovascular, la hipoxemia lleva a un incremento de la frecuencia cardíaca y del gasto cardíaco, lo que favorecerá el transporte de O2, pero a su vez aumentará el esfuerzo del miocardio y las necesidades de aporte de O2. Desde el punto de vista sistémico, la hipoxemia crónica determina vasodilatación e hipotensión. En cuanto a los cambios hematológicos, la hipoxemia a largo plazo producirá un aumento en la síntesis de eritropoyetina y, secundariamente, poliglobulia, un fenómeno que va a potenciar el desarrollo de HTP. Estos fenómenos se deben a la disminución de la afinidad del O2 por la hemoglobina cuando la pO2 disuelta cae por debajo de 55mmHg. Este comportamiento tiene como finalidad facilitar la difusión del O2 desde la sangre hasta los tejidos, pero al mismo tiempo determina una pérdida en el contenido total de O2.
Figura 1. Mecanismos de compensación de la hipoxemia. Consecuencias beneficiosas y adversas 3 . Hgb: hemoglobina; Hto: hematocrito; HTP: hipertensión pulmonar; PAP: presión arterial pulmonar; V/Q: ventilación/perfusión.
Efectos de la oxigenoterapiaCuando aumenta la pO2 al incrementar la concentración de O2 del aire ambiente, los mecanismos de compensación natural dejan de ser necesarios. Cuando se incrementa la pO2, revierten la hiperventilación, la taquicardia y la vasodilatación hipóxica2. Además, al normalizarse el aporte tisular de O2, se corrigen las alteraciones neurológicas, miocárdicas y renales3.
Sin embargo, la administración de O2 puede tener un impacto en los determinantes fisiológicos de la presión arterial de O2. Así, para un determinado flujo de O2 adicional suministrado, la FiO2 (fractional inspired oxygen ‘fracción inspiratoria de O2’) real que se consigue depende del grado de ventilación alveolar. Además, el incremento de la presión de O2 en el alvéolo favorece la difusión de éste hacia el capilar. Por otra parte, cuando desaparece la vasoconstricción hipóxica, pueden empeorar las alteraciones de la relación V/Q. También un aumento excesivo de la pO2 tendrá un efecto perjudicial sobre la ventilación alveolar por depresión de los centros que la controlan.
IndicacionesSituaciones de hipoxia agudaLa oxigenoterapia en situaciones agudas merece algunos comentarios por sus características especiales. En primer lugar, puede estar indicada en situaciones en las que, a pesar de que la pO2 sea superior a 60mmHg, ocurra un deterioro del aporte tisular, como cuando se produce un bajo gasto secundario a shock cardiogénico o en la anemia aguda. Otro aspecto diferencial hace referencia a las FiO2 necesarias y a los sistemas de dispensación. Los sujetos con insuficiencia respiratoria aguda suelen presentar taquipnea intensa con elevados grados de ventilación, lo que hace que requieran concentraciones de O2 muy elevadas con dispositivos de alto flujo o mascarillas de rebreathing parcial, que incorporan bolsas reservorios que permiten suministrar concentraciones de O2 de hasta el 70%3.
Se pueden distinguir 2 grupos de indicaciones agudas, según haya o no hipoxemia1,2:
Desequilibrio V/Q: la respuesta a la oxigenoterapia depende de la relación V/Q en las diferentes áreas del pulmón y, por tanto, es impredecible. Las neumonías, las bronquiolitis, el asma o las atelectasias son algunos ejemplos.
Hipoventilación alveolar (central o periférica): la oxigenoterapia corrige rápidamente la hipoxemia, si bien el objetivo fundamental en estas enfermedades ha de ser la restauración de la ventilación. En este grupo se incluyen las enfermedades neuromusculares o las depresiones respiratorias por fármacos.
Shunt derecha-izquierda (intrapulmonar o extrapulmonar): es el caso de las cardiopatías congénitas cianosantes, fístulas arteriovenosas, tromboembolias, etc. Cuando el shunt supera el 20%, la hipoxemia persiste pese a la oxigenoterapia.
Disminución de la FiO2 en el aire ambiente: grandes alturas.
Situaciones de bajo gasto cardíaco: anemia, insuficiencia cardíaca y shock hipovolémico.
Intoxicación por CO (carbone monoxide ‘monóxido de carbono’): a pesar de una pO2 normal, la administración de O2 es beneficiosa debido a su competencia con el CO en su unión a la hemoglobina, que logra reducir la vida media de la carboxihemoglobina (de 320 a 80min).
Hipoxemia arterial. Es la indicación más frecuente. Responde a varios mecanismos fisiopatológicos:
Hipoxia tisular sin hipoxemia. En este grupo puede estar indicada la oxigenoterapia pese a haber una pO2 superior a 60mmHg porque hay un deterioro del aporte tisular. Resulta imprescindible la corrección de la causa subyacente a fin de mejorar la oxigenación tisular:
La oxigenoterapia en situaciones agudas debe finalizar cuando se alcanza una pO2 de 60mmHg equivalente a una SatO2 del 90%. En pacientes sin hipoxemia, pero con riesgo de hipoxia tisular, el tratamiento debe finalizar cuando el equilibrio acidobásico y la situación clínica del paciente indiquen la desaparición de este riesgo.
Situaciones de hipoxia crónicaEn Pediatría, el empleo de la oxigenoterapia domiciliaria tuvo sus inicios en los lactantes con enfermedad pulmonar crónica neonatal (EPCN), que representan el grupo más importante de pacientes pediátricos con este tratamiento; Pinney2 en 1976 publica el alta precoz de estos pacientes gracias a la oxigenoterapia domiciliaria. Posteriormente, esta técnica se aplica también para otros pacientes pediátricos con hipoxemia crónica.
Las recomendaciones para la oxigenoterapia domiciliaria en recién nacidos y niños pequeños son distintas de las de adultos, por esto han ido apareciendo diferentes consensos por parte de las sociedades de Neumología que hacen hincapié en esta diferenciación3. La enfermedad respiratoria del niño pequeño que precisa oxigenoterapia domiciliaria es muy distinta a la del adulto o a la del niño ya en edad escolar con una enfermedad progresiva; el tratamiento con O2 suele ser limitado en el tiempo, pues el niño suele mejorar y dejar de precisarlo. En la tabla 1 se reflejan algunas de las diferencias principales con el adulto.
Tabla 1. Diferencias principales con la oxigenoterapia crónica en el adulto 15
| • La mayoría de las situaciones clínicas en el niño son exclusivas de la edad pediátrica y no se ven en adultos, aunque algunas veces hay un solapamiento entre los niños mayores y los adultos jóvenes. • El pronóstico en la infancia suele ser bueno; muchos niños sólo necesitan O 2 durante un período limitado de tiempo. • El crecimiento y el desarrollo neurológico son consideraciones importantes. • La valoración es diferente, particularmente por la dificultad en la obtención de muestras de sangre arterial. • Se requieren equipamientos específicos que permitan flujos bajos de O 2 . • Casi todos los niños con oxigenoterapia crónica también requieren O 2 ambulatorio (en los traslados). • Muchos niños sólo necesitan aportes de O 2 por la noche, generalmente menos de 15 h, criterio que forma parte de la definición de oxigenoterapia crónica en el adulto. • Todos los niños requieren supervisión por un adulto o un cuidador. |
O2: oxígeno.
El objetivo fundamental de la oxigenoterapia domiciliaria es tratar la hipoxemia crónica o intermitente derivada de la enfermedad de base que presente el niño. Aunque no hay criterios aceptados universalmente sobre cuándo iniciar la oxigenoterapia a largo plazo en niños, se recomienda en alguna de las siguientes situaciones: a) hipoxemia, 3 desviaciones estándares por debajo de lo esperable con el niño en situación estable respirando aire ambiente; b) períodos de desaturación durante el sueño con SatO2 inferior al 90% durante más del 20% del tiempo de registro, y c) presencia de HTP, hipertrofia ventricular derecha o policitemia secundaria a hipoxemia crónica, aunque es raro encontrar estos signos en niños4.
Las enfermedades pediátricas susceptibles de tratamiento con oxigenoterapia crónica se reflejan en la tabla 2. Se dividen fundamentalmente en enfermedades pulmonares y enfermedades cardíacas.
Tabla 2. Indicaciones de oxigenoterapia crónica
| Enfermedades pulmonares |
| Afectación parenquimatosa intrínseca |
| Enfermedad pulmonar crónica neonatalHipoplasia pulmonarHernia diafragmática congénitaEnfermedades pulmonares intersticialesFibrosis pulmonar idiopáticaFibrosis quística avanzadaBronquiolitis obliteranteBronquiectasias |
| Enfermedad pulmonar restrictiva |
| Enfermedades neuromuscularesEnfermedades de la pared torácica |
| Obstrucción de la vía aérea superior |
| Hipertensión pulmonar primaria o secundaria a enfermedad pulmonar |
| Enfermedades cardíacas con HTP |
| Cuidados paliativos |
HTP: hipertensión pulmonar.
Dentro de las enfermedades pulmonares se puede hablar de:
Afectación parenquimatosa intrínseca: entre las que se encontraría la EPCN, la fibrosis quística y otras que se reflejan en la tabla 2. En la enfermedad pulmonar intersticial, el tratamiento de sostén consiste en la oxigenoterapia, administrar O2 suplementario para aliviar la hipoxemia y prevenir la HTP y el cor pulmonale. En esta enfermedad, el ajuste de la dosis de O2 debe mantenerse por encima del 90% y titularse alto para reducir la disnea.
Enfermedad pulmonar restrictiva: es el caso de algunas enfermedades neuromusculares y enfermedades de la pared torácica (distrofias torácicas, cifoescoliosis grave, etc.). Es muy importante destacar que la hipoxia transitoria o persistente en los pacientes con enfermedad restrictiva suele deberse a la formación de atelectasias secundarias a los escasos volúmenes corrientes que movilizan. Estos pacientes requieren, por tanto, ventilación no invasiva y, a medida que avanza la enfermedad, pueden requerir también O2 añadido al circuito del ventilador, pero la oxigenoterapia sin ventiloterapia puede empeorar su insuficiencia respiratoria.
Obstrucción de la vía aérea superior no susceptible de otras formas de tratamiento: síndrome de apnea e hipopnea del sueño secundario a malformaciones craneofaciales, a trisomía 21 o a obesidad mórbida. Estas enfermedades se benefician más de la ventilación no invasiva, pero si el paciente no la tolera, al menos se puede evitar la hipoxemia, aunque es necesario controlar si hay hipercapnia o si ésta aumenta con la administración de O2.
HTP primaria o secundaria a enfermedad pulmonar (tromboembolia pulmonar, conectivopatías, etc.). La oxigenoterapia, al evitar los daños endoteliales y de la musculatura vascular producidos por la hipoxia mantenida, puede enlentecer el progreso de la enfermedad.
Las enfermedades cardíacas susceptibles de este tratamiento comprenden ciertas cardiopatías congénitas asociadas a HTP capaz de revertir con oxigenoterapia. En las cardiopatías congénitas cianosantes sin HTP, la oxigenoterapia domiciliaria es poco útil porque no resuelve la baja SatO2 debida al shunt intracardíaco. Si el niño está pendiente de cirugía correctora o trasplante cardíaco y presenta HTP que aún revierte con O2, puede beneficiarse de su administración.
Otra situación en la que se emplea la oxigenoterapia prolongada es el tratamiento paliativo, una indicación en la que hay menos experiencia en niños, pero es muy útil para el tratamiento de la disnea en adultos ya que alivia sus síntomas.
La indicación más frecuente de oxigenoterapia crónica domiciliaria es la EPCN, que se define como la necesidad de oxigenoterapia en un prematuro más allá de las 36 semanas de edad posmenstrual. Su incidencia es inversamente proporcional a la edad gestacional. Un 12% de los menores de 33 semanas de edad gestacional va a presentar EPCN; de ellos, menos de la mitad precisarán oxigenoterapia domiciliaria hasta alrededor del año de edad. Se ha demostrado una serie de efectos beneficiosos de la oxigenoterapia domiciliaria en estos niños: frecuencia disminuida de desaturaciones de O2 intermitentes, menor riesgo de muerte súbita, disminución de la HTP, reversión de la enfermedad obstructiva pulmonar, prevención del cor pulmonale, efecto positivo sobre el crecimiento y el desarrollo neuropsicológico.
En un estudio multicéntrico, doble ciego, aleatorizado, realizado en 358 lactantes menores de 30 semanas de edad gestacional5 que precisaban oxigenoterapia, se demostró que mantener unas SatO2 de entre el 95 y el 98% no representaba ventaja frente a mantener SatO2 de entre el 91 y el 94% en términos de crecimiento y desarrollo neurológico comparados al año de edad, y sí representaba un aumento del riesgo de secuelas pulmonares y de necesidad de mantener la oxigenoterapia durante más días. Este estudio alerta sobre los riesgos de tener cifras de SatO2 por encima de la normalidad en estos prematuros. Los valores de SatO2 de entre el 89 y el 95% (92±3%) son correctos para conseguir un adecuado desarrollo y un crecimiento del niño. El objetivo, por tanto, en situaciones crónicas sería conseguir una SatO2 mantenida superior al 92%.
Las necesidades de O2 suplementario pueden variar en función del sueño, el ejercicio, la exacerbación respiratoria, el viaje en avión o el desplazamiento a zonas de elevada altitud, donde la FiO2 puede descender hasta el 15%. La oxigenoterapia puede ser necesaria de forma continua, durante las 24h o en períodos intermitentes (sueño, tras las comidas, etc.).
Fuentes de oxígeno y modos de suministroUna vez pautada la oxigenoterapia sobre la base de las indicaciones de ésta, hay que definir a partir de qué fuente de O2 y a través de qué equipo se administra a cada paciente. La elección dependerá del flujo que precise el paciente, de si es en el ámbito hospitalario o domiciliario, del grado de cumplimiento y de la actividad física, de la zona geográfica donde resida y de la forma de reembolso que disponga6,7.
Fuentes de oxígenoCentral de O2
Se emplea en los hospitales, donde el gas se encuentra en un depósito central (tanque) que está localizado fuera de la edificación hospitalaria. Desde el tanque parte un sistema de tuberías que distribuye el O2 hasta las diferentes dependencias hospitalarias (toma de O2 central).
Hay otras 3 formas diferentes de almacenaje y administración de O2 utilizadas fundamentalmente a domicilio, pero también en ámbitos sanitarios:
Bombonas de O2 gaseoso
Son grandes botellas o cilindros de acero que contienen O2 comprimido en forma gaseosa a una presión de 2×124kPa. A pesar de sus incomodidades, relacionadas con la necesidad de recambios frecuentes cada 2 a 4 días en función del flujo, sigue siendo uno de los métodos más utilizados. Las bombonas son muy voluminosas e impiden la autonomía del paciente por su elevado peso. Hay bombonas de transporte de 400 y de 1.000l con una duración entre 2 y 8h, respectivamente. Su uso debería restringirse a fuente de rescate de seguridad para las situaciones en que pueda quedarse sin suministro eléctrico o en aquellos casos en los que el paciente no disponga de instalación eléctrica para el uso de un concentrador de O2.
Concentrador de O2
Se compone de un compresor eléctrico que hace pasar el aire ambiente a través de un filtro, que por absorción y por las diferencias de pesos moleculares entre el nitrógeno y el O2 retiene el nitrógeno y proporciona una concentración de O2 superior al 90% (administrado a un flujo de 2l/min). La ventaja más importante es que permite la movilidad del paciente (conexión de 15 a 20m) y que no precisa recambios. Es, en la actualidad, la fuente de O2 más utilizada. Hay modelos portátiles y ha disminuido considerablemente el ruido de los primeros concentradores. Son baratos, aunque muy ruidosos y permiten una movilidad limitada. No es el método más adecuado para asegurar un aporte determinado de FiO2 (controles periódicos de su adecuado funcionamiento) y es poco utilizado en niños, aunque es el que se usa con más frecuencia en adultos con oxigenoterapia domiciliaria. No es posible su empleo cuando se requiere un flujo de O2 superior a 3l/min (figura 2).
Figura 2. Concentrador de oxígeno (O2) y mochila de O2 líquido.
O2 líquido
Se basa en que el O2 líquido a temperaturas muy bajas ocupa menor volumen, de modo que un litro de O2 líquido libera 850l de O2 gaseoso a presión y a temperatura ambiente. Se han desarrollado pequeños tanques para la distribución domiciliaria de unos 40kg de peso y de unos 20 a 40l de O2 líquido. Tienen que recargarse semanalmente. El paciente tiene el tanque nodriza y un dispositivo portátil que va recargando 1,3l de O2 y que pesa unos 3,5kg y le ofrece una autonomía de 7 a 8h a un flujo de 2l/min. Hay unas mochilas más pequeñas y de menor peso (2kg) más adecuadas para los niños. Los tanques y las mochilas se vacían espontáneamente a medida que pasa el tiempo por pérdidas espontáneas (el tanque en 50 días y las mochilas en unas 60h). Deben almacenarse en zonas ventiladas. Deben revisarse periódicamente tanques y mochilas y, probablemente, es el método de elección en niños si son cumplidores y permanecen mucho tiempo fuera del domicilio. Las características principales y diferenciales de las fuentes se muestran en la tabla 31,8,9.
Tabla 3. Características principales de las fuentes de oxígeno
Bombona de gas comprimido Bombona de gas portátil Concentrador O2 líquido Indicaciones Paciente sin movilidad Complemento de fuente fija para asegurar movilidad Paciente con poca movilidad y bajos flujos Pacientes con buena movilidad Ventajas Ausencia de ruido Movilidad fuera del domicilio No necesita red de distribución. Movilidad fuera del domicilio Autonomía aceptable Recargable desde nodriza Inconvenientes Red de distribución Peso Pérdida de eficacia con altos flujos Red de distribución Fuente estática Red de distribución Ruido Autonomía escasa Sin movilidad fuera del domicilio No recargable Red eléctrica Coste Medio Medio Bajo Alto O2: oxígeno.
Manómetro y manorreductor
Al cilindro de presión se le acopla siempre un manómetro y un manorreductor. Con el manómetro se puede medir la presión a la que se encuentra el O2 dentro del cilindro, lo que se indica mediante una aguja sobre una escala graduada. Con el manorreductor se regula la presión a la que sale el O2 del cilindro.
En los hospitales, el O2 que procede del tanque ya llega a la toma de O2 con la presión reducida, por lo que no son necesarios ni el manómetro ni el manorreductor.
Flujómetro o caudalímetro
Es un dispositivo que normalmente se acopla al manorreductor y que permite controlar la cantidad de l/min (flujo) que sale de la fuente de suministro de O2. El flujo puede venir indicado mediante una aguja sobre una escala graduada o mediante una «bolita» que sube o baja por un cilindro que también posee una escala graduada.
Humidificador
El O2 se guarda comprimido y para esto hay que licuarlo, enfriarlo y secarlo. Antes de administrar el O2, hay que humidificarlo para que no reseque las vías aéreas. Esto se consigue con un humidificador, que es un recipiente al que se le introduce agua destilada estéril hasta aproximadamente dos tercios de su capacidad. Algunos autores consideran que flujos menores de 3 lpm no precisan humidificación, y evita así el paso de bacterias desde el agua al flujo de O2. El humidificador-calentador está indicado a partir de un flujo de 4lpm.
Son las interfases que llevarán el O2 al paciente, y éstas deberán escogerse de forma individualizada en función de las necesidades de cada paciente, tanto clínicas, de edad como de grado de tolerabilidad y cumplimiento.
Sistemas de alto flujo
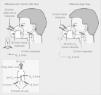
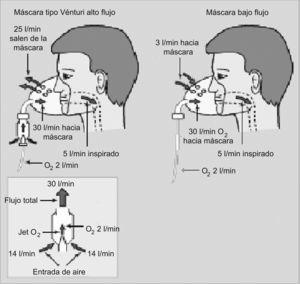
Los sistemas de alto flujo aportan mezclas preestablecidas de gas con FiO2 altas o bajas a velocidades de flujo que exceden las demandas del paciente, es decir, el flujo total de gas que suministra el equipo es suficiente para proporcionar la totalidad del gas inspirado. Los dispositivos de alto flujo utilizan el sistema Venturi con base en el principio de Bernoulli, en el que el equipo mezcla en forma estandarizada el O2 con el aire ambiente a través de orificios de diferente diámetro. Proporciona FiO2 conocidas entre el 24 y el 50%.
Las máscaras de traqueostomía, los adaptadores de tubo en T para tubos endotraqueales y las tiendas faciales funcionan como sistemas de O2 suplementario de alto flujo si se conectan a un sistema Venturi. Requieren humidificadores de aerosol (micronebulizado) o humidificadores de cascada o reservorios.
Suministra una concentración exacta de O2 independientemente del patrón respiratorio del paciente. Puede producir en el paciente sensación de confinamiento, calor e incluso irritar la piel. Impide al paciente comer y hablar. La concentración de O2 puede variar si no se ajusta adecuadamente la mascarilla, si se angulan los tubos conectores, si se bloquean los orificios de entrada de la mascarilla o si se aplica un flujo de O2 inferior al recomendado (figura 3).
Figura 3. Cánulas nasales y mascarilla Venturi.
Tubo en TEl tubo en T proporciona un alto grado de humedad y se utiliza en pacientes intubados con tubos endotraqueales. La extensión en chimenea funciona como un sistema de recirculación parcial y, por tanto, debe mantenerse colocada, de lo contrario, se disminuye en forma significativa la FiO2.
Campana de oxígenoEs una campana cerrada y compacta que se utiliza en lactantes. Proporciona un alto grado de humedad y funciona como un sistema de alto flujo si se conecta a un sistema Venturi.
Es indispensable utilizarla con un nebulizador. Tiene como desventajas la dificultad para alimentar al lactante y la dificultad para su aplicación en niños activos. Se recomienda eliminar la condensación acumulada en los tubos por lo menos cada 2 h y si se utiliza calentador, asegurar una temperatura de 34,5 a 35,6°C en el interior de la cámara con controles cada 4h.
Tienda facialLa tienda facial funciona como un sistema de alto flujo cuando se acopla a un nebulizador Venturi. Es útil en pacientes que no toleran la mascarilla facial o en caso de traumatismo facial.
Es poco práctica para tratamiento a largo plazo debido a que en algunos pacientes produce sensación de calor y de confinamiento.
El riesgo de reinhalación de dióxido de carbono (CO2) disminuye cuando la máscara se acopla a un sistema Venturi.
Collar o mascarilla de traqueostomíaProporciona un alto grado de humedad. Debe eliminarse la condensación acumulada, por lo menos cada 2 h, con el propósito de evitar el drenaje hacia la traqueostomía. La mascarilla debe limpiarse cada 4 h con agua puesto que las secreciones acumuladas producen infección en el estoma.
El orificio frontal de la máscara permite la aspiración de secreciones y no debe ocluirse. Se recomienda evitar el uso de aerosoles calientes en traqueostomías recientes por el riesgo de causar hemorragias.
Sistemas de bajo flujoEstos sistemas suministran O2 puro (100%) a un flujo menor que el flujo inspiratorio del paciente. El O2 administrado se mezcla con el aire inspirado y, como resultado, se obtiene una concentración de O2 inhalado (la FiO2) variable, alta o baja, dependiendo del dispositivo utilizado y del volumen de aire inspirado por el paciente. Es el sistema de elección si la frecuencia respiratoria es menor de 25 respiraciones por minuto y el patrón respiratorio es estable, de lo contrario, el sistema de elección es un dispositivo de alto flujo. En la figura 4 se pueden ver las diferencias entre los sistemas de alto y bajo flujo.
Figura 4. Diferencia entre las máscaras de bajo y alto flujo.
Cánula, gafas nasalesEs la interfase más utilizada y mejor aceptada por el paciente. Son ligeras, permiten al paciente comer y hablar y tienen una vida media muy larga. Puede suministrar una FiO2 de 0,24 a 0,40 (del 24 al 40%) de O2 a un flujo de hasta 6l/min en adultos (de acuerdo con el patrón ventilatorio). Su eficacia disminuye en respiradores bucales o durante el sueño. En recién nacidos el flujo se debe limitar a máximo 2l/min.
Los consensos sobre oxigenoterapia establecen que el O2 suministrado a los adultos por cánula nasal con cantidades de flujo menor o igual a 4l/min no necesita humidificarse; sin embargo, es común observar en servicios de urgencias y hospitalización la utilización de humidificación. Si la institución establece por protocolo la humidificación de todos los gases inhalados, asimismo, debe establecer los mecanismos de seguimiento, tratamiento y cambio de las soluciones de humidificación utilizadas con el fin de evitar contaminación.
No se aconseja la utilización de cánula cuando son necesarios flujos superiores a 6l/min debido a que el flujo rápido de O2 ocasiona resequedad e irritación de las fosas nasales y no aumenta la concentración del O2 inspirado. Las cánulas reservorio aumentan la FiO2 al inicio de la inspiración (figura 3,figura 7).
Máscara de oxígeno simplePuede suministrar una FiO2 de 0,35 a 0,50 (del 35 al 50%) de O2 con flujos de 5 a 10l/min. Es necesario mantener un flujo mínimo de 5l/min con el fin de evitar la reinhalación de CO2 secundario a la acumulación de aire espirado en la máscara. Se deben tomar precauciones cuando se utiliza una máscara simple (figura 5), pues su empleo a largo plazo puede ocasionar irritación en la piel y úlceras de presión. Durante el período de alimentación, el paciente debe utilizar cánula de O2 para evitar hipoxemia.
Figura 5. Mascarilla simple.
Máscara de reinhalación parcial (máscara con reservorio)Es una máscara simple con una bolsa o un reservorio en su extremo inferior; el flujo de O2 debe ser siempre suficiente para mantener la bolsa inflada. A un flujo de 6 a 10 l/min puede aportar una FiO2 de 0,4 a 0,7 (del 40 al 70%). Las máscaras sin reinhalación de O2 son similares a las máscaras de reinhalación parcial, excepto por la presencia de una válvula unidireccional entre la bolsa y la máscara que evita que el aire espirado retorne a la bolsa. Las máscaras de sin reinhalación deben tener un flujo mínimo de 10 l/min y aportan una FiO2 de 0,6 a 0,8 (del 60 al 80%).
Cánula transtraquealSupone la implantación subcutánea, en la cara anterior del tórax, de un catéter que, al seguir un trayecto subcutáneo, acaba penetrando en la tráquea supraesternal del paciente. La cánula o el catéter transtraqueal aumentan la FiO2 al proporcionar O2 directamente en la tráquea, lo que evita el espacio muerto de la cavidad orofaríngea y favorece que la vía aérea superior actúe como reservorio. Los pacientes que reciben O2 por cánula transtraqueal (pequeñas cánulas transtraqueales diseñadas para oxigenoterapia domiciliaria) pueden continuar recibiendo O2 por este método al llegar a urgencias si no hay problemas adicionales. Si se presentan dificultades relacionadas con la ruta de administración transtraqueal, la oxigenación debe asegurarse por otros medios.
Las complicaciones secundarias precoces son el aumento de la tos, la hemorragia, los tapones mucosos y, más ocasionalmente, el broncoespasmo y la inversión de la punta del catéter por un golpe de tos. A largo plazo se describen lesiones cutáneas alrededor del foramen externo, el enfisema subcutáneo o la rotura del catéter.
En la tabla 4 se muestran las diferentes FiO2 que se obtienen según los dispositivos10,11,12,13.
Tabla 4. Fracción inspiratoria de oxígeno según flujo y diferentes dispositivos de administración
| Dispositivo de administración | Flujo de O2 (l/min) | FiO2 |
| Catéter nasofaríngeo | 0,25–4–6 | 0,24–0,40 |
| Cánulas o gafas nasales | 0,25–4–6 | 0,24–0,40 |
| Mascarilla simple | 5–8 | 0,30–0,60 |
| Mascarilla tipo Venturi | 4–6–8–12–15 | 0,24–0,28–0,35–0,40–0,60 |
| Mascarilla con recirulación parcial con reservorio | 5–12 | 0,40–0,60 |
| Mascarilla sin recirulación parcial con reservorio | 5–15 | 0,55–0,90 |
FiO2: fractional inspired oxygen ‘fracción inspiratoria de oxígeno’; O2: oxígeno.
Son dispositivos especiales con sensor de presión que liberan O2 al inicio de la inspiración con una frecuencia establecida. Se pueden conectar a cualquier fuente de O2 y administrarse por medio de gafas nasales especiales de doble circuito (figura 6).
Figura 6. Sistema a demanda: válvula integrada en la bombona de oxígeno líquido y válvula independiente.
Debido a sus diferentes características, cada sistema presenta ventajas e inconvenientes. Para su correcta prescripción debe ajustarse individualmente el flujo de O2, tanto en reposo como durante el ejercicio o el sueño, con las pruebas pertinentes. En su caso redundarían en una mejor calidad de vida del paciente y, además, en un ahorro económico nada despreciable (figura 7)13,14.
Figura 7. Cánulas nasales con reservorio.
Oxigenoterapia domiciliariaCriterios para el altaLa oxigenoterapia domiciliaria, aunque es cara, proporciona una serie de ventajas, tales como facilitar el alta precoz y mejorar la calidad de vida del niño y de sus padres. También puede evitar que en las reagudizaciones respiratorias haya que ingresar al niño por causa de la hipoxia. Todo esto conlleva asimismo una reducción importante en los costes de hospitalización.
Antes de plantear el alta desde el centro hospitalario, se debe comprobar que el paciente y su familiar cumplen los siguientes criterios y que se han proporcionado las instrucciones necesarias para el empleo de este tratamiento15:
Desde el punto de vista de la oxigenoterapia, las necesidades de O2 deben ser estables con saturación media igual o superior al 93%, sin desaturaciones. La SatO2 no debería situarse por debajo del 90% más de un 5% del registro;
los lactantes deberían ser capaces de tolerar períodos cortos de tiempo sin O2, sin que se produciera un deterioro rápido en caso de que se les salgan las gafas nasales;
ausencia de otras enfermedades que no estén estabilizadas, curva de crecimiento aceptable. No hay episodios de apneas al menos en las 2 semanas previas;
calendario vacunal al día;
aceptación por parte de los padres del alta del niño al domicilio con O2;
condiciones adecuadas en el domicilio;
adiestramiento de los padres e información por escrito con instrucciones sobre el tratamiento del O2 en el domicilio y medidas de reanimación cardiopulmonar;
advertencia sobre no fumar y no exponer a llamas;
adiestramiento a los niños más mayores sobre el empleo de los equipos de O2;
antes del alta, contactar con los servicios sanitarios y trabajadores sociales del área donde reside el paciente para conocer el grado de apoyo del que se va a disponer, y
los padres deben elaborar una lista con los números de teléfono importantes para poder consultar y para conseguir asistencia urgente desde el punto de vista sanitario, así como repuestos para el equipo o asistencia técnica.
El control de la oxigenoterapia domiciliaria debería estar a cargo de un especialista con experiencia en patología respiratoria, como el neumólogo infantil, pero también los neonatólogos, los cardiólogos infantiles o los especialistas en cuidados paliativos. La familia también debe evaluarse para su capacidad del tratamiento del O2 en el domicilio, reconocer la aparición de los signos de hipoxia y ser capaces de enfrentarse a todos los aspectos del cuidado del niño. Una primera visita o un contacto telefónico en las primeras 24h es importante para aliviar la ansiedad familiar.
Sistemas de monitorizaciónEl O2, como cualquier otro tratamiento, debe administrarse en la dosis y durante el tiempo necesario, por esto es conveniente la reevaluación continua del paciente. La oxigenoterapia puede monitorizarse a través de gasometrías arteriales, más importantes cuanto más crónico sea el paciente, o ante la sospecha de hipoventilación asociada. También es posible monitorizar el estado de oxigenación a través de la pulsioximetría.
La oxigenoterapia debe garantizar una pO2 igual o mayor de 60mmHg o una SatO2 superior al 92%, tanto en reposo como durante el sueño. El método disponible en el domicilio para monitorizar al paciente es la pulsioximetría, un sistema de medición seguro y preciso de la oxigenación que muestra mediante espectrofotometría el porcentaje de moléculas de hemoglobina en los vasos sanguíneos que se han combinado con el O2 para formar la oxihemoglobina. La oxihemoglobina capta más cantidad de luz infrarroja y la hemoglobina reducida capta más cantidad de luz roja. Los pulsioxímetros son espectrómetros de doble longitud de onda que tienen capacidad pletismográfica, e indican la frecuencia del pulso y la diferencia entre la absorción de luz antes de que se inicie la pulsación sistólica hasta que se realiza ésta, lo que da como resultado una onda pletismográfica cuya amplitud se emplea para el cálculo de la SatO2 de la hemoglogina y cuyo intervalo sirve para calcular la frecuencia cardíaca. La pulsioximetría en distintas situaciones, como en activo, durante el sueño o mientras el paciente come, ayuda al ajuste de la dosis del flujo, al igual que la pulsioximetría con registro de 24h. La finalidad es ajustar la concentración de O2 complementario para mantener la SatO2 en entre el 92 y el 96% en función de la presencia o la ausencia de enfermedad en esos momentos, como pueden ser crecimiento deficiente, bradicardia recidivante o HTP. El proporcionar un pulsioxímetro a los padres es tema controvertido. No hay pruebas de que el proporcionar el pulsioxímetro mejore el resultado de la oxigenoterapia domiciliaria. Por otra parte, si el niño requiere una monitorización continua, puede que no esté indicado darle alta domiciliaria.
La forma mejor de diagnosticar la hipoxia en el niño es la SatO2, a diferencia de los adultos, en quienes se mide la pO2. Si se obtiene la muestra arterial del niño mientras llora, ésta va a ser muy distinta a la de condiciones reales. La Pcapilar O2 tampoco se correlaciona con la presión parcial de oxígeno (pO2) adecuadamente. En la tabla 5 se ve la correlación entre la SatO2 y la pO2.
Tabla 5. Relación aproximada entre la saturación de oxígeno de la hemoglobina arterial y la presión parcial de oxígeno en mmHg a pH normal
| pO2, mmHg | 50 | 55 | 60 | 65 | 70 | 75 | 80 | 85 | 90 | 95 | 100 | 105 | 110 |
| SatO2, % | 85,1 | 88,3 | 90,7 | 92,4 | 93,8 | 94,9 | 95,7 | 96,6 | 97,0 | 97,5 | 97,9 | 98,2 | 98,4 |
Severinghaus JW. Simple, accurate equations for human blood O2 dissociation computations. J Appl Physiol. 1979;46:599–602.
pO2: presión parcial de oxígeno; SatO2: saturación de oxígeno.
La polisomnografía nocturna se puede utilizar en caso de que se disponga de ésta para titular también el flujo de O2, porque además de la oxigenación también evalúa índices de ventilación.
Los capnógrafos, tanto el transcutáneo como los de aire exhalado, rara vez se emplean para monitorización en pacientes con O2 domiciliario, salvo en circunstancias muy especiales de ventilación mecánica domiciliaria (hipoventilación central alveolar, Arnold-Chiari, etc.). Se supone que los niños con O2 domiciliario no deben experimentar cambios amplios en la presión arterial de dióxido de carbono (PaCO2), por lo que no necesitan comprobar la presión trascutánea de dióxido de carbono (PetCO2) con frecuencia.
ControlesUna vez planteada la indicación de la oxigenoterapia domiciliaria, deben programarse controles cuya periodicidad va a depender de la enfermedad, la edad del paciente y la situación familiar. Durante los primeros 3 meses los controles deberían ser mensuales. La finalidad de tales controles es observar el efecto de la oxigenoterapia, la cumplimentación y la adaptación del niño a la técnica, reevaluar la adecuación de la indicación y facilitar ayuda técnica y apoyo psíquico a la familia.
Las visitas domiciliarias resultan altamente recomendables, pero son difíciles de llevar a cabo por la infraestructura de los servicios sanitarios. Estas visitas sí deben ser obligatorias para la compañía suministradora de O2, con una periodicicidad de uno a 2 meses, a cargo de un técnico y un auxiliar sanitario10.
Los requerimientos de O2 suelen cambiar en el tiempo y, en el caso de los niños con EPCP, se reduce gradualmente. Se debería hacer una primera visita en las primeras 24h y hacer una monitorización de la SatO2 a la semana de estar en el domicilio, bien a través de un pulsioxímetro proporcionado en la consulta o bien con el que se le facilita a la familia15. Si no se aprecia mejoría en los lactantes afectados de DBP mediante la administración de O2 complementario en el domicilio, se debe reevaluar su situación para descartar que el cumplimiento sea insuficiente o incorrecto o que haya otra enfermedad orgánica, como reflujo gastroesofágico con aspiración crónica u otras no detectadas anteriormente. Siempre que el niño necesite un aumento en el aporte de O2, los padres pueden incrementarlo pero comunicándolo siempre al especialista que lo controla.
Otras enfermedades pulmonares neonatales que pueden precisar oxigenoterapia domiciliaria son la hipoplasia pulmonar, la neumonía connatal y el síndrome de aspiración meconial. Comparados con la DBP son menos habituales y no es frecuente que necesiten O2 domiciliario más allá de los 2 años16.
En las situaciones con HTP, el O2 suplementario como vasodilatador pulmonar puede prevenir su desarrollo o enlentecer la progresión17. Tanto en la HTP primaria como la secundaria a enfermedad respiratoria o cardíaca, el O2 suplementario domiciliario se puede utilizar como parte del cuidado médico para reducir los efectos secundarios de la hipoxia crónica en caso de enfermedad respiratoria o como puente al trasplante18. Cuando hay HTP, un electrocardiograma o un ecocardiograma se realiza cada 2 meses para seguimiento de los cambios secundarios a la HTP a medida que se normaliza. En algunas cardiopatías congénitas debe ser el cardiólogo infantil el que tome la decisión de la oxigenoterapia domiciliaria mientras el niño está en espera de cirugía o de trasplante19. La medición de las presiones pulmonares debe formar parte del seguimiento debido a la comorbilidad de la HTP en relación con la hipoxemia crónica y la necesidad de considerar el tratamiento farmacológico para la HTP20.
En la bronquiolitis obliterante no hay ningún tratamiento específico, muchos de estos niños requieren oxigenoterapia domiciliaria. En los pacientes con fibrosis quística, la oxigenoterapia domiciliaria suele ser necesaria para casos con enfermedad grave. Hay pocas pruebas respecto al uso de O2 domiciliario en cuanto al índice de mortalidad, la frecuencia de hospitalización o la progresión de la enfermedad21.
El control en cada visita del crecimiento y del peso del paciente debe ser habitual debido al potencial efecto de la hipoxemia sobre éstos. Las consultas frecuentes permiten vigilar mejor los cambios en el crecimiento y los cambios en las necesidades de O2.
Los lactantes con oxigenoterapia domiciliaria tienen más ingresos hospitalarios que los que no precisan O2 en casa. Es recomendable la vacunación antigripal a los cuidadores y al resto de los familiares así como a estos mismos pacientes si tienen más de 6 meses de edad.
En todo momento se debe intentar conseguir las mejores condiciones sociales posibles para estos pacientes y sus familias; para esto hay que facilitar la disponibilidad del contacto telefónico, colaborar para el reintegro al menos de parte del consumo de electricidad (a través de las ayudas disponibles en cada comunidad), proporcionar ayuda doméstica y favorecer la integración del niño en el ámbito social y escolar.
Retirada. DesteteEl aspecto del «destete», o la retirada del O2, se aplica principalmente a los niños con EPCP y algunas otras enfermedades neonatales. Los niños más mayores con enfermedades pulmonares progresivas, como la fibrosis quística o las enfermedades neuromusculares, suelen precisar la oxigenoterapia de por vida.
El tiempo que los niños con EPCP precisan O2 varía, pero generalmente se sitúa entre 6 meses y un año, aunque alguno lo requiera durante más tiempo.
En general, no hay normas fijas para el destete de O2, aunque se recomienda disminuir progresivamente el flujo de 0,1 a 0,2lpm o 0,02l/kg/min para alcanzar el objetivo, que consiste en mantener saturaciones del 92 al 94%; se realiza en el domicilio del paciente. Después del destete, las saturaciones más bajas se alcanzan dentro de los siguientes 40min. Los pacientes con cifras de PaCO2 más altas suelen requerir más tiempo para el destete. En algunas unidades mantienen el O2 continuo y en otras lo mantienen durante las siestas o durante el sueño, pero no hay ninguna prueba de cuál es la mejor forma para el destete en estos casos15.
La persistencia de síntomas o el fracaso en la retirada de la oxigenoterapia deben hacer pensar en otras enfermedades, como traqueobroncomalacia, granuloma subglótico, aspiración crónica por reflujo gastroesofágico o cardiopatía congénita.
Efectos secundarios y riesgosCuando se pauta tratamiento con oxigenoterapia domiciliaria, se deben sopesar los posibles riesgos frente a sus beneficios. Estos riesgos incluyen los efectos derivados directamente del O2 y los que pueden ocasionar la manipulación y el almacenamiento inapropiado de éste.
El empleo de O2 se ha implicado en la patogénesis de la EPCP, ya que resulta en la formación de radicales libres con el consecuente daño tisular. Esta toxicidad celular puede traducirse en síndromes respiratorios agudos (traqueobronquitis y síndrome de distrés respiratorio del adulto) o crónicos (además de la DBP o EPCP, trastornos inflamatorios similares en los adultos con enfisema y fibrosis) y también en retinopatía (fibroplasia retrolental) en pacientes prematuros.
Se desconoce cuál es la concentración o la duración de la exposición al O2 necesaria para inducir daño pulmonar. Los trabajos iniciales de Northway et al22 indicaban que una FiO2 de entre 0,8 y 1,0 durante 24h se asociaba al desarrollo de DBP. Las cantidades de O2 que se suministran en el domicilio a través de las cánulas nasales son probablemente menores de los umbrales que se suponen potencialmente dañinos. Sin embargo, 2 ensayos aleatorizados con SatO2 variables en niños con EPCP indican que concentraciones de O2 mayores se asocian a una peor evolución desde el punto de vista respiratorio23,24, lo que lleva a suponer que el riesgo de la toxicidad por O2 persiste con el empleo en domicilio.
Se conoce también que la administración de aire enriquecido con O2 altera ciertos aspectos de la función respiratoria. Se ha demostrado que los prematuros con EPCP tienen una respuesta disminuida a la hiperoxia, de forma que la disminución de la ventilación que ocurre como respuesta a la inhalación de O2 puro es menor de lo esperable. Se ha indicado que la exposición a suplementos de O2 podría alterar la sensibilidad de los quimiorreceptores arteriales y prolongar la latencia de la respuesta ventilatoria a los cambios en la presión arterial de O2.
Otros posibles efectos secundarios son los relacionados con el almacenamiento y el tratamiento del O2. Los flujos altos de O2 administrados con gafas nasales pueden dar lugar a sequedad y a irritación de la mucosa nasal; esto ocurre con más frecuencia con flujos superiores a 3l/min.
El O2 no es un gas inflamable, pero favorece a que ardan otras materias. Es importante informar a la familia para que tenga en cuenta los siguientes puntos: a) en todo momento deben mantener lejos del fuego o del calor el cilindro de O2, el tubo de conducción y el propio paciente; b) deben evitar los golpes en la llave de paso del cilindro, y c) en caso de incendio, tienen que cerrar inmediatamente la fuente de O225. En adultos se han descrito accidentes causados al fumar cigarrillos mientras recibían aportes de O2 en gafas nasales. En niños se pueden encontrar referencias en la literatura médica a incidentes más propios de la edad pediátrica, como quemaduras inducidas al inflamarse las gafas nasales cuando el niño se ha acercado a la vela de una tarta de cumpleaños que iba a soplar. También puede producirse condensación del agua en los tubos del sistema10.
Situaciones especialesEn el niño se pueden encontrar algunas situaciones especiales que no se van a dar en el paciente adulto. Así, en ocasiones la edad y la situación social del niño aconsejan su escolarización. En estos casos es fundamental una adecuada coordinación entre el equipo de especialistas en Neumología infantil y los servicios de salud del centro educativo; la actuación conjunta de ambos equipos se puede beneficiar además de un eslabón intermedio, como el pediatra de área. En los casos en los que el niño con O2 precise éste también durante las horas que asiste al colegio se debe tener en cuenta una serie de consideraciones:
los equipos portátiles para el suministro de O2 deben ser ligeros y fáciles de manejar y ajustar;
el centro educativo debería disponer de una fuente de O2 para suplir las necesidades del niño en el caso de que su equipo falle. Las medidas de seguridad de estas fuentes y de otros equipos deben estar expuestas en sitio visible;
este material debe disponer de soporte técnico adecuado;
el personal sanitario del colegio debe recibir adiestramiento en el tratamiento de oxigenoterapia, y
se debe prever la cantidad de O2 necesaria para el traslado desde casa hasta el colegio y de vuelta al domicilio.
Si la situación clínica del niño no lo impide por otros motivos fuera de la necesidad de oxigenoterapia, muchas familias de estos niños emprenden viajes que incluyen transporte en avión. Los viajes en avión o a zonas de gran altura deben tenerse en consideración porque algunos lactantes y niños con SatO2 normales pueden experimentar hipoxemia significativa cuando se los expone a ambientes hipóxicos. La disponibilidad de O2 en un avión comercial presurizado corresponde aproximadamente a un 15% del O2 ambiental o a una desaturación de un 2 a un 3%. El otro factor que se debe tener en cuenta durante los viajes aéreos son los cambios en la presión atmosférica, que pueden dar lugar a un aumento del atrapamiento aéreo. Si es preciso el traslado en avión, la familia debe contactarse con antelación con la línea aérea para comunicar la situación del paciente y asegurar que en el avión puedan llevar la mochila de O2 habitual del paciente y una de repuesto por si se produce una situación de emergencia así como un pulsioxímetro por si necesitan ajustar los aportes de O2 durante el vuelo.
ConclusionesLa oxigenoterapia claramente se ha convertido en un elemento fundamental para el tratamiento de la insuficiencia respiratoria, tanto aguda como crónica, en el paciente pediátrico. El empleo de oxigenoterapia en el domicilio es un tratamiento caro y con riesgos potenciales, por lo que es importante que el cuidado de estos pacientes se lleve a cabo por parte de especialistas con experiencia en su tratamiento. Frente a esto están los beneficios que aporta, como la posibilidad del alta precoz, la disminución de la morbilidad en algunas enfermedades y una integración más rápida en el ambiente familiar y social del niño.
La falta de consenso en muchos aspectos y la escasez de estudios amplios requieren ensayos multicéntricos diseñados apropiadamente para que se puedan obtener pruebas para optimizar el tratamiento con O2 en Pediatría.
Agradecimientos
Grupo de Técnicas de la Sociedad Española de Neumología Pediátrica. D. Álvarez Gil (Hospital Infanta Margarita, Cabra, Córdoba), V. Alzina de Aguilar (Clínica Universitaria de Navarra, Pamplona), A. Andrés Martín (Hospital Universitario de Valme, Sevilla), C. Antelo Landeira (Hospital Infantil La Paz, Madrid), O. Asensio de la Cruz, (Corporació Sanitaria Parc Taul í, Sabadell, Barcelona), M.I. Barrio Gómez de Agüero (Hospital La Paz, Madrid), J. Blanco González (Hospital Universitario Príncipe de Asturias, Alcalá de Henares, Madrid), M. Bermejo Pastor (Hospital Materno-Infantil, Badajoz), A. Bonillo Perales (Hospital Torrecárdenas, Almería), M. Bosque García (Corporació Sanitaria Parc Taulí, Sabadell, Barcelona), G. Cabrera Roca (Hospital Universitario Materno-Infantil, Las Palmas de Gran Canaria), M. Carrasco Zalvide (Hospital Juan Ramón Jiménez, Huelva), A. Cordón Martínez (Hospital Universitario Carlos Haya Materno-Infantil, Málaga), I. Cortell Aznar (Hospital Universitario La Fe, Valencia), J. Elorz Lambarri (Hospital de Cruces, Baracaldo, Bilbao), A. Escribano Montaner (Hospital Clínico Universitario, Valencia), J. Figuerola Mulet (Hospital Son Dureta, Palma de Mallorca), D. Gómez-Pastrana Durán (Hospital de Jerez de la Frontera, Cádiz), M.D. Gutiérrez Guerra (Hospital Juan Ramón Jiménez, Huelva), C. Landaluce Ugarte (Hospital de Txagorritxu, Vitoria), S. Liñán Cortés (Hospital Materno-Infantil Vall d’Hebron, Barcelona), C. Luna Paredes (Hospital Universitario 12 de Octubre, Madrid), M. Machuca Contreras (Hospital Virgen del Rocío, Sevilla), C. Martínez Carrasco (Hospital Infantil la Paz, Madrid), A. Martínez Gimeno (Hospital Universitario 12 de Octubre, Madrid), A. Moreno Galdó (Hospital Materno-Infantil Vall d’Hebron, Barcelona), C. Oliva Hernández (Hospital Nuestra Señora de la Candelaria, Santa Cruz de Tenerife), B. Osona Rodríguez de Torres (Hospital Son Dureta, Palma de Mallorca), T. Pascual Sánchez (Hospital de San Joan, Reus, Tarragona), L. Pardos Rocamora (CAP Balaguer, Lleida), J. Pérez Frías (Hospital Universitario Carlos Haya Materno-Infantil, Málaga), G. Pérez Pérez (Hospital Universitario Virgen Macarena, Sevilla), E. Pérez Ruiz (Hospital Universitario Carlos Haya Materno-Infantil, Málaga), S. Pérez Tarazona (Hospital de la Rivera, Alzira, Valencia), C. Reverté Bover (CAP Amposta, Tarragona), A. Salcedo Posadas (Hospital Universitario del Niño Jesús, Madrid), J. Sánchez Jiménez (Hospital de San Jaume, Calella, Barcelona), E. Sánchez Sánchez (CAP Premià del Mar, Barcelona), L. Sanz Borrell (Hospital de San Joan, Reus, Tarragona), A. Sequeiros González (Hospital Universitario Niño Jesús, Madrid), J. Sirvent Gómez (Complejo Hospitalario Juan Canalejo, A Coruña), J.M. Tabarés Lezcano (Hospital Cristal-Piñor, Orense), J.M. Torres Simón (Hospital de Palamós, Girona), M.I. Úbeda Sansano (CAP Godella, Valencia), J.R. Villa Asensi (Hospital Universitario del Niño Jesús, Madrid).