Desde la descripción inicial de la endocarditis infecciosa (EI) por Osler en 1885, varios aspectos de esta enfermedad han presentado cambios significativos y, a pesar de los avances terapéuticos y de las técnicas de imagen, en la actualidad sigue siendo una enfermedad con alta morbimortalidad1.
La fístula aorto-cavitaria (FAC) es una complicación infrecuente de la EI. Su aparición agrava el pronóstico de la enfermedad, presentando una mortalidad elevada a pesar del tratamiento quirúrgico agresivo2,3.
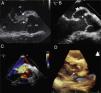
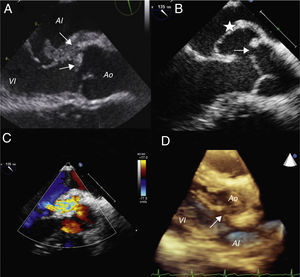
Presentamos el caso de un niño de 10 años sano, que acude por fiebre elevada y cefalea. Destaca a la exploración alteración del nivel de conciencia, rigidez nucal y soplo sistólico plurifocal ii/vi. La analítica muestra leucopenia 1.200/μl, neutropenia 610/μl y proteína C reactica de 22mg/dl. La radiografía de tórax y el electrocardiograma resultan normales. Ante la sospecha de meningoencefalitis, se inicia tratamiento empírico con cefotaxima por vía intravenosa, no realizándose punción lumbar por inestabilidad hemodinámica que precisa soporte vasoactivo. Tras 6 días de tratamiento persiste febril; el hemocultivo resulta positivo a estafilococo aureus y se cambia antibioterapia a cloxacilina y gentamicina que continúa durante 6 semanas. La ecocardiografía transtorácica (ETT) mostró vegetaciones en el velo septal de la válvula mitral y en el seno coronariano derecho de la válvula aórtica, con insuficiencia mitral y aórtica moderada con aumento de la ecogenicidad en la unión auriculoventricular, que se confirma en la ecocardiografía transesofágica (ETE) (fig. 1 A). Queda afebril al octavo día de tratamiento y un mes después del alta hospitalaria presenta un soplo continuo en borde esternal. La ecocardiografía mostró un trayecto fistuloso entre la aorta y la aurícula izquierda, y la formación de un seudoaneurisma del seno de Valsalva no coronariano sin presencia de vegetaciones (fig. 1 B).
A) Ecocardiografía transesofágica con vegetación en válvula mitral y aórtica (flechas). B) Cabeza de flecha muestra la conexión fistulosa. Asterisco a nivel del seudoaneurisma de la pared aórtica. C) Doppler color al mismo nivel que imagen B que muestra la conexión fistulosa entre la aorta y la aurícula izquierda. D) Ecocardiografía transtorácica tridimensional que muestra la fístula (flecha) entre la aorta y la aurícula izquierda.
AI: aurícula izquierda; Ao: aorta; VI: ventrículo izquierdo.
Se realiza cirugía con bypass cardiopulmonar, localizando el lugar de la fístula antes del pinzamiento de la aorta. Se practica cierre de perforación en el seno de Valsalva aórtico no coronariano y en el velo mitral mediante puntos apoyados en pledgets de pericardio autógeno y plicatura del seudoaneurisma a nivel de la unión mitro-aórtica. La ETE perioperatoria mostró una insuficiencia aórtica (IAo) ligera, no siendo necesarias técnicas reconstructivas a nivel de la válvula. El postoperatorio ocurrió sin incidencias y actualmente, 2 años después de la intervención, está asintomático y presenta una IAo moderada.
La EI es rara, con una incidencia de 1,7-6,2 casos por cada 100.000 pacientes/año1. El germen causal más frecuente es el estafilococo aureus y las cardiopatías congénitas son un factor de riesgo primario1,4. La extensión perivalvular en la EI sucede en un 10-40% de los casos en la válvula nativa, con mayor frecuencia en la válvula aórtica, pudiendo provocar abscesos, formación de seudoaneurismas y desarrollo de FAC3.
La FAC crea un shunt intracardiaco que puede ocasionar un importante deterioro clínico e inestabilidad hemodinámica3,5. Se presenta en el 1,6% de los pacientes con endocarditis3,5 y se produce únicamente en endocarditis sobre la válvula aórtica, generalmente asociada a la formación de un absceso perianular. El 62% de los pacientes desarrollan insuficiencia cardiaca, aumentando la mortalidad hasta el 41% en la población general. Las variables identificadas con mayor riesgo de muerte son la insuficiencia cardiaca, la prótesis valvular y el tratamiento quirúrgico urgente5.
Se debe sospechar en los pacientes con endocarditis de válvula aórtica nativa o protésica que presenten deterioro hemodinámico agudo o un cuadro séptico inexplicado3,6.
El diagnóstico debe hacerse con ETE; la ETT solo detecta el 53% de las FAC, en comparación con un 97% de detección con la imagen transesofágica3,5. Se debe realizar una ETE ante la sospecha de endocarditis de válvula protésica o de válvula aórtica nativa asociada a infección por estafilococos, inestabilidad hemodinámica o signos de infección persistente después de 7 días de tratamiento antibiótico correcto5. La Sociedad Europea de Cardiología resalta la importancia del ETE para detectar la extensión perianular y la necesidad de intervención quirúrgica temprana5.
El riesgo de recurrencia varía entre el 2,7 y el 22,5%, por lo que estos pacientes necesitan seguimiento y asesoramiento a largo plazo5,7.
Como conclusión, se debe destacar que la formación de una FAC se asocia a un amplio daño perivalvular, con elevada morbimortalidad a pesar del tratamiento antibiótico adecuado o incluso una estrategia quirúrgica agresiva2. Debemos considerar el tratamiento quirúrgico precoz en pacientes de alto riesgo, especialmente aquellos con endocarditis de válvula protésica, formación de abscesos, edema pulmonar o shock cardiogénico refractario3, de aquí la importancia de la detección precoz de esta complicación, no solo para valorar la necesidad de tratamiento quirúrgico temprano, sino también para mejorar el pronóstico de estos pacientes3,5.