La pubarquia precoz (PP) es generalmente considerada como una enfermedad benigna, pero puede ser el primer signo de una enfermedad subyacente.
ObjetivoAnalizar la etiología y la evolución de parámetros antropométricos, analíticos y de riesgo metabólico, en pacientes con PP.
Material y métodosEstudio retrospectivo, descriptivo y analítico, de 92 pacientes afectos de PP. Se evaluaron medidas antropométricas y analíticas, la edad ósea y marcadores de metabolismo lipídico.
ResultadosMuestra de 92 pacientes (67 mujeres y 25 varones) con PP, con una edad media de 7,1±0,6 años las mujeres y 8,3±0,7 los varones. El 7,7% fueron pequeños para la edad gestacional. La edad ósea estaba adelantada (1,2±0,1 años). Veintiún pacientes fueron clasificados como PP idiopática (23%), 60 como adrenarquia precoz idiopática (65%) y 11 como hiperplasia suprarrenal congénita no clásica (12%). La pubertad se mostró adelantada respecto a la media (11±0,9 años en varones versus 9,9±0,8 años en mujeres), así como la edad de la menarquia (11,8±1,1 años), p<0,001. La talla final alcanzada es próxima a la talla genética. Existe una correlación positiva entre el Z-score del índice de masa corporal, la glucemia y el colesterol LDL, así como una tendencia a la hiperinsulinemia.
ConclusionesEl presente estudio demuestra como la PP en la mayoría de los casos supone una patología benigna, no siendo infrecuente la hiperplasia suprarrenal congénita no clásica (12%). Estos pacientes presentaron un adelanto puberal, de la edad ósea y de la menarquia. El crecimiento fue adecuado, alcanzando prácticamente su talla genética. La PP asociada a obesidad presenta alteraciones analíticas de riesgo metabólico.
Premature pubarche (PP) is generally thought to be a benign condition, but it can also be the first sign of underlying disease.
ObjectiveTo analyse the aetiology and the evolution of the anthropometric, analytical and metabolic risk parameters of a group of patients with PP.
Material and methodsA descriptive and analytical retrospective study of 92 patients affected by PP. Anthropometry, analyses, bone age and indicators of lipid metabolism were all evaluated.
ResultsThe sample included 92 patients with PP (67 female and 25 male), with a mean age of 7.1±0.6 for girls and 8.3±0.7 for boys. Small for gestational age was recorded in 7.7%. There was an accelerated bone age (1.20±0.1 years). A total of 21 patients were classified as idiopathic (23%), 60 as idiopathic premature adrenarche (65%), and 11 with non-classic congenital adrenal hyperplasia (12%). Puberty was reached early (11+0.9 years old in boys and 9.9±0.8 in girls), as was menstruation age (11.8+1.1 years old), P<.001. The stature finally reached was close to their genetic stature. There is a positive correlation between body mass index, blood glucose and LDL cholesterol, as well as a tendency towards hyperinsulinaemia.
ConclusionsThe present study shows that PP is a benign condition in the majority of cases, but non-classic congenital adrenal hyperplasia (12%) is not uncommon. Menstruation and puberty started early and bone age was accelerated. Growth was normal, and more or less in line with genetic size. PP associated with obesity is linked with analytical variations of metabolic risks.
El término descriptivo pubarquia indica la aparición de vello púbico y puede ser un hecho aislado o acompañarse de vello axilar, piel grasa, acné y aumento del olor corporal. Este proceso se considera prematuro cuando aparece antes de los 8 años en las mujeres y 9 en los varones1–4. Cada uno de estos signos clínicos puede ocurrir como evento aislado dentro del fenómeno fisiológico de la adrenarquia, que comienza alrededor de los 6-8 años de edad5. La adrenarquia precoz (AP) hace referencia a la producción prematura de andrógenos adrenales y es la causa más frecuente de pubarquia. La prevalencia varía dependiendo de los criterios que se empleen y de la etnia poblacional, siendo mayor la incidencia en niños afroamericanos6. Presenta un claro predominio femenino (mujer:varón 9/10:1)7 y se caracteriza por ser un fenómeno independiente de la pubertad. El mejor indicador de adrenarquia es el sulfato de dehidroepiandrosterona (DHEA-S): niveles de este metabolito superiores a 40-50μg/dl se consideran indicadores de su inicio1,2,5.
La pubarquia precoz (PP) es considerada una variante de la normalidad, que no se acompaña de ningún otro signo de pubertad, virilización franca o avance anormal de la edad ósea (≥2 años)5,8. Sin embargo, se discute si debe ser considerada una entidad clínica diferente e incluida dentro del hiperandrogenismo prepuberal, ya que estas niñas podrían mostrar hiperinsulinismo prepuberal, aumento de incidencia de disfunción ovárica, hiperandrogenismo ovárico funcional, dislipidemia y obesidad en la adolescencia4,5.
La AP no es equivalente a la PP, aunque a menudo se utilicen como sinónimos. En la literatura no hay criterios unánimes para definir variantes de la normalidad tales como adrenarquia prematura idiopática (API) y pubarquia prematura idiopática (PPI). Algunos autores consideran que la API se define exclusivamente por criterios clínicos (aparición de vello púbico y/o axilar y/o aumento del olor corporal de origen apocrino) antes de los 8 años en niñas y de los 9 en niños, una vez excluidas otras patologías causantes de hiperandrogenismo (tumores, hiperplasia suprarrenal)4,7. Otros autores señalan que la API es aquella que cumple criterios clínicos junto con criterios bioquímicos (valores de DHEA-S mayores que niños/as prepuberales, estableciendo como punto de corte 40μg/dl), considerando la PPI como la aparición de pubarquia antes de los 8 años en niñas y de los 9 en niños, una vez excluidas otras causas de hiperandrogenismo, con valores de DHEA-S por debajo de 40-50μg/dl1,2.
Se desconocen los mecanismos exactos de este fenómeno, pero parece que tanto el tejido adiposo2 como la hipersensibilidad del folículo piloso a las hormonas esteroideas4,9,10 juegan un papel destacado en la etiología presumiblemente multifactorial.
Se presenta un estudio realizado en un grupo de pacientes afectos de PP sobre su evolución clínica hasta la edad adulta, atendiendo a su etiología y haciendo referencia a datos antropométricos, analíticos y de riesgo metabólico.
Pacientes y métodosSe ha realizado un estudio retrospectivo, observacional, descriptivo y analítico, en pacientes afectos de PP, controlados en la Unidad de Endocrinología Pediátrica de un hospital de tercer nivel desde el año 2000 al 2015.
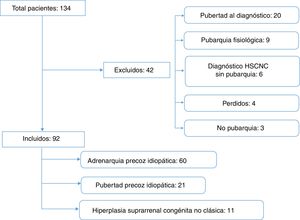
Se incluyeron un total de 92 pacientes que cumplían los siguientes criterios:
- •
Criterios de inclusión:
- -
Inicio de pubarquia aislada en niñas<8 años o en niños<9 años.
- -
Seguimiento en la consulta hasta finalizar el crecimiento.
- -
Clasificación de acuerdo con el examen físico, los niveles hormonales y la edad ósea:
- a)
PPI (niveles DHEA-S normales).
- b)
API (niveles DHEA-S>50μg/dl5).
- c)
Hiperplasia suprarrenal congénita no clásica (HSCNC; niveles de 17-hidroxiprogesterona [17-OHP] post-ACTH>10ng/ml).
- •
Criterios de exclusión:
- -
Ausencia de algún criterio de inclusión.
- -
Presencia de signos puberales: telarquia en niñas y volumen testicular≥4ml en niños.
- -
Causas tumorales de hiperandrogenismo, enfermedad cerebral o síndrome dismórfico que puedan afectar al crecimiento o desarrollo.
La muestra inicial estaba formada por 134 pacientes remitidos por sospecha clínica de PP. Se excluyeron 42 pacientes, 38 por no cumplir los criterios de inclusión y 4 por no disponer de las historias clínicas (fig. 1).
Se revisaron las historias clínicas, obteniéndose datos sobre antecedentes perinatales, familiares, datos auxológicos, analíticos y radiológicos durante su seguimiento. El estudio fue aprobado por el comité de ética e investigación clínica del hospital.
Se registraron el peso y la longitud al nacimiento y se definió a los niños pequeños para la edad gestacional (PEG) como aquellos en los que el peso y/o la longitud al nacimiento fueron inferiores a −2DE (Z-score) para los estándares de referencia11.
Se analizaron variables antropométricas (peso, talla, índice de masa corporal [IMC] y estadio puberal). Se calculó el Z-score según las tablas de referencia españolas12. La pubarquia se clasificó de acuerdo con los 5 estadios de Tanner13, incluyéndose todos los sujetos que presentaban al menos un estadio ii. El inicio de la pubertad se definió, según el estadio de Tanner II13, como el inicio de la telarquia en la mujer y un volumen testicular≥4ml en el varón, determinado con el orquidómetro de Prader.
También fueron consideradas como variables del estudio la edad de la menarquia y los tiempos transcurridos desde el diagnóstico de pubarquia al inicio de la pubertad y desde el diagnóstico de pubarquia y de pubertad a la menarquia.
En todos los pacientes se determinó la edad cronológica (EC) y la edad ósea (EO) (mediante el método de Greulich y Pyle14) y se realizó la predicción de la talla adulta (mediante el método de Bayley y Pinneau15). Se ha definido talla adulta como aquella alcanzada con una EO mayor de 15 años en varones y de 14 años en mujeres y/o una velocidad de crecimiento anual menor de 2cm/año12.
Se obtuvo una muestra de sangre matinal en ayunas para determinar los niveles de 17-OHP (ng/ml) y DHEA-S (μg/dl). Valores de DHEA-S>50μg/dl son indicadores de AP. En aquellos pacientes con valores de 17-OHP>2ng/ml se realizó el test ACTH (mediante la administración intravenosa de 250μg/m2 de ACTH sintética con extracción y medición basal, a los 30 y 60min post-ACTH de 17-OHP y cortisol); valores de 17-OHP tras estímulo en cualquiera de los tiempos>10ng/ml se consideran compatibles con HSCNC, siendo necesario un estudio genético de confirmación. A lo largo del seguimiento se realizó un estudio bioquímico, determinándose glucemia (mg/dl), insulina (μUI/ml), colesterol total (mg/dl), colesterol LDL (c-LDL, mg/dl) y colesterol HDL (c-HDL, mg/dl). Se calculó el índice Homeostasis Model Assessment como marcador indirecto de resistencia insulínica16.
Se realizó un estudio descriptivo y analítico utilizando el programa SPSS 23.0 para Windows. Los resultados descriptivos se expresaron mediante medidas de tendencia central (media) y medidas de dispersión (DE). Se aplicaron test paramétricos para variables cuantitativas con distribución normal (t-Student para 2 variables y ANOVA para más de 2 variables), y test no paramétricos para cuantitativas donde no se asume normalidad (U de Mann-Whitney para 2 variables continuas independientes y Kruskal-Wallis para comparar más de 2 variables continuas independientes). Para variables apareadas se aplicó el test t-Student para datos apareados y el test de correlación de Pearson para el análisis de correlación lineal entre variables cuantitativas. En todos los casos se consideró significación estadística cuando se obtuvo p<0,05.
ResultadosSe analizaron 92 pacientes con PP, el 72,8% mujeres y el 27,2% varones.
La edad media al inicio de la pubarquia fue de 8,3±0,7 años en los varones y de 7,1±0,6 años en las mujeres. La edad media de inicio puberal fue de 11±0,9 años (9,7-12,5 años) en los varones y de 9,9±0,8 años en las mujeres (8,2-11,9 años); la edad media de la menarquia fue de 11,8±1,1 años. El tiempo transcurrido entre el inicio puberal y la menarquia fue de 2,2±1,2 años.
La EO se mostró ligeramente acelerada (relación EO/EC>1 año) en todos los pacientes y durante los distintos periodos de seguimiento, mostrando un rango de variabilidad de 1,1±0,1 a 1,4±0,9.
No se han encontrado diferencias en el Z-score de peso, talla o IMC en los diferentes momentos de evaluación respecto a la población de referencia.
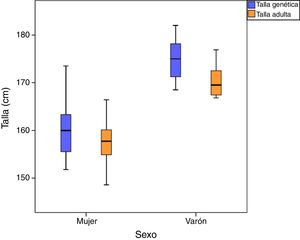
La talla media final alcanzada fue de 170,4±3,7cm (Z-score 1,5±0,9) y de 157,6±4,6cm (Z-score −0,2±1) en varones y mujeres, respectivamente; la diferencia entre talla diana y talla final es más marcada en los varones (4,5±4,1 versus 2,3±3,6cm mujeres) (fig. 2).
Respecto al diagnóstico, 60 pacientes (65%) fueron clasificados como API, 21 casos (23%) como PPI y 11 (12%) como HSCNC. Los pacientes afectos de HSCNC muestran una edad media de inicio de pubarquia menor que los pacientes afectos de API (5,7±1,9 versus 7,9±1,1 años, p=0,01), así como una EO más acelerada (1,7±0,9años, p=0,005). No se observan diferencias en la edad de inicio puberal entre los diferentes grupos ni en la edad media de menarquia (11,5±0,5 años PPI versus 11,4±0,9 años API versus 11,9±0,6 años HSCNC). El tiempo medio transcurrido desde el inicio de la pubarquia a la menarquia resultó menor en los pacientes afectos de API (4,4±1,9 años versus 6,1±0,9 años PPI, p=0,045), siendo esta diferencia menor en lo que respecta al tiempo medio transcurrido desde el inicio de la pubertad a la menarquia (2±1,1 años versus 2,7±1,9 años PPI, p>0,05) (tabla 1).
Evolución de los parámetros auxológicos en distintos periodos de tiempo según el diagnóstico final
| Pubarquia precoz idiopática | Adrenarquia precoz idiopática | Hiperplasia suprarrenal congénita no clásica | ||||||
|---|---|---|---|---|---|---|---|---|
| n | X¯±DE | n | X¯±DE | n | X¯±DE | |||
| Inicio pubarquia | EC | (años) | 21 | 7,1±2,3 | 60 | 7,9±1,1 | 11 | 5,7±1,9** |
| Peso | (kg) | 21 | 32,1±9,3 | 60 | 33,6±8 | 11 | 27,5±5,8 | |
| Z-score | 21 | 0,6±0,7 | 60 | 0,5±0,9 | 11 | 0,7±1 | ||
| Talla | (cm) | 21 | 130,3±18,4 | 60 | 133,1±8,6* | 11 | 123,4±10,4* | |
| Z-score | 21 | 0,6±0,7 | 60 | 0,5±0,9 | 11 | 0,7±1 | ||
| IMC | (kg/m2) | 21 | 18,6±2,7 | 60 | 18,8±2,6 | 11 | 17,9±2,3 | |
| Z-score | 21 | 0,5±1 | 60 | 0,4±0,8 | 11 | 0,6±1 | ||
| EO | (años) | 21 | 9,2±1,8 | 60 | 9,7±1,6 | 11 | 8,4±2,1 | |
| EO/EC | (años) | 21 | 1,1±0,1 | 60 | 1,1±0,1 | 11 | 1,7±0,9** | |
| PC | (cm) | 21 | 167±11,7 | 60 | 165,1±10,8 | 11 | 163,2±8,7 | |
| Z-score | 21 | 0±1,2 | 60 | −0,5±1,2 | 11 | −0,6±1,1 | ||
| Inicio pubertad | EC | (años) | 21 | 10,2±0,8 | 60 | 10,4±0,9 | 11 | 10±0,9 |
| Peso | (kg) | 21 | 40±6,5 | 60 | 41±8,7 | 11 | 40,3±10,9 | |
| Z-score | 21 | 0,3±0,6 | 60 | 0,4±0,8 | 11 | 0,5±0,9 | ||
| Talla | (cm) | 21 | 144,2±8,5 | 60 | 143,1±7,8 | 11 | 140,5±9,5 | |
| Z-score | 21 | 0,5±0,9 | 60 | 0,2±1 | 11 | 0,1±0,9 | ||
| IMC | (kg/m2) | 21 | 19,2±2,4 | 60 | 19,9±2,8 | 11 | 20,2±3,3 | |
| Z-score | 21 | 0,2±0,7 | 60 | 0,4±0,8 | 11 | 0,6±1 | ||
| EO | (años) | 21 | 10,9±1* | 60 | 11,7±0,9* | 11 | 11,4±1,2 | |
| EO/EC | (años) | 21 | 1±0,1* | 60 | 1,2±0,1* | 11 | 1,2±0,1 | |
| PC | (cm) | 21 | 164,6±11,4 | 60 | 162±9 | 11 | 160,4±11,1 | |
| Z-score | 21 | −0,2±1,3 | 60 | −0,9±1 | 11 | −1,2±1 | ||
| Periodos | Pubarquia-pubertad | (años) | 21 | 3,4±1,9 | 60 | 2,5±1,2 | 11 | 3,9±3 |
| Pubarquia-menarquia | (años) | 17 | 6,1±0,9 | 42 | 4,4±0,9* | 8 | 5,8±1,2 | |
| Pubertad-menarquia | (años) | 17 | 2,7±1,9 | 42 | 2±1,1 | 8 | 1,9±0,5 | |
| Última exploración | EC | (años) | 10 | 13,2±1,7 | 20 | 13,4±1 | 5 | 16,6±2*** |
| Peso | (kg) | 10 | 51±4 | 20 | 55,5±9,5 | 5 | 57,1±10,7 | |
| Z-score | 10 | 0,2±0,4 | 20 | 0,5±1 | 5 | 0±0,6 | ||
| Talla | (cm) | 10 | 156,5±8 | 20 | 158,8±7 | 5 | 164,3±8,1 | |
| Z-score | 10 | 0,0±1,3 | 20 | 0,1±1,2 | 5 | −0,1±1,1 | ||
| IMC | (kg/m2) | 10 | 21±2,7 | 20 | 21,9±3,2 | 5 | 21±2,2 | |
| Z-score | 10 | 0,2±0,7 | 20 | 0,4±0,9 | 5 | 0,3±0,8 | ||
| EO | (años) | 8 | 14±0,8 | 20 | 14,5±1 | 1 | 15 | |
| EO/EC | (años) | 8 | 1,1±0,1 | 20 | 1,1±0,1 | 1 | 1,1 | |
| PC | (cm) | 8 | 161,6±7,6 | 20 | 164,3±9,1 | 1 | 175,4 | |
| Z-score | 8 | −0,6±0,9 | 20 | −0,4±0,9 | 1 | −0,1 | ||
| TH-TF | (cm) | 10 | 2,2±5,2 | 20 | 5±5,7 | 5 | 3,9±4 | |
| Z-score | 10 | −1,1±1,0 | 20 | −0,8±0,9 | 5 | −0,1±0,8 | ||
DE: desviación estándar; EC: edad cronológica; EO: edad ósea; EO/EC: relación edad ósea/edad cronológica; IMC: índice de masa corporal; PC: pronóstico de crecimiento; TF: talla final alcanzada; TH: talla genética.
De los 11 niños con HSCNC, 9 presentaron mutaciones homocigotas Val281Leu/Val281Leu (82%) y 2, mutaciones heterocigotas Val281Leu y Pro453Ser. Todos precisaron tratamiento con hidrocortisona durante su seguimiento por una EO acelerada.
Los niveles séricos medios de glucemia, colesterol total, c-LDL y c-HDL estuvieron en rango de normalidad. Los niveles de insulina estaban levemente elevados en los 3 grupos (10,9±6,3 PPI versus 10±7,9 API versus 10,7±5,5μUI/ml HSCNC) (tabla 2). El índice Homeostasis Model Assessment no mostró valores elevados en ningún grupo diagnóstico (2,1±0,1-2,3±0,2).
Determinación analítica de acuerdo con el diagnóstico final
| PPI (n=21) | API (n=60) | HSCNC (n=11) | ||||||
|---|---|---|---|---|---|---|---|---|
| n | X¯±DE | n | X¯±DE | n | X¯±DE | |||
| Glucemia | mg/dl | 8 | 86,8±10,6 | 44 | 80±7,4 | 11 | 79,7±9,4 | |
| Insulina | μUI/ml | 6 | 10,9±6,3 | 21 | 10±7,9 | 6 | 10,7±5,5 | |
| HOMA | 6 | 2,3±0,2 | 21 | 2±0,1 | 6 | 2,1±0,1 | ||
| Colesterol total | mg/dl | 8 | 167,1±41,8 | 42 | 164,1±22,5 | 11 | 176,7±31 | |
| c-LDL | mg/dl | 7 | 106±36,8 | 24 | 93,9±19,5 | 10 | 99,3±25,7 | |
| c-HDL | mg/dl | 7 | 47,3±10,7 | 24 | 53,9±7,9 | 10 | 54,8±10,9 | |
| 17-OHP | ng/ml | 20 | 0,6±0,4 | 59 | 0,8±0,8 | 11 | 14,6±14,9 | |
| DHEA-S | μg/ml | 21 | 0,4±0,1 | 60 | 1,2±0,7 | 11 | 1,7±1,4 | |
| Test ACTH | 17-OHP basal | ng/ml | 0 | 16 | 1,3±0,9 | 10 | 10,6±5,1 | |
| 17-OHP pico | ng/ml | 0 | 16 | 4,5±3,2 | 10 | 28,8±23 | ||
API: adrenarquia prematura idiopática; c-HDL: colesterol HDL; c-LDL: colesterol LDL; DE: desviación estándar; DHEA-S: sulfato de dehidroepiandrosterona; HOMA: índice Homeostasis Model Assessment; HSCNC: hiperplasia suprarrenal congénita no clásica; PPI: pubarquia prematura idiopática; 17-OHP: 17-hidroxiprogesterona.
En cursiva, las variables con significado estadístico y p < 0,05.
Del total de los pacientes estudiados (N=92), un 6,2% (n=6) presentaban un IMC≥2DE en el momento del diagnóstico de pubarquia. Se encontró una correlación positiva entre los niveles de glucemia y c-LDL respecto al Z-score de IMC (tabla 3).
Parámetros de riesgo metabólico y relación con el índice de masa corporal
| Variable dependiente | Variable independiente | R | p |
|---|---|---|---|
| Glucemia (mg/dl) | IMC (kg/m2) | 0,296 | NS |
| Z-score IMC | 0,252 | 0,046 | |
| Insulina (μUI/ml) | IMC (kg/m2) | −0,224 | NS |
| Z-score IMC | −0,239 | NS | |
| Colesterol total (mg/dl) | IMC (kg/m2) | 0,105 | NS |
| Z-score IMC | 0,174 | NS | |
| c-LDL (mg/dl) | IMC (kg/m2) | 0,208 | NS |
| Z-score IMC | 0,318 | 0,043 | |
| c-HDL (mg/dl) | IMC (kg/m2) | 0,095 | NS |
| Z-score IMC | −0,032 | NS |
c-HDL: colesterol HDL; c-LDL: colesterol LDL; IMC: índice de masa corporal; NS: sin diferencias estadísticamente significativas; p: grado de significación; R: coeficiente de correlación.En cursiva, las variables con significado estadístico y p < 0,05.
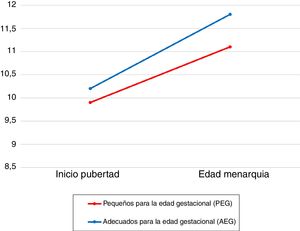
El 7,7% (n=7) de los pacientes nacieron PEG (peso 2,1±0,6kg y longitud 46,9±2,3cm). La edad media de inicio puberal (9,9±0,6 años) y la edad media de la menarquia (11,1±1,5 años) son menores en los pacientes PEG que en los niños nacidos adecuados para la edad gestacional (AEG) (10,2±1 versus 11,8±1,2 años, p>0,05) (fig. 3). El tiempo medio transcurrido desde el inicio de la pubarquia a la menarquia (3,8±2 años en PEG versus 5,2±2,2 años en AEG) y del inicio de la pubertad a la menarquia (1,4±0,4 años en PEG versus 2,2±1,2 años en AEG) fueron menores en los PEG, p>0,05. No se objetivaron diferencias en cuanto a la talla final alcanzada (159,8±7,6cm en PEG versus 161,1±5cm en AEG). Los niveles de DHEA-S (1,2±0,4μg/ml), 17-OHP (0,7±0,3ng/ml) e insulina (10,1±2,6μUI/ml) fueron similares a los de los niños AEG (1,1±0,9μg/dl, 2,6±7,1ng/ml y 10,6±6μUI/ml, respectivamente). El Z-score del IMC fue similar al de los AEG (0,1±0,6 versus 0,5±0,9, respectivamente, p>0,05).
DiscusiónLa PP es un motivo frecuente de consulta en Endocrinología Pediátrica y muestra un claro predominio femenino (72,8% mujeres versus 27,2% varones). La relación entre mujeres y varones afectos de PP oscila entre un 9/10:1, pero existen estudios, como el realizado por Balducci et al.17, en el que la ratio es 4:1, dato similar al obtenido en este trabajo, en el que dicha relación probablemente sea debida a que se trata de pacientes remitidos a una consulta especializada en los que se sospechó alguna alteración de crecimiento o desarrollo.
La API es la causa más frecuente (65%) de PP1,3. La edad media al diagnóstico fue de 8,3±1,6 años en varones y de 7,1±1,6 años en mujeres. La EO se mostró ligeramente acelerada (relación EO/EC>1 año) en todos los pacientes, mostrando un rango de variabilidad de 1,1±0,1 a 1,4±0,9 años, lo cual coincide con lo descrito en diferentes estudios5,18,19.
Con respecto a la evolución longitudinal de los parámetros auxológicos, se objetiva un inicio precoz de la pubertad tanto en los varones (11±0,9 versus 12,3±1,1 años) como en las mujeres (9,9±0,8 versus 10,7±1 años), y de la edad media de la menarquia (11,8±1,1 versus 12,6±1 años) respecto a la población de referencia12. A pesar de esto, la duración de la pubertad (tiempo transcurrido desde el inicio puberal a la menarquia) se mantiene similar a la de la población control (2,2±1,2 versus 2,1±1 años). Estos datos coinciden con los del estudio que Ibáñez et al.20 realizaron en una población de niñas europeas con AP, mostrando una edad media de inicio de la pubertad de 9,7±0,9 años y de la menarquia de 12,0±1 años.
En ambos sexos se alcanza una talla final próxima a la genética, siendo considerada la diferencia entre estas mínima (4,5±4,1cm en los varones y 2,3±3,6cm en las mujeres). Estos datos concuerdan con los de las revisiones existentes, que concluyen que la aceleración de la EO causada por AP no reduce sensiblemente la talla final y que las tallas adultas correlacionan bien con el pronóstico de crecimiento establecido en el momento del diagnóstico y en el inicio de la pubertad2,5,20,21.
Por otro lado, junto con los datos clínicos, es importante la determinación hormonal para establecer el diagnóstico. De la muestra estudiada, el 12% de los casos presentó HSCNC, porcentaje que entra dentro del rango de variabilidad existente en los casos en los que la PP puede ser la primera manifestación de una HSCNC22,23.
Los 3 grupos diagnósticos (PPI, API e HSCNC) mostraron una EO moderadamente acelerada (relación EO/EC entre 1-2 años). A pesar de que el tiempo medio transcurrido desde el inicio de la pubarquia a la menarquia resultó significativamente menor en los pacientes afectos de API (4,4±1,9 versus 6,1±0,9 años en PPI), el tiempo medio transcurrido desde el inicio de la pubertad a la menarquia no muestra tanta discrepancia (2±1,1 versus 2,7±1,9 años en PPI). Estos datos concuerdan con los datos de referencia12 (tiempo medio desde el inicio de la pubertad a la menarquia 2,1±1 años), lo cual permite concluir que el tiempo transcurrido entre la pubertad y la menarquia en los pacientes que presentan PP es igual que en la población general, independientemente del diagnóstico final.
Los niveles séricos medios de glucemia, colesterol total, c-LDL y c-HDL estuvieron dentro de los niveles de referencia de normalidad en los pacientes prepuberales24; sin embargo, los niveles de insulina se mostraron incrementados. Respecto a la dislipidemia e hiperinsulinemia asociada a la AP, existen discrepancias en la literatura. El estudio de Ibáñez et al.25 muestra valores elevados tanto de insulina como de marcadores de metabolismo lipídico, existiendo una mayor prevalencia de síndrome metabólico en niñas con PP en comparación con la población control. Otros estudios26 muestran únicamente una discreta hiperinsulinemia y niveles de lípidos similares entre los pacientes afectos de AP, postulando que la resistencia insulínica es un factor de riesgo independiente de la obesidad para el desarrollo de síndrome metabólico en las pacientes que presentan AP. En el presente estudio se ha objetivado como la presencia de alteraciones analíticas de riesgo metabólico, tales como niveles séricos más elevados de glucemia y c-LDL, aparecen en pacientes con PP que asocian sobrepeso u obesidad.
Dentro del grupo de pacientes que nacieron PEG (7,7%), y a diferencia de lo reportado en diferentes estudios27,28, no se objetivaron cifras más elevadas de insulina, ni en el Z-score de IMC en el momento del diagnóstico respecto a los pacientes que nacieron AEG. Coincidiendo con el estudio realizado por Boonstra et al.29, los niveles de DHEA-S resultaron similares a los del resto de los pacientes. Se aprecia, de acuerdo con el estudio realizado por Ibáñez et al.25, que los pacientes nacidos PEG que desarrollan PP, en comparación con los AEG, muestran una tendencia a presentar un adelanto de la edad media de inicio puberal (9,9±0,6 años) y de la edad media de la menarquia (11,1±1,5 años), así como un tiempo medio transcurrido menor desde el inicio de la pubertad a la menarquia (1,4±0,4 años) y una talla final ligeramente inferior.
En conclusión, la PP representa en la mayoría de los casos una entidad benigna, como se demuestra en el presente trabajo. Los pacientes afectos de PP suelen presentar unas características clínicas bien definidas, como son: un adelanto en el inicio puberal (más acusado en los varones) y de la edad de menarquia, una EO más acelerada, un crecimiento adecuado que les permitirá alcanzar una talla próxima a su talla genética y la presencia de alteraciones analíticas de riesgo metabólico (elevación de cifras de glucemia y c-LDL) asociadas a sobrepeso/obesidad. Según los resultados obtenidos en el presente estudio, el diagnóstico de HSCNC a raíz de la presencia de PP no es algo infrecuente (12%), siendo estos pacientes los que presentan unas características clínicas más llamativas que deben hacernos sospechar esta patología, como son la presencia de una EC de inicio de la pubarquia menor y una mayor aceleración de la EO al diagnóstico. El diagnóstico definitivo de la HSCNC se realizará al llevar a cabo el estudio hormonal suprarrenal y posteriormente se obtendrá la confirmación genética. Por todo ello, aunque la PP es una entidad que no requiere tratamiento endocrinológico específico, sí que es recomendable un seguimiento evolutivo por el riesgo de desarrollar una pubertad adelantada y un futuro síndrome metabólico.
LimitacionesEste estudio presenta un posible sesgo de selección, ya que la muestra está formada únicamente por aquellos casos de PP en los que se consideró necesario el seguimiento en la consulta especializada de Endocrinología Pediátrica por la posible existencia de problemas de crecimiento y/o desarrollo asociados a esta entidad. De esta forma, esta muestra quizás presente diferencias con el total de la población pediátrica que presenta PP. Por este mismo motivo, también puede observarse una prevalencia de PP en varones más elevada que en otras series. Los estudios longitudinales en varones con PP son escasos, pero estos hallazgos evidencian que se deberían diseñar más estudios prospectivos en este grupo para ver si la prevalencia de PP está cambiando en la población y, con ella, sus posibles asociaciones y complicaciones.
Al tratarse de un estudio retrospectivo, existen parámetros que no se han podido analizar, como los valores de testosterona en varones. A pesar de ello, pensamos que los estudios retrospectivos pueden aportar mucha información sobre determinadas enfermedades, y de esta forma permitir una mejora en nuestra práctica diaria, para realizar una asistencia con la mejor calidad posible, como sucede en este caso.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo fue presentado en el 39 Congreso de la Sociedad Española de Endocrinología Pediátrica, Málaga, 10-12 mayo de 2017.