Los niños pequeños tienen una percepción del dolor igual o incluso mayor que los adultos, lo que puede tener consecuencias a corto y largo plazo. Se han descrito intervenciones no farmacológicas para aliviar el dolor en los niños durante el acto de la vacunación. El objetivo de este estudio es valorar 3de estas intervenciones para reducir el dolor asociado a la vacunación: succión no nutritiva (SNN), amamantamiento (LM) y solución de glucosa al 50% (SG50).
Material y métodosEstudio prospectivo, no aleatorizado, de cohortes en niños de 2, 4 y 6 meses que reciben 2, 3 y 1 vacuna, respectivamente, según calendario vacunal sistemático. Se realizaron 3 intervenciones: SNN, LM y ofrecer 2ml de suero glucosado al 50% con SNN. La medición del dolor se efectuó con la escala LLANTO y con el tiempo de llanto.
ResultadosSe incluyó a 387 niños. La media de la escala LLANTO a los 2 y 6 meses era significativamente menor en los niños amamantados que en los niños con SNN (p=0,025 y p<0,001, respectivamente) y en los que recibían SG50 (p=0,025 y p=0,001), sin significación estadística a los 4 meses (p=0,21 y p=0,27). No hubo diferencias significativas entre los niños con SNN y SG50 a los 2, 4 y 6 meses (p=0,66; p=0,93 y p=0,45, respectivamente). El tiempo de llanto fue significativamente menor a los 6 meses en los niños amamantados que en los que recibieron SNN o SG50 (p=0,013 y p=0,017). Ningún niño amamantado (n=129) presentó efectos secundarios.
ConclusionesEn los niños nacidos a término, con peso adecuado a su edad gestacional, el amamantamiento disminuye el dolor cuando se administran 1 y 2 vacunas; cuando se administran 3 vacunas, la disminución es mínima. La administración de SG50 no tiene efecto analgésico adicional respecto a la vacunación de los niños en brazos de sus padres con SNN. La administración de LM durante la vacunación no tiene ningún efecto secundario.
Young children perceive pain as much, or even more than adults, and the pain may have short- and long-term consequences. The literature describes the use of non-pharmacological interventions to alleviate pain during vaccination. The aim of this study was to assess 3such interventions for analgesia during vaccination: non-nutritive sucking (NNS), breastfeeding (BF), and administration of a 50% dextrose solution (D50W).
Materials and methodsA prospective, non-randomised cohort study was carried out on infants aged 2, 4 and 6 months that received 1, 2, or 3 vaccines, respectively, according to the routine immunisation schedule. There were 3treatments: NNS, BF, and 2mL of D50W combined with NNS. Pain was assessed using the LLANTO scale, and the duration of crying.
ResultsThe study included 387 infants. The mean scores in the LLANTO scale at ages 2 and 6 months were significantly lower in breastfed infants compared to infants managed with NNS (P=.025 and P<.001, respectively), or infants given D50W (P=.025 and P=.001), and the difference was not statistically significant at age 4 months (P=.21 and P=.27). There were no significant differences between infants managed with NNS and D50W at 2, 4, and 6 months (P=.66, P=.93 and P=.45, respectively). The duration of crying was significantly lower at age 6 months in breastfeed infants compared to infants managed with NNS or D50W (P=.013 and P=.017). No breastfed child (n=129) experienced side effects.
ConclusionsIn infants born to term with adequate weight for gestational age, breastfeeding reduces pain on the administration of 1 or 2 vaccines. When 3 vaccines are given, the reduction is minimal. Administration of D50W does not have any additional analgesic effect in infants compared to being held by a parent combined with NNS during vaccination. BF during vaccination is not associated with any side effects.
En contraposición a lo creído durante muchos años, diversos estudios han demostrado que la percepción del dolor en recién nacidos (RN) y niños pequeños es igual o incluso mayor que en adultos y, además, que puede tener consecuencias a corto1,2 y a largo plazo (en el desarrollo neurológico y psicosocial3,4, en los procesos cognitivos y de aprendizaje5, en el sueño6 y en la edad adulta1 con una respuesta aumentada al dolor). Sin embargo, la mayoría de los procedimientos dolorosos en RN y lactantes se siguen realizando sin analgesia, principalmente por la falta de formación del personal sanitario7,8.
La administración de vacunas es el procedimiento doloroso realizado más frecuentemente durante el primer año de vida en un lactante sano. El dolor que produce podría ser atenuado con métodos de analgesia no farmacológica. Se han descrito diferentes intervenciones no farmacológicas en RN y niños pequeños9 que han mostrado ser eficaces, económicas y bien toleradas. Las más utilizadas son el amamantamiento o tetanalgesia (LM)10, la succión no nutritiva (SNN)11 y la administración de soluciones dulces12.
Con base en ello, elaboramos un estudio para valorar el dolor cuando se administran vacunas. El objetivo es determinar si 2métodos de analgesia no farmacológica (LM y 2ml de suero glucosado al 50%), comparados con la práctica habitual (SNN con chupete), disminuyen la percepción del dolor a los 2, 4 y 6 meses de vida y realizar un análisis estratificado según el número de vacunas administradas.
Material y métodosEstudio prospectivo, no aleatorizado, de cohortes, no ciego, realizado en el Centro de Vacunación del Hospital Casa de Salud (Valencia) entre junio y diciembre de 2016.
Se incluyó a los lactantes de 2, 4 y 6 meses que acudían a recibir las vacunas (calendario vacunal de la Comunidad Valenciana de 2016). Se excluyó a los lactantes que acudieron a vacunar sin sus progenitores, con alteración del tono muscular o parálisis cerebral o neumopatía; a los RN pretérmino y postérmino, o con bajo peso para la edad gestacional; a los niños que habían recibido previamente a la vacunación medicación analgésica, a aquellos con llanto que no calmaba antes de la vacunación y cuando no había consentimiento informado.
Vacunas administradas- -
A los 2 meses (2 inyecciones): hexavalente (Infanrix-hexa®), antineumocócica (Prevenar 13®).
- -
A los 4 meses (3 inyecciones): hexavalente (Infanrix-hexa®), meningococo C (NeisVac-C®), antineumocócica (Prevenar 13®).
- -
A los 6 meses (1 inyección): hexavalente (Infanrix-hexa®).
Las vacunas fueron administradas siempre por la misma enfermera, por vía intramuscular (vasto externo), insertando la aguja con un ángulo de 70-90°, previa limpieza de la zona con suero fisiológico y administrando el líquido rápidamente, sin aspiración previa. La segunda vacuna se inoculaba en el mismo músculo separada al menos 2cm. Cuando se administraban 3 vacunas, la tercera se inyectaba en el vasto externo contralateral. La vacuna antineumocócica, al ser más dolorosa, se administró en último lugar13.
Intervención- -
A (SNN o control): la madre o el padre, sentado, sujetaba al lactante en brazos, que succiona el chupete mientras se administran las vacunas.
- -
B (LM): se indicaba a la madre que empezara a amamantar a su hijo. Cuando el lactante estaba mamando eficazmente, se inyectaban las vacunas.
- -
C (SG50+SNN): se administraba al lactante 2ml de suero glucosado al 50% por vía oral. A los 2 min se inyectaba la pauta vacunal (con el chupete puesto) en brazos de su progenitor. Se eligió la glucosa al ser más accesible que la sacarosa, sobre todo cuando no hay servicio de farmacia14. Además, la sacarosa podría tener efectos secundarios en niños con intolerancia a la fructosa15. No se han descrito reacciones adversas con el empleo de soluciones de glucosa, salvo algún episodio de bradicardia y desaturación en grandes prematuros, sin repercusión clínica14. La elección de la concentración al 50% se realizó por resultados recientes que orientan a que concentraciones menores podrían no ser eficaces en niños fuera del periodo neonatal16-18.
Los niños se distribuyeron en 3 grupos según edad: grupo 2 (2 meses), grupo 4 (4 meses) y grupo 6 (6 meses) y se asignó el tipo de intervención según la alimentación que recibían: si tomaba LM se incluía en los subgrupos 2B, 4B y 6B. Si no tomaba pecho, se alternaban 8 niños de SNN (2A, 4A, 6A) con 8 a los que se administraba SG50 (2C, 4C, 6C).
Instrumentos de medidaA) Escala LLANTO19, aplicada en el momento de máxima intensidad del llanto, siempre por el mismo médico (especialista en Pediatría). La intensidad del dolor se determinó mediante la suma de puntos, entre 0 y 2, para 5 ítems (llanto, actitud, respiración, tono postural y observación facial). Por tanto, la puntuación oscila entre 0 (ausencia de dolor) y 10 (dolor máximo) (tabla 1). Esta escala fue diseñada para lactantes y preescolares en el Hospital Universitario La Paz (Madrid), por lo que está adaptada a nuestro entorno lingüístico y cultural. No requiere de la utilización de ningún dispositivo electrónico (pulsioxímetro, tensiómetro…) y se puede realizar a distancia, lo que disminuye la interferencia del observador. Se obtiene una estimación precisa del grado de dolor en 20-40 s; los criterios de aplicación son uniformes y presenta un elevado grado de objetividad. Su índice de correlación con la escala CHEOPS20, considerada el patrón oro para la valoración del dolor en los niños, es muy significativa.
Escala LLANTO
| 0 | 1 | 2 | |
|---|---|---|---|
| Llanto | No | Consolable intermitente | Inconsolable continuo |
| Actitud | Dormido o tranquilo | Vigilante o inquieto | Agitado o descontrolado |
| Respiración | Rítmica o pausada | Rápida superficial | Arrítmica |
| Tono postural | Relajado | Indiferente | Contraído |
| Observación facial | Contento o dormido | Serio | Triste |
Fuente: tomado de Reinoso-Barbero et al.19.
B) Tiempo de llanto: duración del llanto en segundos, desde su inicio tras administrar la primera inyección hasta un periodo de silencio de 5 s, excluyendo estos 5 s (tiempo máximo: 3 min). El tiempo de llanto tiene como ventaja su objetividad; como desventaja, que puede producirse por otras causas (hambre, sed, comportamiento de los padres y del personal sanitario…).
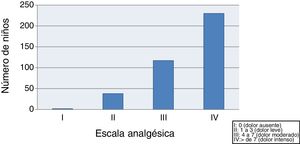
C) Según el resultado de la escala LLANTO, clasificamos el dolor en ausente, leve, moderado o intenso, conforme a la escala analgésica de la OMS:
- -
I: 0 (ausente)
- -
II: 1 a 3 (leve)
- -
III: 4 a 7 (moderado)
- -
IV:> de 7 (intenso).
La inclusión de 43 pacientes en cada subgrupo permitiría la detección de una diferencia de 0,85 puntos en la escala LLANTO. Asumimos una desviación estándar con respecto a la media de 1,2 puntos, un poder del 90% y un error α de 5%, con el nivel de significación establecido en 0,05.
Recogida de datosSe recogieron datos clínicos y sociodemográficos: sexo, edad y nivel de estudios de los padres, clase social, si acudía un solo progenitor o ambos, número de hijos y qué orden ocupaba, edad gestacional y peso al nacimiento, test de Apgar y si estaba despierto en el momento en que se iniciaba la vacunación. Para recoger los datos se realizó una encuesta a los padres, que se recogió en una plantilla y se trasladó posteriormente a una hoja Excel para su evaluación. La clase social se clasificó según la propuesta de Domingo et al.21, que se adaptó dividiéndolos en clase I-II (profesionales liberales, directivos, técnicos superiores y medios) y clase III a VII (cuadros intermedios, administrativos, trabajadores manuales, trabajadores no cualificados y otros casos).
Análisis estadísticoPara todas las variables se realizó un estudio de normalidad (Kolmogorov-Smirnov). Según la distribución fuera normal o no normal se aplicó la prueba t de Student (2 variables), ANOVA (3 o más variables), U de Mann-Whitney (2 variables) o Kruskal-Wallis (3 o más variables). Se compararon variables cualitativas con la prueba de χ2.
Aspectos ético-legalesEl estudio fue aprobado por el Comité Ético del Hospital Universitario y Politécnico La Fe (Valencia). Los padres lo aceptaron mediante la firma de un documento de consentimiento informado.
ResultadosSe incluyó a 387 niños (129 para cada grupo de edad). Cada subgrupo estaba formado por 43 niños: 197 varones (50,9%) y 190 mujeres (49,1%); 189 (48,8%) eran el primer hijo, 175 (45,2%) el segundo y el resto, el tercero o siguientes. En 363 (93,8%) el Apgar al minuto fue> 7 y en el 100% de los casos a los 5 min era≥de 8. La edad media de las madres era de 34,3 años [23-50] y de los padres de 36,5 [25-53]. El 57,7% de las familias pertenecían a la clase social I y II, con un porcentaje de madres universitarias del 68% y de padres universitarios del 57,1%. En el 58,1% acudía a la vacunación solo uno de los progenitores; acudieron ambos en el 41,9%. Del total, 363 niños (93,8%) estaban despiertos al iniciarse la vacunación, mientras que 24 estaban dormidos.
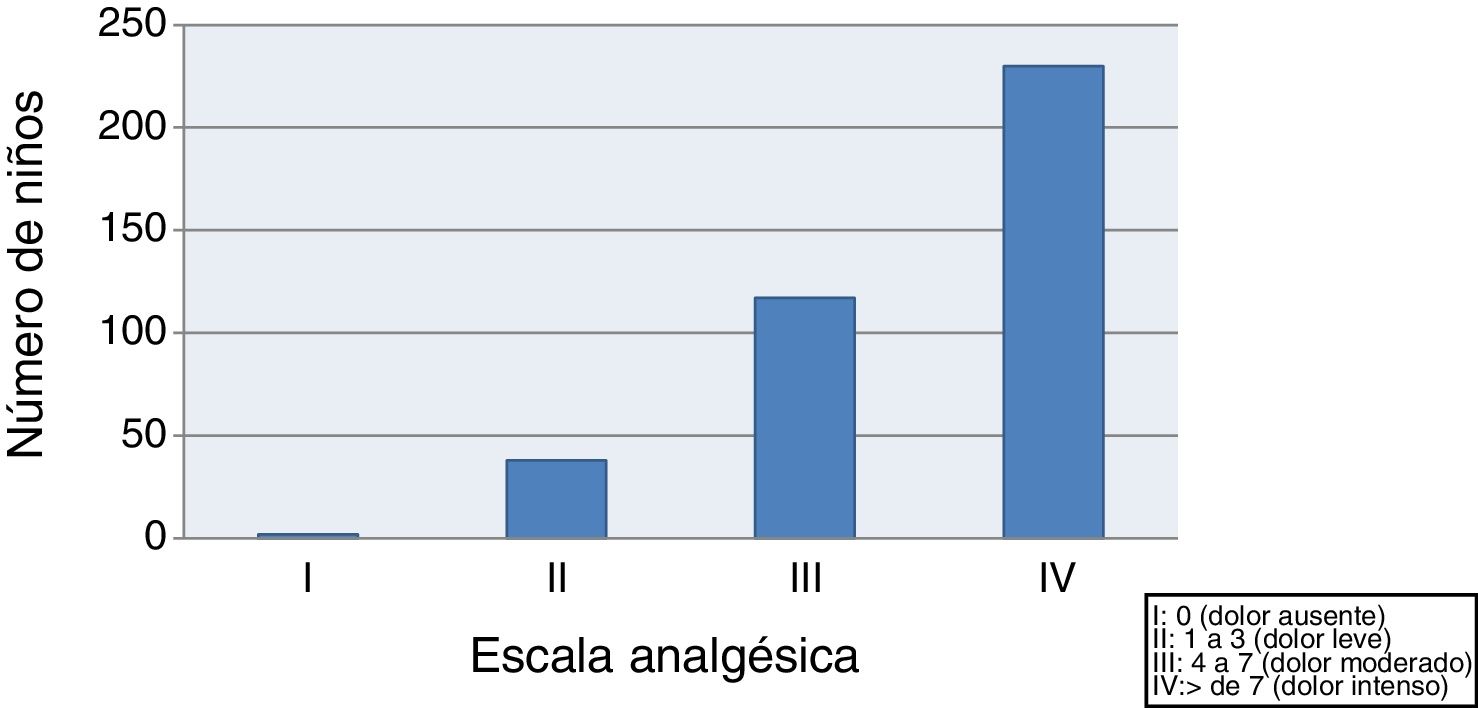
En primer lugar se evaluó la intensidad del dolor observando que el 59,4% de los niños sufrieron dolor moderado-intenso (clase III-IV) tras las vacunas y solo el 10,3% presentaron dolor leve o ausencia de dolor (clase I-II) (fig. 1).
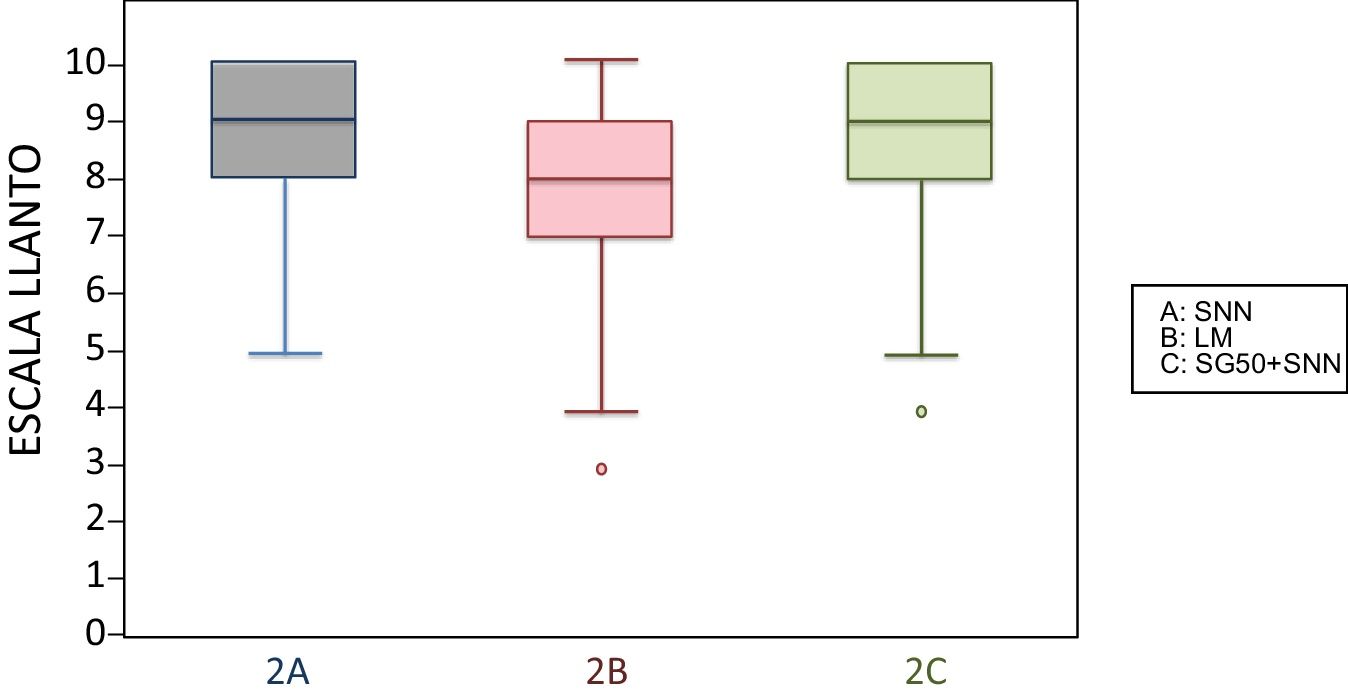
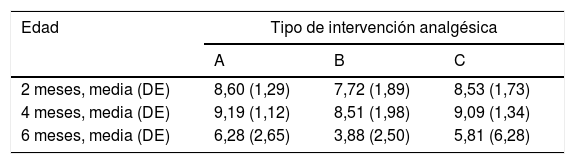
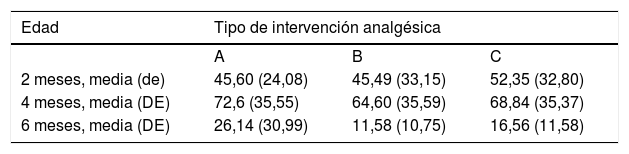
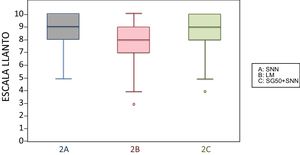
2 meses (2 inyecciones)Al agrupar a los niños de esta edad según la escala analgésica, los niños amamantados durante la vacunación presentaban dolor intenso con menos frecuencia que los otros subgrupos y, por el contrario, mayor frecuencia de dolor moderado. Otros 2 niños amamantados presentaron dolor leve. Los niños amamantados presentaron una media en la escala LLANTO significativamente inferior que los que recibieron SG50 (p=0,024) y que el control (p=0,025). No existía diferencia significativa entre el subgrupo que recibió SG50 y el control (p=0,66) (tabla 2). En la figura 2, apreciamos que la mediana en los niños amamantados es menor que en los otros 2 subgrupos. En el tiempo de llanto no existieron diferencias significativas entre los diferentes subgrupos (tabla 3).
Resultados en la escala LLANTO (media±DE)
| Edad | Tipo de intervención analgésica | ||
|---|---|---|---|
| A | B | C | |
| 2 meses, media (DE) | 8,60 (1,29) | 7,72 (1,89) | 8,53 (1,73) |
| 4 meses, media (DE) | 9,19 (1,12) | 8,51 (1,98) | 9,09 (1,34) |
| 6 meses, media (DE) | 6,28 (2,65) | 3,88 (2,50) | 5,81 (6,28) |
Tipos de intervención analgésica: A: SNN; B: LM; C: SG50+SNN
Resultados en el tiempo de llanto (media±DE en segundos)
| Edad | Tipo de intervención analgésica | ||
|---|---|---|---|
| A | B | C | |
| 2 meses, media (de) | 45,60 (24,08) | 45,49 (33,15) | 52,35 (32,80) |
| 4 meses, media (DE) | 72,6 (35,55) | 64,60 (35,59) | 68,84 (35,37) |
| 6 meses, media (DE) | 26,14 (30,99) | 11,58 (10,75) | 16,56 (11,58) |
Tipos de intervención analgésica: A: SNN; B: LM; C: SG50+SNN.
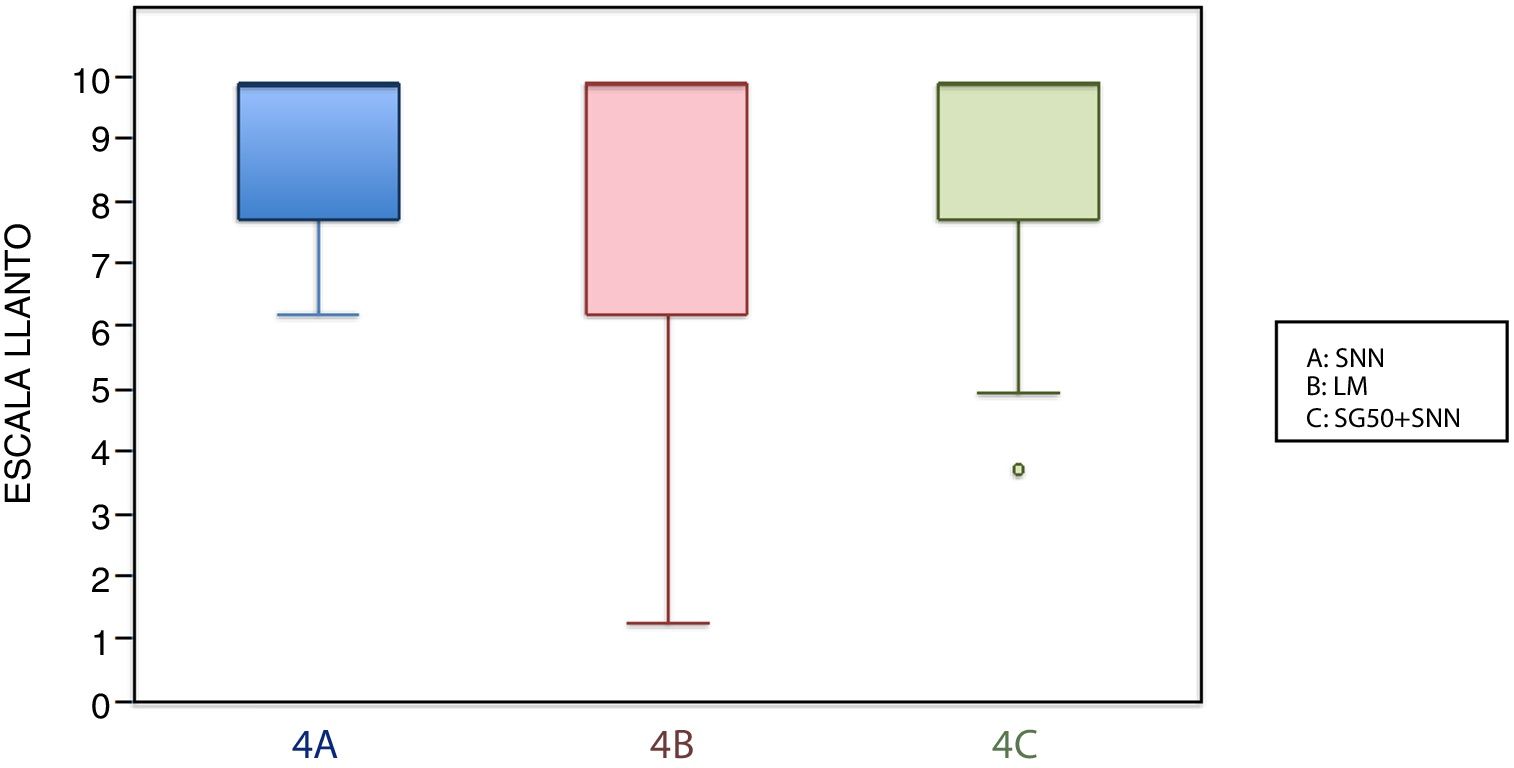
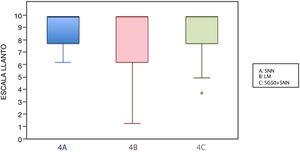
En este grupo de edad, la media de la escala LLANTO fue menor en el subgrupo de lactancia, aunque sin diferencias significativas: entre 4A y 4B (p=0,21), entre 4A y 4C (p=0,93) y entre 4B y 4C (p=0,27) (tabla 2). En la figura 3, se observa que la mediana en los 3 subgrupos es de 10. En el tiempo de llanto no se observaron diferencias significativas entre los diferentes subgrupos (tabla 3).
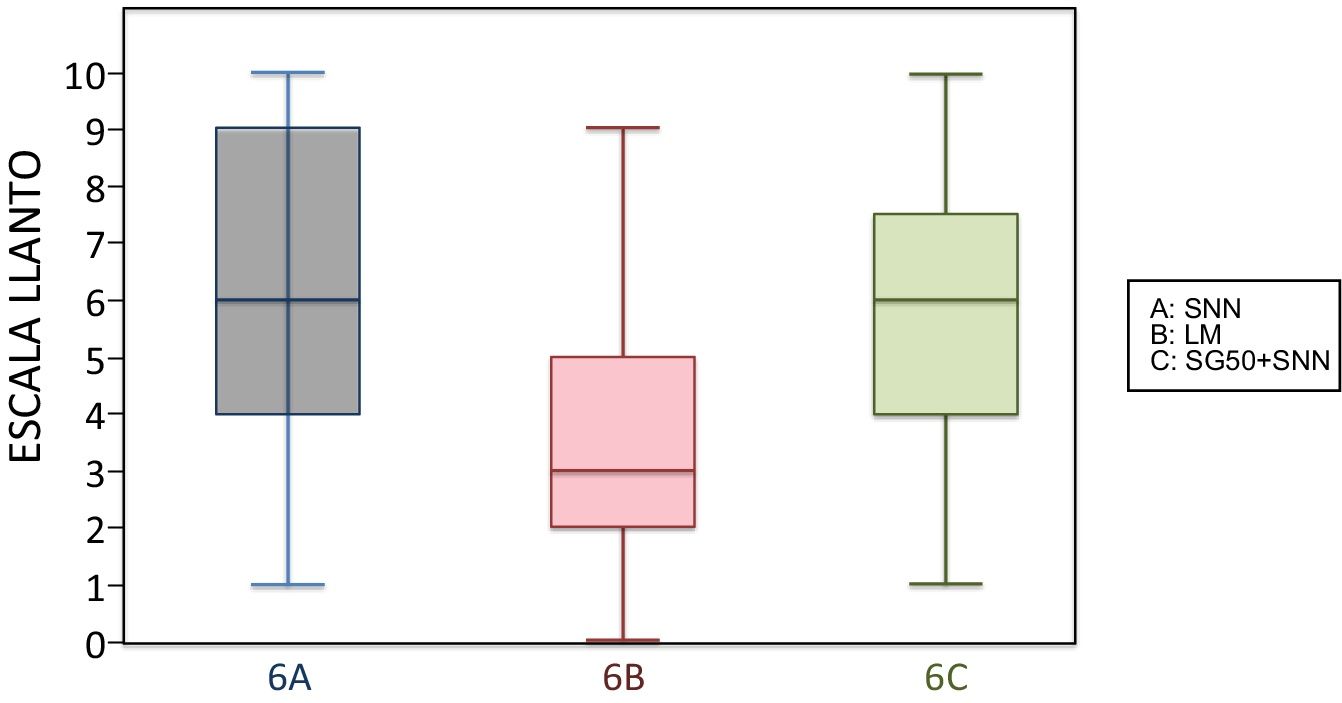
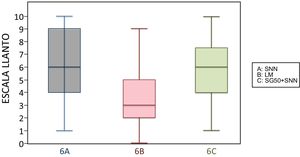
6 meses (1 inyección)Según la escala del dolor, 22 niños amamantados (casi 50%) presentaron dolor leve o ausente frente a 10 en el subgrupo que recibió SG50 y 5 del control. El dolor fue moderado e intenso con más frecuencia en los subgrupos control y en los que habían recibido SG50. En la escala LLANTO observamos una puntuación media más baja en el subgrupo LM que en el SG50 (p=0,001) y que en el control (p<0,001), sin diferencia entre 6A y 6C (p=0,45) (tabla 2). En la figura 4 observamos que la mediana del subgrupo LM es menor que en los otros 2 subgrupos. También se encontró una reducción del tiempo de llanto en los que recibieron LM, que fue significativa entre los subgrupos 6B y 6A (p=0,013) y entre el 6B y 6C (p=0,017). No había diferencias significativas entre el subgrupo 6A y 6C (p=0,66) (tabla 3).
Comparación de otras variablesAl comparar niños y niñas, no se encontraron diferencias significativas a los 2 y 4 meses (p>0,05). Sí había una aumento significativo en la escala LLANTO y en el tiempo de llanto en niñas respecto a niños a los 6 meses (p=0,026 en ambos).
No encontramos diferencias según el número de orden en la familia, edad materna (mayor/menor de 40 años), clase social o según acudían uno o ambos progenitores
No se realizó una comparación global según el lactante estuviera despierto o dormido al inicio de la vacunación, ya que el número inicial de niños dormidos era únicamente de 24.
Efectos secundariosNingún niño amamantado (n=129) presentó ningún efecto secundario. De los 129 que recibieron SG50, 3 presentaron atragantamiento leve, que se resolvió espontáneamente.
DiscusiónDiferentes investigaciones han demostrado que los métodos de analgesia no farmacológica disminuyen el dolor en RN ante procedimientos dolorosos menores12,14,22,23. Sin embargo, no existen resultados concluyentes en niños por encima del periodo neonatal16,17.
Cuando analizamos el dolor que presentan los niños de 2, 4 y 6 meses al ser vacunados, obtuvimos que el 90% tenían dolor moderado o intenso, según la escala LLANTO. El incluir medidas analgésicas sencillas e inocuas, haciendo partícipes a los padres del procedimiento de la vacunación, podría disminuir las reticencias de un sector de nuestra población hacia las vacunas.
La eficacia de la LM como analgésico fue investigada por primera vez en 200224. En la actualidad, su eficacia está ampliamente demostrada en RN cuando se realiza un único procedimiento doloroso23, con un efecto mayor que el de las soluciones azucaradas25,26. El número de estudios realizados en lactantes es mucho menor y son, además, muy heterogéneos. Según nuestros resultados, al administrar una única inyección (6 meses), los niños amamantados tenían una disminución significativa tanto de la escala LLANTO como del tiempo de llanto respecto a los que recibían SG50 y al subgrupo control, lo que coincide con otros estudios16,27. Cuando se administraron 2 inyecciones (2 meses), encontramos una disminución significativa de la escala LLANTO en el subgrupo de LM, no así del tiempo de llanto, en comparación con los otros subgrupos. Al administrar 3 vacunas (4 meses), aunque sí hubo disminución de la escala LLANTO y del tiempo de llanto en los niños amamantados, las diferencias no fueron estadísticamente significativas, lo que indicaría que ante un estímulo nociceptivo intenso la eficacia analgésica del amamantamiento no sería suficiente. Los escasos estudios que analizan el dolor al administrar varias vacunas no comparan los resultados según el número de vacunas administradas28,29 por lo que nuestro trabajo sería el primero en valorar el dolor en función del número de estímulos dolorosos recibidos.
Se han realizado estudios con diferentes soluciones y concentraciones de glucosa y sacarosa en el periodo neonatal que muestran una disminución del dolor en los procedimientos dolorosos menores (punción del talón, venopunción, vacunación)12,30,31. Los estudios sobre su efecto durante la vacunación en niños entre un mes y 12 meses de vida muestran, en general, una eficacia menor que en el RN. En este estudio no encontramos diferencias significativas de la escala LLANTO ni del tiempo de llanto entre el subgrupo SG50 y el control, lo que coincide con parte de la bibliografía revisada17. Un estudio realizado en España, aunque encuentra una disminución significativa del tiempo de llanto tras la administración de sacarosa al 75% al administrar una vacuna, el efecto es considerado clínicamente irrelevante32. En contraposición, otros sí muestran una disminución del dolor tras administrar soluciones de sacarosa y glucosa, generalmente a altas concentraciones33. Esta disparidad de resultados puede ser debida a las diferencias metodológicas entre los diferentes estudios (forma de administración y concentración de las soluciones azucaradas, vacunas administradas, técnica de administración y asociación o no de otras maniobras analgésicas como el uso del chupete o la vacunación en brazos de sus padres). Con el fin de determinar la eficacia real de la solución dulce, en nuestro estudio todos los niños eran sujetados por su madre o por su padre y recibían SNN. El efecto calmante de la SNN ha sido determinado en algunos estudios en RN y parece relacionarse con el número de succiones por minuto31,34,35. Igualmente, algún estudio ha señalado el efecto analgésico de la sujeción materna11. Con base en nuestros resultados, el SG50 no mejora el efecto analgésico obtenido al vacunar a los niños de 2, 4 y 6 meses respecto a la SNN con chupete del lactante sostenido en el regazo de su madre o padre, lo que coincide con otras investigaciones realizadas previamente25, aunque en el periodo neonatal, sin embargo, y también en el RN, algún estudio sí había mostrado un efecto sinérgico entre la administración de soluciones dulces y SNN31.
Algunas investigaciones en adultos destacan que existen diferentes respuestas al dolor según el nivel sociocultural, lo que no ha podido ser objetivado en nuestro estudio36. No encontramos diferencias entre el dolor percibido según el sexo a los 2 y 4 meses. En cambio, a los 6 meses, sí se observa un mayor dolor en el sexo femenino. En adultos, diversos estudios han mostrado una mayor respuesta al dolor en mujeres respecto a varones37. En niños, los resultados son dispares y, aunque algunos no muestran diferencias38, otros observan una mayor respuesta al dolor en el sexo femenino39,40. Serían necesarias más investigaciones para confirmar este diferente comportamiento ante el dolor entre ambos sexos.
Ninguno de nuestros pacientes amamantados presentaron efectos secundarios, lo cual coincide con la bibiliografía27. De los pacientes a los que se administró SG50, solo 3 casos presentaron atragantamiento leve, del que se recuperaron espontáneamente, sin ninguna repercusión clínica. Estos datos son coincidentes con los estudios revisados14,22,33.
El que una madre administre LM a su hijo mientras se le vacuna es una medida analgésica eficaz, que además puede alentar a las madres a amamantar a sus hijos, facilitando la vinculación afectiva y sin ningún coste adicional para el sistema de salud23. Además, no requiere ningún almacenaje ni ningún material especial. Con los resultados obtenidos en este trabajo pensamos que, hoy en día, no debería vacunarse ningún niño a los 2, 4 y 6 meses sin que la madre sea informada de que puede amamantar a su hijo, ya que esto reducirá el dolor que el niño siente al administrarle las vacunas.
Hemos descartado la eficacia analgésica de la SG50 en la vacunación en los lactantes de 2, 4 y 6 meses, al no aportar nuestra solución azucarada efecto sinérgico alguno a la SNN.
Nuestro estudio presenta varias limitaciones, ya que no se trata de un estudio ciego, al condicionar la lactancia materna la asignación al subgrupo; además, el alto nivel socioeconómico puede ser causa de sesgo y el permitir a los padres hablar y acariciar a sus hijos durante el procedimiento podría influir en los resultados. Asimismo, cabe indicar que, al haber excluido a los nacidos pretérmino y no adecuados a su edad gestacional, harían falta estudios en estos pacientes que corroboraran nuestros resultados.
ConclusionesEn los niños nacidos a término, con peso adecuado a su edad gestacional, la tetanalgesia disminuye el dolor cuando se administran 1 y 2 vacunas; cuando se administran 3 vacunas, la disminución es mínima. Por otra parte, la administración de SG50 no tiene efecto analgésico adicional respecto a la vacunación de los niños en brazos de sus padres con SNN. No podemos descartar que otras soluciones azucaradas y concentraciones diferentes puedan tener efecto analgésico. Nos parece importante destacar que la administración de LM durante la vacunación no tiene ningún efecto secundario.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos a todos los compañeros del Servicio de Pediatría del Hospital Casa de Salud de Valencia su colaboración en la realización de este trabajo; igualmente a todos los padres que aceptaron y consintieron que sus hijos participaran.