La tos ferina es una infección respiratoria causada por bacterias del género Bordetella, principalmente por las especies pertussis y parapertussis. A pesar de las altas coberturas vacunales en países desarrollados, está considerada como una enfermedad reemergente existiendo, además, una infranotificación y un infradiagnóstico especialmente en los pacientes que no precisan derivación hospitalaria.
Material y métodosEstudio descriptivo, prospectivo y multicéntrico de diagnóstico de casos de tos ferina, así como el estudio de sus contactos en 17 consultas de pediatría de Atención Primaria (AP) mediante la toma de muestras para realización de técnicas de reacción en cadena de la polimerasa (PCR) a lo largo de cuatro años y tras la implantación de la vacunación sistemática de la tos ferina en el embarazo.
ResultadosSe diagnostican un total de 50 pacientes; la tasa de incidencia estimada en estos años fue superior a las publicadas en edad pediátrica. Un 14% de los casos sucedieron en menores de un año. La media de edad fue de 6,7 años. La tos estuvo presente en el 100% de los casos, seguida de los vómitos y rinorrea como síntomas más frecuentes. Sólo un paciente precisó ingreso y ninguno falleció ni presentó complicaciones. Bordetella pertussis (B. pertussis) (BP) fue el agente causal predominante. Sólo un 40% conocía la fuente de contagio. En un 26% de los casos se comprobó mediante PCR tos ferina en sus contactos y en un 46% se sospechó clínicamente, aunque sin confirmación microbiológica.
ConclusionesEl acceso a pruebas diagnósticas (PCR) para tos ferina en AP permite optimizar su diagnóstico y tratamiento, cortar la cadena de transmisión, conocer las tasas de incidencia reales y valorar el impacto de la vacunación sistemática de las embarazadas en esta enfermedad.
Pertussis is a respiratory infection caused by bacteria of the genus Bordetella, mainly pertussis and parapertussis species. Despite the high vaccination coverage in developed countries, it is considered a re-emerging disease that is also underreported and underdiagnosed, especially in patients who do not require hospital referral.
Material and methodsDescriptive, prospective and multicentre study of pertussis diagnosis and contact investigation in 17 primary care paediatric clinics through collection of samples for polymerase chain reaction (PCR) testing over a period of 4 years and after the implementation of routine vaccination against pertussis during pregnancy.
ResultsPertussis was diagnosed in a total of 50 patients; the estimated incidence in these years was higher compared to previous rates in the paediatric age group. Fourteen percent of the cases occurred in children aged less than 1 year. The mean age was 6.7 years. Cough was present in 100% of cases, followed in frequency by vomiting and rhinorrhoea. Only 1 patient required hospital admission, and none died or developed complications. B. pertussis was the predominant causative agent. Only 40% knew the source of infection. In 26% of the cases, pertussis was confirmed in contacts of the patient by PCR, and in 46% it was suspected based on the clinical presentation but without microbiological confirmation.
ConclusionsAccess to diagnostic tests (PCR) for pertussis in primary care allows us to optimise its diagnosis and treatment, to break the chain of transmission, to know the real incidence rates and to assess the impact of routine vaccination of pregnant women on this disease.
La tos ferina es una infección respiratoria aguda causada por bacterias del género Bordetella. El agente causal más frecuente es la Bordetella pertussis (B. pertussis) (BP).
Además de BP, otras tres especies de Bordetella pueden causar enfermedad en el hombre: B. parapertussis, B. holmesii y B. bronchiseptica. La enfermedad causada B. parapertussis es similar a la tos ferina pero más leve1–3. Mantiene un patrón epidémico cíclico, con ondas que se presentan cada tres a cinco años.
La enfermedad tiene un comienzo insidioso indistinguible de otras infecciones respiratorias leves, siendo esta primera fase o fase catarral, la de mayor contagiosidad de la enfermedad. Sin embargo, el diagnóstico no suele realizarse hasta dos o tres semanas después, cuando la tos progresa en la fase paroxística y puede acompañarse de un estridor inspiratorio característico. Los episodios con crisis de tos aumentan tanto en frecuencia como en gravedad durante cuatro a ocho semanas y luego van cediendo en la fase de convalecencia, pudiendo persistir otras dos a cuatro semanas más4–6.
La presentación clínica de la tos ferina varía con la edad y los antecedentes de vacunación. En los adolescentes y adultos la enfermedad puede ser leve y no identificarse como tos ferina. En los lactantes menores de seis meses, con cobertura vacunal ausente o parcial, existe un mayor riesgo de complicaciones y mortalidad7.
Diferentes estudios seroepidemiológicos8,9 han demostrado amplia circulación de B. pertussis en todo el mundo independientemente de los calendarios y de las coberturas de vacunación. En España, con coberturas vacunales superiores al 95%, la tos ferina aumentó su incidencia desde el año 2010 hasta el 2015, con una distribución bimodal: los lactantes menores de seis meses, en los que no se ha iniciado o no han completado la primovacunación, y adolescentes y adultos por la disminución de su inmunidad, vacunal o natural, con el paso del tiempo8,9.
Entre las posibles causas de este aumento se señalan: la mejora en el acceso a técnicas de diagnóstico rápido que permiten una mejor notificación de la enfermedad, la evanescencia del efecto protector de la vacuna, un aumento de circulación de las cepas de BP, cambios genéticos de las cepas circulantes y una posible menor efectividad de la vacuna acelular frente a la vacuna de células enteras10–13.
No obstante, existen estudios que apuntan a que la incidencia de la enfermedad es muy superior a la detectada por los sistemas de vigilancia pasivos14,15, debido a la existencia de una infranotificación y un infradiagnóstico especialmente en los pacientes que no precisan, por su edad o por la levedad de sus síntomas, derivación hospitalaria en donde se realiza un diagnóstico de confirmación.
La mayor parte de los pacientes susceptibles están total o parcialmente vacunados, siendo poco probable que desarrollen una tos ferina grave. Serán atendidos en su mayoría por sus pediatras de Atención Primaria (AP) especialmente en las fases iniciales de la enfermedad, que son, por otro lado, las de mayor contagiosidad.
Es por tanto deseable que desde AP se disponga de los medios necesarios para su diagnóstico. Actualmente la técnica de elección es la reacción en cadena de la polimerasa (PCR) para la detección de Bordetellapertussis/parapertussis en aspirado o frotis nasofaríngeo. Esta prueba permite un diagnóstico rápido, además de ser altamente sensible (90,7-97%) y específica (93-100%) frente al cultivo (sensibilidad 58-64%, especificidad 100%)16. Sin embargo, existe una gran variabilidad entre comunidades autónomas en su utilización como prueba diagnóstica, tanto en su accesibilidad como en la necesidad de derivación del paciente al ámbito hospitalario para su realización, lo que retrasa y dificulta el diagnóstico en AP17.
En este estudio se pretende demostrar que el acceso y disponibilidad de la toma de muestras para PCR en consultas de pediatría de AP permite: identificar los casos de tos ferina contribuyendo a una mejor notificación y al cálculo real de la tasa de incidencia, optimizar el uso de antibióticos y la instauración del tratamiento en fase precoz de la enfermedad e interrumpir de forma más temprana la cadena de transmisión de la enfermedad.
Pacientes y métodosSe trata de un estudio descriptivo, prospectivo y multicéntrico de los pacientes diagnosticados de tos ferina en población pediátrica de 0 a 14 años mediante la utilización de técnicas de PCR específicas para la detección de Bordetella pertussis/parapertusis en 17 consultas de AP a lo largo de 4 años (desde el 1 de junio de 2016 hasta el 31 de mayo de 2020).
El estudio se realizó en seis Comunidades Autónomas (CC. AA.) con la colaboración de pediatras de AP que participaron voluntariamente en el mismo. En cada Comunidad Autónoma se contó con la colaboración manifiesta de los laboratorios de microbiología de referencia correspondientes.
A todos los padres/tutores legales de los participantes se les proporcionó una hoja informativa de invitación a participar en el estudio y un consentimiento informado que firmaron previamente a la inclusión en el mismo.
El estudio contó, previamente a su inicio, con la aprobación expresa de los Comités Éticos de referencia de cada una de las CC. AA participantes.
En la tabla 1 se enumeran las CC. AA. participantes y el número de pediatras implicados en cada una de ellas, siendo «n» el número total de niños resultante de sumar los cupos de todos los pediatras colaboradores en cada comunidad al inicio del estudio (n total = 16.906). Se incluyen únicamente los cupos y casos de los pediatras de AP que se mantuvieron en el estudio a lo largo de los cuatro años de duración. En todas las comunidades se había implantado la vacunación sistemática en el embarazo antes de finalizar 2015.
El diagnóstico de tos ferina se estableció en base al «Protocolo de vigilancia de tos ferina» establecido por la Red Nacional de Vigilancia Epidemiológica (RENAVE), considerando: caso sospechoso: (persona que cumple los criterios clínicos), caso probable (persona que cumple los criterios clínicos y tiene vínculo epidemiológico, es decir contacto con un caso de tos ferina confirmado por laboratorio entre los seis y 20 días antes del inicio de los síntomas), caso confirmado (persona que cumple los criterios clínicos y microbiológicos)18.
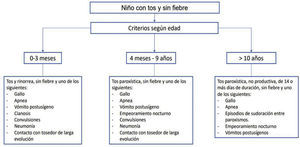
Los criterios clínicos de sospecha utilizados en el estudio fueron los actualizados por la «Global Pertussis Initiative» en 201219 y quedan resumidos en la figura 1.
Criterios clínicos de sospecha para el diagnóstico de tos ferina19.
Modificado de: Cherry JD et al. Clin Infect Dis. 2012:54;1756-1764.
En todos los pacientes que presentaron criterios clínicos y/o epidemiológicos se realizó un estudio de confirmación microbiológica de la infección mediante la detección del ácido nucleico de Bordetella pertussis/parapertussis mediante técnicas de PCR en una muestra clínica (frotis/aspirado nasofaríngeo). Las muestras fueron tomadas por personal sanitario instruido (pediatra o enfermera) en las propias consultas de AP.
Se incluyeron en el estudio todos los niños entre 0 a 14 años, pertenecientes a los cupos de los pediatras colaboradores, en los que, tras la sospecha clínica de tos ferina con base en los criterios descritos, se constata la infección mediante PCR. Se decidió incluir un único caso probable, en el que existió una fuerte sospecha diagnóstica por parte del investigador y con tos ferina confirmada por PCR en uno de sus contactos, en el que el resultado negativo de la prueba se interpretó como un falso negativo al realizarse fuera del periodo de sensibilidad diagnóstica de la misma20.
Fueron excluidos los pacientes que en el momento de recogida de la muestra presentaban: 1) asma bronquial mal controlado con tos persistente, 2) auscultación patológica o 3) presencia de otra infección respiratoria diagnosticada (sinusitis, neumonía, bronquitis/bronquiolitis).
Todos los casos, así como sus contactos estrechos y de alto riesgo, recibieron tratamiento antibiótico y las medidas de aislamiento respiratorio oportunas, aconsejando seguir las recomendaciones vigentes18,21. También todos ellos fueron notificados al Sistema de Vigilancia Epidemiológica.
ResultadosA lo largo de los cuatro años de estudio se detectaron un total de 50 casos. El estudio, se divide en cuatro periodos, tal y como se refleja en la tabla 2. En ella se incluye la estimación de la tasa de incidencia (TI) por cada 100.000 habitantes entre 0 y 14 años en cada periodo.
Casos de tos ferina y estimación de TI en cada periodo
| n | Estimación TI (/100.000 hab.) | |
|---|---|---|
| Periodo 1(1 junio 16- 31 mayo 17) | 21 | 124,2 |
| Periodo 2(1 junio 17- 31 mayo 18) | 12 | 70,9 |
| Periodo 3(1 junio 18- 31 mayo 19) | 13 | 76,9 |
| Periodo 4(1 mayo 19- 31 mayo 20) | 4 | 23,7 |
n: número de casos; TI: tasa de incidencia de 0-14 años.
En los últimos cuatro meses del estudio, coincidiendo con el confinamiento por la pandemia por SARS-CoV-2, no se detectaron casos.
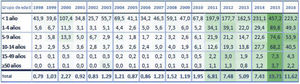
Para poder comparar con tasas de incidencia publicadas, la figura 2 muestra la evolución de los datos disponibles en nuestro país por franjas de edad publicados por RENAVE13,22 y que serán analizados en la discusión.
Tasas de incidencias por grupos de edad (1998-2016)22.
Las características generales de los casos quedan reflejadas en la tabla 3.
Características generales de los casos
| Total = 50 pacientes | ||
|---|---|---|
| Sexo n (%) | Varón 28 (56%) | |
| Mujer 22 (44%) | ||
| Edad media (años) ± DE | 6,76 ± 3,8 | |
| Mediana de edad (años)/ RIC | 6,88 / (3 meses-13 años) | |
| Número de casos en < 1 año n (%) | 7 (14%) | |
| Asiste a guardería n (%) | 4 (8%) | |
| Escolarizado n (%) | 44 (88%) | |
| Vacunado frente a tos ferina n (%) | 50 (100%) | |
| Número de dosis de vacuna recibidas n (%) | 5 dosis: 15 (30%) | |
| 4 dosis: 26 (52%) | ||
| 3 dosis: 2 (4%) | ||
| 2 dosis: 6 (12%) | ||
| 1 dosis: 1 (2%) | ||
| Calendario vacunal actualizado para la edad n (%) | 44 (88%) | |
| Tiempo medio desde última de dosis de vacuna hasta el diagnóstico (años/meses) | 3,8 años/ 46,3 meses | |
| Madre vacunada durante la gestación n (%) | 8 (16%) | |
| EG media (semanas) de vacunación | 32 | |
| EG media (semanas) al nacimiento | 39 | |
n: número de casos; DE: desviación estándar; RIC: rango intercuartílico.
Existe un predominio de niños sobre niñas (56 vs. 44%), con una edad media al diagnóstico de 6,7 ± 3,8 años, siendo la mediana de edad de 6,88 años (el rango de edades de los casos oscila entre los tres meses y los 13 años).
Un total de siete casos (14%) corresponden a niños menores de un año (un caso de tres meses, uno de seis meses, dos de ocho meses, dos de nueve meses y uno de 11 meses de edad).
Un 88% de los casos estaban escolarizados y asistían al colegio o a la guardería.
El 100% de los casos había recibido alguna dosis de vacuna frente a tos ferina, aunque un 12% no habían recibido todas las dosis correspondientes para su edad según establecía su calendario vacunal. El tiempo medio transcurrido entre la última dosis de vacuna y el diagnóstico fue de 3,8 ± 2,5 años.
En la mayoría de los casos (84%), la madre no había sido vacunada durante el embarazo, ya que corresponden a niños de mayor edad nacidos antes de que la vacunación en la embarazada estuviera instaurada ni recomendada en nuestro país.
Los ocho casos (16%) en los que la madre había sido vacunada, corresponden a los siete casos detectados en menores de un año y un caso detectado al año y medio de edad. Por tanto, en todos los casos detectados en menores de un año, la madre había sido vacunada durante la gestación.
La tabla 4 muestra los datos relativos a las manifestaciones clínicas y resultados microbiológicos de los pacientes diagnosticados de tos ferina en el estudio.
Características clínicas y resultados microbiológicos de los casos
| Total = 50 pacientes | |
|---|---|
| Tos n (%) | 50 (100%) |
| Número medio de días de tos hasta diagnóstico/rango | 14,58 / (3-60) días |
| Rinorrea n (%) | 20 (40%) |
| Gallo n (%) | 18 (36%) |
| Vómitos n (%) | 24 (48%) |
| Apneas n (%) | 2 (4%) |
| Fiebre (Tª > 37,5°C) n (%) | 3 (6%) |
| Ingreso hospitalario n (%) | 1 (2%) |
| Ingreso en UCIP | 0 (0%) |
| Complicaciones | 0 (0%) |
| Defunciones n (%) | 0 (0%) |
| Agente causal*n (%) | |
| B. Pertussis | 42 (85,7%) |
| B. Parapertussis | 7 (14,2%) |
| Tipo de muestra | |
| Frotis nasofaríngeo (n/%) | 35 (70%) |
| Aspirado nasofaríngeo (n/%) | 15 (30%) |
| Número medio de días entre toma de muestra y resultado ± DE | 2,1 ± 2 |
| Número medio días entre toma de muestra e inicio de TTo ± DE | 1,4 ± 2,1 |
| Tratamiento antibiótico n (%) | |
| Azitromicina (10 mg/kg/día, 5 días) | 24 (48%) |
| Azitromicina (10 mg/kg/día, 3 días) | 8 (16%) |
| Azitromicina (10 mg/kg/d día, 1 d; 5 mg/kg/d, 2°-5° día) | 18 (36%) |
n: número de casos; Tª: temperatura; DE: desviación estándar; TTo: tratamiento.
La tos estuvo presente en el 100% de los casos, con una duración media desde su inicio hasta el diagnóstico de 14 días (máximo de 60 días y mínimo de tres días). El segundo síntoma más frecuente fueron los vómitos (48%), seguido de la rinorrea (40%) y el estridor/gallo (36%). El aumento de la temperatura y las apneas sólo fueron registradas en un 6 y 2% de los casos, respectivamente.
Sólo un caso, un lactante de ocho meses, precisó ingreso hospitalario durante cinco días. Ningún paciente precisó ingreso en Unidad de Cuidados Intensivos Pediátricos (UCIP).
El 100% de los pacientes evolucionó favorablemente sin complicaciones.
El agente causal aislado de forma mayoritaria fue B. pertussis en el 85,7% de los casos. El tipo de muestra fue frotis nasofaríngeo en el 70% de los casos y en un 30% aspirado nasofaríngeo.
La obtención de los resultados fue rápida, con una media de dos días desde la toma de la muestra, lo cual permitió la instauración de un tratamiento antibiótico precoz.
El antibiótico de elección en el 100% de los casos fue azitromicina y se utilizó mayoritariamente una pauta de cinco días.
Los datos clínicos y microbiológicos correspondientes a los casos menores de un año se recogen en la tabla 5.
Características clínicas y resultados microbiológicos de los casos menores de 1 año
| Total = 7 pacientes | |
|---|---|
| Tos n (%) | 7 (100%) |
| Número medio de días de tos hasta diagnóstico ± DE | 11 ± 6 |
| Rinorrea n (%) | 5 (71,4%) |
| Gallo n (%) | 2 (28,5%) |
| Vómitos n (%) | 2 (28,5%) |
| Apneas n (%) | 1 (14,2%) |
| Fiebre (Tª > 37,5°C) n (%) | 0 (0%) |
| Ingreso hospitalario n (%) | 1 (14,2%) |
| Ingreso en UCIP | 0 (0%) |
| Complicaciones | 0 (0%) |
| Defunciones n (%) | 0 (0%) |
| Agente causal* n (%) | |
| B. Pertussis | 5 (71,4%) |
| B. Parapertussis | 2 (28,5%) |
| Tipo de muestra | |
| Frotis nasofaríngeo (n/%) | 3 (42,8%) |
| Aspirado nasofaríngeo (n/%) | 4 (57,1%) |
| Madre vacunada durante la gestación n (%) | 7 (100%) |
n: número de casos; Tª: temperatura; UCIP: Unidad de Cuidados Intensivos Pediátricos.
En todos los casos, se realizó estudio epidemiológico de contactos que queda reflejado en la tabla 6.
Estudio de contactos
| Total = 50 pacientes | ||
|---|---|---|
| n (porcentaje) | SÍ 20 (40%) | NO 30 (60%) |
| Fuente de contagio conocida, de los cuales | ||
| Núcleo familiar | 14 (70%) | |
| Otros familiares | 2 (10%) | |
| Otros (colegio, amigos) | 4 (20%) | |
| Número casos con contactos con CM, de los cuales | 13 (26%), de los cuales | |
| Núcleo familiar | 11 (87%) | |
| Otros familiares | 0 (0%) | |
| Otros (colegio, amigos) | 2 (13%) | |
| Número casos con contactos sin CM, de los cuales | 20 (40%)*, de los cuales | |
| Núcleo familiar | 17 (85%) | |
| Otros familiares | 6 (30%) | |
| Otros (colegio, amigos) | 0 (0%) | |
n: número de casos; CM: confirmación microbiológica.
La fuente de contagio fue conocida en un 40% de los casos, de los cuales el 70% pertenecía al núcleo familiar (padres, hermanos), un 20% compañeros de clase y un 10% otros familiares (abuelos, primos). Un 60% de los casos desconocían cómo se habían contagiado.
En un 26% de los casos se detectaron contactos con síntomas compatibles con tos ferina que pudo ser confirmada microbiológicamente mediante PCR. El 87% de estos contactos fueron los padres o hermanos de los casos y un 13% compañeros de colegio.
En un 40% se detectaron contactos con sospecha clínica de tos ferina en los que no se pudo realizar confirmación microbiológica por razones no especificadas. Igualmente, la mayoría de estos contactos sospechosos (85%), se dieron en el núcleo familiar.
DiscusiónLa tos ferina es una infección respiratoria bacteriana que continúa siendo un problema de salud pública. A pesar de las altas tasas de cobertura vacunal existentes en países desarrollados, puede ser considerada como una infección reemergente23.
En nuestro país, los datos publicados por la RENAVE obtenidos a través de los sistemas de notificación vigentes, muestran una elevada tasa de incidencia en niños pequeños (menores de un año y en especial menores de tres meses) los cuales han recibido una pauta vacunal incompleta o aún no han tenido acceso a la vacunación por su corta edad. Estos pacientes, por la gravedad de sus síntomas, son generalmente derivados al hospital en donde se les realiza pruebas microbiológicas, principalmente PCR, que confirman el diagnóstico.
El último informe de vigilancia publicado por la RENAVE, Instituto de Salud Carlos III y el Ministerio de Ciencia e Innovación, corresponde al periodo 2017-2018. La última onda epidémica se inició en 2014, alcanzó el pico máximo en 2015 con una tasa de incidencia global de 18,04 por cada 100.000 habitantes, en 2016 comenzó la fase de descenso (TI = 11,60), que ha continuado en 2017 (TI = 10,6) y en 2018 (TI = 7,76)22.
Las TI basándose en los sistemas de vigilancia pasiva del año 2016 (primer año del estudio) son, con excepción de los niños menores de un año, claramente inferiores al cálculo de TI realizado en este estudio con una búsqueda activa de casos: 49,3 (uno a cuatro años), 53,9 (cinco a nueve años) y 40,5 (10-14 años)13 vs. 124,2 estimado en este trabajo.
Las tasas de incidencia de los años 2017 y 2018 son también, excepto en los menores de un año, inferiores a las estimadas22: 56,7 y 39,5, respectivamente (uno a cuatro años), 62,3 y 30,3 (cinco a nueve años) y 37,1 y 33,0 (10-14 años) vs. 70,9 y 76,9 estimado en este estudio.
No se dispone de datos definitivos publicados por la RENAVE correspondientes a los años 2019 y 2020.
Hay que tener en consideración que, con frecuencia, la clínica que presentan los pacientes afectos de tos ferina es inespecífica y puede ser indistinguible de otros procesos respiratorios, sobre todo en niños > un año, que ya han recibido en su mayoría varias dosis de vacuna. Un estudio hospitalario retrospectivo español, muestra que un 33,7% de los pacientes con tos ferina diagnosticados en urgencias acudieron dos o más veces por el mismo proceso hasta que fueron diagnosticados, siendo catalogados inicialmente de otros procesos como infección respiratoria de vías altas, tos, bronquiolitis o bronquitis, laringitis y otros24,25.
En AP se une, a esta falta de sospecha diagnóstica inicial, la gran variabilidad existente entre CC. AA. en el acceso a pruebas diagnósticas como la PCR17, lo que contribuye a que pacientes con tos ferina, sean diagnosticados de otros procesos o bien tratados empíricamente sin confirmación microbiológica, contribuyendo a la infranotificación e infraestimación de la incidencia en aquellos niños que no precisan ser ingresados o derivados al hospital como suelen ser los pacientes mayores de un año.
Estudios hospitalarios recientes16,24, demuestran la utilidad de la PCR en el diagnóstico de tos ferina, pero no existen hasta el momento publicaciones sobre su utilización en consultas de AP. Este trabajo muestra que el acceso a técnicas diagnósticas como la PCR en consultas de pediatría de AP, puede contribuir a conocer la incidencia real de esta enfermedad, obteniendo una estimación de TI superior a las notificadas, a pesar de que este estudio se llevó a cabo durante los años de descenso de la última onda epidémica registrada, cuyo pico fue en el 2015.
Sin embargo, sorprendentemente, a lo largo de estos cuatro años, sólo se detectaron siete casos en menores de un año, por lo que su influencia en las tasas de incidencia estimadas es baja, y sólo en ocho de los 50 casos detectados la madre había sido vacunada durante la gestación, lo cual puede ser consecuencia del impacto positivo de la vacunación frente a tos ferina durante el embarazo.
En España, el Consejo Interterritorial del Sistema Nacional de Salud (CISNS) aprobó la recomendación de vacunar de tos ferina durante la gestación en junio de 2015, con generalización de su indicación en todas las CC. AA. en el año 2016. Al inicio de este estudio todas las CC. AA. participantes vacunaban a sus gestantes frente a la tosferina. La cobertura nacional estimada en 2016 fue del 81,6% aumentando durante los años 2018 y 2019, con una tasa global de cobertura en embarazadas del 82,9 y 83,6, respectivamente25.
El análisis preliminar del impacto de la vacunación en embarazadas publicado en el 2018 por el Ministerio de Sanidad español, apunta a un impacto en la reducción de la enfermedad en lactantes menores de tres meses, con una anticipación en esa disminución en aquellas comunidades que habían implantado más precozmente la vacunación durante el embarazo13.
Estudios recientes corroboran este impacto positivo de la vacunación durante el embarazo en los ingresos hospitalarios pediátricos26, así como una disminución de riesgo de tos ferina en los primeros meses de vida27.
Tal y como muestra el estudio de contactos, los adolescentes y adultos constituyen un reservorio a partir del cual la enfermedad puede transmitirse a lactantes y recién nacidos. Por ello, el calendario de vacunaciones de la Asociación Española de Pediatría (AEP) aconseja una dosis de dTPa del adolescente, estrategia ya adoptada en otros países europeos28.
En cuanto al tratamiento, existe una tendencia poco justificada de utilizar en niños mayores de seis meses, una pauta de azitromicina de cinco días a dosis de 10 mg/kg/día, la cual sólo está indicada en menores de esta edad. Los protocolos vigentes aconsejan una pauta de 10 mg/kg/día, durante tres días o pauta de cinco días, pero a 5 mg/kg/día entre los días 2° y 5° de tratamiento18,21.
Como conclusión, resaltar la importancia del acceso a pruebas diagnósticas de confirmación de tos ferina como la PCR en AP, ya que además de optimizar el diagnóstico, permite un adecuado aislamiento de los casos durante el periodo de contagiosidad, la instauración de un tratamiento antibiótico precoz y la detección de contactos estrechos susceptibles de recibir tratamiento, interrumpiendo la cadena de trasmisión. Además, permitirá el cálculo de la tasa real de incidencia de esta infección.
FinanciaciónEste proyecto obtuvo la beca Asociación Española de Pediatría-Fundación Pediatría y Salud (AEPap–FPS) 2016 para la Investigación en Pediatría de Atención Primaria.
Conflicto de interesesLos autores declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.
Nuestro sincero agradecimiento a todos los colaboradores de este estudio: Beatriz Rituerto Gómez, Ana Castroviejo Gandarias, José Vicente Bernad Usoz, Jaime Tella Madorrán, Irene Calavia Redondo, M.ª Elena León Angós, Teresa Arana Navarro, Teresa Cenarro Guerrero, M.ª Eulalia Muñoz Hiraldo, Beatriz Acosta Navas, María José Martínez Chamorro, Marta Dapena Archilés, Carlos Labordena, Eva Bono, Ana Montañés, Ana Cubero Santos, Ana Grande Tejada, así como a todos los especialistas y técnicos implicados en los Laboratorios de Microbiología de referencia de cada comunidad.