Evaluar si la presencia de persistencia de ductus arterioso (PDA) aumenta la proporción de retinopathy of prematurity (ROP, «retinopatía del prematuro») o su gravedad.
Pacientes y métodoSe incluyó en el estudio una cohorte consecutiva de prematuros diagnosticados de PDA por ecocardiograma nacidos en el Hospital Universitario Miguel Servet desde enero de 2006 hasta mayo de 2009. Comparamos la proporción y gravedad de ROP en este grupo en comparación con un grupo control sin PDA aleatoriamente elegido.
ResultadosEstudiamos un total de 131 prematuros: 79 con PDA y 52 sin PDA. Encontramos relación estadísticamente significativa entre la presencia de PDA y la proporción de ROP (p=0,03) (OR=2,41; 95% CI 1,08–5,38), sin que existieran diferencias significativas en la edad gestacional (EG) entre los grupos. Sin embargo, al usar un modelo de regresión múltiple ajustado a la EG, hay una relación significativa entre ROP y EG (β=−0,322; p=0,003), pero no existe relación estadísticamente significativa entre ROP y PDA (p=0,073 para proporción de ROP y p=0,20 para estadio de ROP).
ConclusionesLa presencia de PDA no aumenta el riesgo de desarrollar ROP ni su gravedad, una vez que se considera el efecto de la EG en la presencia de PDA.
To evaluate whether the presence of patent ductus arteriosus (PDA) increases the rate of retinopathy of prematurity (ROP) or its severity.
Patients and methodA consecutive cohort of premature infants diagnosed with PDA by echocardiography born in the Miguel Servet University Hospital from January 2006 to May 2009 was included in the study. We compared the rate and severity of ROP in this group of patients with a control group of randomly-chosen premature infants with a normal echocardiography.
ResultsWe evaluate a total of 131 premature infants (79 with PDA and 52 without PDA). We found a statistically significant association between the presence of PDA and the rate of ROP (p=0.03) (OR=2.41; 95% CI 1.08–5.38). However, using a multiple regression model adjusted for the gestational age (GA), a significant reverse association was found between ROP and GA (β=−0.322; p=0.003), but there was no statistically significant correlation between ROP and PDA (p=0.073 for rate of ROP and a p=0.20 for stage of ROP).
ConclusionsThe presence of PDA does not increase the risk of developing ROP or its severity, once considered the effect of gestational age in PDA.
La persistencia de ductus arterioso (PDA) es una patología frecuente en los prematuros. La incidencia calculada de PDA sintomática varía del 55 al 70% de los recién nacidos con extremado bajo peso al nacimiento (EBPN) (peso al nacimiento <1.000g)1–3. La PDA se ha relacionado con un aumento de la morbimortalidad de los prematuros en general y de los recién nacidos con EBPN en particular4. Se ha relacionado así con el desarrollo y la evolución de la retinopathy of prematurity (ROP, «retinopatía del prematuro»)5–7, fundamentalmente asociado a los cambios hemodinámicos que produce la PDA y su efecto en una vasculopatía isquémica retiniana como es la ROP8,9. Sin embargo, no está claro si esta relación es por la alteración hemodinámica que produce el shunt izquierda-derecha, por su tratamiento (la indometacina tiene un efecto directo en la disminución del flujo cerebral pudiendo favorecer la isquemia9) o si en realidad todo se relaciona con la propia inmadurez del paciente.
En nuestra práctica clínica hemos apreciado una posible relación en nuestros pacientes entre la PDA y el desarrollo de ROP, por lo que hemos realizado un estudio retrospectivo para poder confirmar esta sospecha clínica.
Pacientes y métodosPacientes. Se incluyó un total de 131 recién nacidos pretérmino (RNPT) en el Hospital Universitario Miguel Servet entre el 1 de enero de 2006 y el 1 de mayo del 2009 y que fueron sometidos al cribado de ROP, siguiendo los criterios de inclusión protocolizados en nuestro hospital y que se basan en las recomendaciones de las Academias Americanas de Pediatría y Oftalmología10–12 y que son: RNPT con ≤31 semanas de edad gestacional (EG) y/o ≤1.500g de peso y/o aquellos RNPT con suplemento significativo de oxígeno independientemente de la EG y el peso al nacimiento. Se excluyeron los niños nacidos con malformaciones congénitas mayores diagnosticadas por estudio prenatal y aquellos con elementos dismórficos en el examen físico realizado al nacer.
La muestra obtenida se dividió en dos cohortes. La cohorte 1 estaba constituida por 79 prematuros consecutivos (35 varones y 44 hembras) con un diagnóstico de PDA confirmado mediante ecocardiografía nacidos entre el 1 de enero de 2006 y el 1 de mayo del 2009. La cohorte 2 estaba formada por 52 prematuros (28 varones y 24 hembras) con ecografía normal y que fueron seleccionados de forma randomizada entre los prematuros nacidos en las mismas fechas. En todos ellos se estudiaron diferentes variables pediátricas y oftalmológicas.
Variables pediátricas. Se registraron parámetros cualitativos y cuantitativos. Los primeros incluyeron el sexo del recién nacido, si el parto fue simple o múltiple, si la concepción fue natural o asistida mediante fecundación in vitro (FIV), si la terminación del parto fue natural (vía vaginal) o asistida (con ayuda de fórceps o por cesárea), si necesitó reanimación cardiopulmonar (RCP) al nacer, adrenalina y/o intubación, si necesitó oxígeno y/o ventilación en el día 28 desde el nacimiento y en la semana 36 de EG, si la madre fue tratada con corticoides, si recibió surfactante pulmonar y si desarrolló sepsis o enfermedad de membrana hialina.
Las variables cuantitativas fueron la EG (en semanas), el peso al nacer (PN) (en gramos), el perímetro cefálico (en cm), la talla al nacer (en cm), la puntuación del test de Apgar en los minutos 1 y 5 de vida, la edad de la madre, el máximo exceso de base en las primeras 12h de vida, la fracción de oxígeno inspirada (FiO2) máxima y mínima registrada, la puntuación de la escala de gravedad Clinical Risk Index of Babies (CRIB, «índice clínico de riesgo en niños»), los días que requirió ingreso en la UCI y/o en el hospital y el peso a los 28 días de nacer y a la semana 36 de EG.
Variables oftalmológicas: se realizó una exploración del fondo de ojo a todos los sujetos bajo midriasis farmacológica con colirios de fenilefrina al 1% y ciclopentolato al 0,5% y se empleó el oftalmoscopio binocular indirecto. El primer examen oftalmológico se realizó entre la 4.a y la 6.a semana de vida, nunca antes de la 31 semana de edad posconcepcional, con revisiones cada 1–2 semanas hasta la vascularización retiniana completa. Cada ojo fue calificado con el grado máximo de retinopatía detectado según la Clasificación Internacional de la ROP (ICROP)13.
El tratamiento con láser diodo se indicó en los pacientes con ROP preumbral tipo 1, ROP umbral o ROP posterior agresiva (AP-ROP) siguiendo las indicaciones del estudio multicéntrico para la crioterapia en la ROP y del estudio multicéntrico para el tratamiento precoz de la ROP14,15. En todos los casos con necesidad de tratamiento se obtuvo un consentimiento informado de los padres o tutores.
Análisis estadístico. Todas las variables mencionadas fueron registradas en una base de datos elaborada con el programa FileMaker Pro 5.0. El análisis estadístico fue llevado a cabo con el programa estadístico SPSS para Windows versión 15.0 (SPSS Inc., Chicago, EE.UU.). De modo previo al análisis de los datos se comprobó el ajuste a la normalidad de las variables cuantitativas mediante el test de Kolmogorov-Smirnov y se observó que la mayoría de ellas no tenían una distribución normal, por lo que se emplearon test estadísticos no paramétricos para el análisis de los datos.
La estadística descriptiva de las variables cuantitativas se realizó mediante medidas de centralización (media) y de dispersión (desviación estándar). Para el análisis de comparación de las medias entre los dos grupos se utilizó el test de U de Mann Whitney. Se emplearon los valores absolutos y porcentuales en la estadística descriptiva de las variables cualitativas y se realizó un análisis estadístico univariante mediante el test no paramétrico de Chi cuadrado.
Las variables que resultaron relacionadas significativamente con la aparición de ROP se incluyeron en un modelo de regresión logística para identificar la influencia aislada de cada una de las variables sobre la aparición de ROP, independientemente del efecto de las demás, y para ajustar el efecto de confusión de alguna de ellas. Se construyó un modelo de análisis multivariante en el que se incluyeron las variables de EG, peso al nacer y presencia de PDA. Este modelo se realizó con las técnicas de introducción hacia delante y hacia atrás para identificar las variables significativamente relacionadas con el riesgo de desarrollar ROP. Se calculó la razón de ventaja (odds ratio; OR) con su correspondiente intervalo de confianza (para el 95%).
El estudio ha sido aprobado por el Comité Ético de Investigación Clínica de Aragón (CEICA).
ResultadosLa muestra del estudio estaba compuesta por 131 prematuros con EG inferior o igual a 31 semanas, de los cuales el 48,1% eran varones (63) y 51,9% eran mujeres (68). De los 131 RNPT, 38 procedían de gestaciones múltiple (29%). Nacieron por vía vaginal (parto eutócico) 57 niños (43,5%), mientras que 74 (54,9%) nacieron mediante cesárea y 2 (1,5%) requirieron fórceps. En el primer mes de vida fallecieron 13 sujetos (9,9%).
La EG media de la muestra fue de 27,24±1,84 semanas con rango de 23–31 semanas. El peso al nacer medio de la muestra fue de 957,23±228,21 gramos con rango de 460–1.460gramos.
La incidencia global de ROP fue del 32,1% (42 sujetos), siendo de grado preumbral en el 13% (17 prematuros), umbral en el 8,4% (11 niños) y ROP posteriores en el 10,7% (14 prematuros).
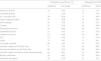
La cohorte 1, formada por 79 prematuros con PDA demostrada en la ecocardiografía, tenía una EG media de 27,06±1,77 semanas (rango: 23–31 semanas) y un peso al nacer medio de 947,82±230,03 gramos (rango: 460–1.460 gramos); mientras que la cohorte 2 (52 prematuros sin PDA en la ecocardiografía) presentaba una EG media de 27,52±1,91 semanas (rango: 24–30 semanas) y un peso al nacer medio de 971,52±226,91 gramos (rango: 550–1.400 gramos). Al comparar estas dos variables cuantitativas entre las dos cohortes mediante el test no paramétrico de la U de Mann Whitney, observamos que no existían diferencias significativas entre los grupos (p=0,506 para la EG y p=0,075 para el peso al nacer), como queda recogido en la tabla 1. La proporción varón:mujer era próxima a 1:1 en ambos grupos y no mostraba diferencias significativas (p=0,287).
Edad gestacional y peso al nacimiento en los dos grupos de estudio con y sin pesistencia de ductus arterioso
| Edad gestacional (semanas) | Peso al nacer (gramos) | |||||||
| Media | DE | Rango | P | Media | DE | Rango | P | |
| Con PDA | 27,06 | 1,77 | 23–31 | 0,506 | 947,82 | 230,03 | 460–1.460 | 0,075 |
| Sin PDA | 27,52 | 1,91 | 24–30 | 971,52 | 226,91 | 550–1.400 | ||
DE: desviación estándar; PDA: persistencia ductus arterioso.
Se detectó ROP en 31 de los 79 sujetos que tenían PDA (39,2%) y en 11 de los 55 sujetos que no tenían PDA (21,2%), y esta diferencia fue significativa (test de Chi cuadrado, p=0,036). El estadio de ROP más frecuente en el grupo con PDA fue el preumbral (41,9%), mientras que en el grupo sin PDA predominaron las formas más severas (45,5% fueron ROP posteriores).
Todas las variables del estudio fueron comparadas entre los dos grupos (tablas 2 y 3). El grupo de prematuros con PDA requirió reanimación avanzada al nacimiento con mayor frecuencia que el grupo sin PDA (88,6 vs 69,2%, p=0,011, y 84,8 vs 66,7%, p=0,019; respectivamente) y presentaron una mayor incidencia de sepsis en el primer mes (62,0 vs 42,3%, p=0,032); sin embargo, fue mayor el número de prematuros sin PDA que necesitaba oxígeno en el día 28 de vida (23,9 vs 56,5%, p=0,001).
Variables cualitativas registradas en los dos grupos de estudio con y sin persistencia de ductus arterioso. Las variables que presentaron diferencias significativas tienen el valor de p resaltado en negrita (p<0,05; test de chi cuadrado)
| Prematuros con PDA (n=79) | Prematuros sin PDA (n=52) | Signif. | |||
| Incidencia | Porcentaje | Incidencia | Porcentaje | ||
| Presencia de ROP | 31 | 39,2 | 11 | 21,2 | 0,036 |
| Asimetría de ROP | 7 | 22,6 | 3 | 27,6 | 0,524 |
| Tto. con láser ROP | 30 | 96,8 | 11 | 100 | 0,738 |
| Buena respuesta al láser | 30 | 96,8 | 10 | 90,9 | 0,460 |
| Parto múltiple | 26 | 32,9 | 12 | 23,1 | 0,245 |
| Cesárea | 43 | 54,4 | 29 | 55,8 | 0,512 |
| Reanimación al nacer | 70 | 88,6 | 36 | 69,2 | 0,011 |
| Adrenalina al nacer | 11 | 14,1 | 10 | 20,4 | 0,462 |
| Intubación al nacer | 67 | 84,8 | 34 | 66,7 | 0,019 |
| FIV | 15 | 19,0 | 6 | 11,5 | 0,333 |
| Exitus | 8 | 10,1 | 5 | 9,6 | 0,586 |
| Corticoides a madre | 56 | 70,9 | 32 | 61,5 | 0,069 |
| Necesitó oxígeno en día 28 de vida | 17 | 23,9 | 26 | 56,5 | 0,001 |
| Necesitó ventilación en día 28 de vida | 50 | 70,4 | 38 | 82,6 | 0,188 |
| Necesitó oxígeno en semana 36 de edad gestacional | 44 | 65,7 | 32 | 80,0 | 0,129 |
| Recibió surfactante | 38 | 48,1 | 26 | 50,0 | 0,860 |
| Desarrolló una sepsis | 49 | 62,0 | 22 | 42,3 | 0,032 |
FIV: fecundación in vitro; PDA: persistencia ductus arterioso; ROP: retinopatía del prematuro (retinopathy of prematurity); Tto.: tratamiento.
Variables cuantitativas registradas en los dos grupos del estudio con y sin persistencia de ductus arterioroso. Las variables que mostraron diferencias significativas tienen el valor de p resaltado en negrita (p<0,05; test de U de Mann-Whitney)
| Prematuros con PDA (n=79) | Prematuros sin PDA (n=52) | Signif. | |||
| Media | DE | Media | DE | ||
| Talla al nacer | 36,161 | 3,2977 | 36,343 | 2,8647 | 0,455 |
| Perímetro cefálico al nacer | 25,017 | 2,1063 | 25,053 | 1,9004 | 0,841 |
| Apgar al minuto 1 de vida | 5,48 | 2,762 | 6,14 | 2,668 | 0,187 |
| Apgar al minuto 5 de vida | 7,74 | 2,160 | 8,12 | 1,966 | 0,313 |
| Edad de la madre | 31,12 | 6,052 | 31,50 | 6,412 | 0,361 |
| Presión de oxígeno mínima | 28,72 | 13,943 | 25,65 | 9,364 | 0,009 |
| Presión de oxígeno máxima | 56,51 | 23,521 | 46,86 | 23,108 | 0,010 |
| Índice de gravedad crib | 4,4030 | 2,99018 | 3,6735 | 3,59043 | 0,030 |
| Días ingresado en el hospital | 73,44 | 37,273 | 63,35 | 36,767 | 0,036 |
| Días ingresado en la UCI | 51,28 | 31,435 | 40,02 | 37,51 | 0,003 |
| Peso en el día 28 de vida | 1.240,87 | 316,839 | 1.290,20 | 315,348 | 0,266 |
| Peso en la semana 36 de edad gestacional | 1.855,58 | 362,606 | 1.874,00 | 377,542 | 0,579 |
| Peor exceso de base en las primeras 12h | −3,9896 | 3,53220 | −2,4673 | 3,30980 | 0,015 |
DE: desviación estándar; PDA: persistencia de ductus arterioso.
La mayoría de las variables cuantitativas estudiadas indicaban mayor gravedad en el grupo de prematuros con PDA, encontrándose diferencias significativas en relación a la fracción de oxígeno inspirada (FiO2) máxima y mínima (p=0,009 y p=0,010 respectivamente), al índice de gravedad CRIB (p=0,030), a los días que el prematuro requirió ingreso hospitalario y en la UCI (p=0,036 y p=0,003 respectivamente), y al máximo exceso de base en las primeras 12h (p=0,015).
Aunque el análisis univariante que correlaciona ROP y PDA mostró una asociación significativa con una razón de ventaja (odds ratio) de 2,407 (IC 95%:1,077–5,380), al realizar un análisis multivariante considerando la EG y el peso al nacimiento como potenciales variables de confusión o modificadoras del efecto de la relación entre PDA y ROP, se observó que la EG es la única variable predictora del modelo.
DiscusiónLa fotocoagulación con láser diodo en la ROP preumbral de riesgo ha mejorado el pronóstico de la enfermedad15, con una disminución significativa de evoluciones desfavorables entendidas como: desprendimiento de retina parcial, desprendimiento de retina total o pliegue falciforme con afectación macular. Sin embargo, se ha visto que existen hasta un 9,1% de evoluciones anatómicas desfavorables a los 2 años, a pesar de haber realizado tratamiento precoz16, sin que se conozca bien cual es la causa que lleva a que el tratamiento sea eficaz en unos casos y en otros no. Por ello, es muy importante conocer los posibles factores de riesgo sistémicos que pueden asociarse al desarrollo o evolución de la ROP para poder mejorar el pronóstico de la misma.
Como la ROP es una vasculopatía isquémica retiniana puede verse afectada tanto en su presentación como en su desarrollo por patologías vasculares sistémicas como la PDA. El aumento de oxigenación posnatal que tiene un papel muy importante en la constricción inicial del ductus y que llevará a la cascada de eventos que conducirán al cierre definitivo del mismo, es perjudicial para la ROP. La disminución de los niveles de saturación de O2 se relaciona con una disminución en la incidencia de ROP tal y como se ha demostrado17. La tendencia actual es a disminuir el rango de saturación de oxígeno, lo que podría aumentar la incidencia de PDA, por lo que si existiera una relación entre PDA y ROP, podría aumentarse la incidencia de ROP. Sin embargo, hay autores que han publicado que la tendencia a disminuir los niveles de saturación de O2 para minimizar los periodos de hiperoxia y controlar así el desarrollo de ROP, si que aumentan la incidencia de PDA precoz, pero la proporción final de cierre de ductus, la respuesta al tratamiento con indometacina y la necesidad de tratamiento quirúrgico no se ve afectado1.
En el análisis inicial en nuestro estudio, no existiendo diferencias significativas en la EG o el PN entre los grupos con y sin PDA, hemos encontrado una incidencia de ROP significativamente mayor en el grupo con PDA que en el grupo sin PDA. En el grupo con PDA eran además más frecuentes las formas preumbrales de ROP, a diferencia del grupo sin PDA, donde habría una menor incidencia de ROP, pero mayor incidencia de formas graves. El grupo con PDA presentaba además una incidencia significativamente mayor de parámetros de gravedad como: sepsis, reanimación avanzada al nacimiento, índice de gravedad CRIB, días de ingreso en UCI y presiones arteriales mínima y máxima. Parece así que los prematuros con PDA son pacientes de mayor riesgo. Sin embargo, al realizar un análisis multivariante, considerando la EG y el PN como potenciales variables de confusión, se vio que la EG era la variable predictora del modelo y que hay una colinealidad entre la PDA y la EG, y es en realidad la EG la que está marcando el riesgo. Por ello, la relación estadísticamente significativa entre ductus y ROP puede deberse a las diferencias en la EG, que influye a su vez en la presencia de PDA. Esta discrepancia en los resultados entre el estudio univariante y el multivariante podría deberse a un tamaño muestral pequeño. Sin embargo, ya otros autores han encontrado estos datos. Chorne et al6 en un análisis inicial encuentran relación entre la PDA y el desarrollo de ROP, pero una vez que el análisis se realiza ajustado a la EG, no encuentran dicha relación. Valcamonico et al18 al estudiar factores de riesgo asociados a la morbilidad a medio y largo plazo en los niños con EBPN encuentran que aunque un EBPN es un factor de riesgo importante de mortalidad perinatal y morbilidad neonatal, la variable más significativa para la evolución a medio y largo plazo es la EG. Por ello, y a tenor de los resultados obtenidos en nuestro estudio, cuando se estudien factores de riesgo en la ROP o bien los tamaños muestrales son amplios o bien deben hacerse siempre análisis multivariantes para determinar la influencia de la EG.
Parece claro que el prematuro es un paciente de riesgo por su propia prematuridad. Cuanto menor es la EG mas patologías de riesgo tendrá asociadas y puede que no sean estas patologías las que influyan en el desarrollo de la ROP, sino que sea la propia prematuridad el factor de riesgo principal.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.